文档内容
江南十校高二 5 月联考化学参考答案详解
可能用到的相对分子质量:H1 C12 O16 F19 Na23 S32 K39 Ni59
一、选择题:本大题共14小题,每小题3分,共42分,在每小题给出的四个选项中,只
有一个选项符合题目要求。
1.化学与生活、科技及环境密切相关。下列说法正确的是 ( )
A.利用二氧化碳为原料人工合成淀粉,有助于实现“碳达峰”和“碳中和”
B.粗铜提纯采用电解法,电解精炼铜时精铜作阳极
C.太阳电池采用的碳纤维框架和玻璃纤维网,二者均为有机物
D.二氧化硫和氯水都有漂白性,将两者混用漂白效果更好
【答案】A
【解析】A项,人工合成淀粉技术的应用,可以有效的减少二氧化碳排放,有助于实现“碳
达峰”和“碳中和”。A正确;B项,用电解法电解精炼铜时粗铜做阳极,精铜做阴极,B不
正确;;C项,碳纤维主要成分为碳单质,玻璃纤维的主要成分为二氧化硅,都属于无机非
金属材料,C不正确;D项.氯水有强氧化性,二氧化硫有还原性,二者混合发生氧化还原
反应降低消毒效果,D不正确。
2.下列化学用语或表述正确的是( )
A.反-2-丁烯的键线式:
B.乙醚的结构简式:CH OCH
3 3
C.BF 的空间结构:平面三角形
3
D.一元酸次磷酸(HPO)的结构简式:
3 2
【答案】C
【解析】A 项, 为顺-2-丁烯的键线式,A 项错误;B 项,乙醚的结构简式为
CH CH OCH CH , B项错误;C项,BF 中硼是sp2杂化(平面三角形),C项正确;D项,次
3 2 2 3 3
磷酸为一元酸,只含有一个羟基, , D项错误;故选C。
3.锗酸盐(如Na₂GeO₃)用于制备特种玻璃、半导体材料或催化剂载体。下列说法正确
的是( )
A.半径:r(Na+)>r(O2-) B. Ge位于元素周期表中p区
C.第一电离能:I(Na)>I(O) D.沸点:NaHHO,故D错误。
2
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.澄清透明的溶液中:Cu2+、Mg2+、SO2-、Cl-
4
c
OH-
B. =1012的溶液中: NH+、K+、SO2-、NO-
c
H+ 4 4 3
C.由水电离出的c(H+)=10-11的溶液中:ClO-、S2-、Cl-、Na+
D.碳酸氢钾溶液中:[Al(OH)]-、Na+、I-、NO-
4 3
【答案】A
【解析】A.澄清透明的溶液中Cu2+、Mg2+、SO2-、Cl--四种离子之间不发生任何反应,能大量
4
c
OH-
共存,A正确;B. =1012的溶液显碱性,NH在碱性溶液中不能大量存在,B错误;
c H+ 4
C.由水电离出的c(H+)=10-11的溶液中,溶液可能呈酸性,也可能呈碱性,ClO-、S2-酸性不
可共存, C错误;D.[Al(OH)]-与HCO之间发生反应,不能大量共存,故D错误。
4 3
5.食醋是一种常见的食品调味剂,含有乙酸、水、乙醇、氨基酸等多种成分。设N 为阿伏
A
加德罗常数的值,下列说法正确的是( )
A.常温下,1L 0.01mol/L的CHCOOH溶液中水电离出的H+的数目小于10-12N
3 A
B.100g质量分数为46%的CHCHOH溶液中,含H-O键的数目为N
3 2 A
C.2mol CHCHOH与1mol CHCOOH充分反应,生成水分子数目为N
3 2 3 A
D.标准状况下,22.4L HO中氧原子的数目大于N
2 A
【答案】D
【解析】A.醋酸是弱酸,不可能全部电离,1L0.01mol/L的CHCOOH溶液中水电离出的H+
3
的数目大于10-12N,A错误;
A
B.乙醇溶液中乙醇和水分子中都含有氢氧键,则100g46%乙醇溶液中含有氢氧键的数目为
100g46% 100g100g46%
1N mol1 2N mol1 7N ,B错误;
46g/mol A 18g/mol A A
C.2molCHCHOH与1molCHCOOH反应是可逆反应不可能完全反应生成1mol 水 C错误;D.标
3 2 3
准状况下水不是气态,22.4L水的物质的量一定大于1mol,其中含有的氧原子数目大于N,
AD正确;
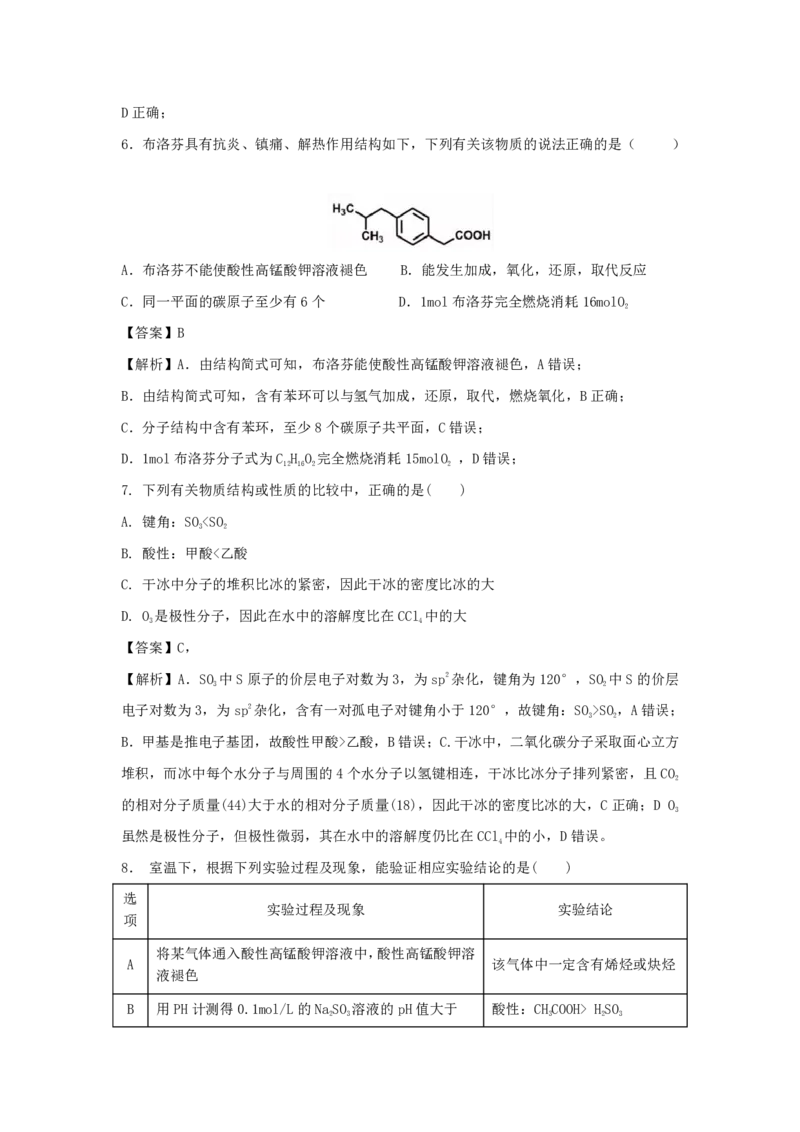
6.布洛芬具有抗炎、镇痛、解热作用结构如下,下列有关该物质的说法正确的是( )
A.布洛芬不能使酸性高锰酸钾溶液褪色 B.能发生加成,氧化,还原,取代反应
C.同一平面的碳原子至少有6个 D.1mol布洛芬完全燃烧消耗16molO
2
【答案】B
【解析】A.由结构简式可知,布洛芬能使酸性高锰酸钾溶液褪色,A错误;
B.由结构简式可知,含有苯环可以与氢气加成,还原,取代,燃烧氧化,B正确;
C.分子结构中含有苯环,至少8个碳原子共平面,C错误;
D.1mol布洛芬分子式为C H O 完全燃烧消耗15molO ,D错误;
12 16 2 2
7. 下列有关物质结构或性质的比较中,正确的是( )
A. 键角:SOSO,A错误;
3 2
B.甲基是推电子基团,故酸性甲酸>乙酸,B错误;C.干冰中,二氧化碳分子采取面心立方
堆积,而冰中每个水分子与周围的4个水分子以氢键相连,干冰比冰分子排列紧密,且CO
2
的相对分子质量(44)大于水的相对分子质量(18),因此干冰的密度比冰的大,C正确;D O
3
虽然是极性分子,但极性微弱,其在水中的溶解度仍比在CCl 中的小,D错误。
4
8. 室温下,根据下列实验过程及现象,能验证相应实验结论的是( )
选
实验过程及现象 实验结论
项
将某气体通入酸性高锰酸钾溶液中,酸性高锰酸钾溶
A 该气体中一定含有烯烃或炔烃
液褪色
B 用PH计测得0.1mol/L的NaSO 溶液的pH值大于 酸性:CHCOOH> HSO
2 3 3 2 30.1mol/L的CHCOONa的溶液的pH值
3
向5mL 0.1mol/LNaOH溶液中依次滴加5滴同浓度
C 0.1mol/L的MgCl 溶液和CuCl 溶液,先产生白色沉 Ksp[Mg(OH)]>Ksp[Cu(OH)]
2 2 2 2
淀,再产生蓝色沉淀
向0.05mol/LCuSO 溶液中加入少量NaCl固体, 溶液 发生了[Cu(HO)]2+到[CuCl]2-
D 4 2 4 4
由蓝色变为黄绿色。 的转化
【答案】D
【解析】能使酸性高锰酸钾溶液褪色的气体有很多,如SO 等,不一定是烯烃或炔烃,A错
2
误;0.1mol/L的NaSO 溶液的PH值大于0.1mol/L的CHCOONa的溶液的pH值说明酸性
2 3 3
CHCOOH> HSO-,B错误;5mL0.1mol/LNaOH溶液中依次滴加5滴同浓度0.1mol/L的MgCl
3 3 2
溶液和CuCl 溶液,反应中氢氧根离子过量,氢氧根离子会和镁离子生成氢氧化镁沉淀、和
2
铜离子生成氢氧化铜沉淀,产生白色沉淀,再产生蓝色沉淀,不能说明
Ksp[Mg(OH)]>Ksp[Cu(OH)],C错误;D.[Cu(HO)]2+在水溶液中呈蓝色、[CuCl]2-在水溶液
2 2 2 4 4
中呈黄色,[Cu(HO)]2+、[CuCl]2-的混合溶液呈黄绿色,根据实验现象知,发生了[Cu(HO)]2+
2 4 4 2 4
到[CuCl]2-的转化,D正确;
4
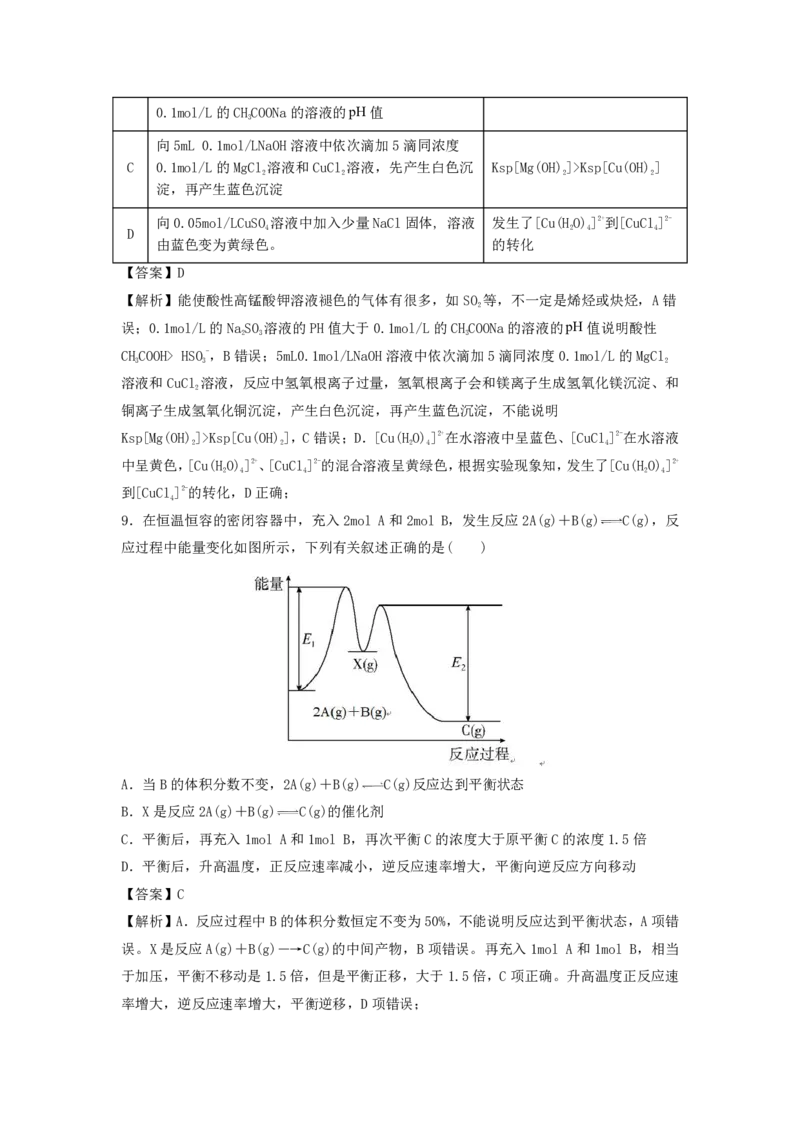
9.在恒温恒容的密闭容器中,充入2mol A和2mol B,发生反应2A(g)+B(g) C(g),反
应过程中能量变化如图所示,下列有关叙述正确的是( )
A.当B的体积分数不变,2A(g)+B(g) C(g)反应达到平衡状态
B.X是反应2A(g)+B(g) C(g)的催化剂
C.平衡后,再充入1mol A和1mol B,再次平衡C的浓度大于原平衡C的浓度1.5倍
D.平衡后,升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
【答案】C
【解析】A.反应过程中B的体积分数恒定不变为50%,不能说明反应达到平衡状态,A项错
误。X是反应A(g)+B(g)―→C(g)的中间产物,B项错误。再充入1mol A和1mol B,相当
于加压,平衡不移动是1.5倍,但是平衡正移,大于1.5倍,C项正确。升高温度正反应速
率增大,逆反应速率增大,平衡逆移,D项错误;10.下列有关电解质溶液的说法正确的是( )
已知HCO 的电离常数K =5.6×10-2、K =1.5×10-4,K(HCN)=4.9×10-10,K(HF)=6.6×10-4,
2 2 4 a1 a2 a a
K(NH.HO) =1.8×10-5
b 3 2
A.物质的量浓度均为0.1mol/L的下列溶液中:①NHCl、②NHF、③NH.HO、④(NH)SO、
4 4 3 2 4 2 4
⑤(NH)Fe(SO),c(NH+)大小⑤>④>①>③>②
4 2 4 2 4
B. pH相等的KF溶液与NaCN溶液:c(K+)-c(F-)=c(Na+)-c(CN-)
C.浓度相等的HF、NaF的混合溶液:c(F-)+c(OH-)<c(H+)+c(HF)
D.NaHCO 的溶液中存在c(Na+)> c(HCO-)> c(OH-)> c(CO2-)
2 4 2 4 2 4
【答案】B
【解析】A.NH+水解呈酸性,以①NHCl为参照,②NHF中F-水解呈碱性,促进NH+水解;以
4 4 4 4
④(NH)SO 为参照,⑤(NH)Fe(SO) 中Fe2+水解呈酸性,抑制NH+水解,弱电解质电离和水
4 2 4 4 2 4 2 4
解很少。c(NH+)大小⑤>④>①>②>③,A错误
4
B. pH相等的KF溶液与NaCN溶液:由电荷守恒c(K+)-c(F-) =c(OH-)-c(H+)
c(Na+)-c(CN-) =c(OH-)-c(H+)。B正确
C.由电荷守恒 c(F-)+c(OH-)=c(H+)+c(Na+);由 K(HF)=6.6×10-4,混合 PH<7,c(F
a
-)>c(Na+)> c(HF),c(F-)+c(OH-)>c(H+)+c(HF), C错误
K 1×10-14
D.HCO-的K(HCO)=1.5×10-4,K= W = =1.78×10-13,K>K,溶
2 4 a2 2 2 4 h K(HCO) 5.6×10-2 a2 h
a1 2 2 4
液显酸性,pH<7;电离大于水解c(Na+)> c(HCO-)> c(H+)> c(CO2-)> c(OH-) D错误
2 4 2 4
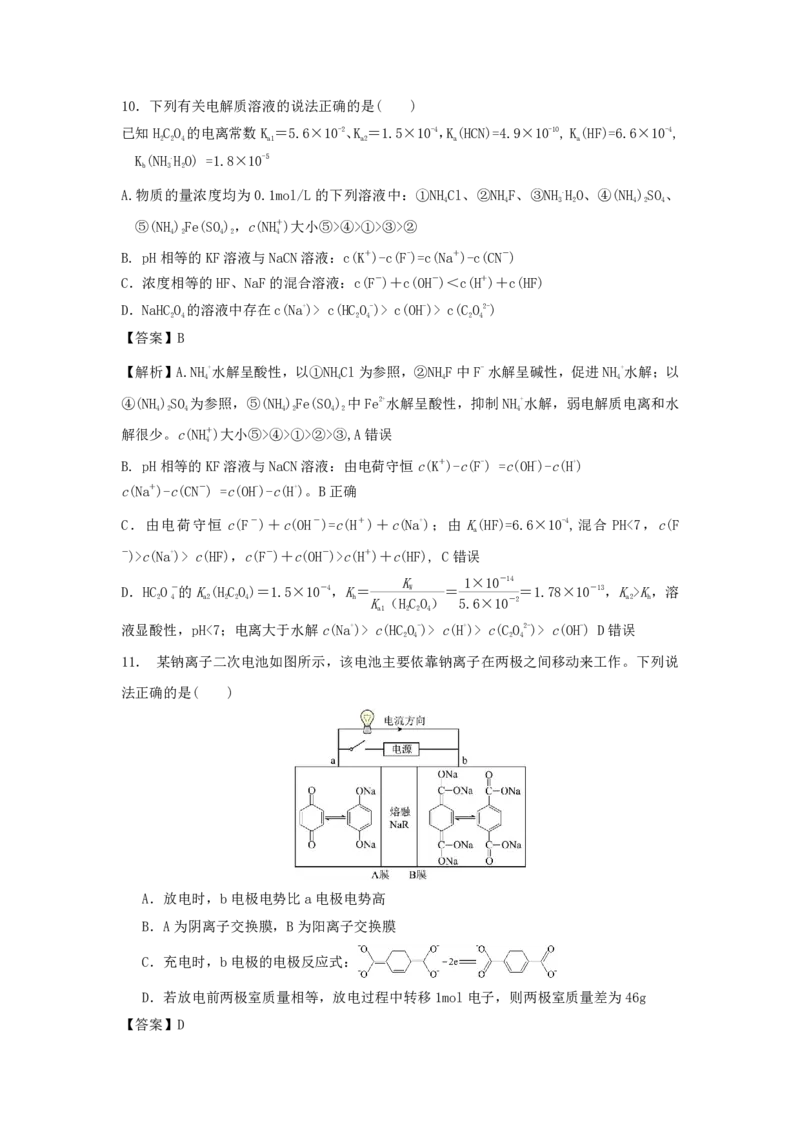
11. 某钠离子二次电池如图所示,该电池主要依靠钠离子在两极之间移动来工作。下列说
法正确的是( )
A.放电时,b电极电势比a电极电势高
B.A为阴离子交换膜,B为阳离子交换膜
C.充电时,b电极的电极反应式:
D.若放电前两极室质量相等,放电过程中转移1mol电子,则两极室质量差为46g
【答案】D【解析】该电池主要依靠钠离子在两极之间移动来工作,由电流方向可知,放电时,b极为
负极, 失去电子发生氧化反应生成 :
,此时钠离子通过阳离子膜B向左侧运动;a极
为正极, 得到电子发生还原反应生成 : +2e-= ,和通过阳离子膜A迁
移过来的钠离子结合生成 ,放电时,a电极电势比b电极电势高,A错误;由分析,A、
B均为阳离子交换膜,B错误;充电时,b电极为阴极,得到电子发生还原反应,电极反应
式: +2e= ,C错误;若放电前两极室质量相等,根据
电子转移关系可知钠离子迁移情况为e-~Na+,则放电过程中转移1mol电子时,有1mol钠离
子由b极区迁移至a极区,b极区减少1mol钠离子、a极增加1mol钠离子,则两极质量差
为23g/mol×1mol×2=46g,D正确。
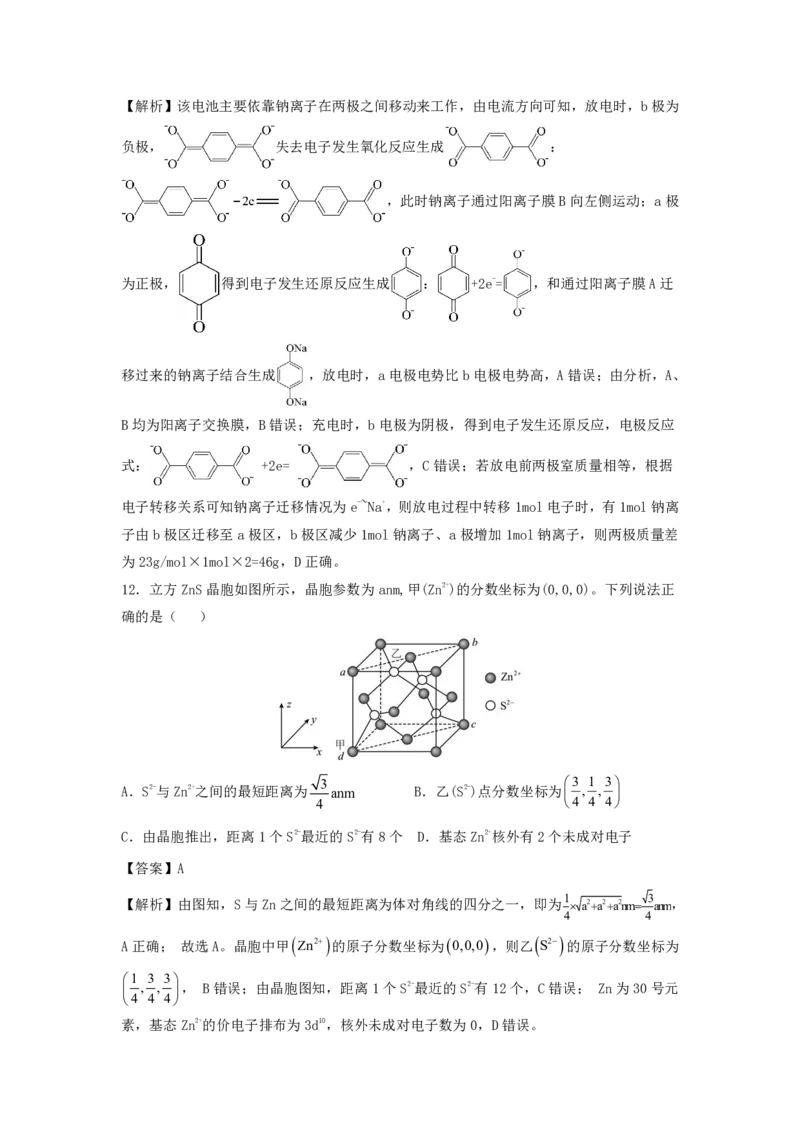
12.立方ZnS晶胞如图所示,晶胞参数为anm,甲(Zn2+)的分数坐标为(0,0,0)。下列说法正
确的是( )
3 3 1 3
A.S2-与Zn2+之间的最短距离为 anm B.乙(S2-)点分数坐标为 , ,
4 4 4 4
C.由晶胞推出,距离1个S2-最近的S2-有8个 D.基态Zn2+核外有2个未成对电子
【答案】A
1 3
【解析】由图知,S与Zn之间的最短距离为体对角线的四分之一,即为 a2a2a2nm anm,
4 4
A正确; 故选A。晶胞中甲 Zn2 的原子分数坐标为0,0,0,则乙 S2 的原子分数坐标为
1 3 3
, , , B错误;由晶胞图知,距离1个S2-最近的S2-有12个,C错误; Zn为30号元
4 4 4
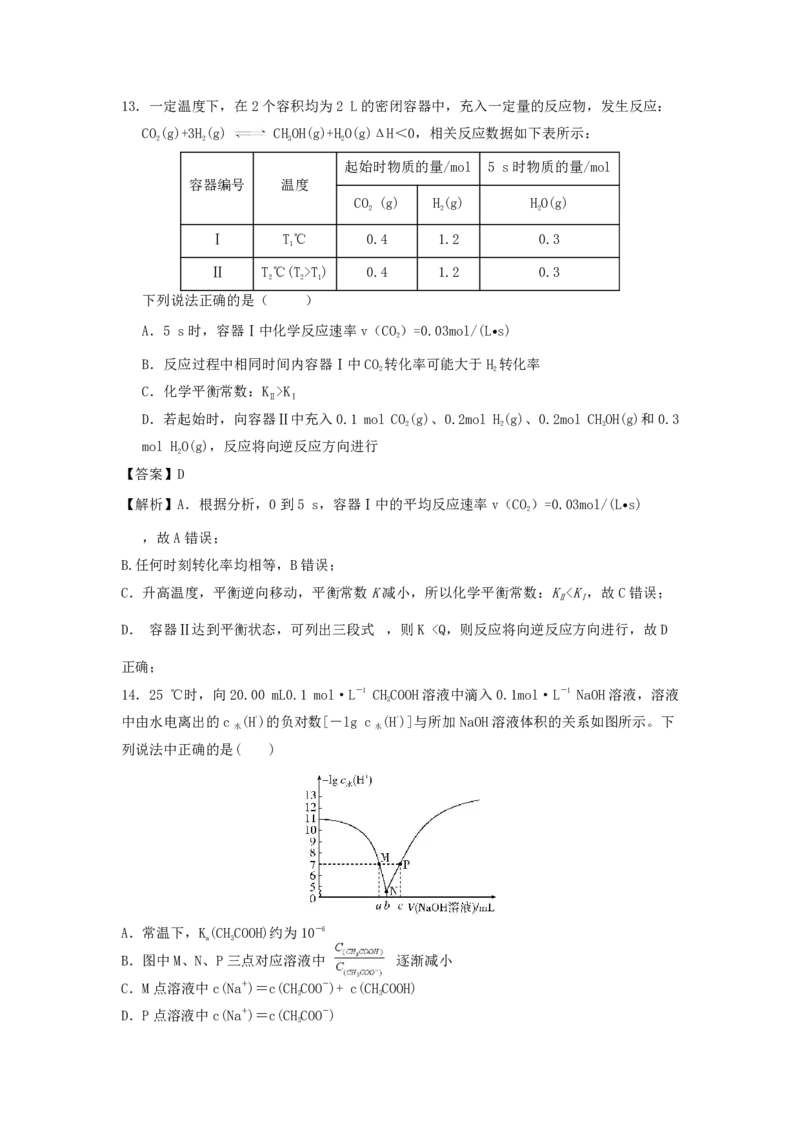
素,基态Zn2+的价电子排布为3d10,核外未成对电子数为0,D错误。13.一定温度下,在2个容积均为2 L的密闭容器中,充入一定量的反应物,发生反应:
CO(g)+3H(g) CHOH(g)+HO(g)ΔH<0,相关反应数据如下表所示:
2 2 3 2
起始时物质的量/mol 5 s时物质的量/mol
容器编号 温度
CO (g) H(g) HO(g)
2 2 2
Ⅰ T℃ 0.4 1.2 0.3
1
Ⅱ T℃(T>T) 0.4 1.2 0.3
2 2 1
下列说法正确的是( )
A.5 s时,容器Ⅰ中化学反应速率v(CO)=0.03mol/(L•s)
2
B.反应过程中相同时间内容器Ⅰ中CO 转化率可能大于H 转化率
2 2
C.化学平衡常数:K >K
Ⅱ Ⅰ
D.若起始时,向容器Ⅱ中充入0.1 mol CO(g)、0.2mol H(g)、0.2mol CHOH(g)和0.3
2 2 3
mol HO(g),反应将向逆反应方向进行
2
【答案】D
【解析】A.根据分析,0到5 s,容器Ⅰ中的平均反应速率v(CO)=0.03mol/(L•s)
2
,故A错误;
B.任何时刻转化率均相等,B错误;
C.升高温度,平衡逆向移动,平衡常数K减小,所以化学平衡常数:K20mL,溶液呈碱性,c(Na+)>c(CHCOO-) D项
3
错误。
二、非选择题:本大题共4个小题,共58分。
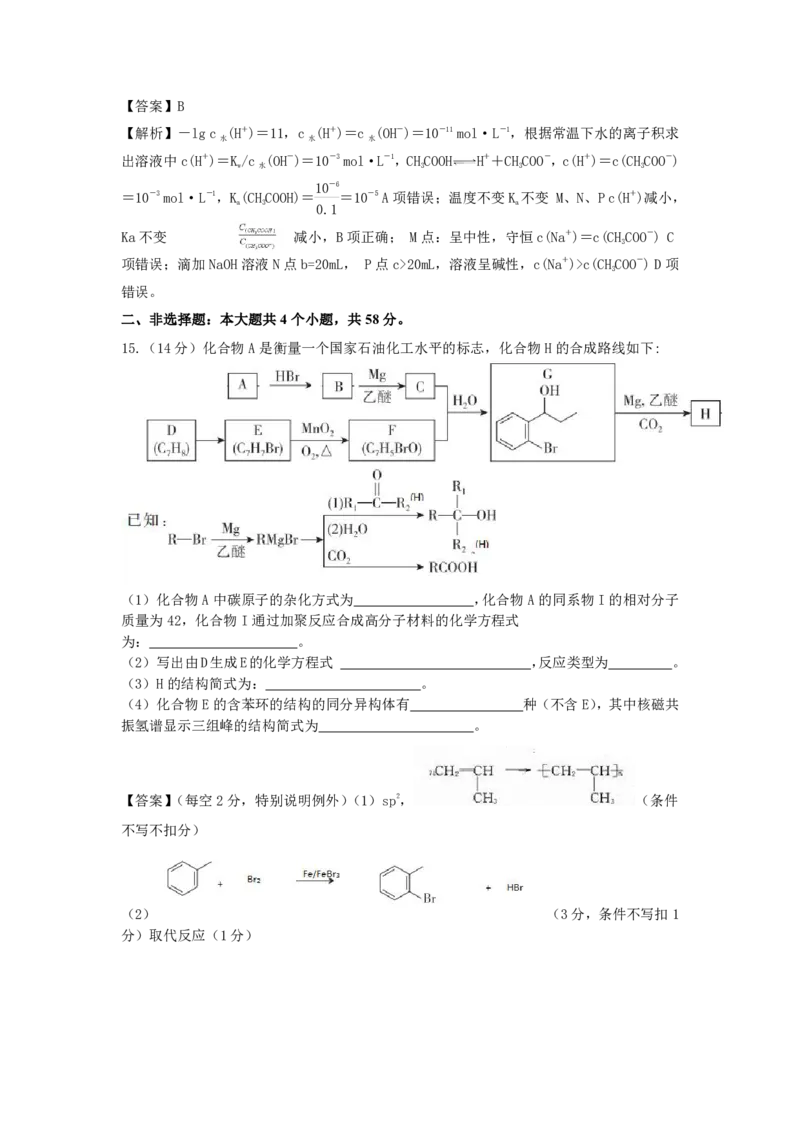
15.(14分)化合物A是衡量一个国家石油化工水平的标志,化合物H的合成路线如下:
(1)化合物A中碳原子的杂化方式为 ,化合物A的同系物I的相对分子
质量为42,化合物I通过加聚反应合成高分子材料的化学方程式
为: 。
(2)写出由D生成E的化学方程式 ,反应类型为 。
(3)H的结构简式为: 。
(4)化合物E的含苯环的结构的同分异构体有 种(不含E),其中核磁共
振氢谱显示三组峰的结构简式为 。
【答案】(每空2分,特别说明例外)(1)sp2, (条件
不写不扣分)
(2) (3分,条件不写扣1
分)取代反应(1分)(3)
(4)3
【解析】此题涉及烃的转化及信息处理,具体推断略,答案如下:
(1)sp2,
(2) 取代反应
(3)
(4)3
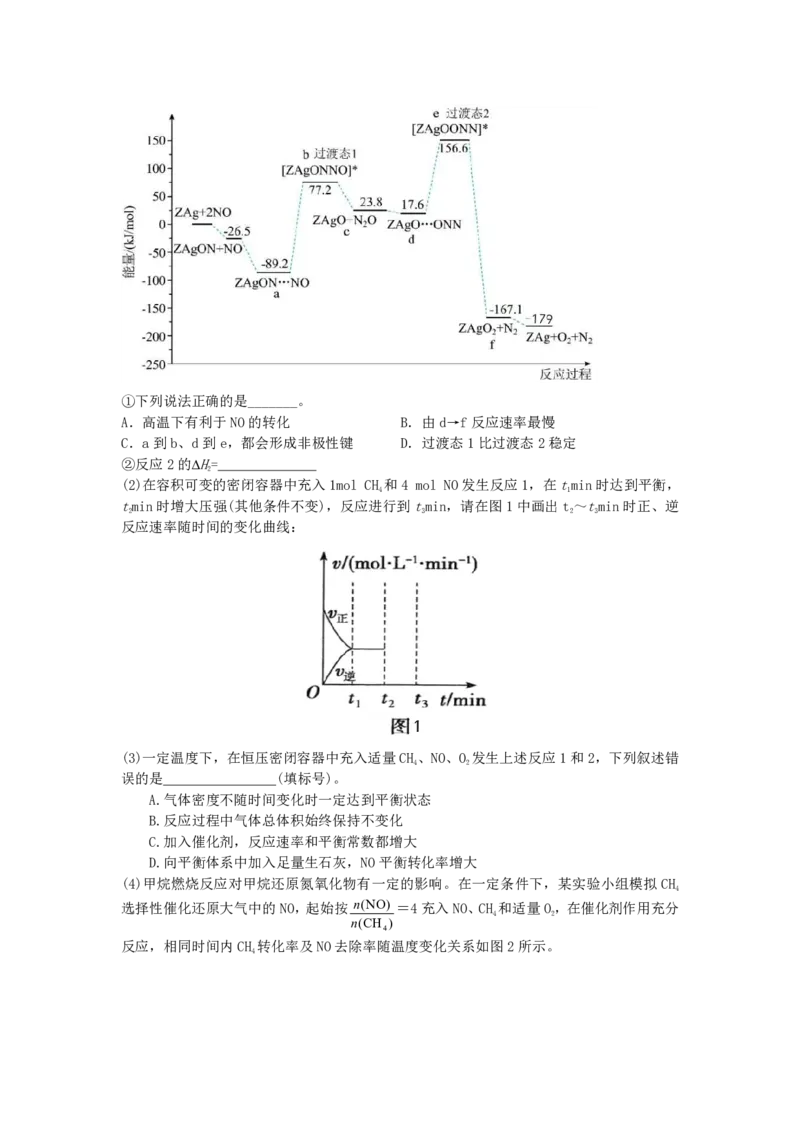
16.(14分)氮氧化物是大气主要污染物之一,富氧条件下甲烷催化还原氮氧化物具有广阔前
景。已知:
反应1:CH(g)+4NO(g) 2N(g)+CO(g)+2HO(g) ∆H=-1160kJ·mol-1
4 2 2 2 1
反应2:CH(g)+2O(g) CO(g)+2HO(g) ∆H
4 2 2 2 2
回答下列问题:
(1)利用催化剂ZAg对NO催化转化的反应过程与能量变化如下图所示。①下列说法正确的是_______。
A.高温下有利于NO的转化 B.由d→f反应速率最慢
C.a到b、d到e,都会形成非极性键 D.过渡态1比过渡态2稳定
②反应2的∆H=
2
(2)在容积可变的密闭容器中充入1mol CH 和4 mol NO发生反应1,在tmin时达到平衡,
4 1
tmin时增大压强(其他条件不变),反应进行到tmin,请在图1中画出t~tmin时正、逆
2 3 2 3
反应速率随时间的变化曲线:
(3)一定温度下,在恒压密闭容器中充入适量CH、NO、O 发生上述反应1和2,下列叙述错
4 2
误的是 (填标号)。
A.气体密度不随时间变化时一定达到平衡状态
B.反应过程中气体总体积始终保持不变化
C.加入催化剂,反应速率和平衡常数都增大
D.向平衡体系中加入足量生石灰,NO平衡转化率增大
(4)甲烷燃烧反应对甲烷还原氮氧化物有一定的影响。在一定条件下,某实验小组模拟CH
4
选择性催化还原大气中的NO,起始按 n(NO) =4充入NO、CH 和适量O,在催化剂作用充分
4 2
n(CH )
4
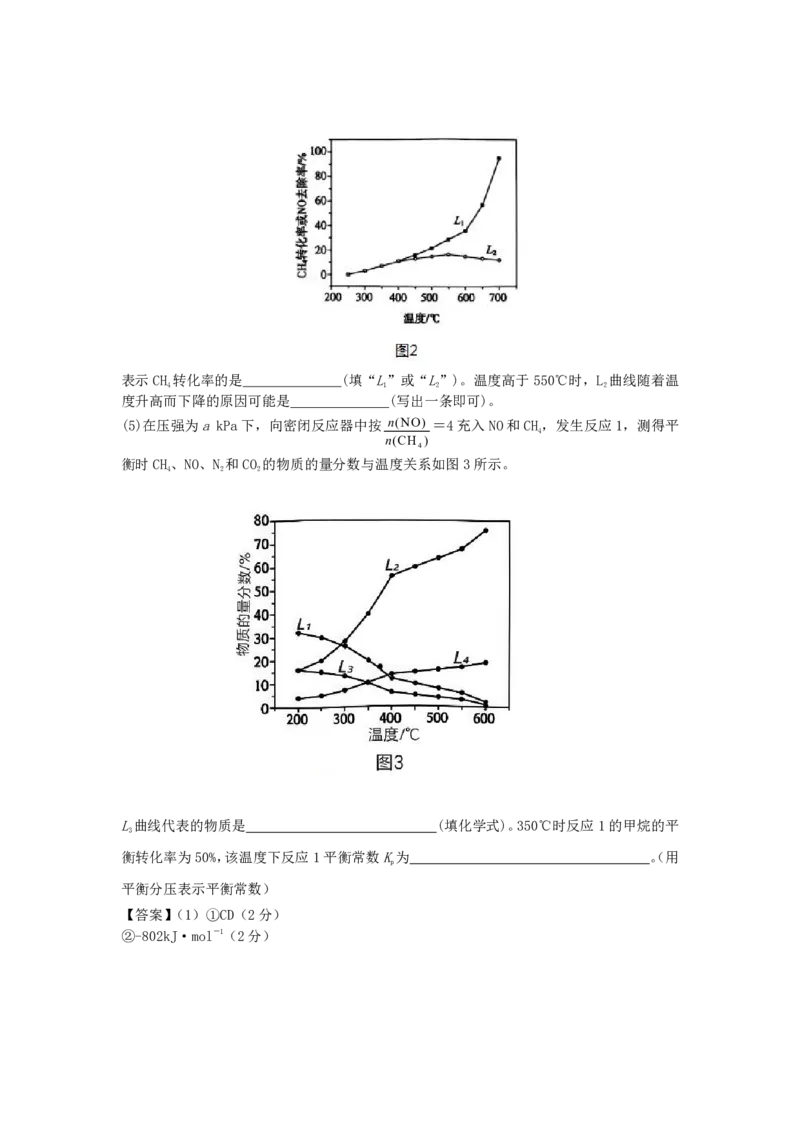
反应,相同时间内CH 转化率及NO去除率随温度变化关系如图2所示。
4表示CH 转化率的是 (填“L”或“L”)。温度高于550℃时,L 曲线随着温
4 1 2 2
度升高而下降的原因可能是 (写出一条即可)。
(5)在压强为akPa下,向密闭反应器中按 n(NO) =4充入NO和CH,发生反应1,测得平
4
n(CH )
4
衡时CH、NO、N 和CO 的物质的量分数与温度关系如图3所示。
4 2 2
L曲线代表的物质是 (填化学式)。350℃时反应1的甲烷的平
3
衡转化率为50%,该温度下反应1平衡常数K为 。(用
p
平衡分压表示平衡常数)
【答案】(1)①CD(2分)
②-802kJ·mol-1(2分)(2) (2分)
(3)AC(2分)
(4)L(1分) 升高温度,反应2为主(2分)
1
(5)CO(1分), 0.0625(或1/16)(2分)
2
【解析】(1)①H<0,低温有利于NO转化,A错;a→c反应活化能最大,反应速率最慢,
B错;a→b形成NN,d→e形成OO,C对;过渡态1的能量较过渡态2能量低,过渡态1稳
定,D对。②根据图形分析2NO(g)=N(g)+O(g)∆H=-179KJ/mol,根据盖斯定律计算∆
2 2
H=-802KJ/mol (2)反应1两边气体系数相等,增大压强速率增大,平衡不发生移动。(3)
2
恒压密闭容器,反应1、2的反应前后物质的量不变,加入催化剂不影响平衡,减少生成物
浓度平衡向正反应方向移动,所以选AC。(4)初始阶段,随着温度升高,反应速率加快,
甲烷转化率与NO的去除率均增大,当温度高于550℃时甲烷的转化率仍然增大,NO去除率
下降,反应1、2存在竞争,反应2为主要反应,所以L 表示甲烷转化率。(5)温度升高反
1
应1平衡向逆向移动,L、L 下降为生成物,L、L 为反应物,根据定量关系,L 为CO,根
1 3 2 4 3 2
据 CH(g)+4NO(g) 2N(g)+CO(g)+2HO(g)
4 2 2 2
起始 1 4 0 0 0
反应 0.5 2 1 0.5 1
平衡 0.5 2 1 0.5 1
Kp=(12×0.5×12)/(0.5×24)=1/16=0.0625
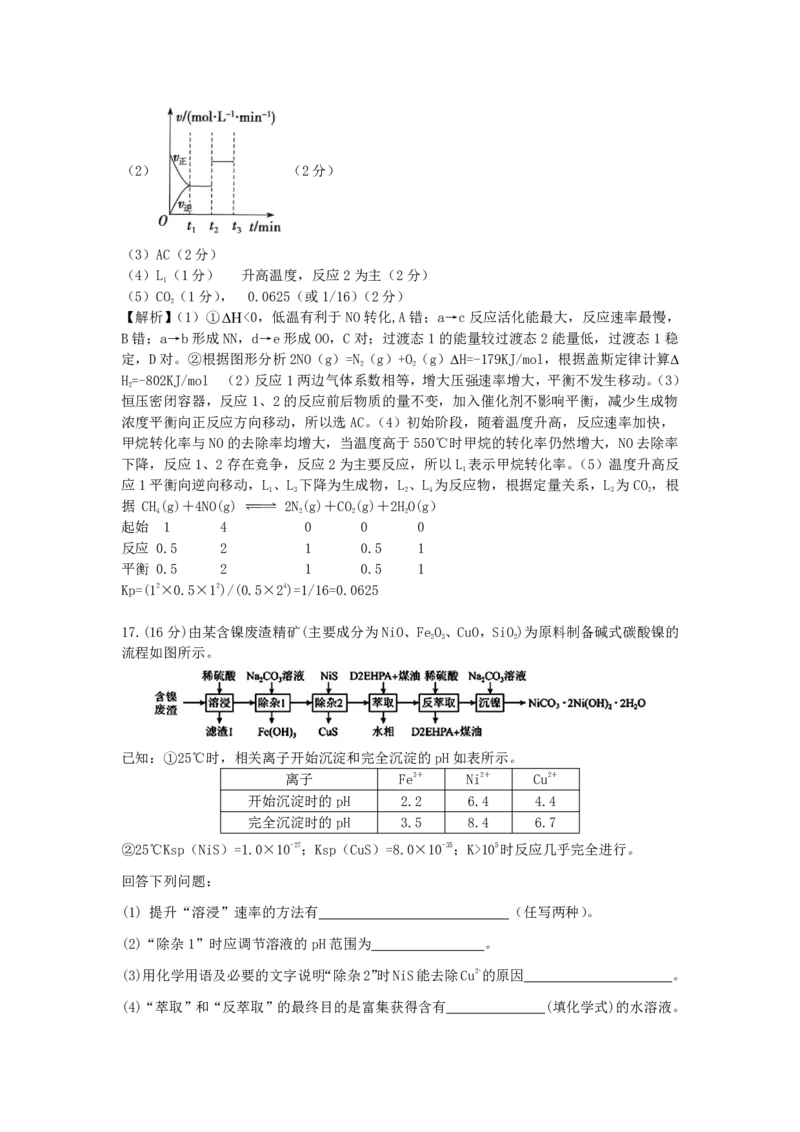
17.(16分)由某含镍废渣精矿(主要成分为NiO、FeO、CuO,SiO)为原料制备碱式碳酸镍的
2 3 2
流程如图所示。
已知:①25℃时,相关离子开始沉淀和完全沉淀的pH如表所示。
离子 Fe3+ Ni2+ Cu2+
开始沉淀时的pH 2.2 6.4 4.4
完全沉淀时的pH 3.5 8.4 6.7
②25℃Ksp(NiS)=1.0×10-27;Ksp(CuS)=8.0×10-35;K>105时反应几乎完全进行。
回答下列问题:
(1) 提升“溶浸”速率的方法有 (任写两种)。
(2)“除杂1”时应调节溶液的pH范围为 。
(3)用化学用语及必要的文字说明“除杂2”时NiS能去除Cu2+的原因 。
(4)“萃取”和“反萃取”的最终目的是富集获得含有 (填化学式)的水溶液。(5)“沉镍”时应控制温度为95℃,反应除生成NiCO·2Ni(OH)·2HO沉淀外,还有一种无
3 2 2
色气体生成,写出该反应的化学方程式: 。
(6)配合物 Ni(CO) 能够和 PCl 发生配体置换反应:Ni(CO)₄+4PCl₃
4 3
=Ni(PCl) +4CO↑
3 4
①Ni(CO) 为无色挥发性液体,可推测 Ni(CO) 的晶体类型是 ,
4 4
Ni(CO) 中δ键与π键的个数比为 。
4
②与CO互为等电子体且带 1 个单位的负电荷的阴离子的电子式为 。
③PCl₃分子空间构型为 _°
④Ni、K、F三种元素组成的一种晶体的长方体晶胞如图所示,若该晶体的密度为
ρg/cm3,则阿伏伽德罗常数N= (用a b ρ的式子表示)
A
【答案】(1)废渣研细、适当升温、适当提高硫酸浓度等(合理即可)。(2分)
(2)3.5≤PH<4.4(2分)
(3)NiS(s)+Cu2+(aq) ⇋ CuS(s)+Ni2+ (aq) K=Ksp(NiS)/Ksp(CuS)
=1.0×10-27/8.0×10-35>105(2分)
(4)NiSO(2分)
4
(5)3NiSO+3NaCO+4HO NiCO•2Ni(OH)•2HO↓+2CO↑+3NaSO(2分)
4 2 3 2 3 2 2 2 2 4
(1 分)
(6)①分子晶体(1 分) 1:1(1 分) ② ③ 三角锥形
mol-1
(1 分)④ (单位不写也给分)(2分)
23
4.26×10
2
【解析】(1)废渣研细、适当升温、适当提高硫酸浓度等(合理即可)。
(2)调节pH使Fe3+完全沉淀,而Ni2+、Cu2+不沉淀,所以3.5≤PH<4.4。
(3)NiS(s)+Cu2+(aq) ⇋ CuS(s)+Ni2+ (aq) K=Ksp(NiS)/Ksp(CuS)
=1.0×10-27/8.0×10-35>105。
(4)根据实验目的及阴离子情况,富集的是NiSO(1分)。
4
(5)3NiSO+3NaCO+4HO NiCO•2Ni(OH)•2HO+2CO↑+3NaSO
4 2 3 2 3 2 2 2 2 4
(6)①分子晶体 1:1 ② ③ 三角锥形 ④根据均摊法晶胞中Ni为
1/8×8+1=2;F为1/4×16+2+1/2×4=8;K为2+1/4×8=4,所以ρ=426/(N×a2b×10-21)所
A
mol-1
以N=
A
23
4.26×10
2
18.(14分)焦亚硫酸钠(NaSO)作为一种还原剂,可以抑制多酚氧化酶的活性,防止食
2 2 5
品中的葡萄糖与氨基酸发生糖氨反应,从而防止食品褐变。某学习小组通过NaHSO 过饱和
3溶液结晶脱水制备NaSO 并进行相关探究,回答下列问题:
2 2 5
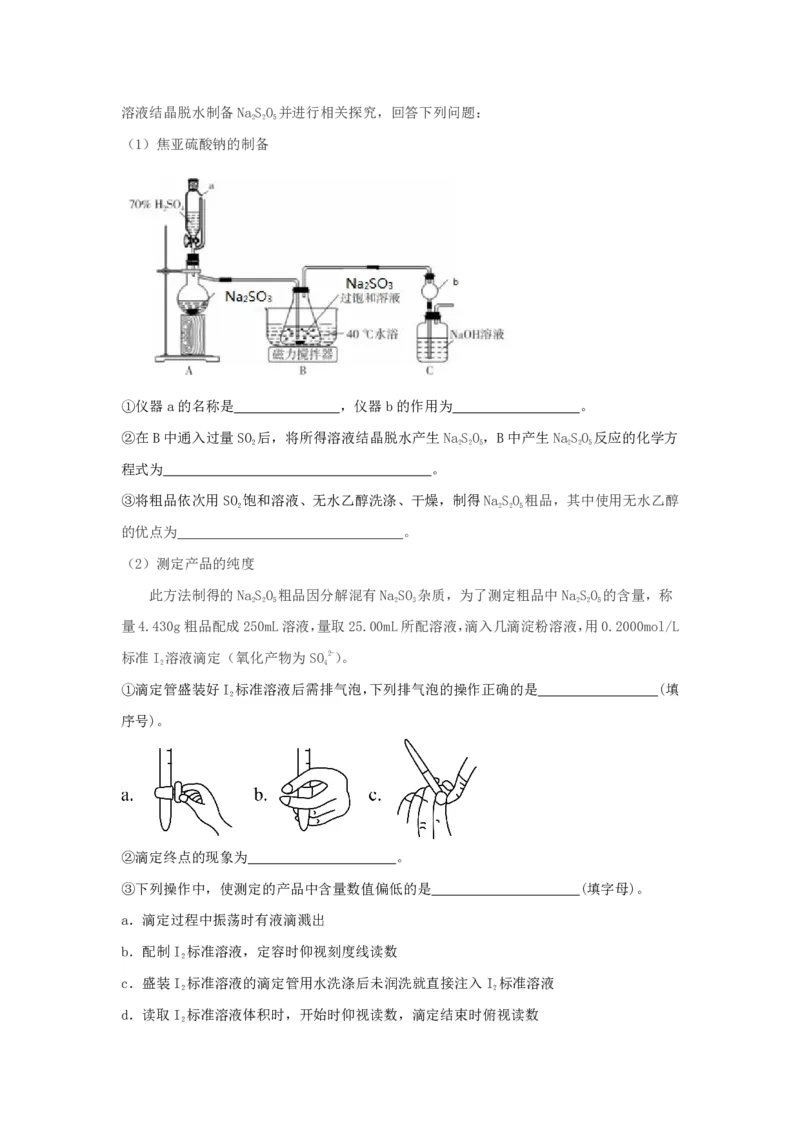
(1)焦亚硫酸钠的制备
①仪器a的名称是 ,仪器b的作用为 。
②在B中通入过量SO 后,将所得溶液结晶脱水产生NaSO,B中产生NaSO 反应的化学方
2 2 2 5 2 2 5
程式为 。
③将粗品依次用SO 饱和溶液、无水乙醇洗涤、干燥,制得NaSO 粗品,其中使用无水乙醇
2 2 2 5
的优点为 。
(2)测定产品的纯度
此方法制得的NaSO 粗品因分解混有NaSO 杂质,为了测定粗品中NaSO 的含量,称
2 2 5 2 3 2 2 5
量4.430g粗品配成250mL溶液,量取25.00mL所配溶液,滴入几滴淀粉溶液,用0.2000mol/L
标准I 溶液滴定(氧化产物为SO2-)。
2 4
①滴定管盛装好I 标准溶液后需排气泡,下列排气泡的操作正确的是 (填
2
序号)。
②滴定终点的现象为 。
③下列操作中,使测定的产品中含量数值偏低的是 (填字母)。
a.滴定过程中振荡时有液滴溅出
b.配制I 标准溶液,定容时仰视刻度线读数
2
c.盛装I 标准溶液的滴定管用水洗涤后未润洗就直接注入I 标准溶液
2 2
d.读取I 标准溶液体积时,开始时仰视读数,滴定结束时俯视读数
2④若达到滴定终点时测得消耗标准溶液的体积平均为22.50mL,则粗品中NaSO 的质量分数
2 2 5
分数为 。(保留三位有效数字)
【答案】(1)①恒压滴液漏斗(分液漏斗给分)(1分),防止倒吸(1分)
②2NaHSO=NaSO+HO(2分)
3 2 2 5 2
③减少产品溶解损失,加快去除表面水分,易于干燥(2分)
(2)①b(2分)②加入最后一滴(或半滴)溶液时溶液由无色突变为蓝色,30s不变(2
分)
③ad(2分) ④85.8%(2分)
【解析】(1)①恒压分液漏斗(分液漏斗给分),防止倒吸
②2NaHSO=NaSO+HO
3 2 2 5 2
③减少产品溶解损失,加快去除表面水分,易于干燥
(2)①酸式滴定的排空气的方法,所以选b(2分)②加入最后一滴(或半滴)溶液时溶液
由无色突变为蓝色,30s不变
③a有液体溅出,测量消耗标准液偏低;b定容仰视刻度线导致配制溶液浓度偏低,消耗标准
液偏高;c没有润洗,导致标准液浓度偏低,消耗量偏高;d开始仰视后俯视读数偏低。所
以选ad)
④NaSO-2I; NaSO-I,设NaSO 的物质的量为x,NaSO 的物质的量为y,则
2 2 5 2 2 3 2 2 2 5 2 3
190x+126y=4.43;2x+y=0.0225×0.2000×10=0.045,解得x=0.02mol,则ω(NaSO)=(0.02
2 2 5
×190)/4.43=85.8%