文档内容
高 2023 级高二下期 5 月阶段性测试化学试题 5.N A 为阿伏加德罗常数的值,下列说法正确的是
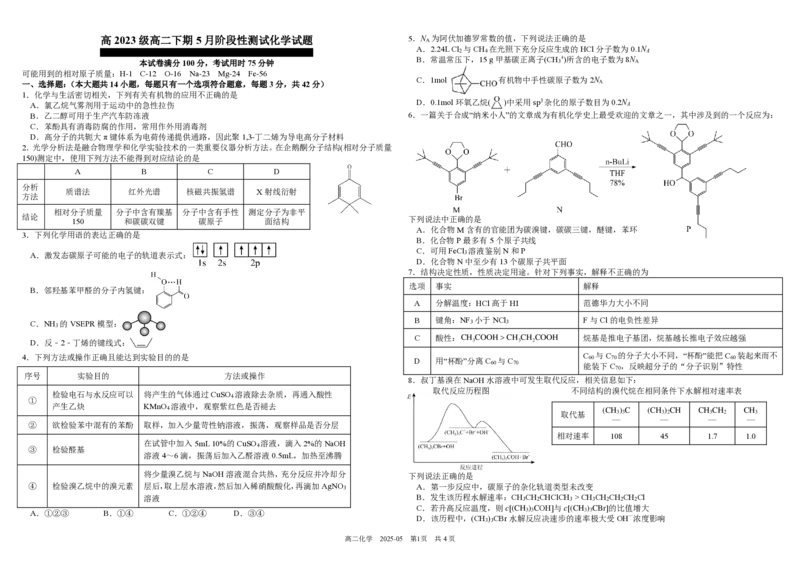
A.2.24L Cl 与CH 在光照下充分反应生成的HCl分子数为0.1N
命题人:张新宇、熊珂 审题人:赵凤玲、许兴旺、奚洋海 2 4 A
B.常温常压下,15 g甲基碳正离子(CH +)所含的电子数为8N
本试卷满分100分,考试用时75分钟 3 A
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 Fe-56
C.1mol 有机物中手性碳原子数为2N
一、选择题:(本大题共14小题,每题只有一个选项符合题意,每题3分,共42分) A
1.化学与生活密切相关,下列有关有机物的应用不正确的是
D.0.1mol环氧乙烷( )中采用sp3杂化的原子数目为0.2N
A.氯乙烷气雾剂用于运动中的急性拉伤 A
B.乙二醇可用于生产汽车防冻液 6.一篇关于合成“纳米小人”的文章成为有机化学史上最受欢迎的文章之一,其中涉及到的一个反应为:
C.苯酚具有消毒防腐的作用,常用作外用消毒剂
D.高分子的共轭大π键体系为电荷传递提供通路,因此聚1,3-丁二烯为导电高分子材料
2.光学分析法是融合物理学和化学实验技术的一类重要仪器分析方法。在企鹅酮分子结构(相对分子质量
150)测定中,使用下列方法不能得到对应结论的是
A B C D
分析
质谱法 红外光谱 核磁共振氢谱 X射线衍射
方法
相对分子质量 分子中含有羰基 分子中含有手性 测定分子为非平
结论
150 和碳碳双键 碳原子 面结构 下列说法中正确的是
A.化合物M含有的官能团为碳溴键,碳碳三键,醚键,苯环
3.下列化学用语的表达正确的是
B.化合物P最多有5个原子共线
C.可用FeCl 溶液鉴别N和P
A.激发态碳原子可能的电子的轨道表示式: 3
D.化合物N中至少有13个碳原子共平面
7.结构决定性质,性质决定用途。针对下列事实,解释不正确的为
选项 事实 解释
B.邻羟基苯甲醛的分子内氢键:
A 分解温度:HCl高于HI 范德华力大小不同
B 键角:NF 小于NCl F与Cl的电负性差异
C.NH 的VSEPR模型: 3 3
3
C 酸性:
D.反﹣2﹣丁烯的键线式:
4.下列方法或操作正确且能达到实验目的的是
序号 实验目的 方法或操作
检验电石与水反应可以 将产生的气体通过CuSO 溶液除去杂质,再通入酸性
4
①
产生乙炔 KMnO 溶液中,观察紫红色是否褪去
4
② 欲检验苯中混有的苯酚 取样,加入少量苛性钠溶液,振荡,观察样品是否分层
在试管中加入5mL 10%的CuSO 溶液,滴入2%的NaOH
4
③ 检验醛基
溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾
将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却分
④ 检验溴乙烷中的溴元素 层后,取上层水溶液,然后加入稀硝酸酸化,再滴加AgNO
3
溶液
A.①②③ B.①④ C.①②④ D.③④
高二化学 2025-05 第1页 共4页
C H
3
C O O H C H
3
C H
2
C O O H 烷基是推电子基团,烷基越长推电子效应越强
C 与C 的分子大小不同,“杯酚”能把C 装起来而不 D 用“杯酚”分离C 与C 60 70 60
60 70 能装下C ,反映超分子的“分子识别”特性
70
8.叔丁基溴在NaOH水溶液中可发生取代反应,相关信息如下:
取代反应历程图 不同结构的溴代烷在相同条件下水解相对速率表
(CH ) C (CH ) CH CH CH CH
取代基 3 3 3 2 3 2 3
— — — —
相对速率 108 45 1.7 1.0
下列说法正确的是
A.第一步反应中,碳原子的杂化轨道类型未改变
B.发生该历程水解速率:CH CH CHClCH > CH CH CH CH Cl
3 2 3 3 2 2 2
C.若升高反应温度,则c[(CH ) COH]与c[(CH ) CBr]的比值增大
3 3 3 3
D.该历程中,(CH ) CBr水解反应决速步的速率极大受OH—浓度影响
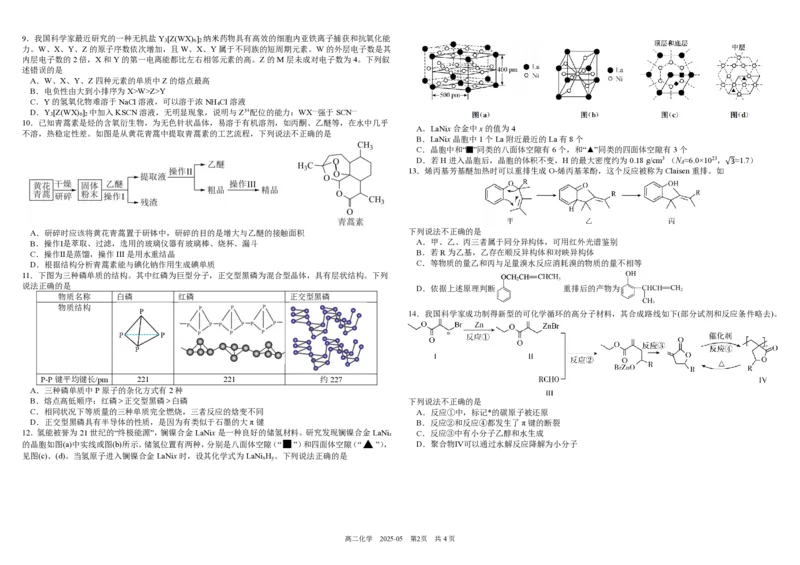
3 39.我国科学家最近研究的一种无机盐Y [Z(WX) ] 纳米药物具有高效的细胞内亚铁离子捕获和抗氧化能
3 6 2
力。W、X、Y、Z的原子序数依次增加,且W、X、Y属于不同族的短周期元素。W的外层电子数是其
内层电子数的2倍,X和Y的第一电离能都比左右相邻元素的高。Z的M层未成对电子数为4。下列叙
述错误的是
A.W、X、Y、Z四种元素的单质中Z的熔点最高
B.电负性由大到小排序为X>W>Z>Y
C.Y的氢氧化物难溶于NaCl溶液,可以溶于浓NH Cl溶液
4
D.Y [Z(WX) ] 中加入KSCN溶液,无明显现象,说明与Z3+配位的能力:WX—强于SCN—
3 6 2
10.已知青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于有机溶剂,如丙酮、乙醚等,在水中几乎
不溶,热稳定性差。如图是从黄花青蒿中提取青蒿素的工艺流程,下列说法不正确的是
A.研碎时应该将黄花青蒿置于研钵中,研碎的目的是增大与乙醚的接触面积
B.操作Ⅰ是萃取、过滤,选用的玻璃仪器有玻璃棒、烧杯、漏斗
C.操作Ⅱ是蒸馏,操作III是用水重结晶
D.根据结构分析青蒿素能与碘化钠作用生成碘单质
11.下图为三种磷单质的结构。其中红磷为巨型分子,正交型黑磷为混合型晶体,具有层状结构。下列
说法正确的是
物质名称 白磷 红磷 正交型黑磷
物质结构
P-P键平均键长/pm 221 221 约227
A.三种磷单质中P原子的杂化方式有2种
B.熔点高低顺序:红磷
高二化学 2025-05 第2页 共4页
正交型黑磷
A.LaNix合金中x的值为4
B.LaNix晶胞中1个La附近最近的La有8个
C.晶胞中和“ ”同类的八面体空隙有6个,和“▲”同类的四面体空隙有3个
D.若H进入晶胞后,晶胞的体积不变,H的最大密度约为0.18 g/cm3 (N
A
≈6.0×1023,√3≈1.7)
13.烯丙基芳基醚加热时可以重排生成O-烯丙基苯酚,这个反应被称为Claisen重排。如
下列说法不正确的是
A.甲、乙、丙三者属于同分异构体,可用红外光谱鉴别
B.若R为乙基,乙存在顺反异构体和对映异构体
C.等物质的量乙和丙与足量溴水反应消耗溴的物质的量不相等
D.依据上述原理判断 重排后的产物为
14.我国科学家成功制得新型的可化学循环的高分子材料,其合成路线如下(部分试剂和反应条件略去)。
白磷 下列说法不正确的是
C.相同状况下等质量的三种单质完全燃烧,三者反应的焓变不同 A.反应①中,标记*的碳原子被还原
D.正交型黑磷具有半导体的性质,是因为有类似于石墨的大π键 B.反应②和反应④都发生了π键的断裂
12.氢能被誉为21世纪的“终极能源”,镧镍合金LaNix是一种良好的储氢材料。研究发现镧镍合金LaNi
x
C.反应③中有小分子乙醇和水生成
的晶胞如图(a)中实线或图(b)所示。储氢位置有两种,分别是八面体空隙(“ ”)和四面体空隙(“ ”), D.聚合物Ⅳ可以通过水解反应降解为小分子
见图(c)、(d)。当氢原子进入镧镍合金LaNix时,设其化学式为LaNi H 。下列说法正确的是
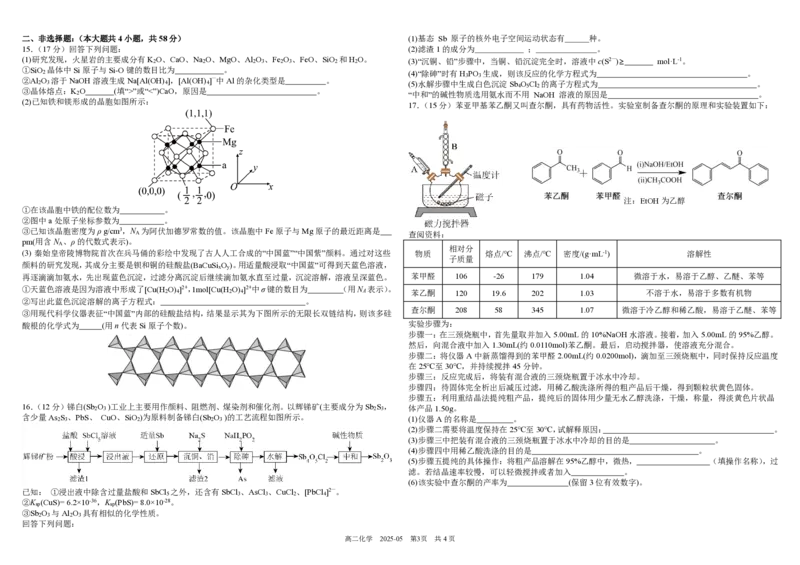
x y二、非选择题:(本大题共4小题,共58分) (1)基态 Sb 原子的核外电子空间运动状态有 种。
15.(17分)回答下列问题: (2)滤渣1的成分为 ; 。
(1)研究发现,火星岩的主要成分有K 2 O、CaO、Na 2 O、MgO、Al 2 O 3 、Fe 2 O 3 、FeO、SiO 2 和H 2 O。 (3)“沉铜、铅”步骤中,当铜、铅沉淀完全时,溶液中c(S2—)≥ mol·L-1。
①SiO 晶体中Si原子与Si-O键的数目比为 。
2 (4)“除砷”时有H PO 生成,则该反应的化学方程式为 。
3 3
②Al O 溶于NaOH溶液生成Na[Al(OH) ],[Al(OH) ]—中Al的杂化类型是 。
2 3 4 4 (5)水解步骤中生成白色沉淀Sb O Cl 的离子方程式为 。
4 5 2
③晶体熔点:K O (填“>”或“<”)CaO,原因是 。
2 “中和”的碱性物质选用氨水而不用 NaOH 溶液的原因是 。
(2)已知铁和镁形成的晶胞如图所示:
17.(15分)苯亚甲基苯乙酮又叫查尔酮,具有药物活性。实验室制备查尔酮的原理和实验装置如下:
注:EtOH为乙醇
①在该晶胞中铁的配位数为 。
②图中a处原子坐标参数为 。
③已知该晶胞密度为ρ g/cm3,N 为阿伏加德罗常数的值。该晶胞中Fe原子与Mg原子的最近距离是
A 查阅资料:
pm(用含N 、ρ的代数式表示)。
A
相对分
(3) 秦始皇帝陵博物院首次在兵马俑的彩绘中发现了古人人工合成的“中国蓝”“中国紫”颜料。通过对这些 物质 熔点/℃ 沸点/℃ 密度/(g·mL-1) 溶解性
子质量
颜料的研究发现,其成分主要是钡和铜的硅酸盐(BaCuSi O )。用适量酸浸取“中国蓝”可得到天蓝色溶液,
x y
再逐滴滴加氨水,先出现蓝色沉淀,过滤分离沉淀后继续滴加氨水直至过量,沉淀溶解,溶液呈深蓝色。 苯甲醛 106 -26 179 1.04 微溶于水,易溶于乙醇、乙醚、苯等
①天蓝色溶液是因为溶液中形成了[Cu(H O) ]2+,1mol[Cu(H O) ]2+中σ键的数目为 ( 用N 表示)。
2 4 2 4 A 苯乙酮 120 19.6 202 1.03 不溶于水,易溶于多数有机物
②写出此蓝色沉淀溶解的离子方程式: 。
查尔酮 208 58 345 1.07 微溶于冷乙醇和稀乙酸,易溶于乙醚、苯等
③用现代科学仪器表征“中国蓝”内部的硅酸盐结构,结果显示其为下图所示的无限长双链结构,则该多硅
酸根的化学式为 (用n代表Si原子个数)。 实验步骤为:
步骤一:在三颈烧瓶中,首先量取并加入5.00mL的10%NaOH水溶液。接着,加入5.00mL的95%乙醇。
然后,向混合液中加入1.30mL(约0.0110mol)苯乙酮。最后,启动搅拌器,使溶液充分混合。
步骤二:将仪器A中新蒸馏得到的苯甲醛2.00mL(约0.0200mol),滴加至三颈烧瓶中,同时保持反应温度
在25℃至30℃,并持续搅拌45分钟。
步骤三:反应完成后,将装有混合液的三颈烧瓶置于冰水中冷却。
步骤四:待固体完全析出后减压过滤,用稀乙酸洗涤所得的粗产品后干燥,得到颗粒状黄色固体。
步骤五:利用重结晶法提纯粗产品,提纯后的固体用少量无水乙醇洗涤,干燥,称量,得淡黄色片状晶
16.(12分)锑白(Sb 2 O 3 )工业上主要用作颜料、阻燃剂、煤染剂和催化剂。以辉锑矿(主要成分为Sb 2 S 3 , 体产品1.50g。
含少量As 2 S 3 、PbS、 CuO、SiO 2 )为原料制备锑白(Sb 2 O 3 )的工艺流程如图所示。 (1)仪器A的名称是 。
(2)步骤二需要将温度保持在25℃至30℃,试解释原因: 。
(3)步骤三中把装有混合液的三颈烧瓶置于冰水中冷却的目的是 。
(4)步骤四中用稀乙酸洗涤的目的是 。
(5)步骤五提纯的具体操作:将粗产品溶解在95%乙醇中,微热, (填操作名称),过
滤。若结晶速率较慢,可以轻微搅拌或者加入 。
(6)该实验中查尔酮的产率为 (保留3位有效数字)。
已知: ①浸出液中除含过量盐酸和SbCl
5
之外,还含有SbCl
3
、AsCl
3
、CuCl
2
、[PbCl
4
]2—。
②K (CuS)= 6.2×10-36,K (PbS)= 8.0×10-28。
sp sp
③Sb O 与Al O 具有相似的化学性质。
2 3 2 3
回答下列问题:
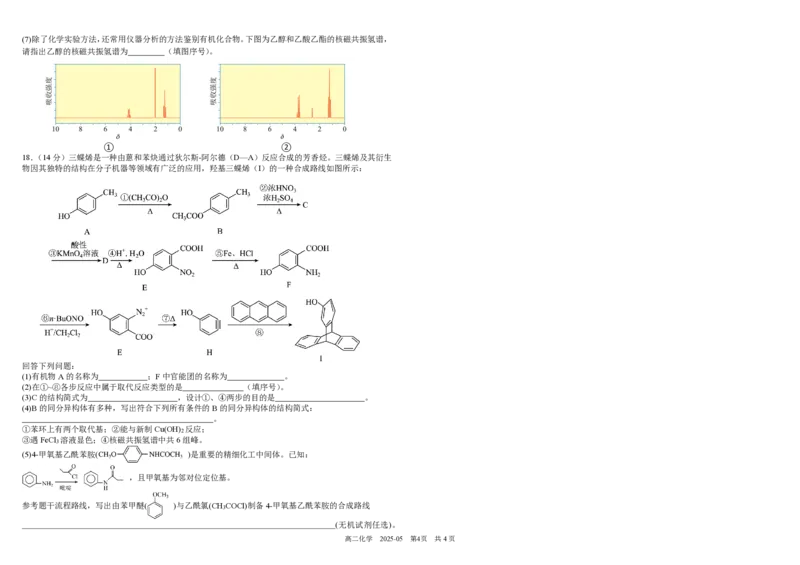
高二化学 2025-05 第3页 共4页(7)除了化学实验方法,还常用仪器分析的方法鉴别有机化合物。下图为乙醇和乙酸乙酯的核磁共振氢谱,
请指出乙醇的核磁共振氢谱为 (填图序号)。
① ②
18.(14分)三蝶烯是一种由蒽和苯炔通过狄尔斯-阿尔德(D—A)反应合成的芳香烃。三蝶烯及其衍生
物因其独特的结构在分子机器等领域有广泛的应用,羟基三蝶烯(I)的一种合成路线如图所示:
回答下列问题:
(1)有机物A的名称为 ;F中官能团的名称为 。
(2)在①~⑧各步反应中属于取代反应类型的是 (填序号)。
(3)C的结构简式为 ,设计①、④两步的目的是 。
(4)B的同分异构体有多种,写出符合下列所有条件的B的同分异构体的结构简式:
。
①苯环上有两个取代基;②能与新制Cu(OH)
2
反应;
③遇FeCl
3
溶液显色;④核磁共振氢谱中共6组峰。
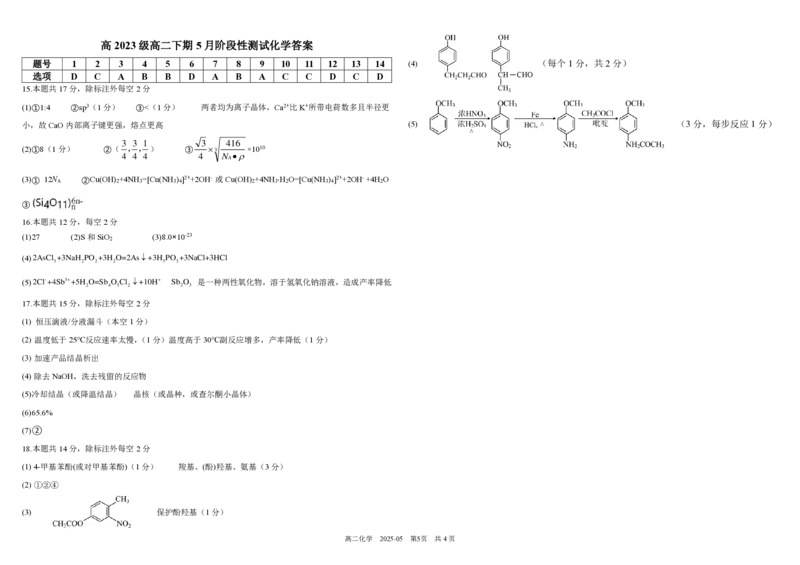
(5)4-甲氧基乙酰苯胺( )是重要的精细化工中间体。已知:
,且甲氧基为邻对位定位基。
参考题干流程路线,写出由苯甲醚( )与乙酰氯(CH
3
COCl)制备4-甲氧基乙酰苯胺的合成路线
(无机试剂任选)。
高二化学 2025-05 第4页 共4页高 2023 级高二下期 5 月阶段性测试化学答案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
选项 D C A B B D A B A C C D C D
15.本题共17分,除标注外每空2分
(1)①1:4 ②sp3(1分) ③<(1分) 两者均为离子晶体,Ca2+比K+所带电荷数多且半径更
小,故CaO内部离子键更强,熔点更高
(2)①8(1分) ②(
高二化学 2025-05 第5页 共4页
3
4
,
3
4
,
1
4
) ③
4
3
3
4 1 6
N
A
•
×1010
(3)① 12N
A
②Cu(OH)
2
+4NH
3
=[Cu(NH
3
)
4
]2++2OH- 或Cu(OH)
2
+4NH 3·H
2
O=[Cu(NH
3
)
4
]2++2OH- +4H
2
O
③
16.本题共12分,每空2分
(1)27 (2)S和SiO (3)8.0×10-23
2
(4) 2 A s C l
3
+ 3 N a H
2
P O
2
+ 3 H
2
O = 2 A s + 3 H
3
P O
3
+ 3 N a C l+ 3 H C l
(5) 2 C l - + 4 S b 3 + + 5 H
2
O = S b
4
O
5
C l
2
+ 1 0 H + S b
2
O
3
(4) (每个1分,共2分)
(5) (3分,每步反应1分)
是一种两性氧化物,溶于氢氧化钠溶液,造成产率降低
17.本题共15分,除标注外每空2分
(1) 恒压滴液/分液漏斗(本空1分)
(2) 温度低于25℃反应速率太慢,(1分)温度高于30℃副反应增多,产率降低(1分)
(3) 加速产品结晶析出
(4) 除去NaOH,洗去残留的反应物
(5)冷却结晶(或降温结晶) 晶核(或晶种,或查尔酮小晶体)
(6)65.6%
(7)②
18.本题共14分,除标注外每空2分
(1) 4-甲基苯酚(或对甲基苯酚)(1分) 羧基、(酚)羟基、氨基(3分)
(2) ①②④
(3) 保护酚羟基(1分)