文档内容
静海一中2025-2026第一学期高二化学(12月)
学生学业能力调研试卷
考生注意:本试卷分第Ⅰ卷基础题(78分)和第Ⅱ卷提高题(22分)两部分,
含卷面分3分,共100分。
知 识 与 技 能 学习能力(学法)
内容 反应热 原电池 速率平衡 电解质溶液 规律提炼 易混易错 方法归纳
分数 5 17 13 62 9 4 15
相对原子质量:H:1 C:12 O:16 Cr:52
第Ⅰ卷 基础题(共78分)
一、选择题: 每小题3分,共36分。
1. 化学与社会、生产、生活密切相关,下列说法不正确的是
A.施肥时,草木灰(有效成分KCO)不能与NH Cl混合使用
2 3 4
B.向工业废水中加入FeS固体,可以除去废水中的Hg2+
C.FeCl 用于印刷线路板是因为FeCl 水解呈酸性
3 3
D.使用含氟牙膏预防龋齿利用了沉淀转化的原理
2. 下列解释实验事实的方程式正确的是
A.铅蓄电池放电时负极反应式:Pb−2eˉ=Pb2+
B.NaHCO 溶液水解:HCO + H O HO+ + CO
3 2 3
C.“NO 球”浸泡在冷水中,颜色变浅:2NO (g) NO(g) ΔH>0
2 2 2 4
D.饱和NaCO 溶液与CaSO 固体反应:CO +CaSO CaCO +SO
2 3 4 4 3
3. 常温下,下列离子在指定环境中一定能够大量共存的是
A.通入SO 气体:
2
B. 的溶液中:
C. 的明矾溶液中:
D.水电离出来的 mol·L-1的溶液: 、HCO、 、
4. 某温度下,在某一恒容密闭容器中,充入一定物质的量的NO和Cl,发生反应
2
2NO(g)+Cl(g) 2NOCl(g) ∆H<0下列说法正确的是
2
A.适当降低温度,该反应的正反应速率加快,逆反应速率减慢
B.该反应的反应物的键能总和大于生成物的键能总和C.加入合适的催化剂,该反应达到平衡时 的值将不变
D.保持其他条件不变,仅充入少量的稀有气体,该反应的速率将增大
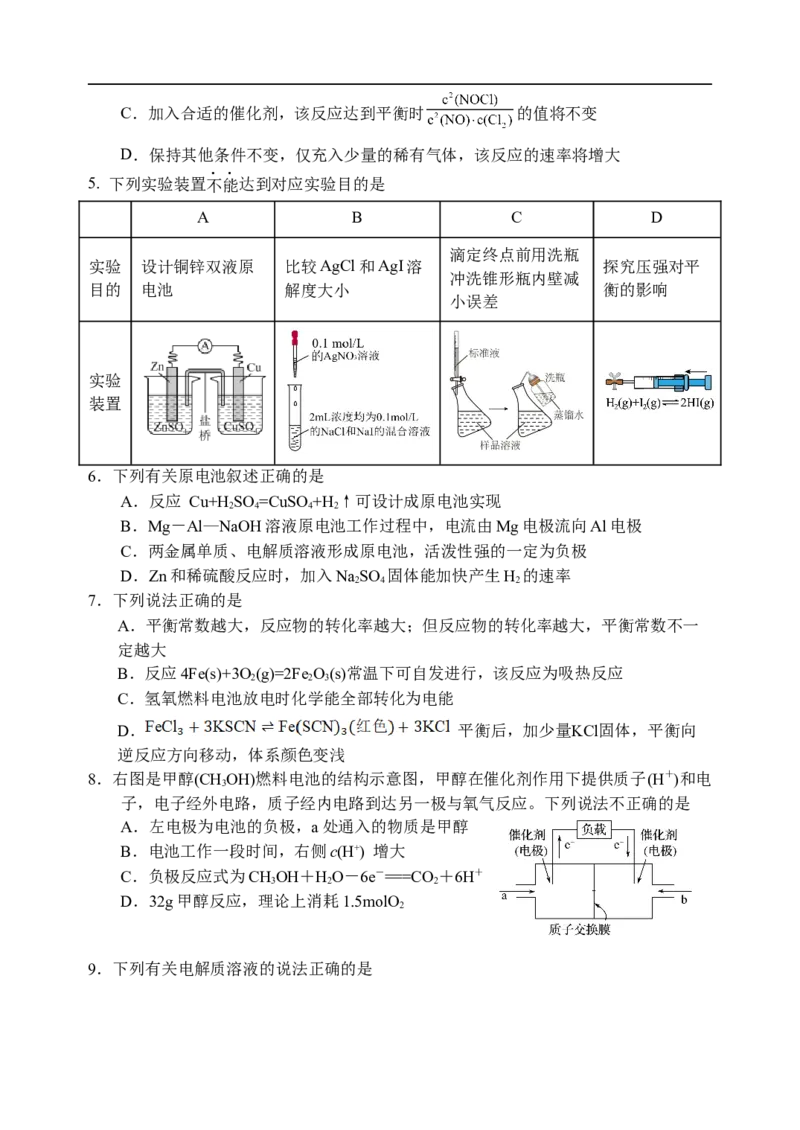
5. 下列实验装置不能达到对应实验目的是
A B C D
滴定终点前用洗瓶
实验 设计铜锌双液原 比较AgCl和AgI溶 探究压强对平
冲洗锥形瓶内壁减
目的 电池 解度大小 衡的影响
小误差
实验
装置
6.下列有关原电池叙述正确的是
A.反应 Cu+H SO =CuSO+H ↑可设计成原电池实现
2 4 4 2
B.Mg-Al—NaOH溶液原电池工作过程中,电流由Mg电极流向Al电极
C.两金属单质、电解质溶液形成原电池,活泼性强的一定为负极
D.Zn和稀硫酸反应时,加入NaSO 固体能加快产生H 的速率
2 4 2
7.下列说法正确的是
A.平衡常数越大,反应物的转化率越大;但反应物的转化率越大,平衡常数不一
定越大
B.反应4Fe(s)+3O (g)=2Fe O(s)常温下可自发进行,该反应为吸热反应
2 2 3
C.氢氧燃料电池放电时化学能全部转化为电能
D. 平衡后,加少量KCl固体,平衡向
逆反应方向移动,体系颜色变浅
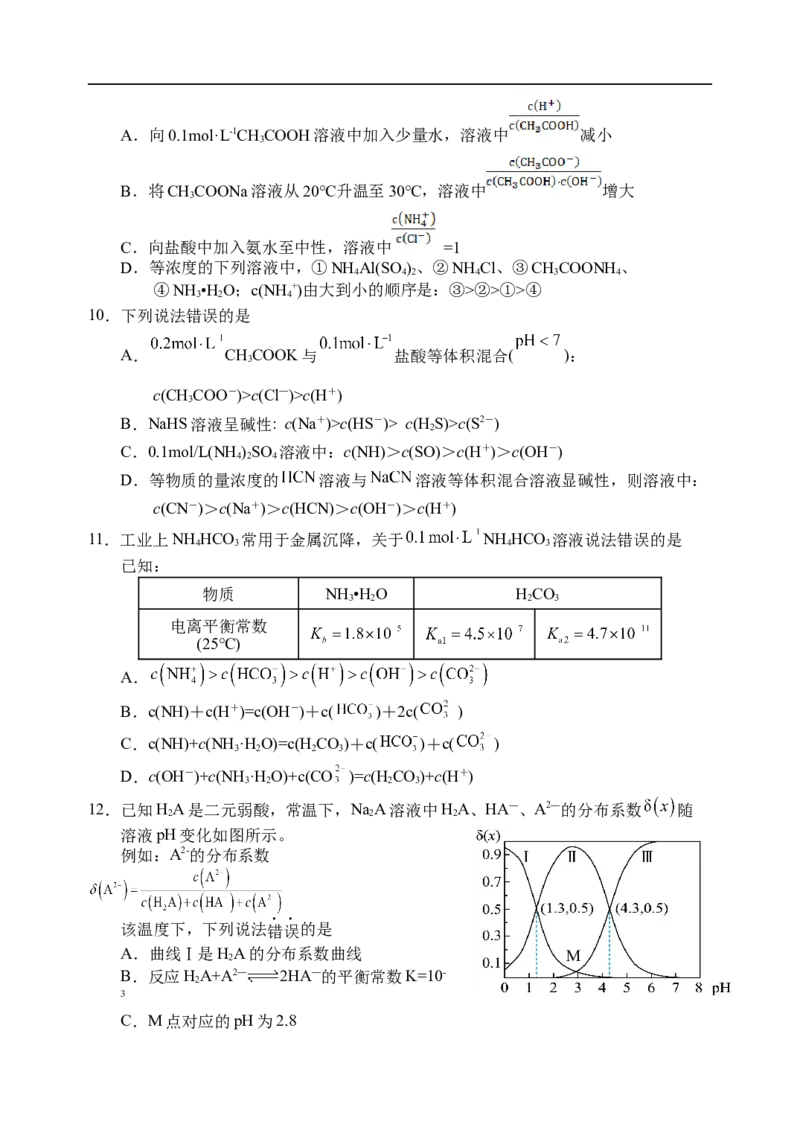
8.右图是甲醇(CHOH)燃料电池的结构示意图,甲醇在催化剂作用下提供质子(H+)和电
3
子,电子经外电路,质子经内电路到达另一极与氧气反应。下列说法不正确的是
A.左电极为电池的负极,a处通入的物质是甲醇
B.电池工作一段时间,右侧c(H+) 增大
C.负极反应式为CHOH+HO-6e-===CO +6H+
3 2 2
D.32g甲醇反应,理论上消耗1.5molO
2
9.下列有关电解质溶液的说法正确的是A.向0.1mol·L-1CHCOOH溶液中加入少量水,溶液中 减小
3
B.将CHCOONa溶液从20℃升温至30℃,溶液中 增大
3
C.向盐酸中加入氨水至中性,溶液中 =1
D.等浓度的下列溶液中,①NH Al(SO )、②NH Cl、③CHCOONH、
4 4 2 4 3 4
④NH •H O;c(NH +)由大到小的顺序是:③>②>①>④
3 2 4
10.下列说法错误的是
A. CHCOOK与 盐酸等体积混合( ):
3
c(CHCOO-)>c(Cl—)>c(H+)
3
B.NaHS溶液呈碱性: c(Na+)>c(HS-)> c(H S)>c(S2-)
2
C.0.1mol/L(NH )SO 溶液中:c(NH)>c(SO)>c(H+)>c(OH-)
4 2 4
D.等物质的量浓度的 溶液与 溶液等体积混合溶液显碱性,则溶液中:
c(CN-)>c(Na+)>c(HCN)>c(OH-)>c(H+)
11.工业上NH HCO 常用于金属沉降,关于 NH HCO 溶液说法错误的是
4 3 4 3
已知:
物质 NH •H O HCO
3 2 2 3
电离平衡常数
(25℃)
A.
B.c(NH)+c(H+)=c(OH-)+c( )+2c( )
C.c(NH)+c(NH ·H O)=c(HCO)+c( )+c( )
3 2 2 3
D.c(OH-)+c(NH ·H O)+c(CO )=c(H CO)+c(H+)
3 2 2 3
12.已知HA是二元弱酸,常温下,NaA溶液中HA、HA—、A2—的分布系数 随
2 2 2
溶液pH变化如图所示。
例如:A2-的分布系数
该温度下,下列说法错误的是
A.曲线Ⅰ是H 2 A的分布系数曲线 M
B.反应HA+A2— 2HA—的平衡常数K=10-
2
3
C.M点对应的pH为2.8D.PH=4.3时,溶液中c(Na+)+c(H+)=c(OH-)+3c(A2-)
二、填空题:共42分.
13.(易混易错)(4分)正误判断。正确的在括号内打“√”;错误的打“×”,并说明
理由。
(1)0.1 mol·L-1 Na CO 溶液中CO、HCO、HCO 的粒子总数为 。
2 3 2 3
( )
(2)等浓度的(NH )SO 溶液和NH Cl溶液,NH的水解程度一样。
4 2 4 4
( )
(3)升高温度,沉淀溶解平衡不一定正向移动。
( )
(4)电池放电时,负极材料的质量一定减小。
( )
14.(6分)盐类水解在生产生活中有广泛应用,请用化学用语回答有关问题。
(1)将CuSO ·5H O、AlCl 、Fe (SO ) 、NaClO分别溶于水,再将其溶液加热,蒸发结
4 2 3 2 4 3
晶、再灼烧,得到化学组成与原固体物质相同的是 。(填写化学式)
(2)为了除去CuCl 酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤
2
后,再向滤液中加入适量的盐酸,这种试剂是_____________。(填写化学式)
(3)SbCl 能发生强烈的水解,生成难溶的SbOCl,反应的化学方程式是
3
。
(4)若将Al (SO ) 溶液和NaS溶液混合,反应的离子方程式是________________。
2 4 3 2
15.(15分)(方法归纳)常温下,电解质溶液中的粒子浓度大小关系。
(1)0.4 mol·L-1HB溶液和0.2 mol·L-1NaOH溶液等体积混合后,溶液的PH=6,混合
后溶液中粒子浓度由大到小的顺序为___________________________(包括HB),
该溶液中c(B-)-c(HB)= mol·L-1(填精确数值)。
(2)pH=4的盐酸与pH=10的氨水等体积混合,混合后溶液中离子浓度由大到小的顺
序为________________________________。
(3)0.1 mol·L-1 Na C O 溶液与0.1 mol·L-1 HCl溶液等体积混合,写出混合后溶液的
2 2 4
电
荷守恒 。
(4)CHCOONH 溶液中的质子守恒 。
3 4
(5)在相同温度、相同浓度下列溶液中①HCl②CHCOOH③NaCO,由水的电离产
3 2 3
生
的c(H+)由大到小的顺序为 (填序号)。
(6)已知酸性:CHCOOH> HCN,相同温度、相同浓度①NaCN②CHCOONa
3 3③NaCl溶液中,阴离子总浓度由大到小的顺序为 (填序号)。
学法题:通过(1)、(2),回答在比较混合溶液中的粒子浓度大小时需注意什么问题?
__________________________________________________________________________
16.(9分)(规律提炼)电化学技术在处理污染气体
领域的应用广泛。
(1)利用反应6NO +8NH=7N +12H O构成电池的方
2 3 2 2
法,
能实现有效消除氮氧化物的排放,装置如图所示。
写出电极B的电极反应为 。
(2)以含SO 废气为原料,用电化学法制硫酸。装置如图所示,写出负极电极反应式
2
。
(3)镍镉电池是二次电池,电解质为KOH溶液,总反
应:
Cd+2NiOOH+2H O Cd(OH) +2Ni(OH) , 写
2 2 2
出放电时的负极反应式 。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时
NiO(OH)
转化为Ni(OH) ,写出负极电极反应式 。
2
学法题:准确书写电极反应式,需注意
17.(8分)工业废水中常含有氧化性较强的Cr O2-,利用滴定原理测定Cr O2-含量如
2 7 2 7
下:
步骤Ⅰ:量取30.00 mL 废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应: 。
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000 mol/LNa SO 溶液进行
2 2 3
滴定:I+2Na SO=2NaI+Na SO 。
2 2 2 3 2 4 6
(1)量取30.00 mL 废水选择的仪器是___________,步骤Ⅲ中滴加的指示剂为
___________,滴定达到终点时的实验现象是______________________。
(2)经测定,消耗NaSO 标准溶液的体积为18.00 mL,则工业废水中Cr O2-的含量
2 2 3 2 7
为___________g/L。
(3)以下操作对废水中Cr O2-含量测定结果的影响(填“偏高”“偏低”或“无影
2 7响”)。
A. 量取NaSO 溶液的滴定管用蒸馏水洗后未用标准液润洗
2 2 3
B. 滴定终点读数时,俯视滴定管的刻度
第Ⅱ卷 提高题(共22分)
18.(2分)下列说法正确的为
pH=0的溶液中Fe3+与S2−因发生双水解而不共存
25℃, PH=7的CHCOONH 溶液, 水电离出的 c(H+)=10-7mol/L
① 3 4
③将0.1mol的NaCO 溶于水中,形成溶液中阴离子总数小于0.1N
② 2 3 A
④泡沫灭火器内的玻璃筒里盛放碳酸氢钠溶液,铁筒里盛放硫酸铝溶液
pH=2的盐酸和醋酸,均稀释到pH=5,醋酸加水量大
⑤
NaHSO 溶液中加入少量NaOH固体,将 增大
3
⑥
⑦用稀盐酸可洗涤AgCl沉淀表面的可溶性杂质同时可以减少损失
19.(8分)有关溶液中的计算
(1)已知常温下HPO 的电离常数为K =6.9×10-3,K =6.2×10-8,K =4.8×10-13,则
3 4 a1 a2 a3
NaHPO 溶液显 性(填“酸”或“碱”),请利用以上数据计算说明原因
2 4
。
(2)25℃,将 a mol·L—1 的氨水与0.01mol·L—1 的盐酸等体积混合,反应平衡时溶液中
c(NH )=c(Cl—),用含a的代数式表示 NH 的水解平衡常数K = 。
h
(3)在 和 浓度都是0.1mol·L—1的混合溶液中逐滴加入 溶液(忽略体积
改变)时,
先沉淀(填“Cl”或“CrO2
”);当 开始沉淀时,
4
溶液中 。[已知: ;
]
20.(9分)CO 催化加氢合成甲醇是重要碳捕获利用与封存技术,该过程发生下列反应:
2
反应①CO(g) + 3H(g) CHOH(g)+ HO(g)
2 2 3 2
反应②CO(g) + H(g) CO(g)+ HO(g)
2 2 2
(1) 继续加氢生成气态甲醇的热化学方程式为 。
(2)现向 恒容密闭容器中加入 ,在恒温下发生上述反应。 后反
应达到平衡,此时容器内CHOH的浓度为 , 为 。则反应
3②的平衡常数为 (计算结果保留一位小数)。
(3)若恒温恒容条件下只发生反应①,起始投料比 ,能说明反应①
达平衡状态的 。
a.单位时间内消耗 的同时生成
b. 生成的同时有 键断裂
c. 和 的浓度保持不变
d.容器内压强保持不变
e. 和 的物质的量之比保持不变
(4)在体积可变的容器中,充入1 mol CO 和3.2
2
mol H 发生上述反应,平衡时CHOH和CO
2 3
在含碳产物中的物质的量分数及 转化率
随温度的变化如图所示。曲线b代表的物质是 (填“CHOH”或“
3
”),250℃下发生上述反应,平衡时CO的物质的量为 。
21. 卷面分:(3分)
静海一中2025-2026第一学期高二化学(12月)
学生学业能力调研试卷答题纸
第Ⅰ卷 基础题(共78分)
学校:
姓名:
班级:
考场:
座号
一、选择题: 每小题3分,共36分.
二、填空题:
13.(4分)(1)( )
(2)( )
(3)( )
(4)( )
14.(6分)
(1) (2)
(3)
(4)
15.(15分)
(1)
(2)
(3)
(4)
(5) (6)
【学法题】
16.(9分)
(1)
(2)
(3)
(4)
【学法题】
17.(8分)
(1)
(2) (3)
第Ⅱ卷 提高题(共22分)
18.(2分)
19.(8分)
(1)_____________
(2) (3)
20.(9分)
(1)
(2) (3)
(4)21.卷面分:(3分)
静海一中2025-2026第一学期高二化学(12月)
参考答案
一、选择题: 每小题3分,共36分。
1.C 2.D 3.B 4.C 5.D 6.B 7.A 8.B 9.C 10. D 11. A 12. B
二、填空题:(共42分)
13. (每空1分,共4分)
(1)(×) (2)(×) (3)(√) (4)(×) 理由合理即可
14.(除标注外每空2分,共6分)
(1)Fe (SO ) (1分) (2)CuO或Cu (OH) 或Cu (OH) CO 任写一种(1分)
2 4 3 2 2 2 3
SbCl H OSbOCl2HCl
(3) 3 2 (4)
15.(除标注外每空2分,共15分)
(1)c(B-)>c(Na+)> c(HB)> c(H+) > c(OH-) 1.98ⅹ10-6
(2)c(NH)>c(Cl-)>c(OH-)>c(H+)
(3)c(Cl-)+2c(C O)+c(HC O)+c(OH-)=c(Na+)+c(H+)
2 2
(4)c(H+)+c(CHCOOH)= c(NH ·H O)+ c(OH-)
3 3 2
(5)③>②>① (6)③>②>①
学法题:能反应的先反应,根据反应后溶质的电离、水解情况分析(合理即可) (1分)
16.(除标注外每空2分,共9分)
(1) 2NO +8eˉ+4H O=N+8OH- (2)
2 2 2(3) (4) Al-3eˉ+4OH—=[Al(OH) ]—
4
学法题:注意得失电子、介质等(1分)
17.(除标注外每空2分,共8分)
(1) 酸式滴定管(1分) 淀粉溶液(1分) 滴入最后半滴标准液,溶液蓝色恰好褪
去,且30秒内无变化
(2)2.16 (3)偏高(1分) 偏低(1分)
18. (2分)⑤⑥⑦
19. (除标注外每空2分,共8分)
(1)碱性(1分) NaHPO 溶液中 ,水解平衡常
2 4
数 ,溶液中水解
程度大,溶液显碱性
(2)(100a - 1)×10—7 (3)Cl- (1分)
20. (除标注外每空2分,共9分)
(1)CO(g)+2H (g)=CH OH(g) H=
2 3
(2) 0.1 (3)bcd (4) C△O(1分) 0.1 mol
21.卷面分:(3分)