文档内容
四川省 2021 级高三大数据精准教学第一次统一监测
化学试题参考答案与详细解析
7.【答案】D
【解析】A.船舶的外壳装上若干锌块后,由于Zn 比Fe 活泼,发生电化学腐蚀时Zn作负
极,Fe 被保护,是牺牲阳极的阴极保护法,A选项不符合题意;B.直径5nm 的碳量子点介
于1nm~100 nm,所形成的分散系属于胶体,B 选项不符合题意;C.纤维素属于多糖,其主
要功能是加强胃肠的蠕动,因人体没有水解纤维素的酶而导致其不被吸收,C 选项不符合题
意;D.“祝融号”火星车所用的铝基碳化硅属于复合材料,D选项符合题意。故答案选D。
8.【答案】A
【解析】A.10.6gNa CO 固体的物质的量为0.1mol,n(Na+)=0.2 mol,n(CO2)=0.1 mol,
2 3 3
Na+的数目比CO2多0.1N ,A 选项符合题意;B.D O的摩尔质量为20g/mol,1个D O分
3 A 2 2
子中含10个中子,0.9g重水中所含中子的物质的量为 0.45mol,B 选项不符合题意;C.Cl
2
与 H O 反应的方程式 Cl +H O HCl+HClO 为可逆反应,7.1 g Cl 为 0.1 mol,转移电子数
2 2 2 2
应小于0.1N ,C选项不符合题意;D.标准状况下,SO 为固体,11.2L的物质的量远大于
A 3
0.5mol,D选项不符合题意。故答案为A。
9.【答案】C
【解析】X、Y、Z、W、M 为原子序数依次增大的短周期主族元素,最外层电子数之和为
17。其中X、M同主族,且仅M 为金属元素。短周期金属元素仅有Li、Be、Na、Mg、Al,
显然,M只可能在第三周期且只能为Na,若为Mg,则X为Be,与且仅M 为金属元素矛盾;
若为Al,则X为B。Y最外层电子数大于3,最外层电子数之和必大于等于21,与题意矛盾。
综上,M 为Na、X为H;Y、Z、W 为第二周期的非金属元素,且最外层电子数之和为15。
则Y、Z、W 可能为B(3)、N(5)、F(7)或C(4)、N(5)、O(6)。
A.Y、Z、W为第二周原子序数增大的主族元素,原子半径Y>Z>W,A 选项不符合题意;
B.Z为N,在元素周期表中的位置第二周期ⅤA族,B选项不符合题意;
C.若 W 为 F,M 为 Na,二者形成 NaF,仅含离子键;若 W 为 O,M 为 Na,二者可形成
Na O,仅含离子键,或形成Na O ,含离子键和非极性共价键,C选项符合题意;
2 2 2
D.若 W 为O,Z 为 N,简单气态氢化物的稳定 H O>NH ;若 W 为 F,Z 为N,简单气态氢
2 3
化物的稳定性HF>NH ,D选项不符合题意。故答案为C。
3
第 1 页 共 6 页
{#{QQABCY6AogCAQAIAAQhCUwF6CAGQkAGAAAoGRAAEMAAByAFABAA=}#}10.【答案】C
【解析】A.化学式为C H O,A选项不符合题意;B.含碳碳双键,能使酸性高锰酸钾
10 12
溶液褪色,B 选项不符合题意;C.所有碳原子有可能处于同一平面,C 选项符合题意;D.结
构中含1个苯环、1个碳碳双键,故1mol该化合物最多能与4mol H 反应,D选项不符合题
2
意。故答案为C。
11.【答案】D
【解析】A.将某混合气体依次通过盛有品红溶液和澄清石灰水的洗气瓶,观察到品红褪
色,说明混合气体中一定有 SO 。若只有 SO ,过量的 SO 也能使澄清石灰水变浑浊,A 选
2 2 2
项不符合题意;B.石蜡油主要成分为烷烃或环烷烃,高温分解产物可能生成乙烯或其他烯
烃,均能使酸性高锰酸钾溶液褪色,B 选项不符合题意;C.用光洁无锈的铁丝蘸取某溶液放
在酒精灯外焰里灼烧,观察到火焰呈黄色,说明溶液中存在 Na+,要证明是否含 K+,需透过
蓝色钴玻璃观察火焰颜色,若观察到有紫色火焰,证明存在K+,若未观察到紫色火焰,则证
明不存在K+,C选项不符合题意;D.向盛有10滴0.lmol/LAgNO 溶液的试管中滴加0.1mol/L
3
NaCl 至不再有白色沉淀生成,再向其中滴加0.1mol/LKI 溶液,白色沉淀转化为黄色沉淀。
说明发生AgCl(s)+I–(aq) AgI(s)+Cl–(aq),即K (AgI)K (HA-),溶液显酸
a a2 h a h
Ka1
10
5.4
性[c(H+)>c(OH-)],D选项不符合题意。故答案为B。
第 2 页 共 6 页
{#{QQABCY6AogCAQAIAAQhCUwF6CAGQkAGAAAoGRAAEMAAByAFABAA=}#}26.(14分)
【解析】:
(1)仪器X 的名称为干燥管。
(2)引发反应后就能保持微沸状态,说明反应为放热反应,逐滴加入混合液可防止反应
剧烈使体系温度过高,导致乙醚从球形冷凝管中大量逸出。
(3)若温度过低,反应速率慢,反应时间过长;若温度过高,乙醚的沸点为34.6℃,导
致乙醚从冷凝管大量逸出。
(4)若图1使用直型冷凝管,冷凝接触面积减少,回流效果差或若图2使用球型冷凝管
会有积液在凹槽中。
(5)①长导气管可起到安全管的作用或平衡气压的作用。水蒸气蒸馏时,若观察到长导
管水位突然升高,可能发生堵塞导致装置内气压过大,应打开活塞K或打开活塞K,再移走
热源。
②水蒸气蒸馏原理是在难溶或不溶于水的有机物中通入水蒸气使难溶或不溶于水的液态
有机物(乙醚、溴苯)和水一起蒸出,因此,主要除去的杂质为乙醚、溴苯,粗产品存留在
图2甲中。
27.(14分)
【解析】:
(1)粉碎固体残渣或搅拌或加热或适当增大H SO 的浓度或增大H C O 的浓度等(答增
2 4 2 2 4
大接触面积不给分)。
(2)ZnMn O 可用氧化物的形式表示ZnO•Mn O ,
2 4 2 3
ZnO•Mn O +2H SO ══ZnSO +MnSO +2H O+MnO 可知Mn O +H SO ══MnSO +H O+MnO 。
2 3 2 4 4 4 2 2 2 3 2 4 4 2 2
仅加入H SO 时,部分锰元素以MnO 沉淀的形式存在。为提高 Mn 的浸出率,需加入 H C O
2 4 2 2 2 4
作还原剂(MnO 具有氧化性)发生反应:MnO +H SO +H C O ══MnSO +2CO ↑+2H O,进
2 2 2 4 2 2 4 4 2 2
而提高Mn 的浸出率。
(3)①由图可知,当c(H SO)=0.5mol•L-1时,Mn的浸出率等于90%,Zn的浸出率大于90%。
2 4
由ZnO+H SO ══ZnSO +H O;MnO+H SO ══MnSO +H O;ZnMn O +2H SO ══ ZnSO +
2 4 4 2 2 4 4 2 2 4 2 4 4
MnSO +2H O+MnO ;MnO +H SO +H C O ══MnSO +2CO ↑+2H O可知,Zn的浸出只需H SO
4 2 2 2 2 4 2 2 4 4 2 2 2 4
即可,所以Zn 元素浸出时不需要还原剂,而+4 价Mn(MnO 、Mn O 、Mn O )需加入H C O
2 2 3 3 4 2 2 4
作还原剂更有利于Mn 的浸出。或MnO +H SO +H C O ══MnSO +2CO ↑+2H O,故Mn的
2 2 4 2 2 4 4 2 2
浸出率受H C O 浓度变化更大,a 曲线表示 Zn 的浸出率受H C O 浓度变化,b曲线表示
2 2 4 2 2 4
Mn 的浸出率受H C O 浓度变化。
2 2 4
(4)“精制除杂”的目的是除去溶液中的草酸,因为 MnO + H SO +H C O ══
2 2 4 2 2 4
MnSO +2CO ↑+2H O,不会引入杂质,过量的 MnO 也可通过过滤去除,而 ZnO 与 H C O
4 2 2 2 2 2 4
发生ZnO+H C O ══ ZnC O +H O,MnO与H C O 发生MnO+H C O ══MnC O +H O,都
2 2 4 2 4 2 2 2 4 2 2 4 2 4 2
第 3 页 共 6 页
{#{QQABCY6AogCAQAIAAQhCUwF6CAGQkAGAAAoGRAAEMAAByAFABAA=}#}只是将H C O 转化为C O2—,无法实现精制除杂的目的。故所选试剂为 MnO 。
2 2 4 2 4 2
(5)①Mn2+―2e―+2H O══MnO +4H+。
2 2
②阴极可能发生的电极反应为 Zn2++2e―══Zn,2H++2e―══H ↑。阳极可能发生的电极反
2
应为 Mn2+―2e―+2H O══MnO +4H+,4OH――4e―══2H O+O ↑。当 n(H ):n(O )=2:1 时,二
2 2 2 2 2 2
者变化的电子转移数恰好相等,则电极反应Zn2++2e―══Zn与Mn2+―2e―+2H O══MnO +4H+
2 2
的转移电子数也应相等,因此参加反应的n(Zn2+):n(Mn2+)=1:1。
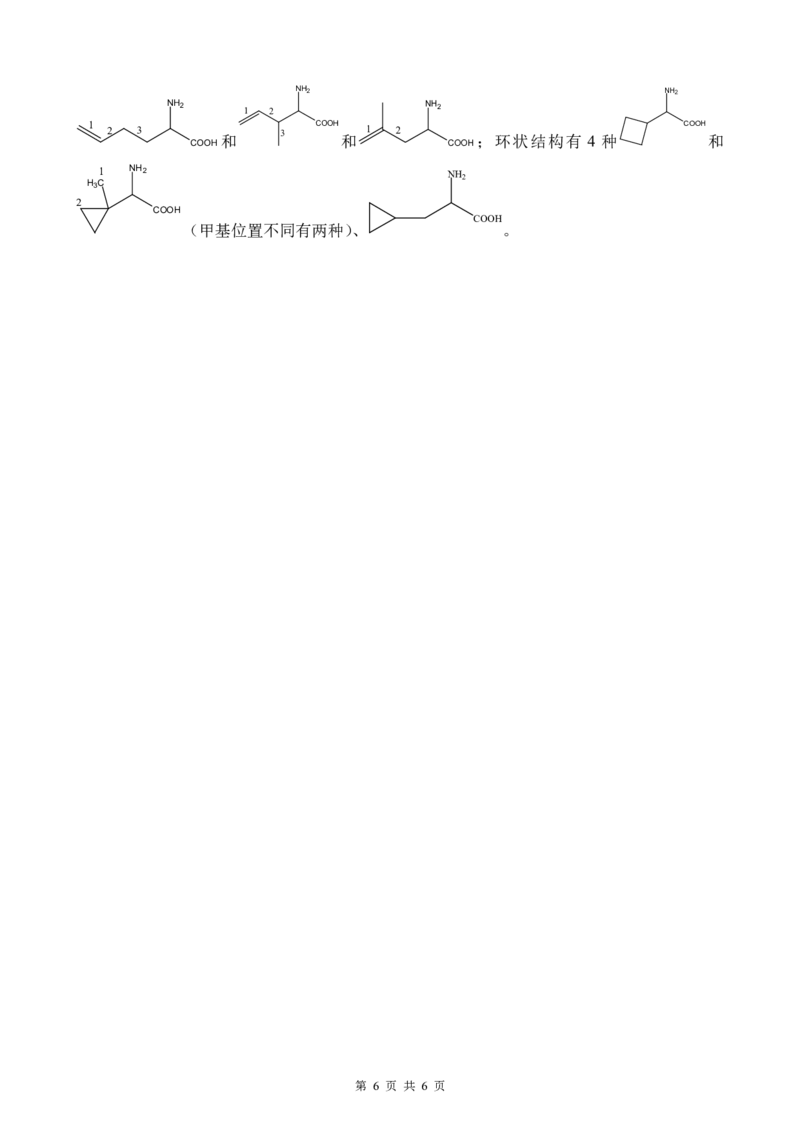
28.(15分)
【解析】:
(1)发现目标方程式中FeC O ·2H O与第一个方程式相差4倍,目标方程式中O 与第二
2 4 2 2
个方程式相差 2倍,根据盖斯定律,将第一个热化学方程式扩大 4倍加上第二个热化学方程
式扩大2倍即为答案4a+2b。
(2)x=FeC O /[FeC O •2H O]= 144 =80.0%,y=Fe O /2[FeC O •2H O]= 160 =44.4%
2 4 2 4 2 2 3 2 4 2
180 360
CO(g)+NO(g) CO(g)+N(g)
2 2 2
开始 50 x 0 0
转化 -17.5 -17.5 +17.5 +17.5
(3)①利用已知信息列出三段式为平衡 32.5 17.5 17.5 ,因为方程式计量数相等
CO(g)+NO(g) CO(g)+N(g)
2 2 2
开始 50 50 0 0
转化 -17.5 -17.5 +17.5 +17.5
p(开始)=p(总),故x=50,平衡时N 2 O=32.5,三段式为平衡 32.5 32.5 17.5 17.5 ,求解可得
17.5 17.5
17.517.5
K
p
= 100 100 或 32.532.5 。
32.5 32.5
100 100
②历程一中 R→IM1 段活化能最大,速率最慢,故为决速步。观察能量变化ΔH<0,升高
温度,化学平衡逆移,平衡常数减小。
③观察历程二中有碳氮键断裂的为 TS→P。历程二中煤焦催化第一步会释放 945.98
kJ·mol-1的能量,有利于提供第二步吸收127.27kJ·mol-1的能量,而历程一第一步就需要吸收
218.76kJ·mol-1的能量。
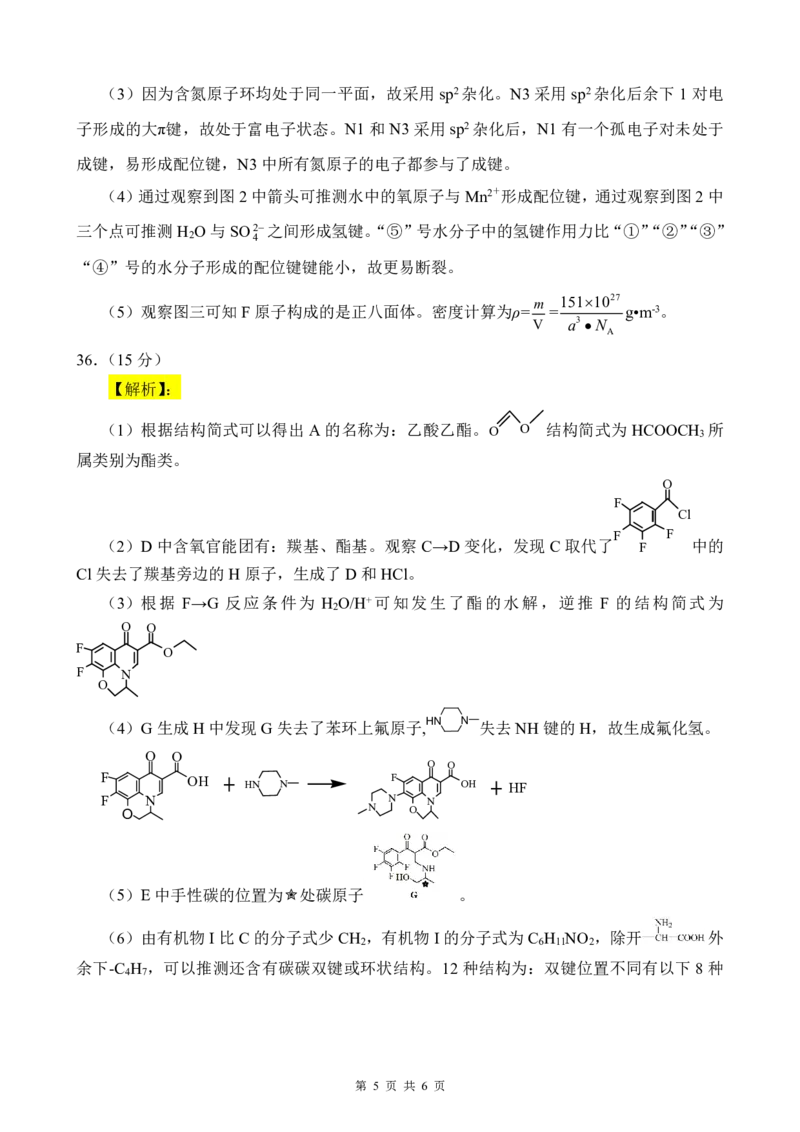
35.(15分)
【解析】:
(1)3d64s2失去2e-为3d6。
(2)依据Na、Fe、O三种元素在周期表中的位置,可得电负性大小顺序为Na