文档内容
邯郸市 2024 届高三年级第四次调研监测
化学
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改
动,用橡皮擦干净后,再洗涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在
本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:高考全部内容。
5.可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Ti 48 Fe 56 Zn 65
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题意。
1. “挖掘文物价值,讲好中国故事。”下列文物在潮湿空气中易发生电化学腐蚀的是
选项 A B
文物
名称 先锋煲(陶) 翔鹭纹铜鼓
选项 C D
文物
六棱柱形水晶穿
名称 弦纹玻璃杯
珠
A. A B. B C. C D. D
2. 亚氨基化硫( )的制备原理: 。下列化学用语表述正确的
是
第1页/共11页
学科网(北京)股份有限公司A. 基态S原子的价层电子排布式:
B. 的VSEPR模型:
C. 的电子式:
D. 的结构式:
3. 以50%乙醇为溶剂,采用重结晶法提纯2―硝基―1,3―苯二酚,下列仪器不需要被使用的是
A B C D
A. A B. B C. C D. D
4. 下列化学事实不符合“事物的双方既相互对立又相互统一”的哲学观点的是
A. 小苏打溶液中存在电离和水解平衡
B. 若硫化氢和浓硫酸反应后的含硫产物只有 , 既是氧化产物,又是还原产物
C. 电解饱和食盐水时阴极和阳极反应同时发生
D. 、 、 的氧化性随着卤素原子序数的增大而减弱
5. 下列物质性质和原理分析相匹配的是
选项 物质性质 原理分析
冰醋酸中没有能自由移动的离子
A 冰醋酸不导电,醋酸溶液能导电
醋酸溶液中有能自由移动的离子
B 的酸性比 的强 的摩尔质量小于
C 甲酸的沸点高于二甲醚 甲酸 的范德华力大于二甲醚
第2页/共11页
学科网(北京)股份有限公司甲苯是非极性溶剂,水是极性溶剂
D 油漆易溶于甲苯,不溶于水
油漆是极性大的物质
A. A B. B C. C D. D
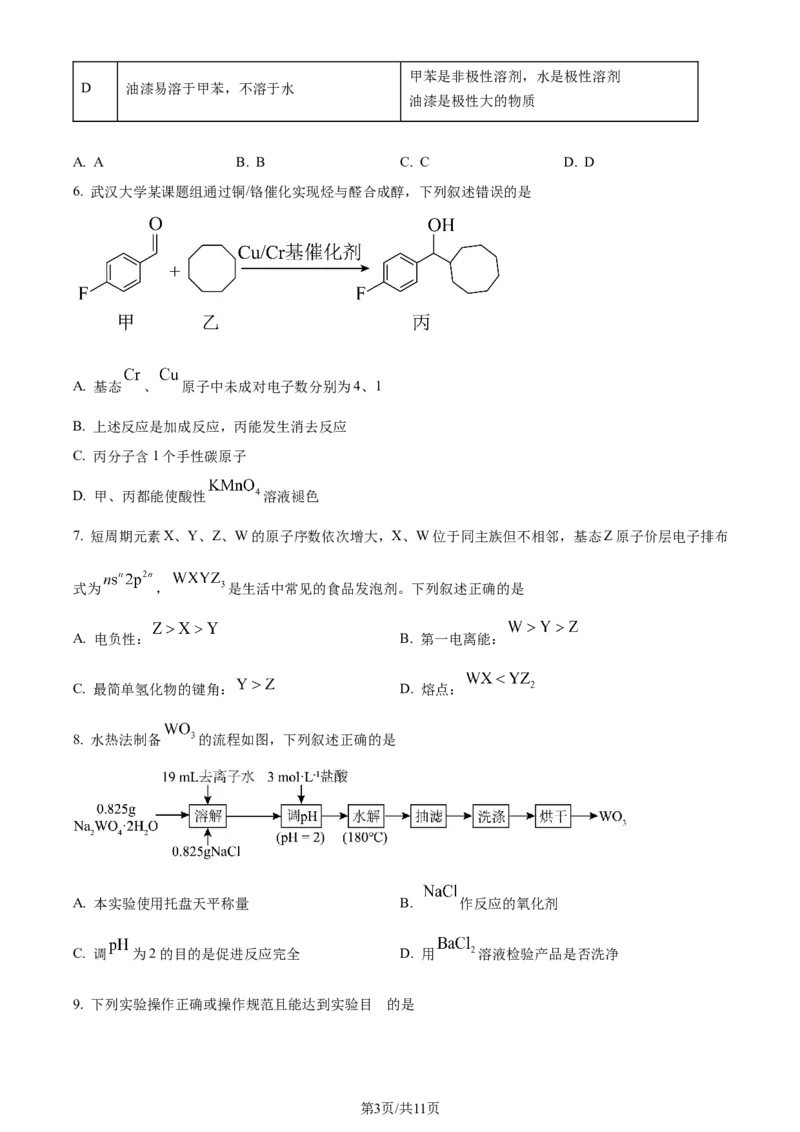
6. 武汉大学某课题组通过铜/铬催化实现烃与醛合成醇,下列叙述错误的是
A. 基态 、 原子中未成对电子数分别为4、1
B. 上述反应是加成反应,丙能发生消去反应
C. 丙分子含1个手性碳原子
D. 甲、丙都能使酸性 溶液褪色
7. 短周期元素X、Y、Z、W的原子序数依次增大,X、W位于同主族但不相邻,基态Z原子价层电子排布
式为 , 是生活中常见的食品发泡剂。下列叙述正确的是
A. 电负性: B. 第一电离能:
C. 最简单氢化物的键角: D. 熔点:
8. 水热法制备 的流程如图,下列叙述正确的是
A. 本实验使用托盘天平称量 B. 作反应的氧化剂
C. 调 为2的目的是促进反应完全 D. 用 溶液检验产品是否洗净
的
9. 下列实验操作正确或操作规范且能达到实验目 的是
第3页/共11页
学科网(北京)股份有限公司选项 操作 目的
A 取适量 晶体溶于浓硝酸中,加水稀释到指定刻度 配制一定物质的量浓度的溶液
B 用碱式滴定管盛装标准 溶液并滴定草酸溶液 测定草酸溶液浓度
C 向 的酒精中加入钠粒 证明 的酒精中含水
向 溶液中先滴加少量 溶
D 液 明:
振荡后再滴加少量 溶液
A. A B. B C. C D. D
10. 硫代硫酸钠 主要用于照相时作定影剂,也可用作氰化物的解毒剂,下列离子方程式书写错
误的是
A. 用过量的 溶液除去底片上的 时有 生成:
B. 久置空气中的 溶液变质:
C. 用 溶液吸收工业尾气中足是的 :
D. 向 溶液中滴加稀硫酸:
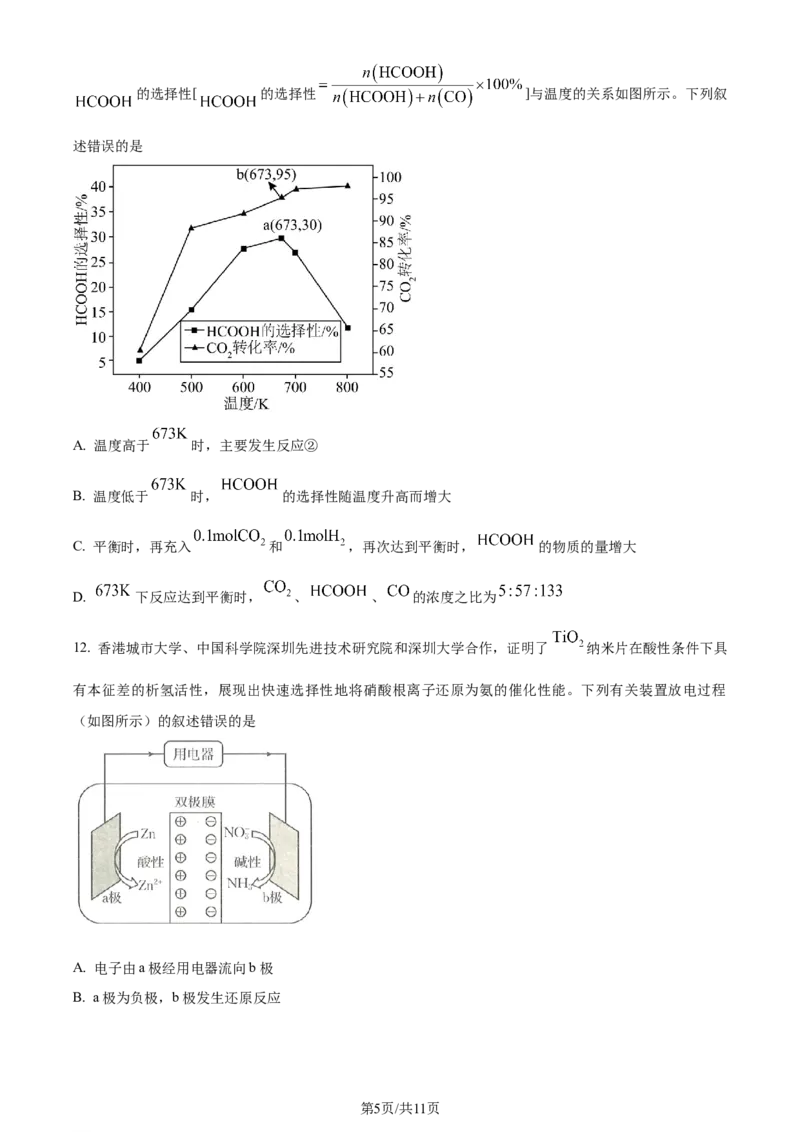
11. 的回收和利用是实现“碳中和”的有效途径。在一恒容密闭反应器中充入体积之比为 的
和 ,发生反应:① ,②
。在相同时间内, 的转化率、
第4页/共11页
学科网(北京)股份有限公司的选择性[ 的选择性 ]与温度的关系如图所示。下列叙
述错误的是
A. 温度高于 时,主要发生反应②
B. 温度低于 时, 的选择性随温度升高而增大
C. 平衡时,再充入 和 ,再次达到平衡时, 的物质的量增大
D. 下反应达到平衡时, 、 、 的浓度之比为
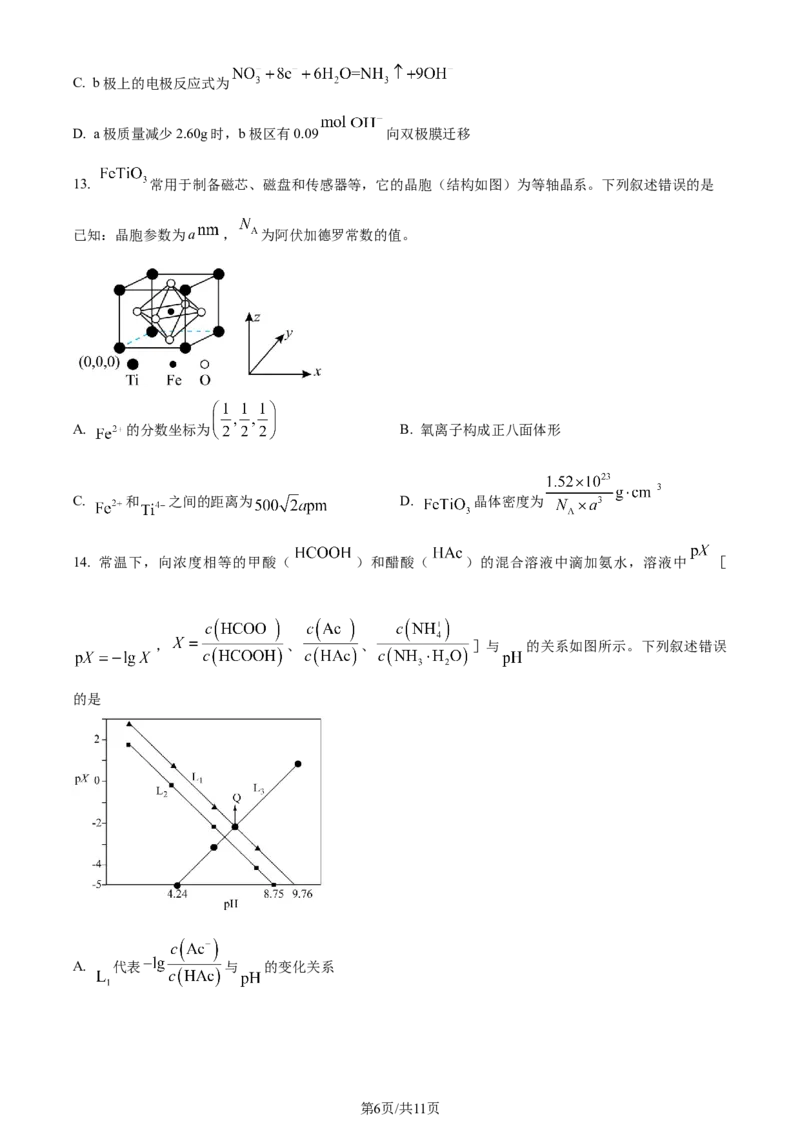
12. 香港城市大学、中国科学院深圳先进技术研究院和深圳大学合作,证明了 纳米片在酸性条件下具
有本征差的析氢活性,展现出快速选择性地将硝酸根离子还原为氨的催化性能。下列有关装置放电过程
(如图所示)的叙述错误的是
A. 电子由a极经用电器流向b极
B. a极为负极,b极发生还原反应
第5页/共11页
学科网(北京)股份有限公司C. b极上的电极反应式为
D. a极质量减少2.60g时,b极区有0.09 向双极膜迁移
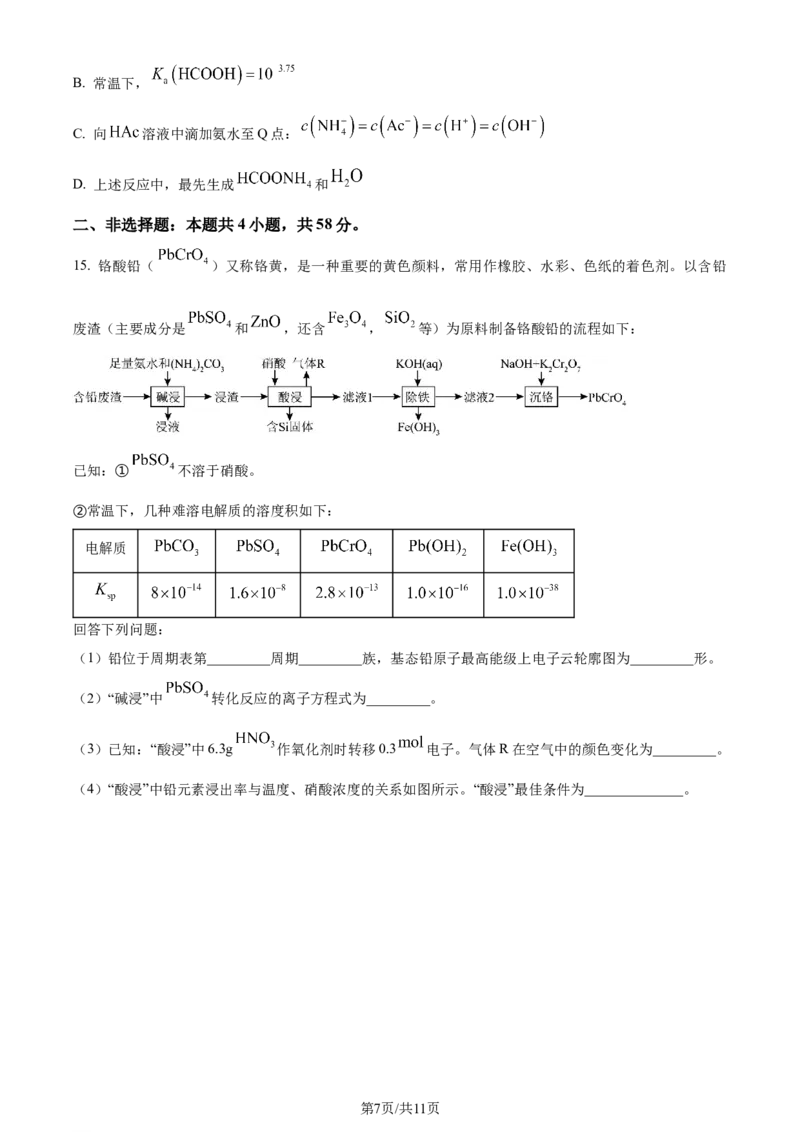
13. 常用于制备磁芯、磁盘和传感器等,它的晶胞(结构如图)为等轴晶系。下列叙述错误的是
已知:晶胞参数为a , 为阿伏加德罗常数的值。
A. 的分数坐标为 B. 氧离子构成正八面体形
C. 和 之间的距离为 D. 晶体密度为
14. 常温下,向浓度相等的甲酸( )和醋酸( )的混合溶液中滴加氨水,溶液中 [
, 、 、 ]与 的关系如图所示。下列叙述错误
的是
A. 代表 与 的变化关系
第6页/共11页
学科网(北京)股份有限公司B. 常温下,
C. 向 溶液中滴加氨水至Q点:
D. 上述反应中,最先生成 和
二、非选择题:本题共4小题,共58分。
15. 铬酸铅( )又称铬黄,是一种重要的黄色颜料,常用作橡胶、水彩、色纸的着色剂。以含铅
废渣(主要成分是 和 ,还含 , 等)为原料制备铬酸铅的流程如下:
已知:① 不溶于硝酸。
②常温下,几种难溶电解质的溶度积如下:
电解质
回答下列问题:
(1)铅位于周期表第_________周期_________族,基态铅原子最高能级上电子云轮廓图为_________形。
(2)“碱浸”中 转化反应的离子方程式为_________。
(3)已知:“酸浸”中6.3g 作氧化剂时转移0.3 电子。气体R在空气中的颜色变化为_________。
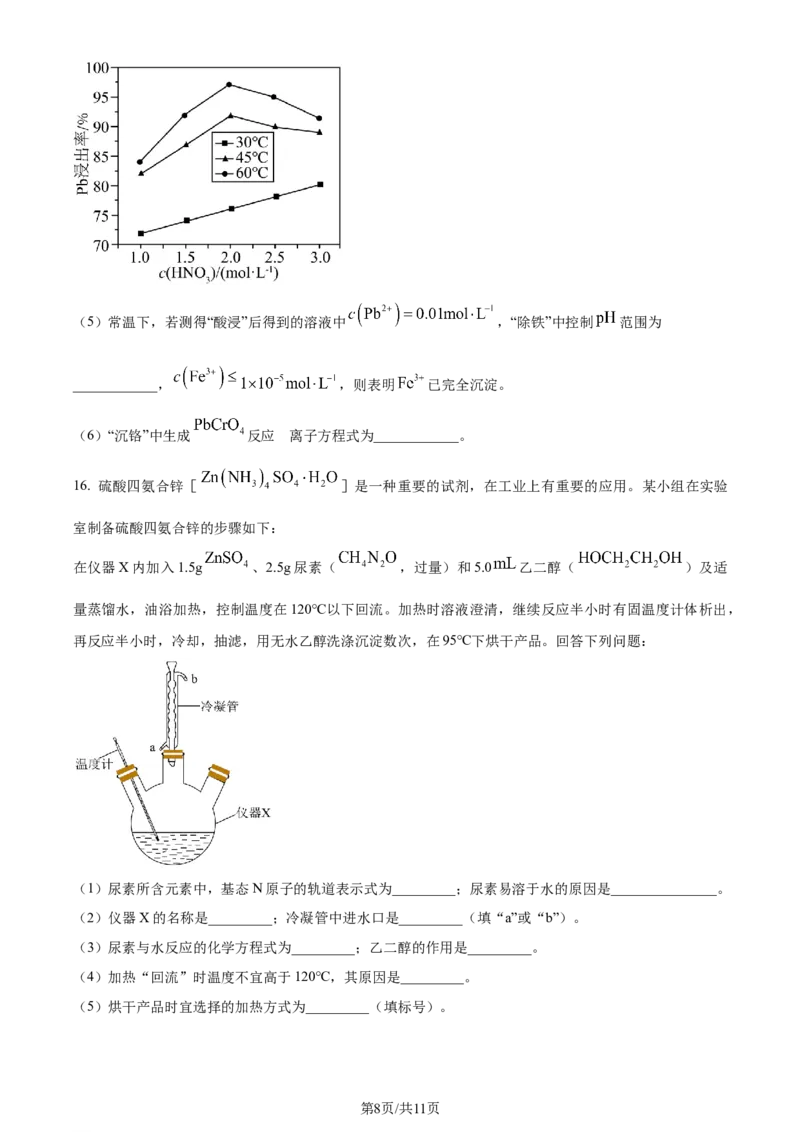
(4)“酸浸”中铅元素浸出率与温度、硝酸浓度的关系如图所示。“酸浸”最佳条件为______________。
第7页/共11页
学科网(北京)股份有限公司(5)常温下,若测得“酸浸”后得到的溶液中 ,“除铁”中控制 范围为
____________, ,则表明 已完全沉淀。
的
(6)“沉铬”中生成 反应 离子方程式为____________。
16. 硫酸四氨合锌[ ]是一种重要的试剂,在工业上有重要的应用。某小组在实验
室制备硫酸四氨合锌的步骤如下:
在仪器X内加入1.5g 、2.5g尿素( ,过量)和5.0 乙二醇( )及适
量蒸馏水,油浴加热,控制温度在120℃以下回流。加热时溶液澄清,继续反应半小时有固温度计体析出,
再反应半小时,冷却,抽滤,用无水乙醇洗涤沉淀数次,在95℃下烘干产品。回答下列问题:
(1)尿素所含元素中,基态N原子的轨道表示式为_________;尿素易溶于水的原因是_______________。
(2)仪器X的名称是_________;冷凝管中进水口是_________(填“a”或“b”)。
(3)尿素与水反应的化学方程式为_________;乙二醇的作用是_________。
(4)加热“回流”时温度不宜高于120℃,其原因是_________。
(5)烘干产品时宜选择的加热方式为_________(填标号)。
第8页/共11页
学科网(北京)股份有限公司a.酒精灯直接加热 b.沙浴 c.水浴加热
(6)用乙醇洗涤产品,而不用水洗涤,利用了乙醇的性质是_________。
(7)若最终得到1.976g ,则产率为_________(保留3位有效数字)。
17. 我国科学家开发出了高效催化剂ZnZrO ,实现CO 催化还原合成乙烯和丙烯,反应原理如下:
x 2
Ⅰ. ;
Ⅱ. 。
回答下列问题:
(1)在周期表中, 和 相邻,二者中第二电离能与第一电离能之差较大的是_________(填“ ”或“
”)。
(2)已知几种可燃物的燃烧热如下:
物质
燃烧热
-285.8 -1411.0 -2058.0
。则 _________ 。
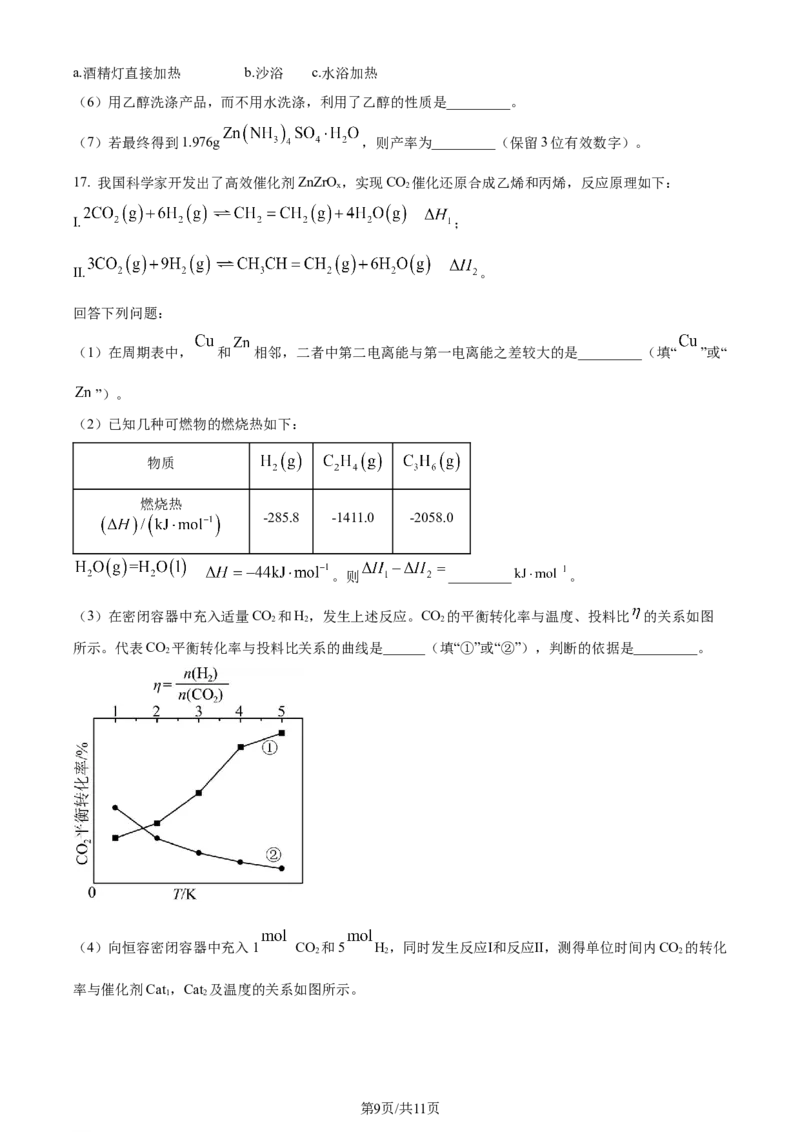
(3)在密闭容器中充入适量CO 和H,发生上述反应。CO 的平衡转化率与温度、投料比 的关系如图
2 2 2
所示。代表CO 平衡转化率与投料比关系的曲线是______(填“①”或“②”),判断的依据是_________。
2
(4)向恒容密闭容器中充入1 CO 和5 H,同时发生反应Ⅰ和反应Ⅱ,测得单位时间内CO 的转化
2 2 2
率与催化剂Cat,Cat 及温度的关系如图所示。
1 2
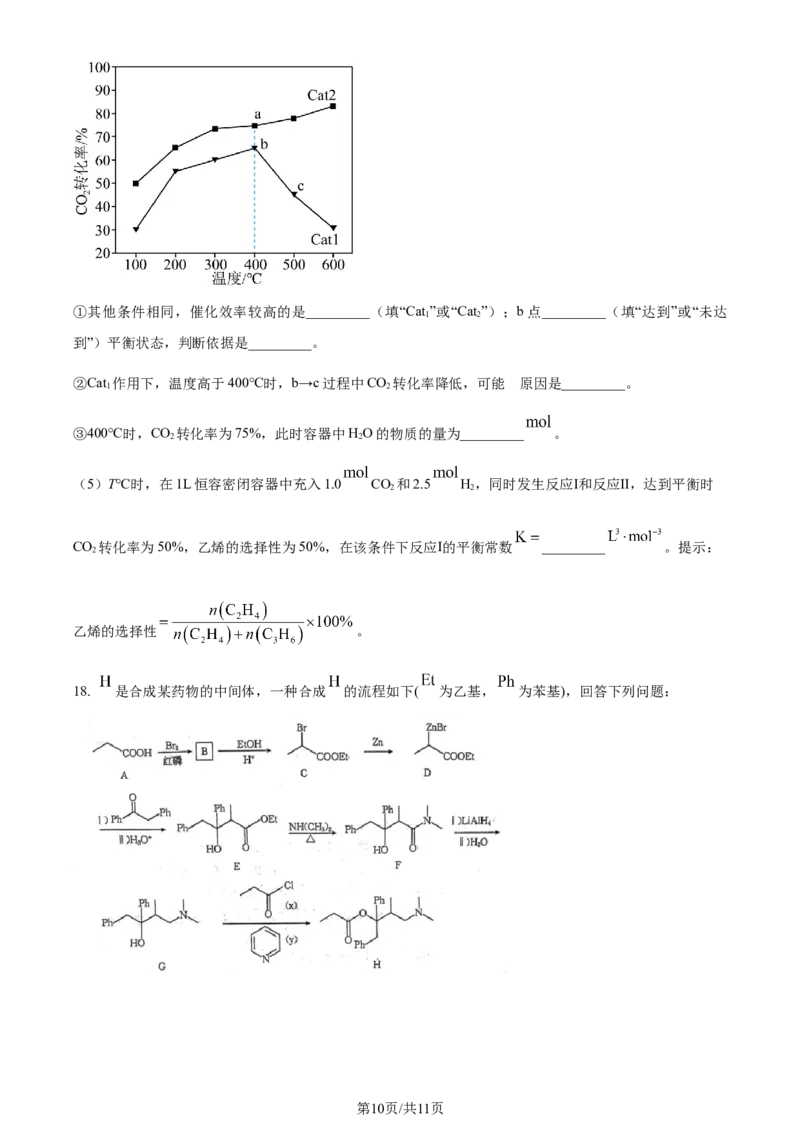
第9页/共11页
学科网(北京)股份有限公司①其他条件相同,催化效率较高的是_________(填“Cat”或“Cat”);b点_________(填“达到”或“未达
1 2
到”)平衡状态,判断依据是_________。
的
②Cat 作用下,温度高于400℃时,b→c过程中CO 转化率降低,可能 原因是_________。
1 2
③400℃时,CO 转化率为75%,此时容器中HO的物质的量为_________ 。
2 2
(5)T℃时,在1L恒容密闭容器中充入1.0 CO 和2.5 H,同时发生反应Ⅰ和反应Ⅱ,达到平衡时
2 2
CO 转化率为50%,乙烯的选择性为50%,在该条件下反应Ⅰ的平衡常数 _________ 。提示:
2
乙烯的选择性 。
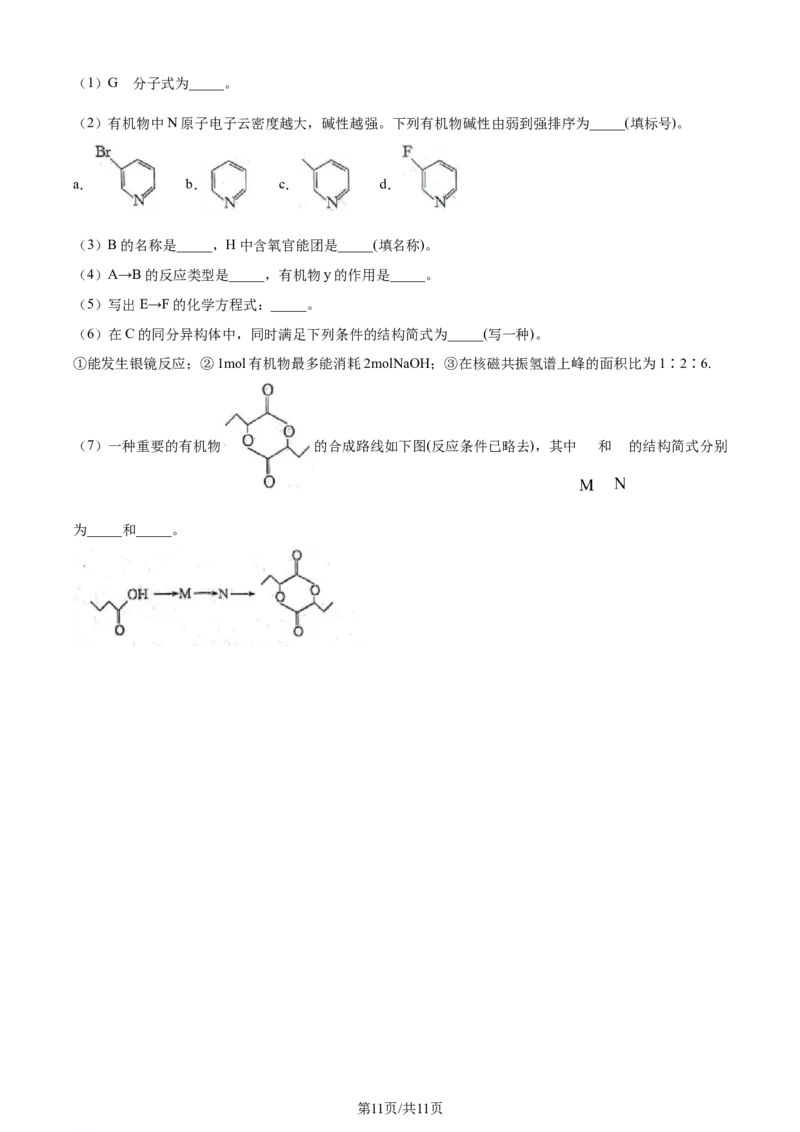
18. 是合成某药物的中间体,一种合成 的流程如下( 为乙基, 为苯基),回答下列问题:
第10页/共11页
学科网(北京)股份有限公司的
(1)G 分子式为_____。
(2)有机物中N原子电子云密度越大,碱性越强。下列有机物碱性由弱到强排序为_____(填标号)。
a. b. c. d.
(3)B的名称是_____,H中含氧官能团是_____(填名称)。
(4)A→B的反应类型是_____,有机物y的作用是_____。
(5)写出E→F的化学方程式:_____。
(6)在C的同分异构体中,同时满足下列条件的结构简式为_____(写一种)。
①能发生银镜反应;②1mol有机物最多能消耗2molNaOH;③在核磁共振氢谱上峰的面积比为1∶2∶6.
(7)一种重要的有机物 的合成路线如下图(反应条件已略去),其中 和 的结构简式分别
为_____和_____。
第11页/共11页
学科网(北京)股份有限公司