文档内容
公众号:云儿和花
2023 级“贵百河—武鸣高中”10 月高二年级新高考月考测试
化 学
(考试时间:75分钟 满分:100分)
注意事项:
1.本试卷分选择题和非选择题两部分。答卷前,考生务必将自己的姓名、学校、班级、准考
证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需
改动,用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 P-31 S-32 Fe-56 Cu-64
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符
合题意要求的。
1.化学与生产、生活密切相关,下列有关说法正确的是( )
A.工业合成氨温度为400~500 是因为升高温度有利于提高反应物的平衡转化率
B.石油的裂化、裂解,煤的干馏、气化都属于化学变化
C.多糖、蛋白质、油脂属于有机高分子化合物
D.用作信息高速公路的石英光导纤维是一种新型的有机高分子材料
2.设N 为阿伏加德罗常数的值,下列有关叙述正确的是( )
A
A.标准状况下,4.48LNO和3.2g O 充分反应,产物的分子数为0.2N
2 A
B.1mol C H O含有的C-H键为5N
2 6 A
C.1mol/L CH COOH溶液中,CH COOH分子的数目为N
3 3 A
D.1mol Cu和等物质的量S共热充分反应后转移的电子数为N
A
3.关于下列说法正确的是( )
A.若 31g 白磷的能量比 31g 红磷多 b kJ,则白磷转化为红磷的热化学方程式为 P (白磷,
4
s)===4P(红
磷,s) ΔH=-4b kJ/mol
B.若S(s)+O (g) === SO (g) ΔH ;2SO (g)+O (g)===2SO (g) ΔH ,硫的燃烧热为
2 2 1 2 2 3 2
C.已知中和热∆H=-57.3 kJ/mol,则NaOH(aq)+CH COOH(aq)===CH COONa(aq)+H O(l)
3 3 2
∆H<-57.3 kJ/mol
D.若NH (g)+HCl(g) === NH Cl(s)常温下能自发则该反应的∆H>0
3 4
4.下列离子方程式正确的是( )
A.硫化钠和硝酸混合:S2-+2H+ === H S↑
2
B.氢氧化钡溶液与硫酸铜反应:Ba2++SO 2- === BaSO ↓
4 4
C.石灰水与过量碳酸氢钠溶液反应:2HCO -+ Ca2++2OH- === CaCO ↓+ 2H O+CO 2-
3 3 2 3
D.足量的铁与稀硝酸反应:Fe+NO -+4H+ === Fe3++NO↑+2H O
3 2
5.对于反应“CO+NO CO + NO”,其速率方程为 v=kc2(NO ),k为速率常数,只与温度有
2 2 2
关,则下列说法正确的是( )
A.升高温度,v 增大,v 减小
正 逆
B.增大CO的浓度,化学反应速率不变
C.反应达到平衡后,缩小体积,平衡正向移动
D.该反应速率由反应物共同影响
6.据报道,在300 、70 MPa下由二氧化碳和氢气合成乙醇已成为现实,涉及反应为:公众号:云儿和花
2CO (g)+6H (g) CH CH OH(g)+3H O(g),下列错误的是( )
2 2 3 2 2
A.使用催化剂可大大提高生产效率
B.充入大量CO 气体可提高H 的转化率
2 2
C.反应需在300 进行可推测该反应是吸热反应
D.从平衡混合气体中分离出CH CH OH和H O可提高CO 和H 的利用率
3 2 2 2 2
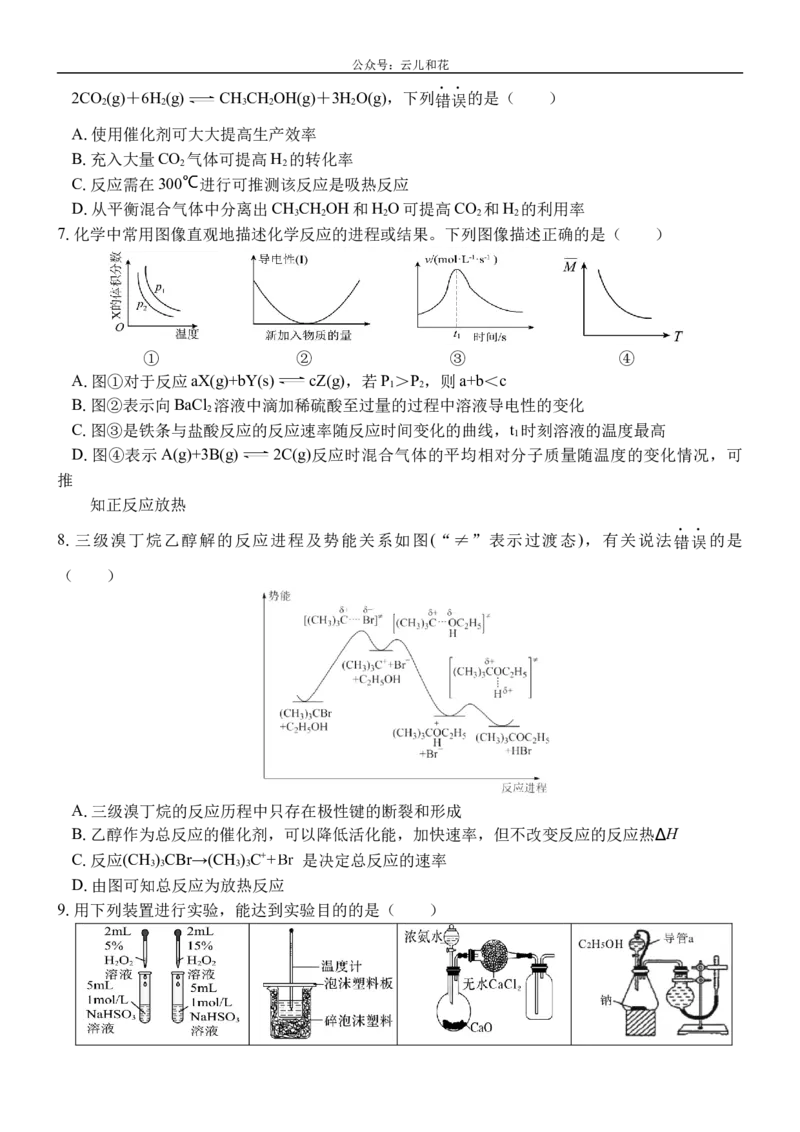
7.化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( )
① ② ③ ④
A.图①对于反应aX(g)+bY(s) cZ(g),若P >P ,则a+b<c
1 2
B.图②表示向BaCl 溶液中滴加稀硫酸至过量的过程中溶液导电性的变化
2
C.图③是铁条与盐酸反应的反应速率随反应时间变化的曲线,t 时刻溶液的温度最高
1
D.图④表示A(g)+3B(g) 2C(g)反应时混合气体的平均相对分子质量随温度的变化情况,可
推
知正反应放热
8.三级溴丁烷乙醇解的反应进程及势能关系如图(“≠”表示过渡态),有关说法错误的是
( )
A.三级溴丁烷的反应历程中只存在极性键的断裂和形成
B.乙醇作为总反应的催化剂,可以降低活化能,加快速率,但不改变反应的反应热∆H
C.反应(CH ) CBr→(CH ) C++ 是决定总反应的速率
3 3 3 3
D.由图可知总反应为放热反应
9.用下列装置进行实验,能达到实验目的的是( )公众号:云儿和花
A.探究浓度对反应速 B.中和反应反应热 C.制取并收集干燥的 D.测定乙醇与钠反
率的影响 的测定 氨气 应生成H 的体积
2
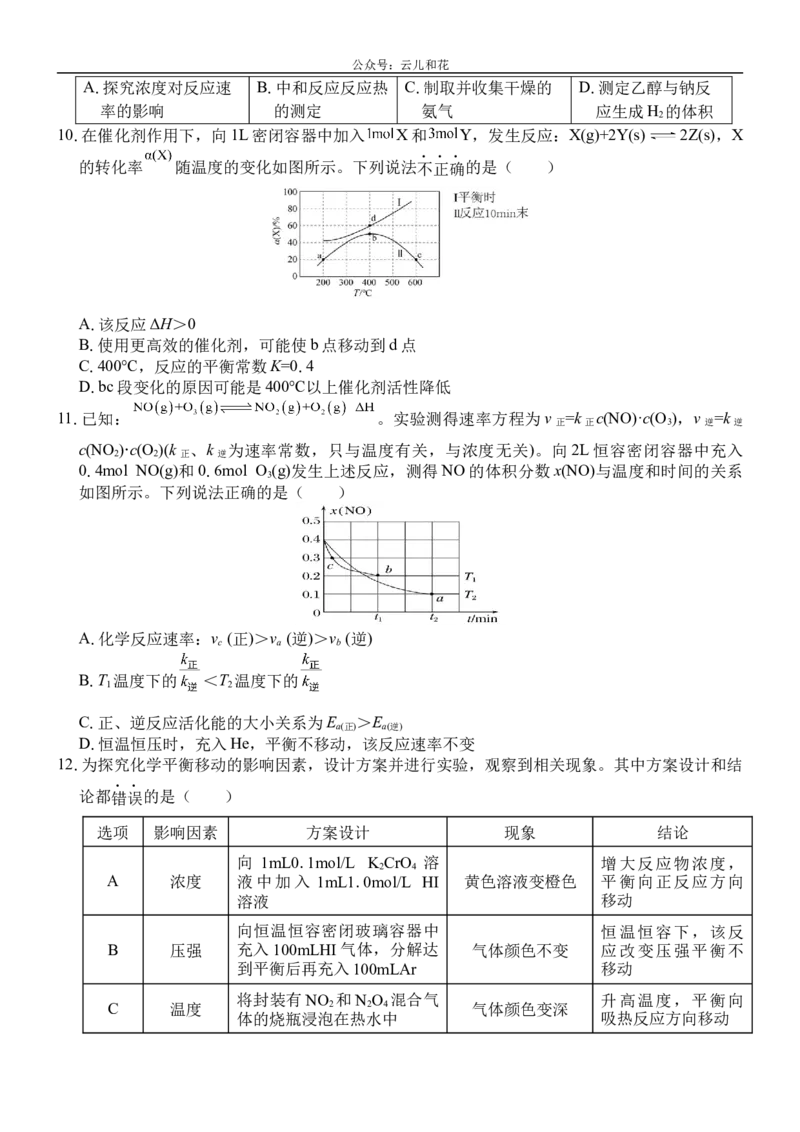
10.在催化剂作用下,向1L密闭容器中加入 X和 Y,发生反应:X(g)+2Y(s) 2Z(s),X
的转化率 随温度的变化如图所示。下列说法不正确的是( )
A.该反应ΔH>0
B.使用更高效的催化剂,可能使b点移动到d点
C.400℃,反应的平衡常数K=0.4
D.bc段变化的原因可能是400℃以上催化剂活性降低
11.已知: 。实验测得速率方程为v =k c(NO)·c(O ),v =k
正 正 3 逆 逆
c(NO )·c(O )(k 、k 为速率常数,只与温度有关,与浓度无关)。向2L恒容密闭容器中充入
2 2 正 逆
0.4mol NO(g)和0.6mol O (g)发生上述反应,测得NO的体积分数x(NO)与温度和时间的关系
3
如图所示。下列说法正确的是( )
A.化学反应速率:v (正)>v (逆)>v (逆)
c a b
B.T 温度下的 <T 温度下的
1 2
C.正、逆反应活化能的大小关系为E >E
a(正) a(逆)
D.恒温恒压时,充入He,平衡不移动,该反应速率不变
12.为探究化学平衡移动的影响因素,设计方案并进行实验,观察到相关现象。其中方案设计和结
论都错误的是( )
选项 影响因素 方案设计 现象 结论
向 1mL0.1mol/L K CrO 溶 增大反应物浓度,
2 4
A 浓度 液中加入 1mL1.0mol/L HI 黄色溶液变橙色 平衡向正反应方向
溶液 移动
向恒温恒容密闭玻璃容器中 恒温恒容下,该反
B 压强 充入100mLHI气体,分解达 气体颜色不变 应改变压强平衡不
到平衡后再充入100mLAr 移动
将封装有NO 和N O 混合气 升高温度,平衡向
C 温度 2 2 4 气体颜色变深
体的烧瓶浸泡在热水中 吸热反应方向移动公众号:云儿和花
向 1mL 乙 酸 乙 酯 中 加 入
使用合适的催化剂
D 催化剂 1mL0.3mol/L H SO 溶液, 上层液体逐渐减少
2 4 可使反应速率加快
水浴加热
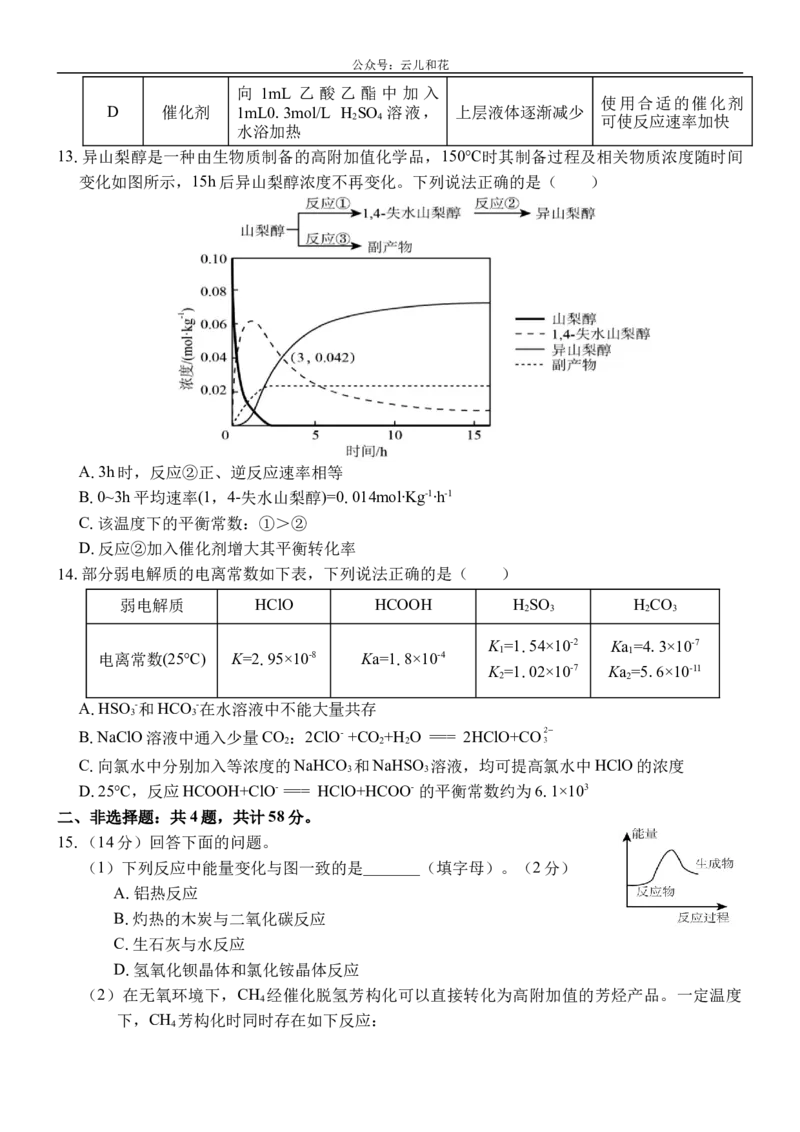
13.异山梨醇是一种由生物质制备的高附加值化学品,150℃时其制备过程及相关物质浓度随时间
变化如图所示,15h后异山梨醇浓度不再变化。下列说法正确的是( )
A.3h时,反应②正、逆反应速率相等
B.0~3h平均速率(1,4-失水山梨醇)=0.014mol∙Kg-1∙h-1
C.该温度下的平衡常数:①>②
D.反应②加入催化剂增大其平衡转化率
14.部分弱电解质的电离常数如下表,下列说法正确的是( )
弱电解质 HClO HCOOH H SO H CO
2 3 2 3
K =1.54×10-2 Ka =4.3×10-7
1 1
电离常数(25℃) K=2.95×10-8 Ka=1.8×10-4
K =1.02×10-7 Ka =5.6×10-11
2 2
A.HSO -和HCO -在水溶液中不能大量共存
3 3
B.NaClO溶液中通入少量CO :2ClO- +CO +H O === 2HClO+CO
2 2 2
C.向氯水中分别加入等浓度的NaHCO 和NaHSO 溶液,均可提高氯水中HClO的浓度
3 3
D.25℃,反应HCOOH+ClO- === HClO+HCOO- 的平衡常数约为6.1×103
二、非选择题:共4题,共计58分。
15.(14分)回答下面的问题。
(1)下列反应中能量变化与图一致的是_______(填字母)。(2分)
A.铝热反应
B.灼热的木炭与二氧化碳反应
C.生石灰与水反应
D.氢氧化钡晶体和氯化铵晶体反应
(2)在无氧环境下,CH 经催化脱氢芳构化可以直接转化为高附加值的芳烃产品。一定温度
4
下,CH 芳构化时同时存在如下反应:
4公众号:云儿和花
i.CH (g)→C(s)+2H (g) ∆H =+74.6kJ∙mol-1 ∆S=+80.84J∙mol-1∙K-1
4 2 1
ii.6CH (g)→C H (l)+9H (g) ∆H
4 6 6 2 2
回答下列问题:
①反应ⅰ在1000K时_______(选填“能”或“不能”)自发进行。(2分)
②已知25℃时有关物质的燃烧热数据如表,则反应ⅱ的∆H = kJ∙mol-1(用含a、
2
b、c的代数式表示)。(2分)
物质 CH (g) C H (l) H (g)
4 6 6 2
∆H/(kJ‧mol-1) a b c
(3)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,回
答下列问题:
①a、b、c三点溶液的pH的大小: 。(2分)
②用湿润的pH试纸测量a处溶液的pH,测量结果 (填
“偏大”、“偏小”或“不变”)。(2分)
③用蒸馏水稀释c处的溶液,则下列各式表示的数值随水量的增
加而减小的是___________。(2分)
A. B.电离度α(CH COOH)
3
C.n(H+) D.
(4)相同条件下,将pH=3的硫酸溶液和醋酸溶液,分别稀释成pH=5,加水后的体积:前者
后者(填“>”、“<”或“=”)。(2分)
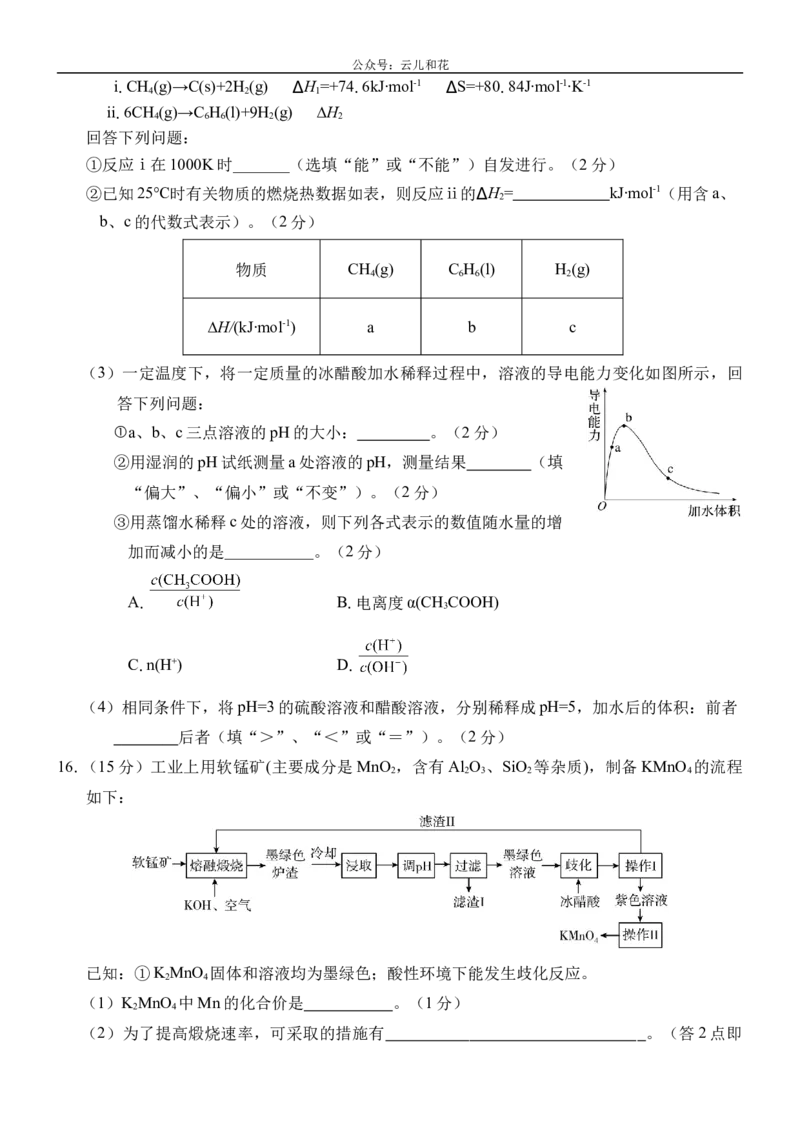
16.(15分)工业上用软锰矿(主要成分是MnO ,含有Al O 、SiO 等杂质),制备KMnO 的流程
2 2 3 2 4
如下:
已知:①K MnO 固体和溶液均为墨绿色;酸性环境下能发生歧化反应。
2 4
(1)K MnO 中Mn的化合价是 。(1分)
2 4
(2)为了提高煅烧速率,可采取的措施有 。(答2点即公众号:云儿和花
可)
(2分)
(3)熔融煅烧时将空气改用KClO也能达到目的,写出KClO与软锰矿反应的主要化学方程
式: 。(2分)
(4)向浸取后的溶液中通入 CO ,调节其 pH,经过滤得滤渣Ⅰ,滤渣Ⅰ的成分是
2
。
(2分)整个流程中可以循环利用的物质是 。(2分)
(5)写出歧化一步发生的离子反应方程式: 。(2分)
(6)“歧化”时,下列物质能代替冰醋酸的是: (填序号)。(2分)
①浓盐酸 ②H SO ③稀硫酸 ④HI
2 3
(7)“操作Ⅱ”可通过 、 ,过滤、洗涤、干燥等一系列操作获得 KMnO
4
晶体。(每空1分)
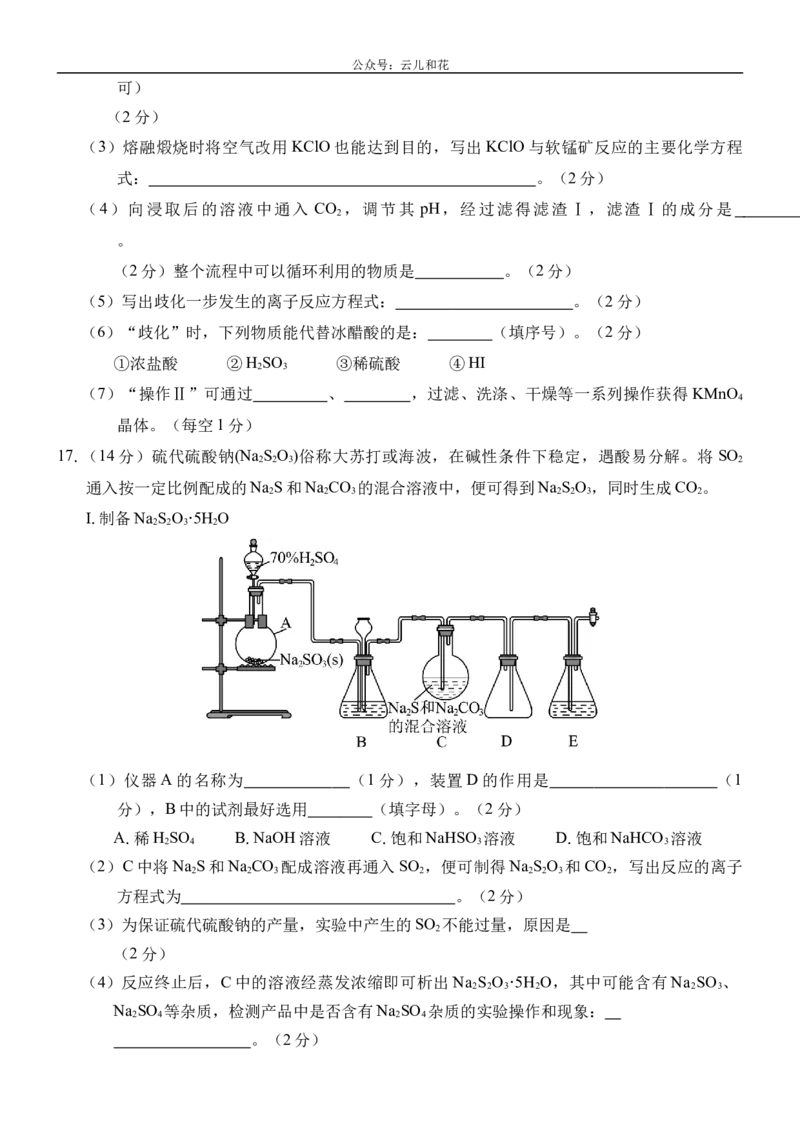
17.(14分)硫代硫酸钠(Na S O )俗称大苏打或海波,在碱性条件下稳定,遇酸易分解。将 SO
2 2 3 2
通入按一定比例配成的Na S和Na CO 的混合溶液中,便可得到Na S O ,同时生成CO 。
2 2 3 2 2 3 2
Ⅰ.制备Na S O ·5H O
2 2 3 2
(1)仪器 A的名称为 (1分),装置 D的作用是 (1
分),B中的试剂最好选用 (填字母)。(2分)
A.稀H SO B.NaOH溶液 C.饱和NaHSO 溶液 D.饱和NaHCO 溶液
2 4 3 3
(2)C中将Na S和Na CO 配成溶液再通入SO ,便可制得Na S O 和CO ,写出反应的离子
2 2 3 2 2 2 3 2
方程式为 。(2分)
(3)为保证硫代硫酸钠的产量,实验中产生的SO 不能过量,原因是
2
(2分)
(4)反应终止后,C中的溶液经蒸发浓缩即可析出Na S O ·5H O,其中可能含有Na SO 、
2 2 3 2 2 3
Na SO 等杂质,检测产品中是否含有Na SO 杂质的实验操作和现象:
2 4 2 4
。(2分)公众号:云儿和花
Ⅱ.探究Na S O 的部分化学性质
2 2 3
Ⅲ.Na S O 的应用
2 2 3
已知: 。
某同学探究与稀H SO 反应的速率影响因素时,设计了如下系列实验:
2 4
0.1mol/L Na S O 溶液 0.1mol/LH SO 溶 水的体积/ 水 浴 温 测 定 变 浑
编号 2 2 3 2 4
的体积/ 液的体积/ 度/℃ 浊时间/s
① 10.0 15.0 0 35 t
1
② 10.0 10.0 V 35 t
1 2
③ 15.0 0 45 t
3
(5) 。(2分)
(6)通过对比实验①和②,验证 对反应速率的影响,因此测定变浑浊的时间t t
1 2
(填“>、“<”或“=”)。(每空1分)
18.(15分)Ⅰ.工业上利用甲醇和水蒸气催化重整法可制备氢气。
(1)知:
反应1:CH OH(g) CO(g)+2H (g) ∆H =+90.0 kJ∙mol-1 K
3 2 1 1
反应2:CO(g)+H O(g) CO (g)+H (g) ∆H =-41.0 kJ∙mol-1 K
2 2 2 2 2
则反应 3:CH OH(g)+H O(g) CO (g)+3H (g) K= (用含 K 、K 的代数式表
3 2 2 2 1 2
示)。
(2分)
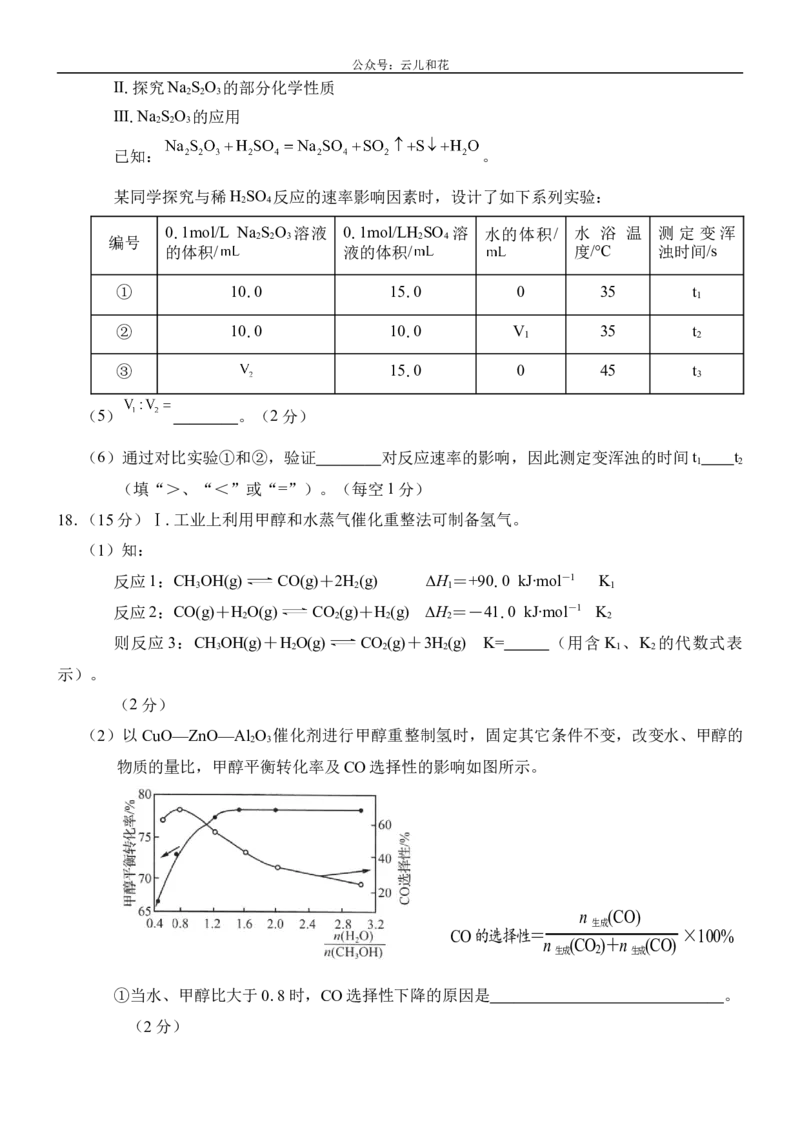
(2)以CuO—ZnO—Al O 催化剂进行甲醇重整制氢时,固定其它条件不变,改变水、甲醇的
2 3
物质的量比,甲醇平衡转化率及CO选择性的影响如图所示。
n (CO)
生成
CO的选择性= ×100%
n (CO)+n (CO)
生成 2 生成
①当水、甲醇比大于0.8时,CO选择性下降的原因是 。
(2分)公众号:云儿和花
②当水、甲醇比一定时,温度升高,CO选择性有所上升,可能原因是
。
(2分)
(3)在t℃下,在1L密闭容器中,当投入的CH OH和H O均为1mol时,甲醇平衡转化率为
3 2
80%、CO选择性为60%。则c(CO)= mol∙L-1。(2分)
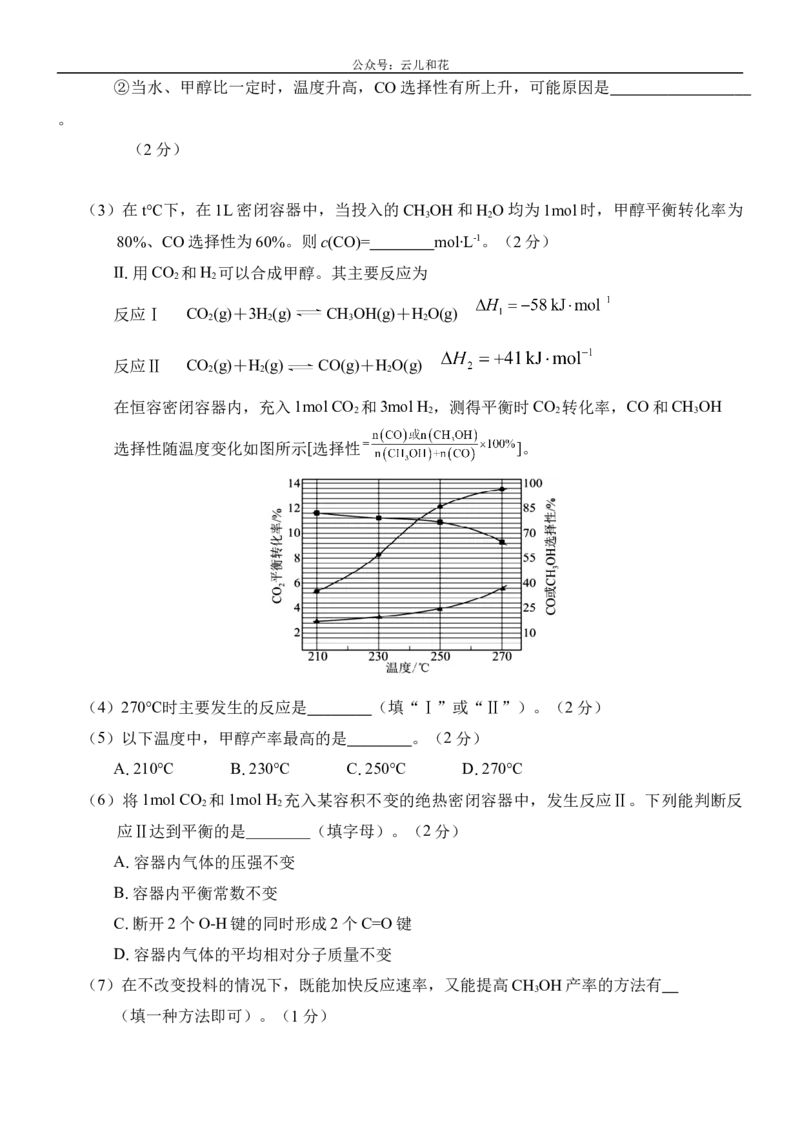
Ⅱ.用CO 和H 可以合成甲醇。其主要反应为
2 2
反应Ⅰ CO (g)+3H (g) CH OH(g)+H O(g)
2 2 3 2
反应Ⅱ CO (g)+H (g) CO(g)+H O(g)
2 2 2
在恒容密闭容器内,充入1mol CO 和3mol H ,测得平衡时CO 转化率,CO和CH OH
2 2 2 3
选择性随温度变化如图所示[选择性 ]。
(4)270℃时主要发生的反应是 (填“Ⅰ”或“Ⅱ”)。(2分)
(5)以下温度中,甲醇产率最高的是 。(2分)
A.210℃ B.230℃ C.250℃ D.270℃
(6)将1mol CO 和1mol H 充入某容积不变的绝热密闭容器中,发生反应Ⅱ。下列能判断反
2 2
应Ⅱ达到平衡的是________(填字母)。(2分)
A.容器内气体的压强不变
B.容器内平衡常数不变
C.断开2个O-H键的同时形成2个C=O键
D.容器内气体的平均相对分子质量不变
(7)在不改变投料的情况下,既能加快反应速率,又能提高CH OH产率的方法有
3
(填一种方法即可)。(1分)公众号:云儿和花
2023 级“贵百河—武鸣高中”10 月高二年级新高考月考测试
化学参考答案
一、选择题(每题3分,共42分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 B D A C B C D B D C B A C D
二、非选择题:共4小题,共58分(除特别说明外每空2分)
15.(14分)
(1)BD(写对一个得1分,错选或多选不给分)
(2)①能
②6a-b-9c
(3)①c>a>b
②偏小
③AD(写对一个得1分,错选或多选不给分)
(4)<
16.(15分)
(1)+6(1分)
(2)软锰矿粉碎、搅拌等
(3)MnO +KClO+2KOH KMnO +KCl+H O(条件或者配平不对扣1分,只写对反应物和生成物得1分)
2 2 4 2
(4)HSiO、Al(OH) (写对一个得1分) MnO
2 3 3 2
(5)3MnO 2-+4CH COOH=== 2MnO -+MnO +2HO +4CH COO-(配平不对扣1分,只写对反应物和生成物得1
4 3 4 2 2 3
分)
(6)③
(7)蒸发浓缩(1分) 冷却结晶(1分,写“结晶”而已不给分)
17.(14分)
(1)圆底烧瓶(1分) 安全瓶,防倒吸(1分) C
(2)CO2-+2S2-+4SO === 3SO2-+CO
3 2 2 3 2
(3)若SO 过量,溶液显酸性,产物NaSO 遇酸易分解,导致产率下降
2 2 2 3
(4)取少量产品溶于足量稀盐酸,静置,取上层清液,再滴加BaCl 溶液,若出现沉淀,则说明含有NaSO 杂质
2 2 4
(合理即给分)
(5)1∶2
(6)HSO 浓度(或浓度)(1分) < (1分)
2 4
18.(15分)
(1)KK
1 2
(2)①加水的用量(或增大水、甲醇比),促进反应2或反应3正向进行,CO 选择性上升,CO选择性下降。
2
②反应1为吸热反应,升高温度,反应1正向移动,n(CO)增大,反应2为放热反应,升高温度,反应
2逆向进
行,n(CO)增大,导致CO选择性上升。
(3)0.48
(4)I
(5)C
(6)AB
(7)加压(或缩小容器体积)(1分)