文档内容
2004 年广东高考化学真题及答案
第I卷(选择题共72分)
可能用到的原子量:H 1 C 12 N 14 O 16 Cu 64
一、选择题(本题包括9小题,每小题4分,共36分。每小题只有一个选项符合题意)
1、下列各组物质中,互为同位素的是
A、重氢、超重氢 B、氧、臭氧 C、红磷、白磷 D、乙酸、丙酸
2、上世纪80年共后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关于NO的说法不
正确的是
A、NO分子中有极性共价键 B、NO是造成化学烟雾的因素之一
C、NO是汽车尾气的有害成分之一 D、NO分子所含电子总数为偶数
3、pH相同的盐酸和醋酸两种溶液中,它们的
A、H+的物质的量相同 B、物质的量浓度相同
C、H+的物质的量浓度不同 D、H+的物质的量浓度相同
4、把Ba(OH) 溶液滴入明矾溶液中,使SO2ˉ全部转化成BaSO 沉淀,此时铝元素的主要存在形式是
2 4 4
A、Al3+ B、Al(OH) C、AlOˉ D、Al3+和Al(OH)
3 2 3
5、在恒温时,一固定容积的容器内发生如下反应:2NO(g) NO(g) 达到平衡时,再向容器内通
2 2 4
入一定量的NO(g),重新达到平衡后,与第一次平衡时相比,NO 的体积分数
2 2
A、不变 B、增大 C、减小 D、无法判断
6、下列有关溶液性质的叙述,正确的是
A、室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B、20℃,100g水可溶解34.2g KCl,此时KCl饱和溶液的质量分数为34.2%
C、强电解质在水中溶解度一定大于弱电解质
D、相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加
7、分子为CHCl的同分异构体有
4 9
A、1种 B、2种 C、3种 D、4种
8、下列叙述正确的是
A、发生化学反应时失去电子越多的金属原子,还原能力越强
B、金属阳离子被还原后,一定得到该元素的单质
C、核外电子总数相同的原子,一定是同种元素的原子
D、能与酸反应的氧化物,一定是碱性氧化物
9、一定温度下,反应2SO + O 2SO,达到平衡时,n(SO):n(O):n(SO)= 2:3:4。缩小体积,反应
2 2 2 2 2 3
再次达到平衡时,n(O)=0.8mol,n(SO)=1.4mol,此时 的物质的量应是
2 3 SO2
A、0.4mol B、0.6mol C、0.8mol D、1.2mol
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只
包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个
且都正确的4分,但只要选错一个,该小题就为0分)
10、 下列有碱金性铷(Rb)的叙述中,正确的是
A、灼烧氯化铷时,火焰有特殊颜色
B、硝酸铷是离子化合物,易溶于水
C、在钠、钾、铷三种单质中,铷的熔点最高
D、氢氧化铷是弱碱
11、 pH = a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能
是
第1页 | 共8页A、NaOH B、HSO C、AgNO D、NaSO
2 4 3 2 4
12、 下列离子方程式中,正确的是
A、在氯化亚铁溶液中通入氯气 Fe2+ + Cl = Fe3+ + 2Clˉ
2
B、三氯化铁溶液跟过量氨水反应 Fe3+ + 3NH•HO = Fe(OH)↓ + 3NH+
3 2 3 4
C、碳酸氢钙溶液跟稀硝酸反应 Ca(HCO) + 2H+ = Ca2+ + 2HO + 2CO↑
3 2 2 2
D、氯气通入冷的氢氧化钠溶液中 2Cl + 2OHˉ = 3Clˉ + ClOˉ + HO
2 2
13、 下列反应完成后没有沉淀的是
A、BaCl 溶液与NaCO 溶液加足量稀CHCOOH
2 2 3 3
B、Ba(OH) 溶液与KNO 溶液加足量稀HSO
2 3 2 4
C、AgNO 溶液与NaCO 溶液加足量稀HCl
3 2 3
D、Ca(OH) 溶液与FeCl 溶液加足量稀HNO
2 3 3
14、 甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol/L时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现
有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为a、乙酸、
b。由此可知
A、a的浓度必小于乙酸的浓度
B、a的浓度必大于乙酸的浓度
C、b的浓度必小于乙酸的浓度
D、b的浓度必大于乙酸的浓度
15、 X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成
自然界最硬的原子晶体。下列叙述错误的是
A、WX 是沼气的主要成分
4
B、固态XY是分子晶体
2
C、ZW是原子晶体
D、ZY 的水溶液俗称“水玻璃”
2
16、 下列说法正确的是
A、pH = 2与pH = 1的硝酸中c(H+)之比为1:10
B、NaCO 溶液中c(Na+)与c(CO2ˉ )之比为2:1
2 3 3
C、0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1
D、NO 溶于水时,被氧化的n(NO)与被还原的n(NO)之比为3:1
2 2 2
17、 已知葡萄糖的燃烧热是2804kJ/mol,当它氧化生成1g水时放出的热量是
A、26.0kJ B、51.9kJ C、155.8kJ D、467.3kJ
18、 右图曲线a表示放热反应 X(g) + Y(g) Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化
的关系。若要改变起始条件,使反应过程按b曲线 X 进行,可采
的
取的措施是 转
A、升高温度 化 b
率
B、加大X的投入量 a
C、加催化剂
D、增大体积 o
时间
第Ⅱ卷(非选择题,共78分)
三、(本题包括2小题,共20分)
19、 (4分)用仪器A、B和胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外不能选用其
他试剂)。
第2页 | 共8页20、 (16分)海水的综合利用可以制备金属镁,其流和如下图所示:
水,重结晶
粗盐 精盐
蒸发
海水
盐酸 脱水 电解
母液 Mg(OH) MgCl •6H MgCl Mg
2 浓缩 2 2 2
O
煅烧 水
贝壳 CaO 石灰乳
(1)若在空气中加热MgCl•6HO,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式
2 2
用电解法制取金属镁时,需要无水氧化镁。在干燥的HCl气流中加热MgCl•6HO时,能得到无水
2 2
MgCl,其原因是
2
(2)Mg(OH) 沉淀中混有的Ca(OH) 应怎样除去?写出实验步骤。
2 2
(3)实验室时将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分
别说明在这三种情况下使用玻璃棒的目的:
溶解时:
过滤时:
蒸发时:
四、(本题包括2小题,共20分)
21、 (10 分)A、B、C、D 是四种可溶的化合物,分别由阳离子 K+、Ba2+、Al3+、Fe3+和阴离子 OHˉ、
CO2ˉ、NOˉ、SO2ˉ两两组合而成,它们的溶液发生如下反应:
3 3 4
A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。
C与D反应生成有色沉淀。
B与C反应生成白色沉淀。
写出它们的化学式:
A: B: C: D:
22、 (10分)我国研制的长征捆绑式火箭在第一、二级发动中用“编二甲(基)肼”和四氧化二氮作为液
体燃料。
(1) 已知偏二甲(基)肼的相对分子质量为60,其中含碳40%,含氢13.33%,其余为氮;又知其分
子中有一个氮原子不与氢原子相连。通过计算写出偏二(基)肼的化学式和分子结构简式:
第3页 | 共8页(2) 在发动机中偏二甲(基)肼在四氧化二氮中充分燃烧,写出该燃烧反应的化学方程式(反应中
所有的氮元素均转化为N)。
2
五、(本题包括2小题,共18分)
23、 (8分)根据下面的反应路线及所给信息填空。
Cl
Cl2, 光照 NaOH, 乙醇 Br2的C Cl4溶液
A B
① △ ,② ③ ④
(一氯环已烷)
(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ,③的反应类型是 。
(3)反应④的化学方程式是
24、 (10分)
(1)具有支链的化合物A的分子式为CHO,A可以使Br 的四氯化碳溶液褪色。1molA
4 9 2 2
和1mol NaHCO 能完全反应,则A的结构简式是 。写出与 A 具有
3
相同官能团的A的所有同分异构体的结构简式
。
(2)化合物 B 含有 C、H、O 三种元素,分子量为 60,其中碳的质量分数为 60%,氢的质量分数为
13.3%。B在催化剂Cu的作用下被氧气氧化成C,C能发生银镜反应,
则B的结构简式是
(3)D在NaOH水溶液中加热反应,可生成A的钠盐和B,相应反应的化学方程式是
六、(本题包括2小题,共20分)
25、 (8分)维生素C(又名抗坏血酸,分子式为CHO)具有较强的还原性,放置在空气中易被氧化,其
6 8 6
含量可通过在弱酸性溶液中用已知浓度的I 溶液进行滴定。该反应的化学方程式如下:
2
第4页 | 共8页CHO + I = CHO + 2HI
6 8 6 2 6 6 6
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10mL 6mol/LCHCOOH,加入100mL
3
蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000g样品,溶解于上述冷却的溶液中。加入1mL淀
粉指示剂,立即用浓度为0.05000mol/L的I 溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗
2
21.00mL I 溶液。
2
(1)为何加入的CHCOOH稀溶液要先经煮沸、冷却后才能使用?
3
(2)计算样品中维生素C的质量分数。
26、 (12分)孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO•yCu(OH) (x、y为正整数且x≤2,y≤2)
3 2
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO 的物质的量之
2
比为4:1;石青则为3:1。请推算它们的化学组成。
孔雀石: 石青:
第5页 | 共8页(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO 3.36L(标
2
准状况下);加热另一份样品使其完全分解,得到CuO 20g,试通过计算确定该混合物中孔雀石和石青
的物质的量之比。
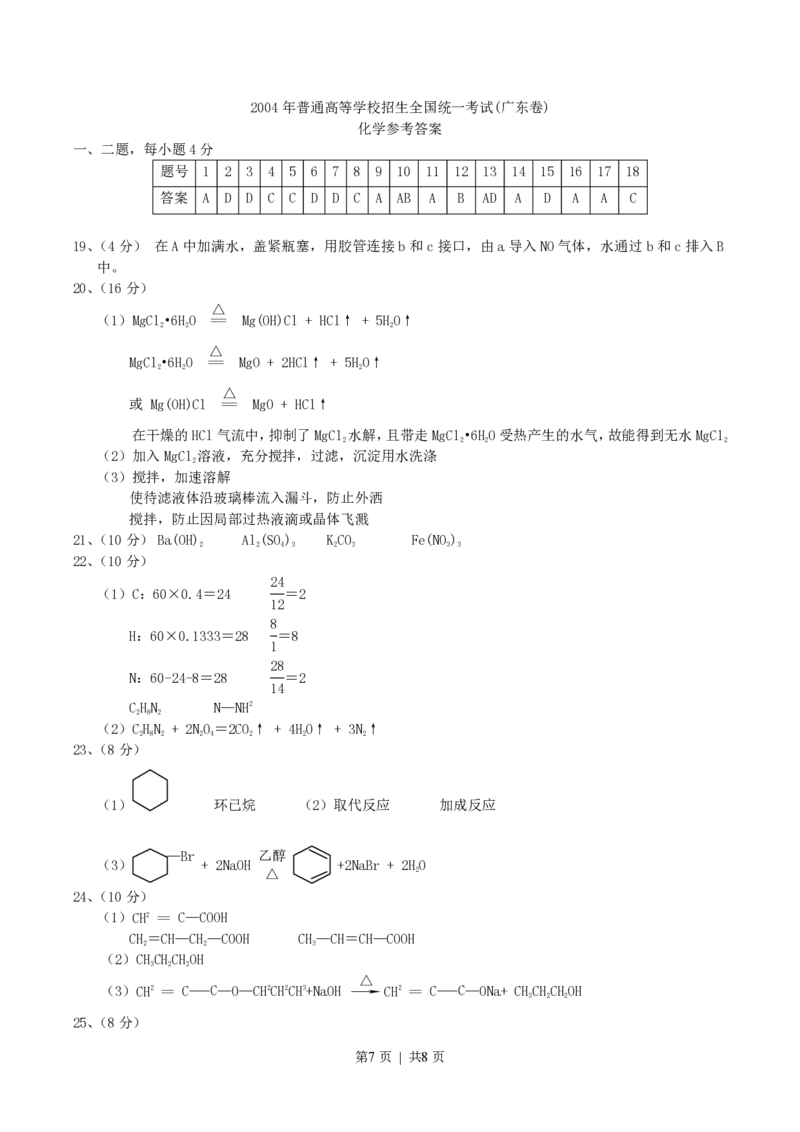
第6页 | 共8页2004年普通高等学校招生全国统一考试(广东卷)
化学参考答案
一、二题,每小题4分
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
答案 A D D C C D D C A AB A B AD A D A A C
19、(4分) 在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B
中。
20、(16分)
△
(1)MgCl•6HO = Mg(OH)Cl + HCl↑ + 5HO↑
2 2 2
△
MgCl•6HO = MgO + 2HCl↑ + 5HO↑
2 2 2
△
或 Mg(OH)Cl = MgO + HCl↑
在干燥的HCl气流中,抑制了MgCl 水解,且带走MgCl•6HO受热产生的水气,故能得到无水MgCl
2 2 2 2
(2)加入MgCl 溶液,充分搅拌,过滤,沉淀用水洗涤
2
(3)搅拌,加速溶解
使待滤液体沿玻璃棒流入漏斗,防止外洒
搅拌,防止因局部过热液滴或晶体飞溅
21、(10分)Ba(OH) Al(SO) KCO Fe(NO)
2 2 4 3 2 3 3 3
22、(10分)
24
(1)C:60×0.4=24 =2
12
8
H:60×0.1333=28 =8
1
28
N:60-24-8=28 =2
14
CHN N—NH2
2 8 2
(2)CHN + 2NO=2CO↑ + 4HO↑ + 3N↑
2 8 2 2 4 2 2 2
23、(8分)
(1) 环已烷 (2)取代反应 加成反应
—Br 乙 醇
(3) + 2NaOH +2NaBr + 2HO
△ 2
24、(10分)
(1)CH2 = C—COOH
CH=CH—CH—COOH CH—CH=CH—COOH
2 2 3
(2)CHCHCHOH
3 2 2
△
(3)CH2 = C—C—O—CH2CH2CH3+NaOH →CH2 = C—C—ONa+ CHCHCHOH
3 2 2
25、(8分)
第7页 | 共8页(1)煮沸是为了除去溶液中溶解的O,避免维生素C被O 氧化,冷却是为了减缓滴定过程中维生素C
2 2
与液面上空气接触时被氧化的速度。
0.05000mol/L × 21.00mL × 176.0g/mol
(2) × 100% = 92.40%
1.000mL/L × 0.2000g
26、(12分)
解:(1)设孔雀石的化学式为xCuCO•yCu(OH)
3 2
x 1 x 1
则依题意 = =
(2x + 2y) 4 y 1
孔雀石的化学式为 CuCO•Cu(OH)
3 2
又设石青的化学式为 xCuCO•yCu(OH)
3 2
x 1 x 2
则依题意 = =
(2x + 2y) 3 y 1
石青的化学式为 2CuCO•Cu(OH)
3 2
(2)设该样品中孔雀石物质的量分数为x,则石青为 1- x
x + (1 - x)2 3.36 + 22.4 3
= =
2x + (1 - x)3 20 + 80 5
孔雀石与石青物质的量之比为1:1
第8页 | 共8页