文档内容
山东省聊城市2025-2026学年高二上学期11月期中教学质量检测化学试题
一、单选题
1.下列说法不正确的是
A.合成氨工业中采用循环操作,主要是为了提高平衡混合物中氨的含量
B.燃油汽车上的三元催化器中的催化剂提高了反应物中活化分子百分数,加快了反应速率
C.同温同压下, 在光照条件下和点燃条件下的 相同
D.在实验室配制NaS溶液时,常滴加几滴浓NaOH溶液
2
2. 为阿伏加德罗常数的值。下列说法正确的是
A.25℃时,1 L pH=1的HSO 溶液中H+的物质的量为:
2 4
B. 熔融的NaHSO 中,阳离子的数目为:0.2
4
C.25℃时,pH=11的NaCO 溶液中 的数目为:0.001
2 3
D.25℃时,pH=10的CHCOONa溶液中,水电离出的 浓度为:
3
3.下列反应均能自发进行。下列判断不正确的是
①
②
③
④
A. B.
C. D.
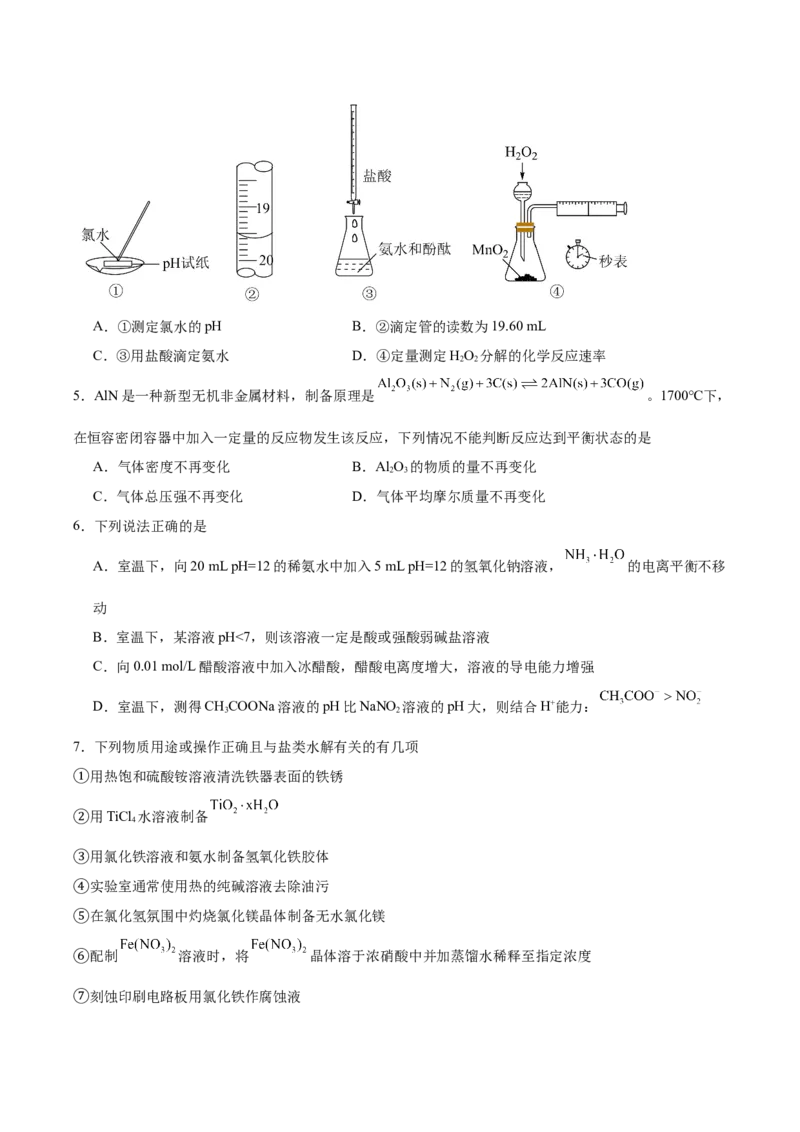
4.下列各实验或装置的叙述正确的是A.①测定氯水的pH B.②滴定管的读数为19.60 mL
C.③用盐酸滴定氨水 D.④定量测定HO 分解的化学反应速率
2 2
5.AlN是一种新型无机非金属材料,制备原理是 。1700℃下,
在恒容密闭容器中加入一定量的反应物发生该反应,下列情况不能判断反应达到平衡状态的是
A.气体密度不再变化 B.Al O 的物质的量不再变化
2 3
C.气体总压强不再变化 D.气体平均摩尔质量不再变化
6.下列说法正确的是
A.室温下,向20 mL pH=12的稀氨水中加入5 mL pH=12的氢氧化钠溶液, 的电离平衡不移
动
B.室温下,某溶液pH<7,则该溶液一定是酸或强酸弱碱盐溶液
C.向0.01 mol/L醋酸溶液中加入冰醋酸,醋酸电离度增大,溶液的导电能力增强
D.室温下,测得CHCOONa溶液的pH比NaNO 溶液的pH大,则结合H+能力:
3 2
7.下列物质用途或操作正确且与盐类水解有关的有几项
用热饱和硫酸铵溶液清洗铁器表面的铁锈
①
用TiCl 水溶液制备
4
②
用氯化铁溶液和氨水制备氢氧化铁胶体
③实验室通常使用热的纯碱溶液去除油污
④在氯化氢氛围中灼烧氯化镁晶体制备无水氯化镁
⑤
配制 溶液时,将 晶体溶于浓硝酸中并加蒸馏水稀释至指定浓度
⑥
刻蚀印刷电路板用氯化铁作腐蚀液
⑦用泡沫灭火器灭火
⑧A.3 B.4 C.5 D.6
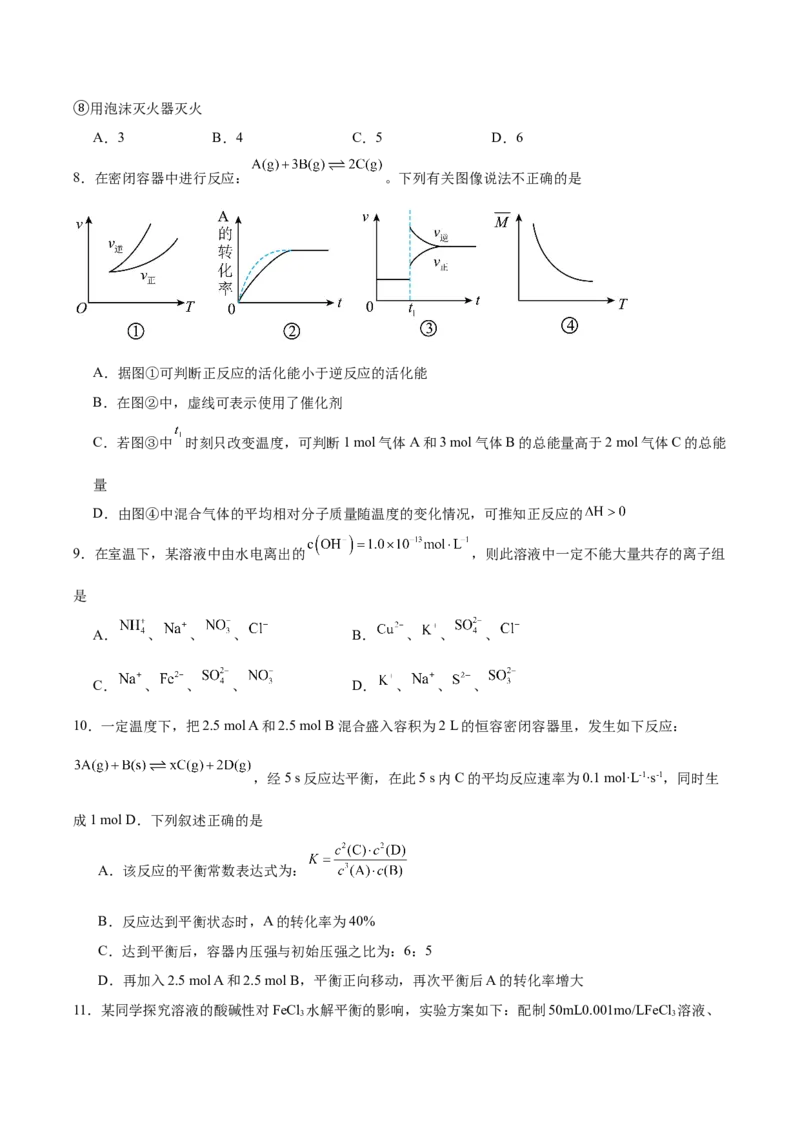
8.在密闭容器中进行反应: 。下列有关图像说法不正确的是
A.据图①可判断正反应的活化能小于逆反应的活化能
B.在图②中,虚线可表示使用了催化剂
C.若图③中 时刻只改变温度,可判断1 mol气体A和3 mol气体B的总能量高于2 mol气体C的总能
量
D.由图④中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的
9.在室温下,某溶液中由水电离出的 ,则此溶液中一定不能大量共存的离子组
是
A. 、 、 、 B. 、 、 、
C. 、 、 、 D. 、 、 、
10.一定温度下,把2.5 mol A和2.5 mol B混合盛入容积为2 L的恒容密闭容器里,发生如下反应:
,经5 s反应达平衡,在此5 s内C的平均反应速率为0.1 mol·L-1·s-1,同时生
成1 mol D.下列叙述正确的是
A.该反应的平衡常数表达式为:
B.反应达到平衡状态时,A的转化率为40%
C.达到平衡后,容器内压强与初始压强之比为:6:5
D.再加入2.5 mol A和2.5 mol B,平衡正向移动,再次平衡后A的转化率增大
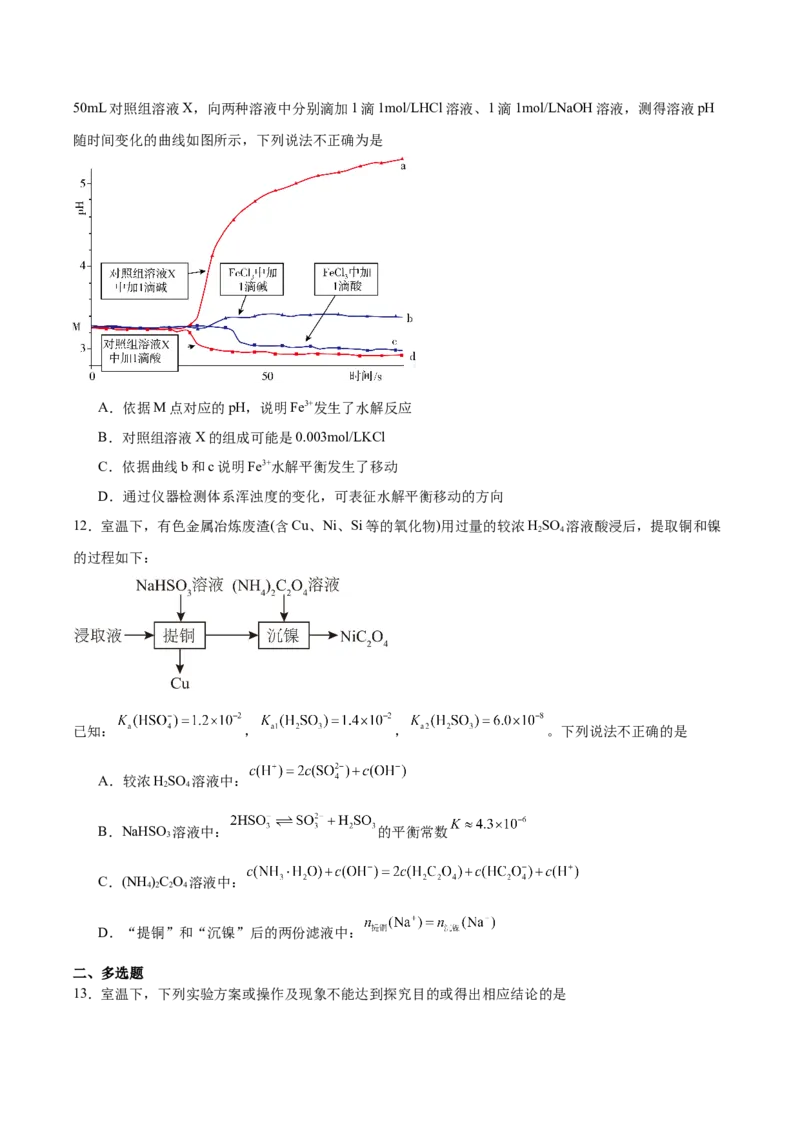
11.某同学探究溶液的酸碱性对FeCl 水解平衡的影响,实验方案如下:配制50mL0.001mo/LFeCl 溶液、
3 350mL对照组溶液X,向两种溶液中分别滴加1滴1mol/LHCl溶液、1滴1mol/LNaOH溶液,测得溶液pH
随时间变化的曲线如图所示,下列说法不正确为是
A.依据M点对应的pH,说明Fe3+发生了水解反应
B.对照组溶液X的组成可能是0.003mol/LKCl
C.依据曲线b和c说明Fe3+水解平衡发生了移动
D.通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向
12.室温下,有色金属冶炼废渣(含Cu、Ni、Si等的氧化物)用过量的较浓HSO 溶液酸浸后,提取铜和镍
2 4
的过程如下:
已知: , , 。下列说法不正确的是
A.较浓HSO 溶液中:
2 4
B.NaHSO 溶液中: 的平衡常数
3
C.(NH )C O 溶液中:
4 2 2 4
D.“提铜”和“沉镍”后的两份滤液中:
二、多选题
13.室温下,下列实验方案或操作及现象不能达到探究目的或得出相应结论的是选
实验方案或操作及现象 探究目的或结论
项
向盛有 溶液的试管中滴 探究CHCOOH的 与
3
A
加 溶液,观察气泡产生的情况 HCO 的 的大小
2 3
分别测浓度均为 的CHCOONH 溶液和 比较 和 的水
B 3 4
NaHCO 3 溶液的pH值 解常数
向盛有NO 与NO 的恒压密闭容器中通入一定体 化学平衡向NO 减少的方向
C 2 2 4 2
积的N,最终气体颜色变浅 移动
2
NH 和空气的混合气体通过热的Cr O,Cr O 持续
D 3 2 3 2 3 该反应
红热
A.A B.B C.C D.D
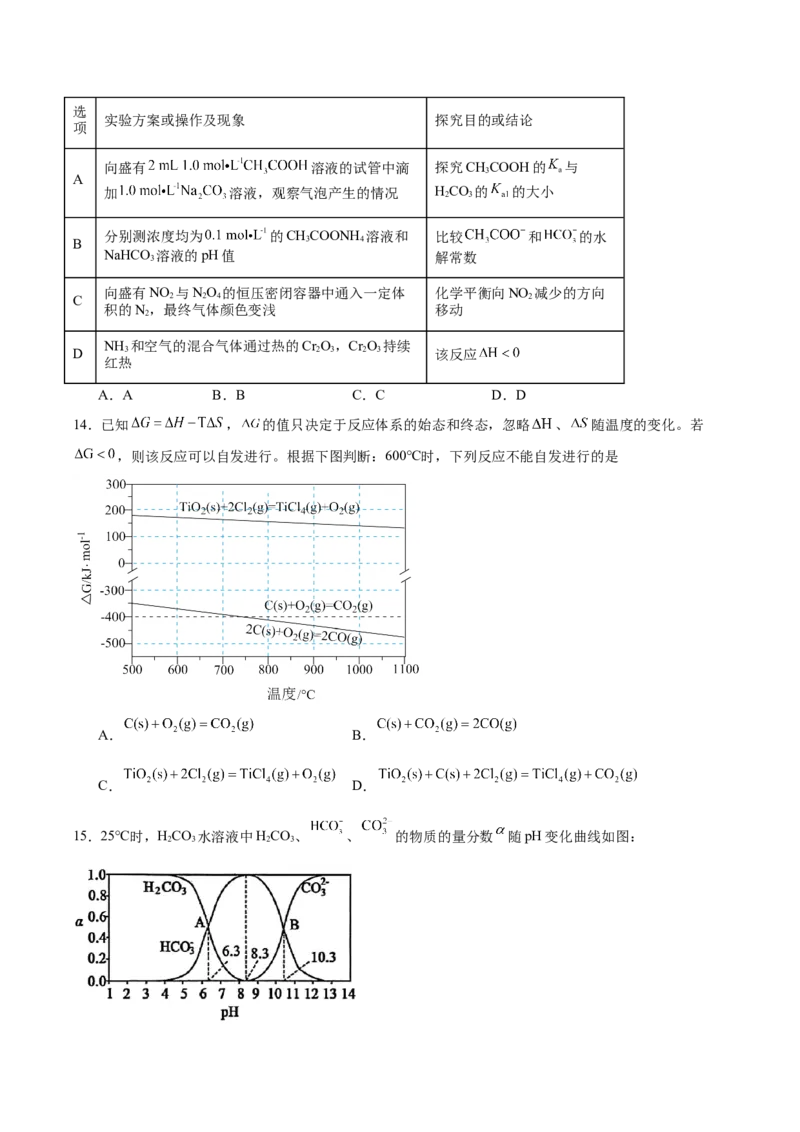
14.已知 , 的值只决定于反应体系的始态和终态,忽略 、 随温度的变化。若
,则该反应可以自发进行。根据下图判断:600℃时,下列反应不能自发进行的是
A. B.
C. D.
15.25℃时,HCO 水溶液中HCO、 、 的物质的量分数 随pH变化曲线如图:
2 3 2 3已知: , 为气相CO 分压。下列说法不正确
2
的是
A. 的数量级是10-6
B. 溶液与 溶液的pH值之差小于0.5
C.若加入NaOH溶液至pH=8.3时,
D. ,则
三、解答题
16.电解质在水溶液中存在各种行为,如电离、水解等。回答下列问题:
(1)已知:25℃时,0.1 mol·L-1的HA溶液中 。写出HA的电离方程式 。
(2)已知:
弱电解质 CHCOOH HClO HCO
3 2 3
或 (25℃) 1.75×10-5 4.0×10-8 、 1.8×10-5
相同pH的HClO溶液和CHCOOH溶液,溶液的浓度 (填“>”、“<”或
3
①
“=”)。
常温下,向10 mL一定浓度的CHCOOH溶液中加入蒸馏水稀释至100 mL的过程中,醋酸的电离程度
3
②(填“增大”、“减小”或“不变”),下列数据变大的是 (填字母)。
A. B. C. D. E.
相同物质的量浓度的5种溶液:a.CHCOONa溶液;b.NaClO溶液;c.NaCO 溶液;d.NH Cl溶液;
3 2 3 4
③e.CHCOONH 溶液。pH从小到大的排序是 (填字母)。
3 4
向NaClO溶液中通入少量CO,发生反应的离子方程式为 。
2
④
(3)某温度下, ,向 溶液中加入等浓度的NaHSO 溶液至 恰好沉淀完全,
4
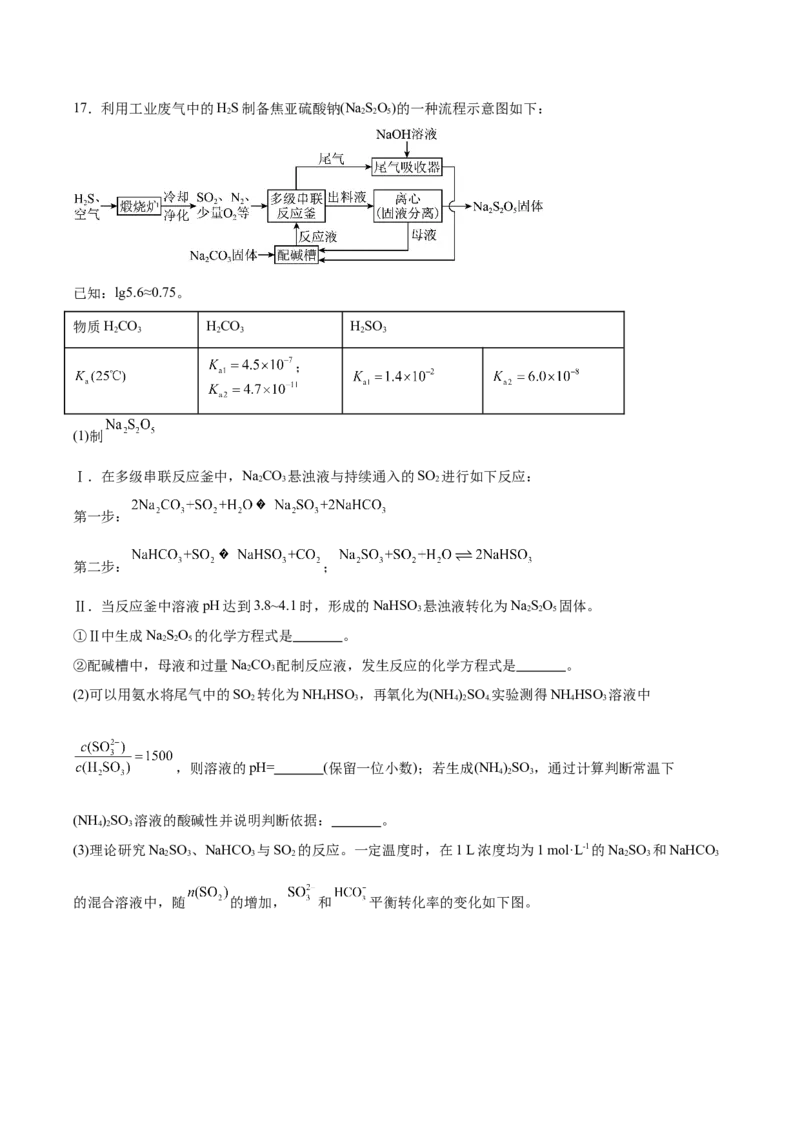
所得混合溶液的pH= (忽略溶液体积变化)。17.利用工业废气中的HS制备焦亚硫酸钠(Na SO)的一种流程示意图如下:
2 2 2 5
已知:lg5.6≈0.75。
物质HCO HCO HSO
2 3 2 3 2 3
;
(1)制
Ⅰ.在多级串联反应釜中,NaCO 悬浊液与持续通入的SO 进行如下反应:
2 3 2
第一步:
第二步: ;
Ⅱ.当反应釜中溶液pH达到3.8~4.1时,形成的NaHSO 悬浊液转化为NaSO 固体。
3 2 2 5
①Ⅱ中生成NaSO 的化学方程式是 。
2 2 5
②配碱槽中,母液和过量NaCO 配制反应液,发生反应的化学方程式是 。
2 3
(2)可以用氨水将尾气中的SO 转化为NH HSO ,再氧化为(NH )SO 实验测得NH HSO 溶液中
2 4 3 4 2 4. 4 3
,则溶液的pH= (保留一位小数);若生成(NH )SO ,通过计算判断常温下
4 2 3
(NH )SO 溶液的酸碱性并说明判断依据: 。
4 2 3
(3)理论研究NaSO 、NaHCO 与SO 的反应。一定温度时,在1 L浓度均为1 mol·L-1的NaSO 和NaHCO
2 3 3 2 2 3 3
的混合溶液中,随 的增加, 和 平衡转化率的变化如下图。①0~a mol,与SO 优先反应的离子是 。
2
②a~b mol, 平衡转化率上升而 平衡转化率下降,结合方程式解释原因: 。
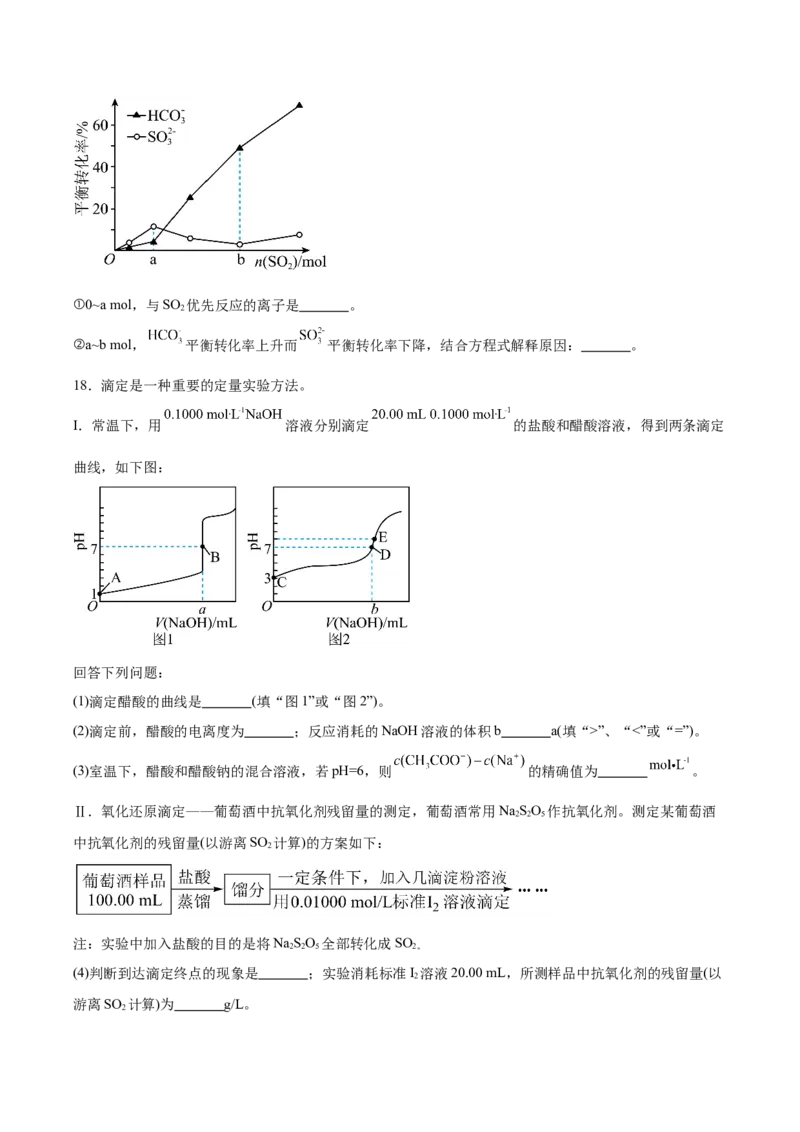
18.滴定是一种重要的定量实验方法。
I.常温下,用 溶液分别滴定 的盐酸和醋酸溶液,得到两条滴定
曲线,如下图:
回答下列问题:
(1)滴定醋酸的曲线是 (填“图1”或“图2”)。
(2)滴定前,醋酸的电离度为 ;反应消耗的NaOH溶液的体积b a(填“>”、“<”或“=”)。
(3)室温下,醋酸和醋酸钠的混合溶液,若pH=6,则 的精确值为 。
Ⅱ.氧化还原滴定——葡萄酒中抗氧化剂残留量的测定,葡萄酒常用NaSO 作抗氧化剂。测定某葡萄酒
2 2 5
中抗氧化剂的残留量(以游离SO 计算)的方案如下:
2
注:实验中加入盐酸的目的是将NaSO 全部转化成SO
2 2 5 2。
(4)判断到达滴定终点的现象是 ;实验消耗标准I 溶液20.00 mL,所测样品中抗氧化剂的残留量(以
2
游离SO 计算)为 g/L。
2(5)下列情形会造成测定结果偏高的_______(填字母)。
A.滴定持续时间稍长,溶液中部分SO 被空气氧化
2
B.滴定前平视,滴定后俯视
C.盛装标准I 溶液的滴定管用蒸馏水洗净后,未润洗
2
D.滴定前滴定管尖嘴无气泡,滴定后有气泡
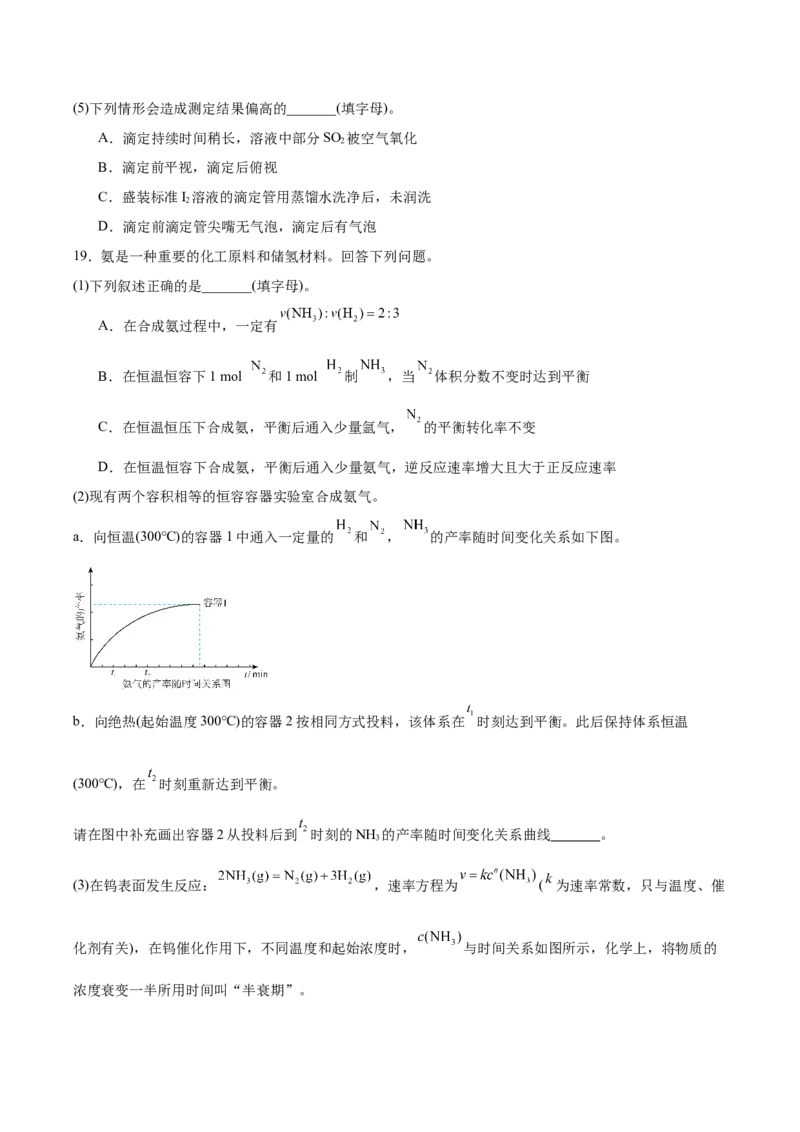
19.氨是一种重要的化工原料和储氢材料。回答下列问题。
(1)下列叙述正确的是_______(填字母)。
A.在合成氨过程中,一定有
B.在恒温恒容下1 mol 和1 mol 制 ,当 体积分数不变时达到平衡
C.在恒温恒压下合成氨,平衡后通入少量氩气, 的平衡转化率不变
D.在恒温恒容下合成氨,平衡后通入少量氨气,逆反应速率增大且大于正反应速率
(2)现有两个容积相等的恒容容器实验室合成氨气。
a.向恒温(300℃)的容器1中通入一定量的 和 , 的产率随时间变化关系如下图。
b.向绝热(起始温度300℃)的容器2按相同方式投料,该体系在 时刻达到平衡。此后保持体系恒温
(300℃),在 时刻重新达到平衡。
请在图中补充画出容器2从投料后到 时刻的NH 的产率随时间变化关系曲线 。
3
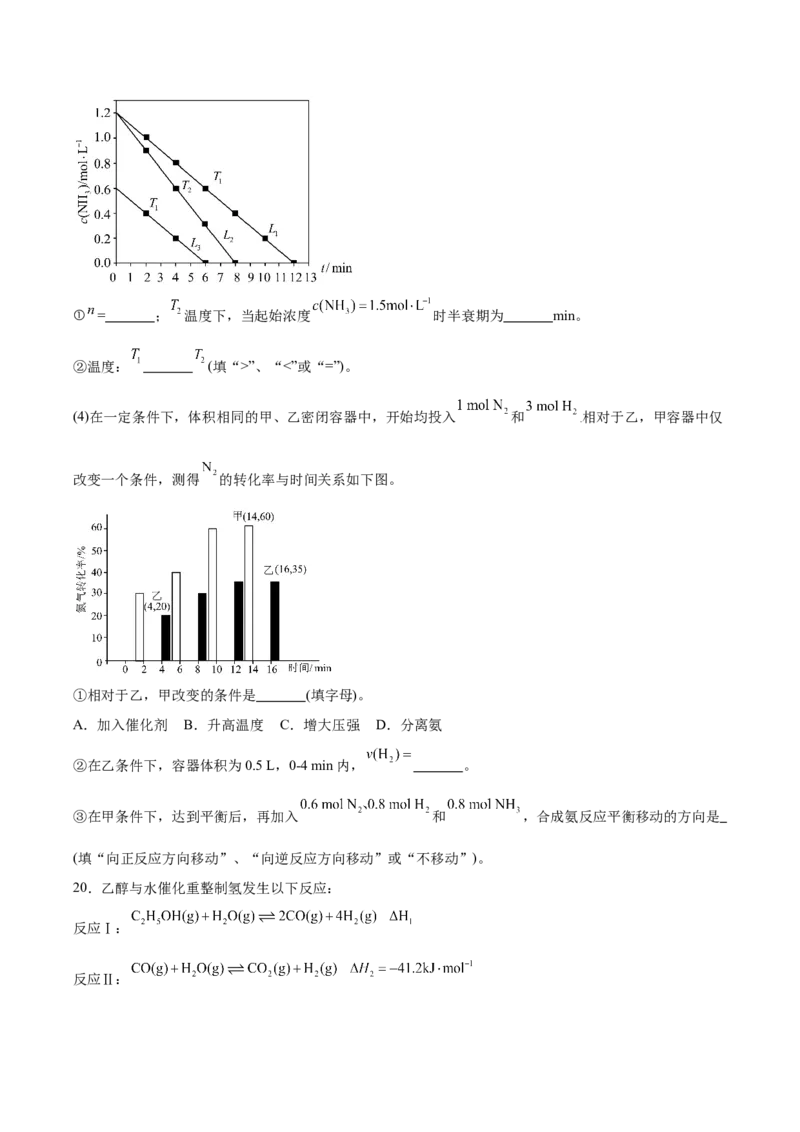
(3)在钨表面发生反应: ,速率方程为 ( 为速率常数,只与温度、催
化剂有关),在钨催化作用下,不同温度和起始浓度时, 与时间关系如图所示,化学上,将物质的
浓度衰变一半所用时间叫“半衰期”。① = ; 温度下,当起始浓度 时半衰期为 min。
②温度: (填“>”、“<”或“=”)。
(4)在一定条件下,体积相同的甲、乙密闭容器中,开始均投入 和 相对于乙,甲容器中仅
.
改变一个条件,测得 的转化率与时间关系如下图。
①相对于乙,甲改变的条件是 (填字母)。
A.加入催化剂 B.升高温度 C.增大压强 D.分离氨
②在乙条件下,容器体积为0.5 L,0-4 min内, 。
③在甲条件下,达到平衡后,再加入 和 ,合成氨反应平衡移动的方向是
(填“向正反应方向移动”、“向逆反应方向移动”或“不移动”)。
20.乙醇与水催化重整制氢发生以下反应:
反应Ⅰ:
反应Ⅱ:反应Ⅲ:
回答下列问题:
(1) ,该反应能自发进行的条件为 。
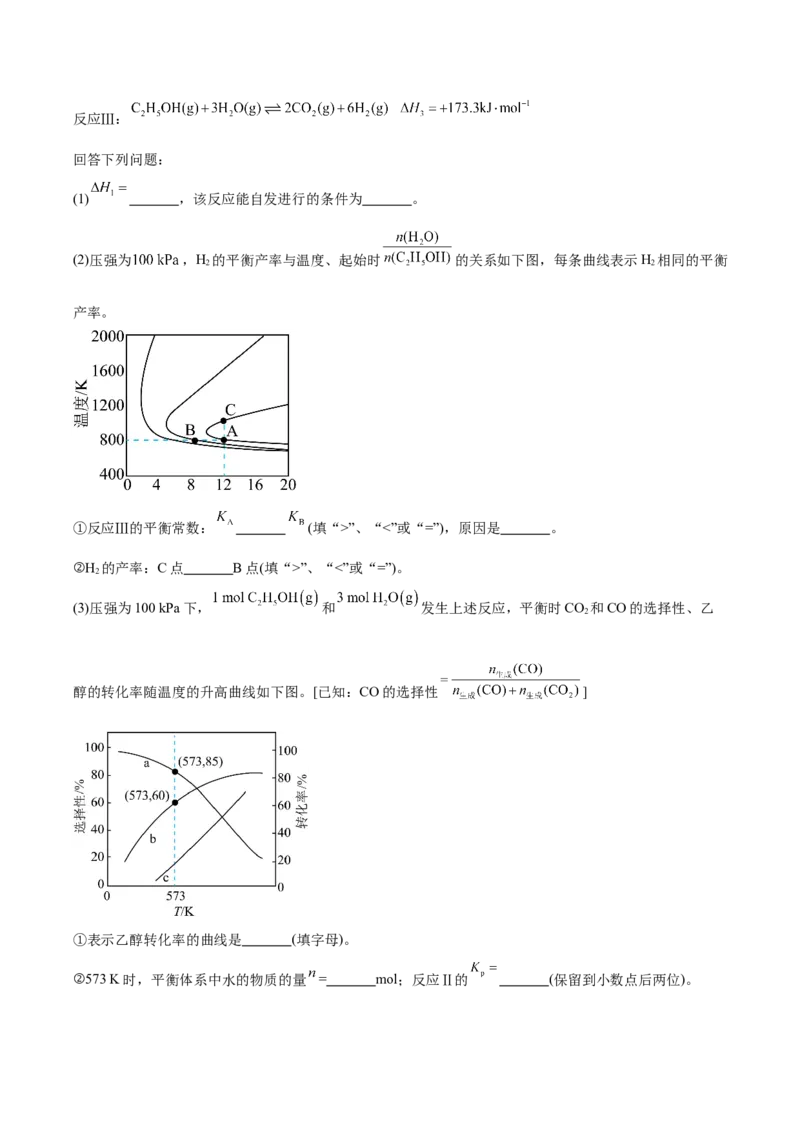
(2)压强为 ,H 的平衡产率与温度、起始时 的关系如下图,每条曲线表示H 相同的平衡
2 2
产率。
①反应Ⅲ的平衡常数: (填“>”、“<”或“=”),原因是 。
②H 的产率:C点 B点(填“>”、“<”或“=”)。
2
(3)压强为100 kPa下, 和 发生上述反应,平衡时CO 和CO的选择性、乙
2
醇的转化率随温度的升高曲线如下图。[已知:CO的选择性 ]
①表示乙醇转化率的曲线是 (填字母)。
②573 K时,平衡体系中水的物质的量 = mol;反应Ⅱ的 (保留到小数点后两位)。题号 1 2 3 4 5 6 7 8 9 10
答案 A D B B D A C D C C
题号 11 12 13 14 15
答案 B A BC BC AD
16.(1)
(2) > 增大 BD deabc
(3)10
17.(1)
(2) 6.1 显碱性; , , 的水解程度大于 ,故
显碱性
(3) CO 逸出,促进 的平衡正向进行, 的平衡转化率上升;
2
增大,使 的平衡逆向进行, 的平衡转化率下降
18.(1)图2
(2) 1% <
(3) (或 )
(4) 滴入最后半滴标准液,溶液由无色变为蓝色,且半分钟内不褪色 0.128
(5)C
19.(1)AD
(2)
(3) 0 5 <
(4) C 向正反应方向移动
20.(1) 高温
(2) = B点温度等于A点 >(3) b 1.38 14.04