文档内容
德阳市高中 2024 级高二上期期中教学质量监测考试
化学试卷
命题人: 四川省中江中学校
说明:
1.本试卷分第I卷和第I卷,共8页。考生作答时,须将答案答在答题卡上,在本试卷、草
稿纸上答题无效。考试结束后,将答题卡交回。
2.本试卷满分100分,75分钟完卷。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 I-127
第Ⅰ卷(选择题 共45分)
一、单项选择题:(本题包括15题,每小题3分,共45分。每题只有一个选项符合题意。)
1.化学与生产、生活和科技息息相关,下列说法正确的是 ( )
A.二氧化硅制成的太阳能电池可将太阳能转化为电能
B.“北斗三号”导航卫星使用的透光电极材料——石墨烯,属于新型无机非金属材料
C.合成氨工业中选择400~500℃的目的是提高N 和H 的转化率
2 2
D.高分子材料蚕丝、塑料、棉花均为天然纤维
2.下列有关化学反应原理的说法中正确的是 ( )
A.化学反应体系向环境释放或从环境吸收的热量就是反应热
B.平衡常数发生变化,化学平衡不一定发生移动
C.燃料电池提供的电能等于相同燃料燃烧反应的|∆H|
D.弱电解质的电离平衡右移,电离程度可能减小
3.下列措施不能增大反应速率的是 ( )
A.锌和稀盐酸反应制氢气时,滴加少量的硫酸铜溶液
B.乙酸和乙醇进行酯化反应时采取加热措施
C.常温下用浓硫酸代替稀硫酸与铝反应制氢气
D.氨氧化制备硝酸时加入铂作催化剂
4.已知反应:2NO(g)+Br (g) 2NOBr(g) ΔH=-a kJ·mol-1(a>0),其反应机理如下:
2
①NO(g)+Br (g) NOBr (g) 快
2 2
②NO(g)+NOBr (g) 2NOBr(g) 慢
2
下列有关该反应的说法正确的是 ( )
A.反应②的活化能比反应①的大
B.NOBr 是该反应的催化剂
2
C.该反应历程中存在非极性键的断裂与形成
D.增大NO(g)的浓度能增大活化分子百分数,加快反应速率
5.解释下列实验现象的离子方程式错误的是 ( )
A.CuCl 浓溶液稀释,绿色溶液变蓝:
2
B.向酸性KMnO 溶液中滴入草酸溶液,紫红色溶液变为无色:2MnO+5C O2− +16H===2Mn2+
4 2 4
10CO↑+8HO
2 2
德阳市高中2024级高二上期期中教学质量监测考试化学试卷 第 1 页 (共 9
页)C.NaSO 溶液中滴加稀硫酸出现浅黄色浑浊:S
O2−
+2H=S↓+SO ↑+H O
2 2 3 2 3 2 2
D.KCrO 溶液中滴加HSO ,黄色溶液变为橙色:2CrO2− +2H+ Cr O2− +H O
2 4 2 4 4 2 7 2
6.设N 为阿伏加德罗常数的值。下列说法正确的是 ( )
A
A.常温时,pH=11的NaCO 溶液中阴离子总数大于0.001N
2 3 A
B.工业合成氨,充入1molN 与3molH 充分反应,转移电子数目为6N
2 2 A
C.将1mol Cl 通入水中,则溶液中n(HClO)+n(Cl-)+n(ClO-)=2mol
2
D.常温下,由水电离出H+的浓度为1×10-13 mol·L-1的溶液中pH值可能等于1
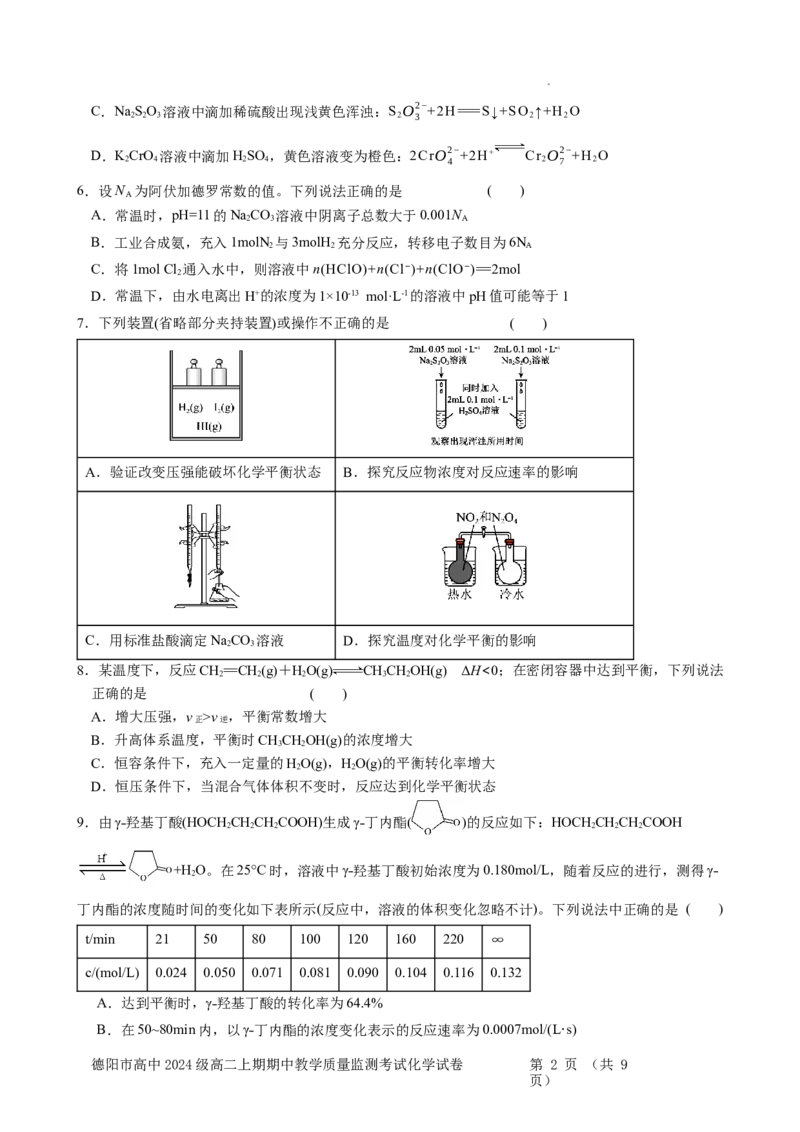
7.下列装置(省略部分夹持装置)或操作不正确的是 ( )
A.验证改变压强能破坏化学平衡状态 B.探究反应物浓度对反应速率的影响
C.用标准盐酸滴定NaCO 溶液 D.探究温度对化学平衡的影响
2 3
8.某温度下,反应CH==CH(g)+HO(g) CHCHOH(g) ΔH<0;在密闭容器中达到平衡,下列说法
2 2 2 3 2
正确的是 ( )
A.增大压强,v >v ,平衡常数增大
正 逆
B.升高体系温度,平衡时CHCHOH(g)的浓度增大
3 2
C.恒容条件下,充入一定量的HO(g),HO(g)的平衡转化率增大
2 2
D.恒压条件下,当混合气体体积不变时,反应达到化学平衡状态
9.由γ˗羟基丁酸(HOCHCHCHCOOH)生成γ˗丁内酯( )的反应如下:HOCH CHCHCOOH
2 2 2 2 2 2
+H O。在25°C时,溶液中γ˗羟基丁酸初始浓度为0.180mol/L,随着反应的进行,测得γ˗
2
丁内酯的浓度随时间的变化如下表所示(反应中,溶液的体积变化忽略不计)。下列说法中正确的是 ( )
t/min 21 50 80 100 120 160 220 ∞
c/(mol/L) 0.024 0.050 0.071 0.081 0.090 0.104 0.116 0.132
A.达到平衡时,γ˗羟基丁酸的转化率为64.4%
B.在50~80min内,以γ˗丁内酯的浓度变化表示的反应速率为0.0007mol/(L·s)
德阳市高中2024级高二上期期中教学质量监测考试化学试卷 第 2 页 (共 9
页)C.在25°C时,该反应的平衡常数为K=2.75
D.为提高平衡时γ˗羟基丁酸的转化率,及时移出γ˗丁内酯使平衡正向移动,正反应速率加快
10.下列各组离子在指定条件下,一定能大量共存的是 ( )
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO2− 、NO−
3 3
B.常温下在c(H+)>√K 的溶液中:Cu2+、Al3+、SO2− 、NO−
W 4 3
C.能使淀粉碘化钾试纸变蓝的溶液中:Fe3+、NH+ 、S2-、Br−
4
D.c(Fe3+)=0.1mol·L-1的溶液中: 、 、NO− 、SCN−
3
11.下列实验操作能够达到目的的是 ( )
选项 实验操作 目的
取新制氯水,观察颜色呈黄绿色,然后向其中滴加AgNO 溶液, 证明氯气与水的反应存在
A 3
产生白色沉淀 限度
向Fe (SO ) +6KSCN 2Fe(SCN) +3K SO 反应体系中滴入浓 探究c(SO2− )对平衡移动
B 2 4 3 3 2 4 4
硫酸,观察溶液颜色变化 的影响
C 分别向MgCl 溶液和AlCl 溶液中滴加足量氨水 验证金属性:Mg > Al
2 3
量取同体积不同浓度的NaClO溶液,分别加入等体积等浓度的 探究浓度对化学反应速率
D
NaSO 溶液,对比现象 的影响
2 3
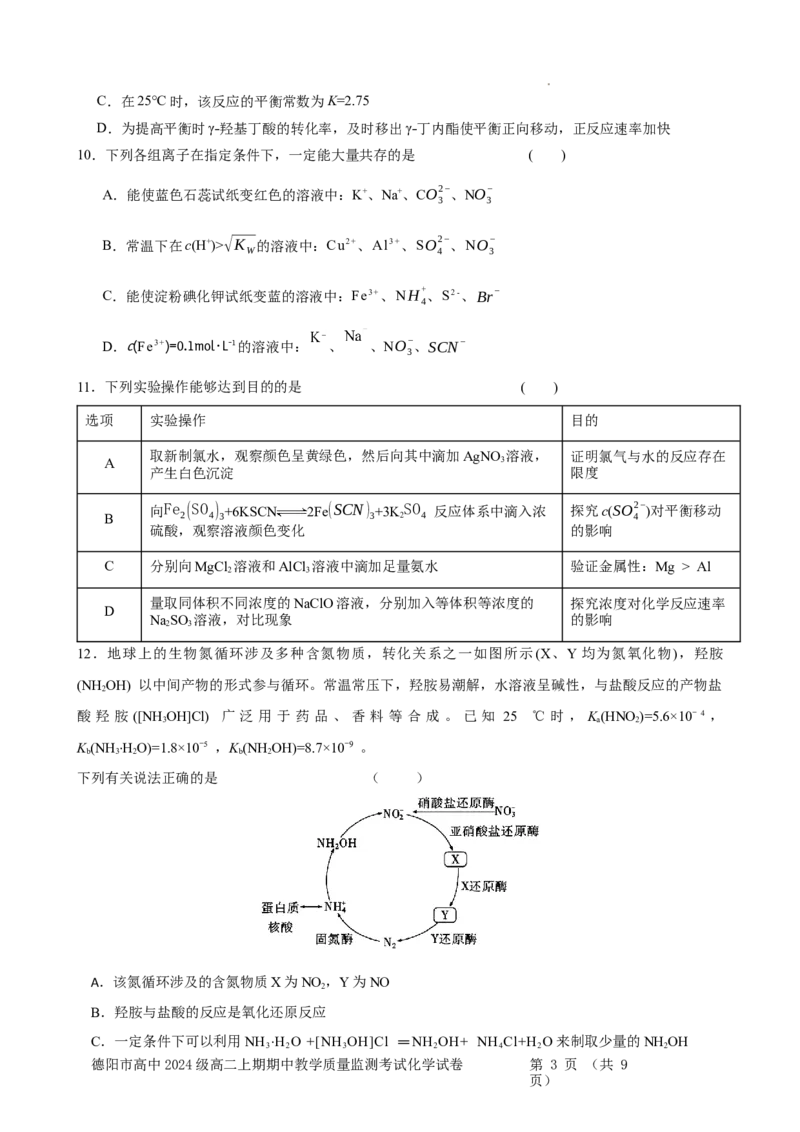
12.地球上的生物氮循环涉及多种含氮物质,转化关系之一如图所示(X、Y均为氮氧化物),羟胺
(NH OH) 以中间产物的形式参与循环。常温常压下,羟胺易潮解,水溶液呈碱性,与盐酸反应的产物盐
2
酸 羟 胺 ([NH OH]Cl) 广 泛 用 于 药 品 、 香 料 等 合 成 。 已 知 25 ℃ 时 , K(HNO)=5.6×10− 4 ,
3 a 2
K (NH ·HO)=1.8×10−5 ,K (NH OH)=8.7×10−9 。
b 3 2 b 2
下列有关说法正确的是 ( )
A.该氮循环涉及的含氮物质X为NO ,Y为NO
2
B.羟胺与盐酸的反应是氧化还原反应
C.一定条件下可以利用NH ·H O +[NH OH]Cl =NH OH+ NH Cl+H O来制取少量的NH OH
3 2 3 2 4 2 2
德阳市高中2024级高二上期期中教学质量监测考试化学试卷 第 3 页 (共 9
页)D.NH OH (aq) +H O(l) NH OH+(aq) + OH-(aq) ΔH > 0,若升高温度,平衡常数K 减
2 2 3 b
小
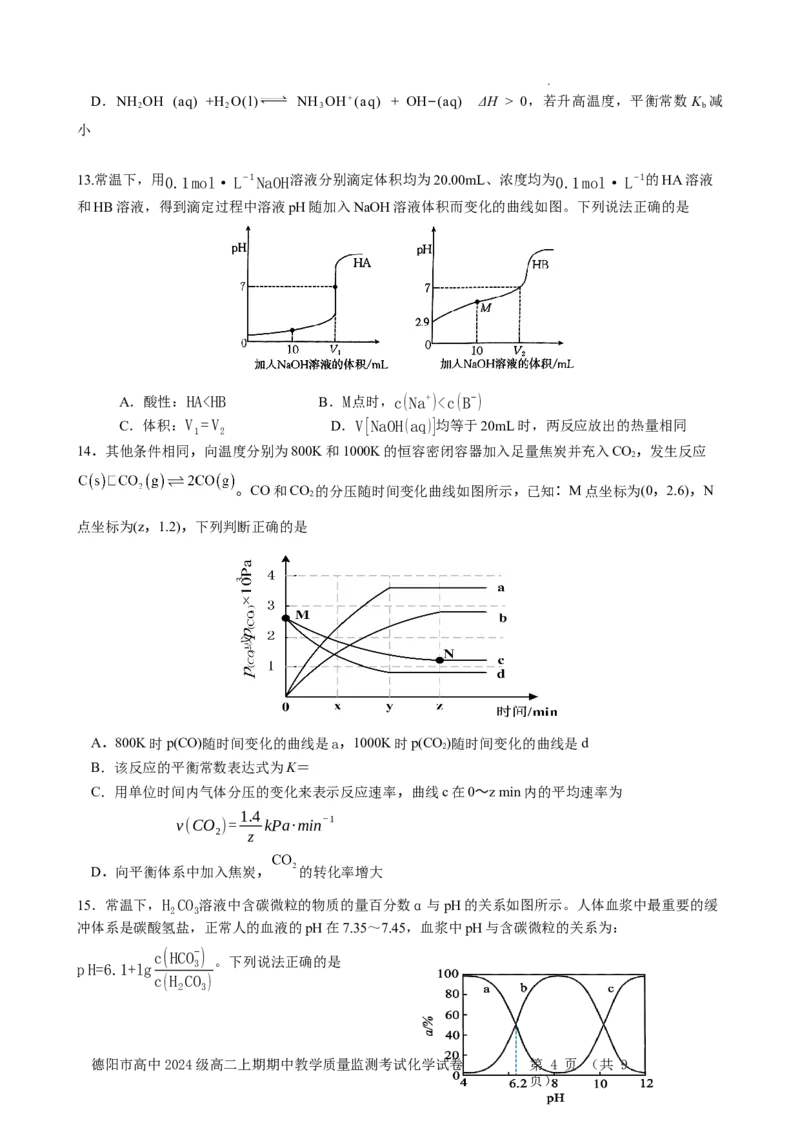
13.常温下,用0.1mol·L−1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L−1的HA溶液
和HB溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的曲线如图。下列说法正确的是
A.酸性:HA