文档内容
2023---2024学年第一学期期中考
高三化学试卷
考试时长: 7 5 分钟
可能用到的相对原子质量:H-1 C-12 N-14 Cl-35.5 K-39 O-16 S-32 Ce-140
第Ⅰ卷
一、选择题:(本题共15小题,每小题3分,共45分,每小题只有一项符合题目要求)
1. “蓝天、碧水、净土”三大环保保卫战正加快生态环境治理和现代化建设。下列说法错误的是(
)
A. 废旧电池必须回收处理,可以防止重金属污染
B. 尽量少用或不用含磷洗涤剂,以防止水体富营养化
C. 农田使用铵态氮肥要深施覆土,以防止氮肥被氧化
D. 在燃油车上安装三元催化转化器,以降低污染气体的排放
2.五育并举,劳动先行。下列生活应用或生产活动,没有运用相应化学知识的是( )
选项 生活应用或生产活动 化学知识
A 用SO 漂白纸张 SO 具有氧化性
2 2
B 用铝槽车运输浓硝酸 Al在冷的浓硝酸中发生钝化
C 用铁盐净水 Fe3+水解得到Fe(OH) 胶体
3
D 用热的纯碱溶液清洗铁屑油污 油脂在碱性条件下可水解
3. 某公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为
(制备原料为 、 和 ),电解液为 的碳酸丙烯酯溶液。下列化学
用语正确的是( )
A. 的电子排布式为:
B. 基态碳原子的价层电子轨道表示式为
C. 中子数为20的氯原子:
D. 与 同主族,基态 原子的简化电子排布式为:
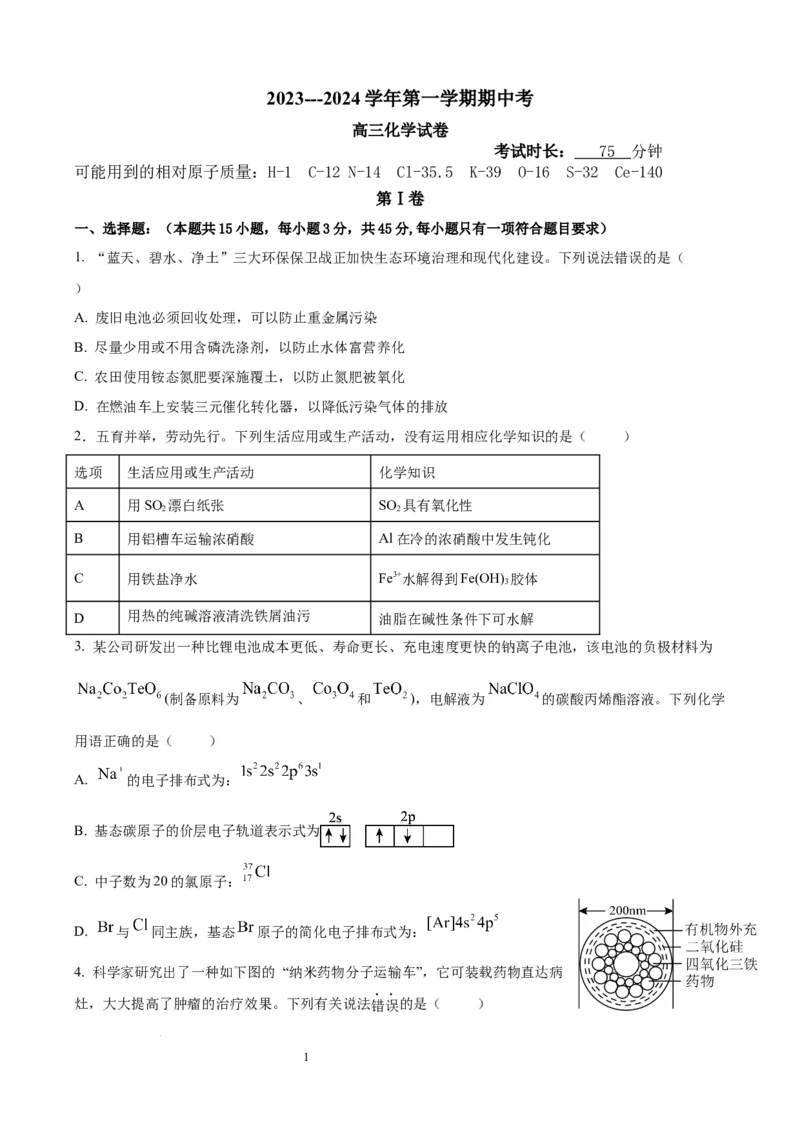
4. 科学家研究出了一种如下图的 “纳米药物分子运输车”,它可装载药物直达病
灶,大大提高了肿瘤的治疗效果。下列有关说法错误的是( )
1
学科网(北京)股份有限公司1
A. 四氧化三铁属于无机物 B. 二氧化硅属于酸性氧化物
C. 该“纳米药物分子车”属于混合物 D. 该“纳米药物分子车”分散于水中能形成胶体
5. 常温下,在指定溶液中下列各组离子可能大量共存的是( )
A. 滴加KSCN显红色的溶液: 、Cl-、K+、
B. KS溶液中: 、K+、Cl-、Cu2+
2
C. 由水电离出的c(OH-)=10-12 mol/L的溶液:Al3+、H+、Cl-、Na+
D. 强酸性溶液中: Cl-、Na+、 、
6. 下列反应的离子方程式正确的是( )
A. 向硝酸银溶液中加入足量铜:Cu+Ag+=Ag+Cu2+
B. 用HO 从酸化的海带灰浸出液中提取碘:2I-+H O+2H+=I +2H O
2 2 2 2 2 2
C. 等体积、等物质的量浓度的NaHCO 溶液与Ba(OH) 溶液混合:2HCO +Ba2++2OH-=BaCO ↓+2H O+CO
3 2 3 2
D. 向硫酸铜溶液中加入过量氨水:Cu2++2NH·H O =Cu(OH) ↓+2NH
3 2 2
7.下列说法正确的是( )
A.标准状况下,22.4 L Br 所含溴原子的数目为2 N
2 A
B.等质量的NO 和NO 所含原子总数不同
2 2 4
C.136 g熔融的KHSO 中含有2 N 个阳离子
4 A
D.标准状况下,22.4 L CO 与足量NaO 反应转移的电子数为N
2 2 2 A
8. 下列说法正确的是( )
A. 将足量NH 、CO 依次通入饱和食盐水中,无白色沉淀生成
3 2
B. 将KSCN溶液滴入盐酸和Fe(NO ) 的混合溶液中,溶液显红色
3 2
C. 将饱和FeCl 溶液滴入NaOH溶液中,可制得Fe(OH) 胶体
3 3
的
D. 将盐酸酸化 BaCl 溶液滴入某溶液中产生白色沉淀,证明该溶液中一定含有SO
2
9. 下列物质的应用中,与氧化还原反应无关的是( )
A. 用含Fe O 的铁矿石冶炼Fe
2 3
B. 用NaO 作潜水艇的供氧剂
2 2
C. 用NaOH作沉淀剂去除粗盐水中的Mg2+
2
学科网(北京)股份有限公司2
D. 以NH 为原料制备HNO
3 3
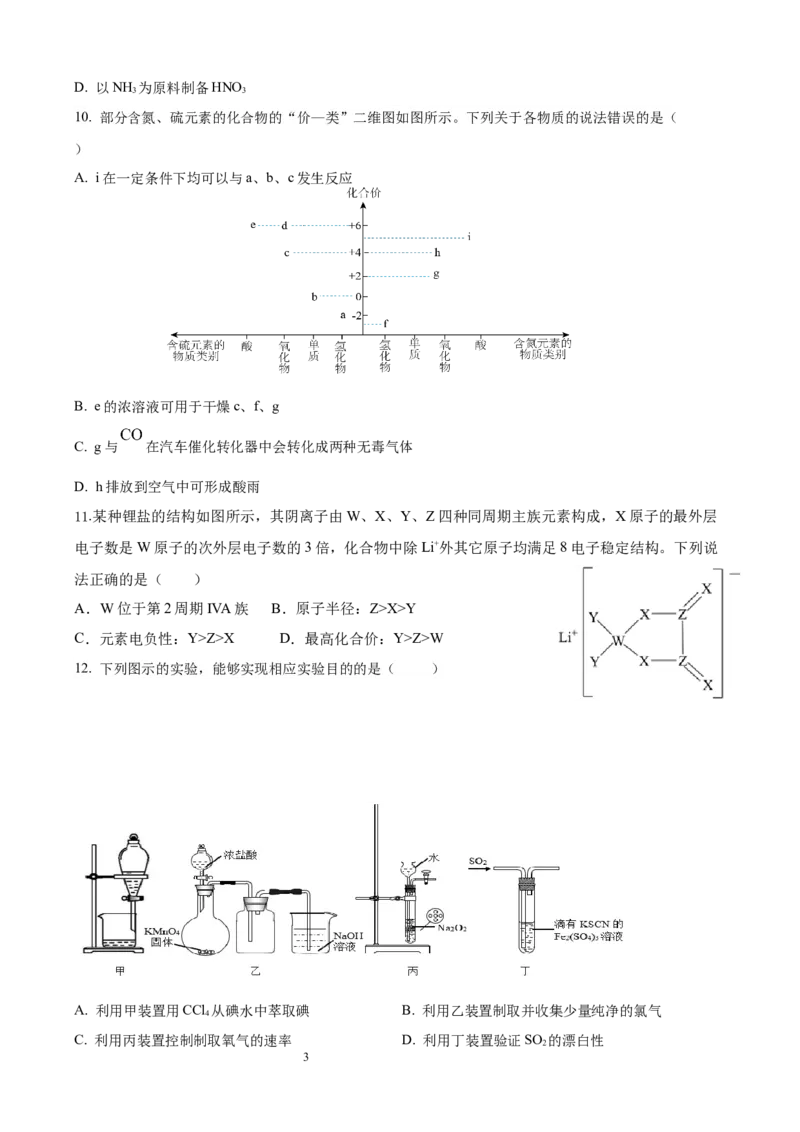
10. 部分含氮、硫元素的化合物的“价—类”二维图如图所示。下列关于各物质的说法错误的是(
)
A. i在一定条件下均可以与a、b、c发生反应
B. e的浓溶液可用于干燥c、f、g
C. g与 在汽车催化转化器中会转化成两种无毒气体
D. h排放到空气中可形成酸雨
11.某种锂盐的结构如图所示,其阴离子由W、X、Y、Z四种同周期主族元素构成,X原子的最外层
电子数是W原子的次外层电子数的3倍,化合物中除Li+外其它原子均满足8电子稳定结构。下列说
法正确的是( )
A.W位于第2周期IVA族 B.原子半径:Z>X>Y
C.元素电负性:Y>Z>X D.最高化合价:Y>Z>W
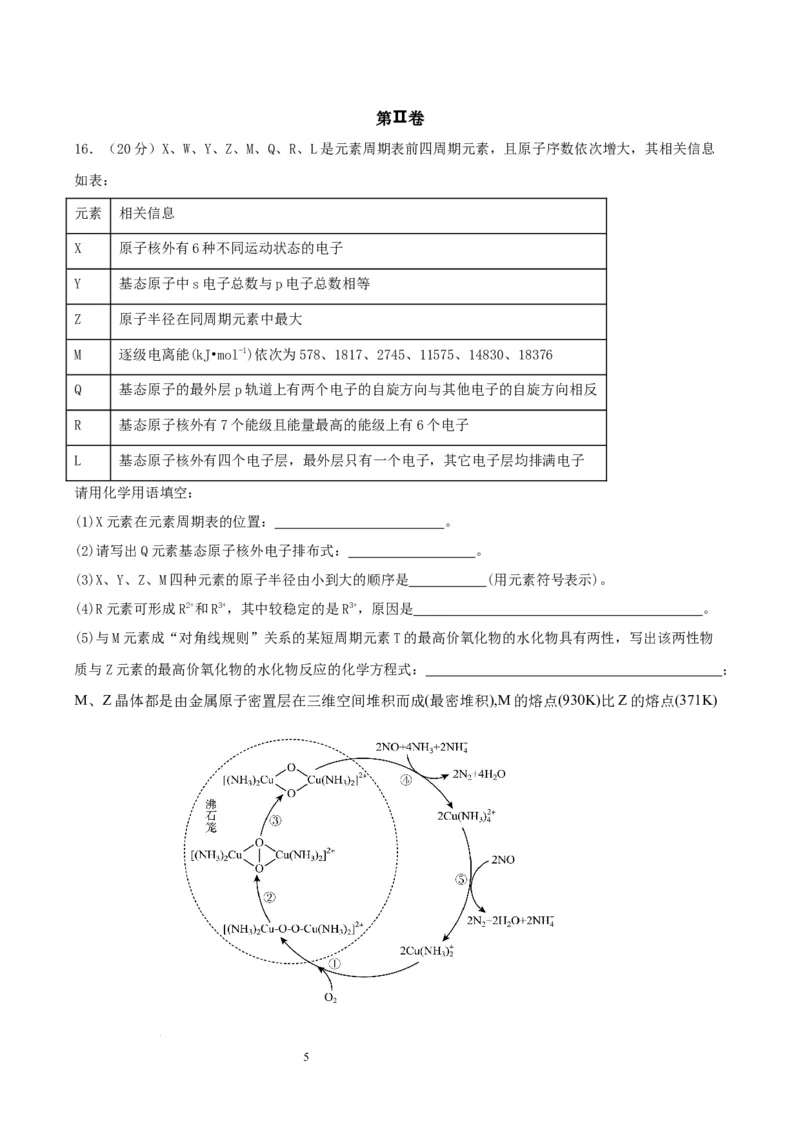
12. 下列图示的实验,能够实现相应实验目的的是( )
A. 利用甲装置用CCl 从碘水中萃取碘 B. 利用乙装置制取并收集少量纯净的氯气
4
C. 利用丙装置控制制取氧气的速率 D. 利用丁装置验证SO 的漂白性
2
3
学科网(北京)股份有限公司3
13.工业上制备下列物质的生产流程合理的是( )
A.由铝土矿冶炼铝:铝土矿AlO AlCl Al
2 3 3
B.由NaCl制漂白粉:饱和食盐水 Cl 漂白粉
2
C.由石英砂制纯硅:石英砂 粗硅 SiHCl 纯硅
3
D.工业合成硝酸:N NO NO HNO
2 2 3
14. 实验室模拟工业处理含铬废水,操作及现象如图1所示,反应过程中铬元素的化合价变化如图2,已
知:深蓝色溶液中生成了CrO。下列说法不正确的是( )
5
A. 0-5 s过程中,发生的氧化还原反应为:
B. 实验开始至30 s溶液中发生的总反应离子方程式为:
C. 30-80 s过程中,Cr元素被氧化,可能是溶液中剩余的HO 所致
2 2
D. 80 s时,在碱性条件下,溶液中含铬微粒主要为
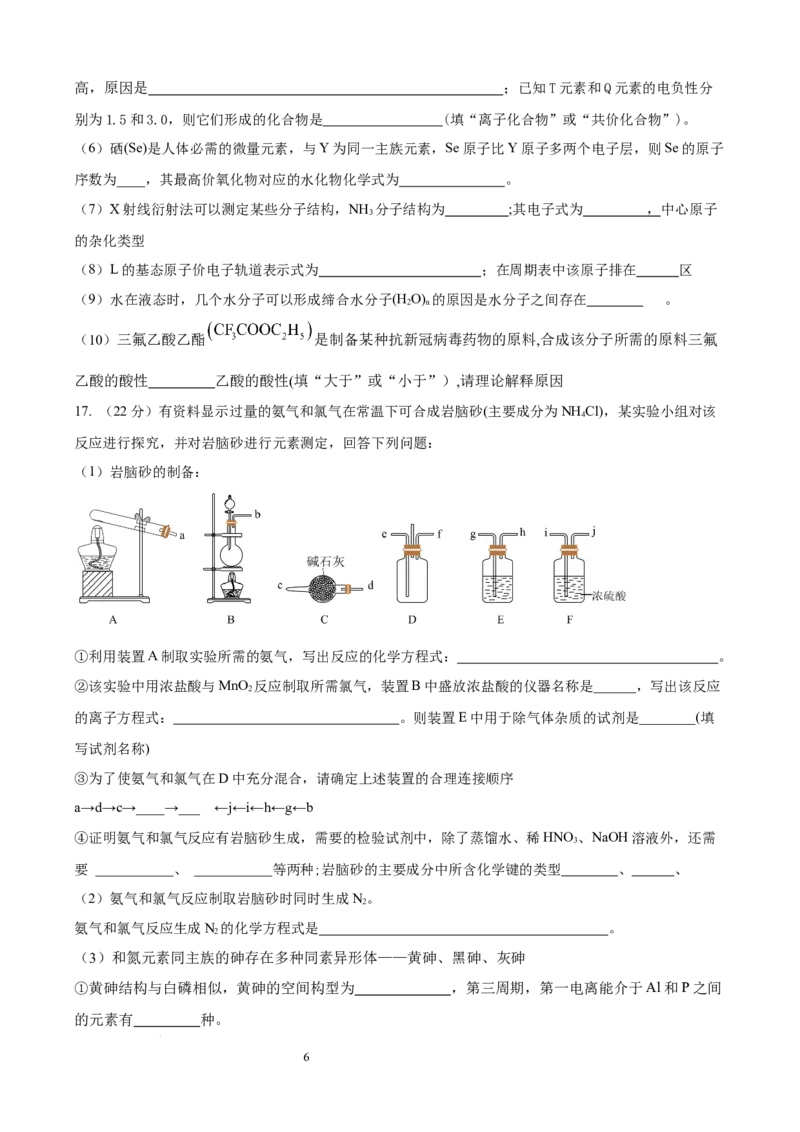
15.氮氧化物 会对生态系统和人体健康造成危害。一种以沸石笼作为载体对氮氧化物进行催化还原
的原理如图所示。下列叙述不正确的是( )
A. 反应⑤变化过程可表示为:
B. 图中总过程中每吸收 需要标准状况下的氧气为
C. 反应③未涉及元素化合价的变化
D. 反应④涉及非极性共价键的断裂与生成
4
学科网(北京)股份有限公司4
第Ⅱ卷
16.(20分)X、W、Y、Z、M、Q、R、L是元素周期表前四周期元素,且原子序数依次增大,其相关信息
如表:
元素 相关信息
X 原子核外有6种不同运动状态的电子
Y 基态原子中s电子总数与p电子总数相等
Z 原子半径在同周期元素中最大
M 逐级电离能(kJ•mol-1)依次为578、1817、2745、11575、14830、18376
Q 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反
R 基态原子核外有7个能级且能量最高的能级上有6个电子
L 基态原子核外有四个电子层,最外层只有一个电子,其它电子层均排满电子
请用化学用语填空:
(1)X元素在元素周期表的位置: 。
(2)请写出Q元素基态原子核外电子排布式: 。
(3)X、Y、Z、M四种元素的原子半径由小到大的顺序是 (用元素符号表示)。
(4)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是 。
(5)与M元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物
质与Z元素的最高价氧化物的水化物反应的化学方程式: ;
M、Z晶体都是由金属原子密置层在三维空间堆积而成(最密堆积),M的熔点(930K)比Z的熔点(371K)
5
学科网(北京)股份有限公司5
高,原因是 ;已知T元素和Q元素的电负性分
别为1.5和3.0,则它们形成的化合物是 (填“离子化合物”或“共价化合物”)。
(6)硒(Se)是人体必需的微量元素,与Y为同一主族元素,Se原子比Y原子多两个电子层,则Se的原子
序数为____,其最高价氧化物对应的水化物化学式为 。
(7)X射线衍射法可以测定某些分子结构,NH 分子结构为 ;其电子式为 ,中心原子
3
的杂化类型
(8)L的基态原子价电子轨道表示式为 ;在周期表中该原子排在 区
(9)水在液态时,几个水分子可以形成缔合水分子(H O) 的原因是水分子之间存在 。
2 n
(10)三氟乙酸乙酯 是制备某种抗新冠病毒药物的原料,合成该分子所需的原料三氟
乙酸的酸性 乙酸的酸性(填“大于”或“小于”),请理论解释原因
17. (22分)有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH Cl),某实验小组对该
4
反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)岩脑砂的制备:
①利用装置A制取实验所需的氨气,写出反应的化学方程式: 。
②该实验中用浓盐酸与MnO 反应制取所需氯气,装置B中盛放浓盐酸的仪器名称是______,写出该反应
2
的离子方程式: 。则装置E中用于除气体杂质的试剂是________(填
写试剂名称)
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序
。
a→d→c→____→___ ←j←i←h←g←b
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO、NaOH溶液外,还需
3
要 ___________、 ___________等两种;岩脑砂的主要成分中所含化学键的类型 、 、
(2)氨气和氯气反应制取岩脑砂时同时生成N。
2
氨气和氯气反应生成N 的化学方程式是 。
2
(3)和氮元素同主族的砷存在多种同素异形体——黄砷、黑砷、灰砷
①黄砷结构与白磷相似,黄砷的空间构型为 ,第三周期,第一电离能介于Al和P之间
的元素有 种。
6
学科网(北京)股份有限公司6
②近年来,黑砷在催化电解水方面的研究受到关注,其晶体结构与石墨类似。根据图中信息,下列说
法正确的有 (填标号)。
a.黑砷中As—As键的键能均相同
b.黑砷与C 都属于混合型晶体
60
c.黑砷单层中As原子与As—As键的个数比为2:3
d.黑砷层与层之间的作用力为范德华力
18(13分)我国是稀土储量大国,氧化铈(CeO)是一种应用广 泛
2
的稀土氧化物。一种用氟碳铈矿(CeFCO,含BaO、SiO 等杂质)为原料制备CeO 的工艺如下图。
3 2 2
已知:①Ce3+可形成难溶于水的复盐[(Ce (SO )·Na SO ·nH O],其氢氧化物也难溶于水。
2 4 3 2 4 2
②硫脲的结构简式为CS(NH ),在酸条件下易被氧化为(CSN H)。
2 2 2 3 2
请回答:
(1)实验室常用下图所示仪器进行固体物质的粉碎,该仪器的名称是___________。
步骤①和步骤②均有 操作(填操作名称)
(2)焙烧后加入稀硫酸浸出,Ce元素的浸出率和稀硫酸浓度、温度的关系如图所 示,
下列说法正确的是
A. 固体A的成分是SiO B. 步骤②加入硫脲的目的将 还原为
2
C. 根据上图,焙烧后加入稀硫酸浸出时,适宜的条件为85℃,c(HSO )=2.5mol/L
2 4
(3)步骤④发生的离子方程式为 _ 。
(4)取ag所制CeO,溶解后配制成250mL溶液。取bmL该溶液用0.01mol·L-1(NH )Fe(SO ) 溶液滴定,
2 4 2 4 2
滴定时发生反应:Fe2++Ce4+=Fe3++Ce3+,达到滴定终点时消耗(NH )Fe(SO ) 溶液VmL。
4 2 4 2
滴定过程中,接近终点时需采用半滴操作,具体操作是:慢慢旋转滴定管旋塞,使滴定管口悬挂液滴而不
7
学科网(北京)股份有限公司7
滴落,用 靠落液滴,并用 将液滴冲入溶液中,振荡锥形瓶使溶液充分混
合。
(5)该产品中CeO 的质量分数为___________ (列出表达式)
2
(6)与铈同为过度金属的Fe元素在自然界中形成黄铁矿(主要成分FeS),FeS 晶体的晶胞结构如图所
2 2
示。在晶胞中,Fe2+位于S 所形成的_______(填“正四面体”或 “正八面体”)空隙;若晶胞参数为 a nm,
密度为ρg·cm −3 ,阿伏加德罗常数的值为N ,则FeS 的摩尔质量 M=_______ (用含 a、ρ、N
A 2 A
的代数式表示)。
8
学科网(北京)股份有限公司