文档内容
B.常温常压下,3.2gCH 中含质子数为2N
山东省高三年级适应性联考(一) 4 A
C.98gH PO 和H SO 的混合物中含O原子数为4N
3 4 2 4 A
化学试题 D.1mol·L-1的CH
3
COOH溶液中含CH
3
COOH和CH
3
COO-的总数为N
A
5.下列有关说法正确的是( )
本试卷共 4页,20 题。全卷满分 100分。考试用时 90 分钟。
A.Cl 和HCl均既有氧化性又有还原性
2
注意事项:
B.氢氧化铝胶体带正电荷,故明矾可以做净水剂
1.答题前,先将自己的姓名、准考证号填写在答题卡上,并将准考证号条形码粘贴在答题卡上的
C.严禁使用有毒的SO 用于做食品漂白剂、防腐剂和抗氧化剂
2
指定位置。
D.电解质溶液导电是阴、阳离子在电场作用下的定向移动,为物理变化
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。写在试 6.结合如下装置(可以重复使用),下列有关说法错误的是( )
题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题
卡上的非答题区域均无效。
4.考试结束后请将本试题卷和答题卡一并上交。
可能用到的原子量:H1 Li7 C12 O16 Na23 Mg24 P31 S32 Cl35.5 Fe56 Ni59
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.化学与生产、生活和社会息息相关,下列有关说法错误的是( ) A.可选用装置ACDE制备并收集纯净的Cl 2
A.合成氨的反应塔与外加电源的正极相连,并维持一定的电压可以钝化防腐 B.制备并收集干燥的NH
3
的接口顺序为bcdghj
B.药用泡腾片中只含有碳酸氢钠,遇水产生大量气泡加速药物分散和溶解 C.可选用ADG制备SO
2
并验证其漂白性
C.运动员剧烈运动后,补充的运动饮料中含有糖类和一定浓度的NaCl、KCl等 D.G中的倒置漏斗可以用球形干燥管代替
D.开发利用新能源,减少化石燃料的使用是实现“碳中和”目标的有效途径 7.下列关于溶液的说法正确的是( )
2.下列关于元素与物质分类的说法正确的是( ) A.透明的中性溶液中,K+、Fe3+、NO 3 -、MnO 4 -能大量共存
A.InNi 3 C 0.5 •Fe 3 O 4 中金属元素均为过渡金属元素 B.84消毒液中通入少量SO 2 :2ClO-+SO 2 +H 2 O=2HClO+SO 3 2-
B.SiO 2 可与氢氟酸反应,故SiO 2 为碱性氧化物 C.稀硫酸中逐滴加入等浓度Ba(OH) 2 溶液,溶液的导电性始终不变
C.NaH 2 PO 2 为正盐,故H 3 PO 2 为一元酸 D.向CuSO 4 溶液中逐滴加入浓氨水,先有蓝色沉淀,最后得深蓝色溶液
D.直径介于1~100nm的氮化镓(GaN)为胶体 8.下列说法正确的是( )
3.下列关于实验操作的说法正确的是( ) A.2Na(s)+ O (g)=Na O(s) ΔH 2Na(s)+O (g)=Na O (s) ΔH ,则ΔH >ΔH
2 2 1 2 2 2 2 1 2
A.取用药品时,剩余药品均不得放回原试剂瓶 1
B.H 的摩尔2 燃烧焓为-285.8kJ·mol-1,则2H (g)+O (g)=2H O(g) ΔH=-571.6kJ·mol-1
B.中和热测定时,只需记录溶液的初始温度和最高温度 2 2 2 2
C.3O (g)=2O (g) ΔH>0,则完全破坏等质量的O 和O 中的化学键,需要的能量O 大
C.稀硫酸、KMnO 溶液等沾到皮肤上应立即用大量清水冲洗 2 3 2 3 3
4
D.N (g)+3H (g)=2NH (g) ΔH =-92.2kJ·mol-1,则28gN 与足量H 反应放热46.1kJ
D.酸碱中和滴定时,不能加入蒸馏水,以免溶液稀释产生误差 2 2 3 1 2 2
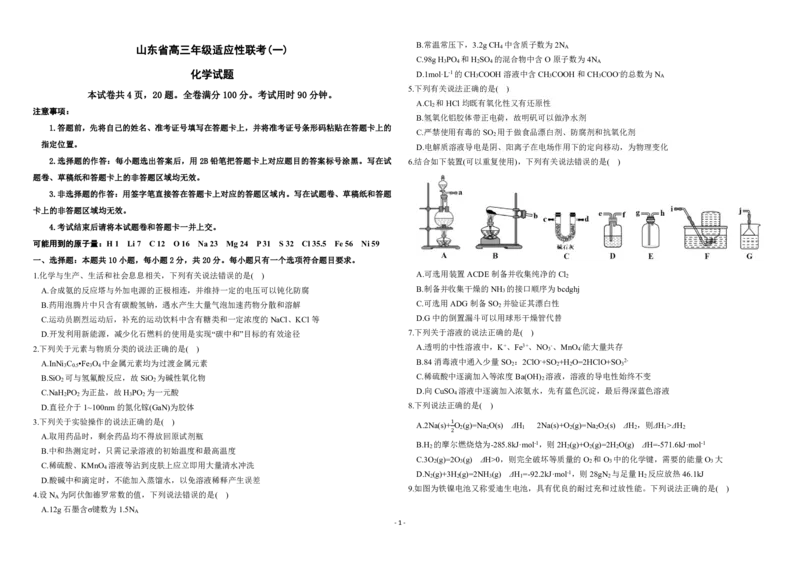
9.如图为铁镍电池又称爱迪生电池,具有优良的耐过充和过放性能。下列说法正确的是( )
4.设N 为阿伏伽德罗常数的值,下列说法错误的是( )
A
A.12g石墨含σ键数为1.5N
A
-1-B.A电极反应为4OH--4e-=2H O+O ↑
2 2
C.氧化性顺序:•OH>H O >O
2 2 2
D.电路中通过0.15mol电子,B电极生成0.05mol•OH
12.下列实验操作、现象或数据和结论均准确无误的是( )
选项 实验操作 实验现象或数据 结论
用稀盐酸清洗铂丝后灼烧至
A.放电时,a电极电势比b电势高 A. 火焰呈紫色 待测液含有K+
火焰无色,蘸取待测液灼烧
B.放电时,b极发生Ni(OH) +2e-=Ni+2OH-
2
向BaCl 溶液中通入SO ,然 开始无明显现象,通入A
2 2
C.充电时,阴极附近的pH减小 B. 白色沉淀为BaSO
4
后再通入A气体 后产生白色沉淀
D.充电时,每生成1molFe O •4H O,有4molNi(OH) 被氧化
3 4 2 2
用pH试纸测定等浓度的
10.常温下部分难溶电解质的溶度积(K sp )如下表: NaClO溶液pH大于 酸性:
C. CH COONa溶液和NaClO溶
3
难溶电解质 AgCl Ag 2 CrO 4 AgBr AgI Ag 2 S CH 3 COONa溶液 CH 3 COOH>HClO
液的pH
K 1.8×10-10 1.1×10-12 5.4×10-13 8.5×10-17 1.8×10-50 以甲基橙为指示剂,用 溶液由橙色变黄色,
sp
下列叙述中错误的是( ) D. 0.1mol·L-1NaOH溶液滴定 且30s内不恢复原色; 草酸为二元弱酸
A.AgCl在等物质的量浓度的NaCl和AgNO 溶液中的溶解度相同 0.1mol·L-1 草酸溶液 V(NaOH)=2V(草酸)
3
B.向Ag CrO 悬浊液中加入0.1mol·L-1NaBr溶液,可完成沉淀的转化 13.某含钒矿石(主要成分为V 2 O 5 、SiO 2 、Al 2 O 3 、FeS 2 等)制取V 2 O 5 的流程如下:
2 4
C.2AgI(s)+S2-(aq) Ag S(s)+2I-(aq)的平衡常数约为4.0×10-17
2
D.含AgCl和AgBr固体的溶液中离子浓度关系为:c(Ag+)>c(Cl-)>c(Br-)
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部
选对得4分,选对但不全的得2分,有选错的得0分。
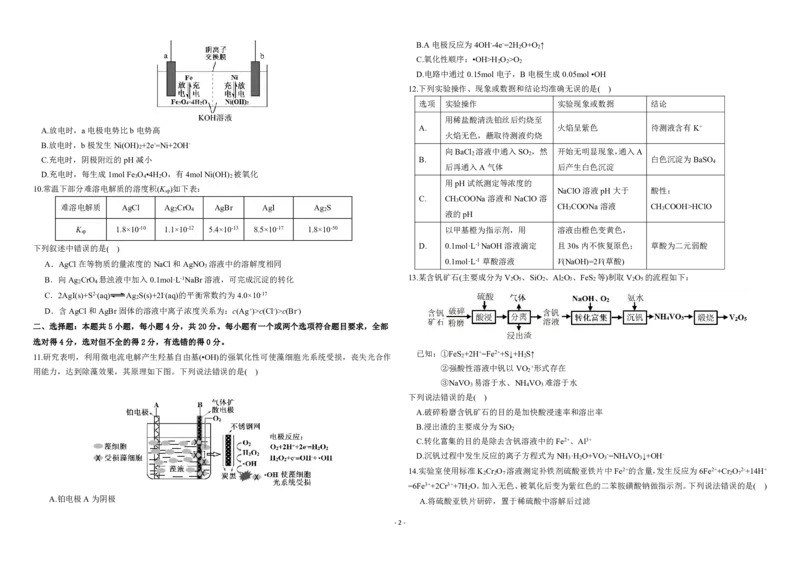
11.研究表明,利用微电流电解产生羟基自由基(•OH)的强氧化性可使藻细胞光系统受损,丧失光合作 已知:①FeS 2 +2H+=Fe2++S↓+H 2 S↑
用能力,达到除藻效果,其原理如下图。下列说法错误的是( )
②强酸性溶液中钒以VO
2
+形式存在
③NaVO 易溶于水、NH VO 难溶于水
3 4 3
下列说法错误的是( )
A.破碎粉磨含钒矿石的目的是加快酸浸速率和溶出率
B.浸出渣的主要成分为SiO
2
C.转化富集的目的是除去含钒溶液中的Fe2+、Al3+
D.沉钒过程中发生反应的离子方程式为NH ·H O+VO -=NH VO ↓+OH-
3 2 3 4 3
14.实验室使用标准K Cr O 溶液测定补铁剂硫酸亚铁片中Fe2+的含量,发生反应为6Fe2++Cr O 2-+14H+
2 2 7 2 7
=6Fe3++2Cr3++7H O。加入无色、被氧化后变为紫红色的二苯胺磺酸钠做指示剂。下列说法错误的是( )
2
A.铂电极A为阴极 A.将硫酸亚铁片研碎,置于稀硫酸中溶解后过滤
-2-B.标准重铬酸钾液应用酸式滴定管取用 ③最终溶液中溶质的物质的量浓度约为____________。
C.由实验可知酸性溶液中还原性:Fe2+>二苯胺磺酸钠>Cr3+ (3)已知 K
sp
[Fe(OH)
3
]=1.0×10-39,若使 100mL 0.1mol·L-1Fe
2
(SO
4
)
3
溶液中的 Fe3+完全沉淀(c≤
D.酸性K Cr O 溶液与乙醇生成乙酸的离子方程式为:
1.0×10-6mol·L-1),应调节pH最小为________。
2 2 7
(4)Na FeO 是一种新型高效水处理剂,可用Fe(OH) 和NaClO在碱性条件下制备,则该反应的化学方
2Cr O 2-+3C H OH+13H+=3CH COO-+4Cr3++11H O 2 4 3
2 7 2 5 3 2
程式为___________________。
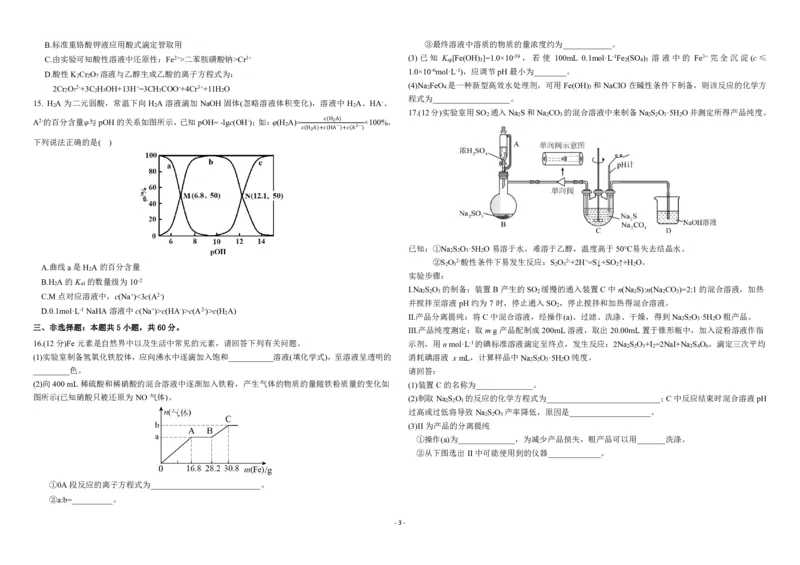
15. H A为二元弱酸,常温下向H A溶液滴加NaOH固体(忽略溶液体积变化),溶液中H A、HA-、
2 2 2
17.(12分)实验室用SO 通入Na S和Na CO 的混合溶液中来制备Na S O ·5H O并测定所得产品纯度。
2 2 2 3 2 2 3 2
A2-的百分含量φ与pOH的关系如图所示,已知pOH=-lgc(OH-);如:φ(H A)= ×100%。
2
(H2A)
− 2−
下列说法正确的是( ) (H2A)+ (HA )+ (A )
已知:①Na S O ·5H O易溶于水,难溶于乙醇,温度高于50℃易失去结晶水。
2 2 3 2
②S O 2-酸性条件下易发生反应:S O 2-+2H+=S↓+SO ↑+H O。
A.曲线a是H A的百分含量 2 3 2 3 2 2
2
实验步骤:
B.H A的K 的数量级为10-2
2 a1
Ⅰ.Na S O 的制备:装置B产生的SO 缓慢的通入装置C中n(Na S):n(Na CO )=2:1的混合溶液,加热
2 2 3 2 2 2 3
C.M点对应溶液中,c(Na+)<3c(A2-)
并搅拌至溶液pH约为7时,停止通入SO ,停止搅拌和加热得混合溶液。
2
D.0.1mol·L-1NaHA溶液中c(Na+)>c(HA-)>c(A2-)>c(H A)
2 Ⅱ.产品分离提纯:将C中混合溶液,经操作(a)、过滤、洗涤、干燥,得到Na S O ·5H O粗产品。
2 2 3 2
三、非选择题:本题共5小题,共60分。
Ⅲ.产品纯度测定:取mg产品配制成200mL溶液,取出20.00mL置于锥形瓶中,加入淀粉溶液作指
16.(12分)Fe元素是自然界中以及生活中常见的元素,请回答下列有关问题。 示剂,用nmol·L-1的碘标准溶液滴定至终点,发生反应:2Na S O +I =2NaI+Na S O ,滴定三次平均
2 2 3 2 2 4 6
(1)实验室制备氢氧化铁胶体,应向沸水中逐滴加入饱和___________溶液(填化学式),至溶液呈透明的 消耗碘溶液 xmL,计算样品中Na S O ·5H O纯度。
2 2 3 2
_________色。 请回答:
(2)向400mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的物质的量随铁粉质量的变化如 (1)装置C的名称为______________。
图所示(已知硝酸只被还原为NO气体)。 (2)制取Na S O 的反应的化学方程式为____________________________;C中反应结束时混合溶液pH
2 2 3
过高或过低将导致Na S O 产率降低,原因是____________________。
2 2 3
(3)II为产品的分离提纯
①操作(a)为______________,为减少产品损失,粗产品可以用_______洗涤。
②从下图选出II中可能使用到的仪器_____________。
①0A段反应的离子方程式为___________________________。
②a:b=__________。
-3-(5)煅烧过程中发生的化学方程式为___________________________。
19.(12分)已知25℃部分弱电解质的电离平衡常数如下表:
H C O CH COOH H CO NH ·H O
2 2 4 3 2 3 3 2
K =5.6×10-2 K =5.4×10-5 K=1.7×10-5 K =4.2×10-7 K =5.6×10-11 K =1.7×10-5
a1 a2 a a1 a2 b
(1)过量NaHC O 与Na CO 反应的离子方程式为__________________________。
2 4 2 3
(2)浓度均为0.1mol·L-1的①NH HCO 溶液 ②NH HC O 溶液 ③CH COONH 溶液 ④氨水
4 3 4 2 4 3 4
⑤(NH ) C O 溶液 ⑥(NH ) CO 溶液中c(NH +)由大到小的顺序为__________(填序号)。
4 2 2 4 4 2 3 4
(3)0.1mol·L-1的NH HCO 溶液中c(NH ·H O)_______c(H CO )(填“>”、“<”或“=”)。
4 3 3 2 2 3
(4)III为氧化还原滴定法测定样品中Na S O ·5H O的纯度
2 2 3 2 (4)由CH COOH滴定NaOH溶液过程中得c(Na+)=2c(CH COO-)的溶液的溶质为_______(填化学式)
3 3
①滴定终点的现象是__________________________。②样品中Na S O ·5H O的纯度为__________。
2 2 3 2 (5)浓度均为0.1mol·L-1的 Na C O 和 NaHC O 混合溶液中除c(Na+)外的其他离子浓度的等量关系为
2 2 4 2 4
18.(12分)利用蛇纹石提镁后的中和渣(主要成分为Fe O 及SiO 、Al O 、Cr O 、CoO、NiCO 、PbCO
2 3 2 2 3 2 3 3 3 ______________。
等杂质)提取高附加值的铁红(Fe O )的一种工艺流程如下图所示。
2 3 (6)已知K (CaCO )=1.6×10-9,则CaCO 饱和溶液中的最多的含碳微粒是_______(填微粒符号)。
sp 3 3
20.(12分)(1)已知顺-2-丁烯与反-2-丁烯之间的转化称为“异构化”,两种物质与氢气加成的热化学方程式
如下,则顺-2-丁烯异化为反-2-丁烯的热化学方程式为__________________________。
已知:(1)K (CoS)=3.0×10-26 K (NiS)=2.8×10-21
sp sp
(2)溶液中离子浓度≤1.0×10-5mol·L-1时可认为完全沉淀
请回答下列问题:
(2)已知:2CO(g)+4H (g)=CH OCH (g)+H O(g) ΔH=-202kJ·mol-1。下表是几种化学键的键能,则O-H
(1)滤渣1的成分为___________(填化学式),滤液2中主要的金属阳离子为___________。 2 3 3 2
的键能为______kJ·mol-1。
(2)还原过程中发生反应的离子方程式为__________________,可用试剂_______检验还原是否完全。
化学键 C-H C-O H-H C≡O
(3)欲制备高纯铁红,净化过程溶液中各离子的去除率与pH的关系如下图,则应控制pH为______。
键能/kJ·mol-1 413 326 436 1072
(3)由CH CH OH和O 构成的质子交换膜燃料电池的结构示意如下图所示,电池总反应为
3 2 2
CH CH OH+3O =2CO +3H O,请回答下列问题。
3 2 2 2 2
①a电极的电极反应式为______________________。
②若用该燃料电池为铅蓄电池充电,电极b连接铅蓄电池的_____极(填“Pb”或“PbO ”),通过质子交
2
换膜2molH+时,上述燃料电池所消耗的O 在标准状况下的体积为__________L,铅蓄电池中电解液
2
质量________(填“增大”或“减小”)__________g。
(4)沉钴镍时,若溶液中Co2+、Ni2+浓度均为0.01mol·L-1逐渐加入Na S,则先沉淀的离子为_____,计
2
算说明两种离子能否彻底先后分离____________________________________。
-4-