文档内容
2024~2025学年(上)高三年级期中质量监测
化 学
注 意 事 项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共6页。满分为100分,考试时间为75分钟。考试结束后,请将答题卡交回。
2.答题前,请您务必将自己的姓名、学校、考试号等用书写黑色字迹的0.5毫米签字笔填写在答
题卡上规定的位置。
3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号与本人是否相符。
4.作答选择题,必须用2B铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡皮擦
干净后,再选涂其他答案。作答非选择题,必须用0.5 毫米黑色墨水的签字笔在答题卡上的指
定位置作答,在其他位置作答一律无效。
5.如需作图,必须用2B铅笔绘、写清楚,线条、符号等须加黑、加粗。
可能用到的相对原子质量:H1 C12 016 Cu 64 I127
一、单项选择题:共13题,每题3分,共39分。每小题只有一个选项最符合题意。
1.我国四大发明对世界产生了深远的影响。下列涉及到的物质中属于有机物的是
A.纸张中的纤维素 B.活字中的陶瓷土
C.黑火药中的木炭 D.指南针中的四氧化三铁
2.反应4KO?+2CO?=2K?CO?+30?可用于航天供氧。下列说法正确的是
A. KO?中只含离子键 B. CO?的电子式为:?:C:?:
C. CO?-的空间构型为平面三角形 D.中子数为10的氧原子:"o
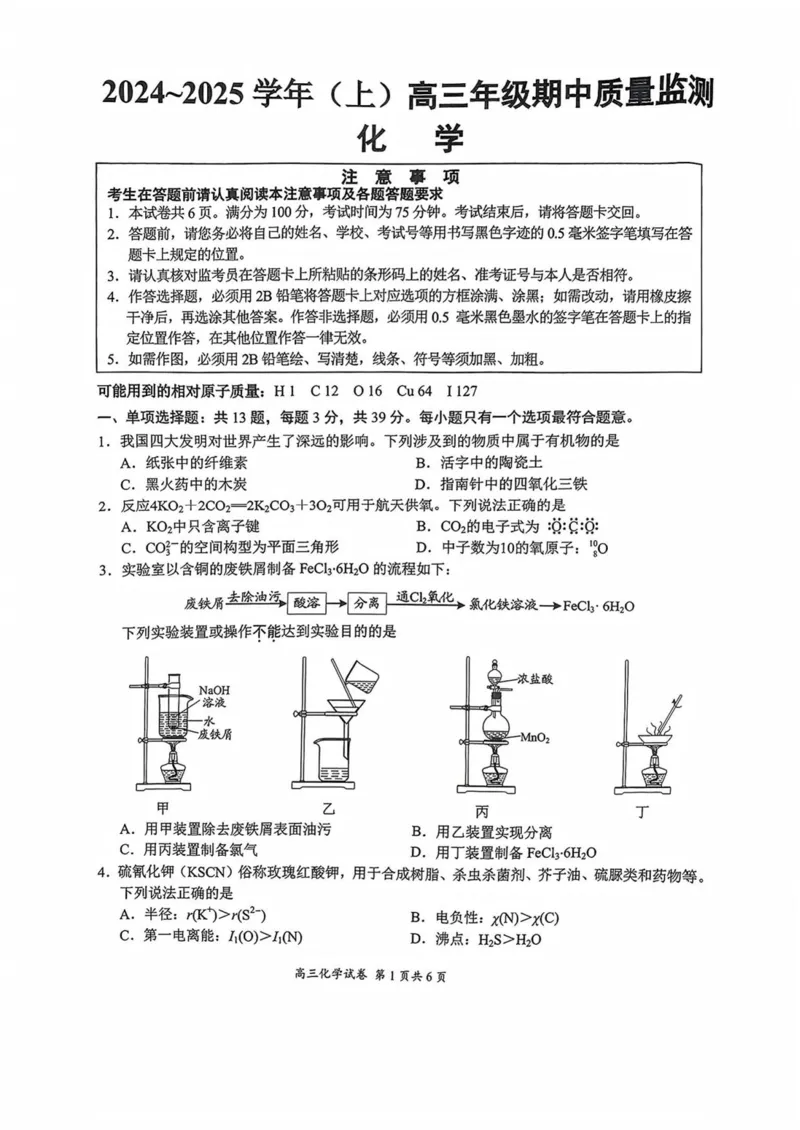
3.实验室以含铜的废铁屑制备 FeCl?·6H?O的流程如下:
废铁屑去除油污 通Cl?氧化
酸溶 分离 氯化铁溶液一→FeCl·6H?O
下列实验装置或操作不能达到实验目的的是
员
浓盐酸
NaOH
溶液
0
水
废铁屑 MnO?
廷
甲 乙 丙 丁
A.用甲装置除去废铁屑表面油污 B.用乙装置实现分离
C.用丙装置制备氯气 D.用丁装置制备FeCl?·6H?O
4.硫氰化钾(KSCN)俗称玫瑰红酸钾,用于合成树脂、杀虫杀菌剂、芥子油、硫脲类和药物等。
下列说法正确的是
A.半径:r(K)>r(s2-) B.电负性:x(N)>x(C)
C.第一电离能:I?(O)>I?(N D.沸点:H?S>H?O
高三化学试卷 第1页共6页
{#{QQABTYqEggggQhBAAAgCEQEyCgCQkgACAYgOAAAIMAAAyAFABCA=}#}阅读材料,完成5~7题:
N、P为第VA族元素。NH?、N?H?是氮的常见氢化物,氨水与 Ag*形成 Ag(NH?)?OH。工业
上利用NH?和CO?制取尿素[CO(NH?)?].常温下N?H?为液体,具有很高的燃烧热(622.1 kJ-mol1)。
次磷酸(H?PO?)是一元弱酸,具有较强还原性,可将溶液中的 Ag*转化为银,自身变为 H?PO?,
用于化学镀银。磷化镓(GaP)的结构与晶体硅类似,是第三代半导体研究的热点。
5.下列说法正确的是
A. NH?中的键角大于NH?中的键角
B. 1 mol [Ag(NH?)?]OH 中有10 molo键
C. Ga基态核外电子排布式为[Ar]4s24p'
D. NH?和 CO?制取尿素时C的杂化类型由 sp转化为sp2
6.下列化学反应表示正确的是
A.向AgNO?溶液加入过量氨水:Ag*+NH?H?O=AgOH+NH?
B. H?PO?与足量的 NaOH 溶液反应:H?PO?+30H-=PO+3H?O
C. H?PO?用于化学镀银:4Ag*+H?PO?+2H?O=4Ag+H?PO?+4H*
D. N?H?燃烧的热化学方程式:N?H?(1)+O?(g)=N?(g)+2H?O(g) △H=-622.1 kJ-mor
7.下列物质结构与性质或性质与用途具有对应关系的是
A. NH?易溶于水,可作制冷剂
B. H—N的键能大于H—P,NH?的热稳定性大于PH?
C. N?H?中的N原子与H形成配位键,N?H?具有还原性
D. GaN 硬度大,可用作半导体材料
8.在给定条件下,下列制备过程涉及的物质转化均可实现的是
A.制备漂白粉:NaCl溶液电解cl?石灰孔漂白粉
B.制备硫酸:FeS2高温so?2OH?SO?
C.制备金属铝:Al(OHD?HCAICl?电解A?
D.制备乙醇:CH?=CH?CH?CH?BrNaOH乙醇CH?CH?OH
9.反应4HClg)+O?(g)“Cl2CL(g)+2H?O(g)可将工业副产物HCI转化成Cl?,实现氯资源的再利
用。研究发现反应的历程如下:
反应①:2CuCl?(s)=2CuCl(s)+Cl?(g)
反应②:……
反应③:CuO(s)+2HCl(g)=CuCl?(s)+H?O(g)
下列说法正确的是
A.反应制得1 molCl?,须投入2 molCuCl?
B.反应①增大压强,达新平衡后Cl?浓度减小
C.反应②应为:2CuCl(s)+O?(g)=2CuO(s)+Cl?(g)
D.由反应历程可知催化剂参与反应,且降低了反应的焓变
高三化学试卷 第2 页共6页
{#{QQABTYqEggggQhBAAAgCEQEyCgCQkgACAYgOAAAIMAAAyAFABCA=}#}10.磷酸铁(FePO?)主要用于制造磷酸铁锂电池材料。工业上可以用电解磷铁渣(主要含FeP等)
的方法制备FePO?,装置如题10图所示。下列说法正确的是 磷铁渣、 石墨
A.溶液中H*穿过质子交换膜向磷铁渣电极移动
0.1mol-L' 0.1mol-L1
B.电解结束一段时间后,NaOH浓度不变
磷酸溶液 NaOH溶液
C.阳极的电极反应:FeP+4H?O+8e-=FePO?+8H
质子交换膜
D.每生成 1 molFePO?,石墨电极产生2 molO?
题10图
11.化合物Z是一种药物合成中间体,其合成路线如下:
下列说法止确的是
A. X分子中所有碳原子一定共平面
B.Y分子中不含有手性碳原子
C. 1 molY中含3 mol 碳氧π键
D.Z可以与HCHO在一定条件下发生缩聚反应
12.下列实验探究方案能达到探究目的的是
选项 探究方案 探究目的
A
用铂丝蘸取某溶液进行焰色反应,观察火焰焰色 判断溶液中存在NaCl
向蔗糖溶液中滴加稀硫酸,水浴加热,再加入新制 判断蔗糖是否发生水解
B
Cu(OH)?悬浊液,观察现象
取5mL0.1 mol· L1KI溶液和1mL0.1 mol· L'FeCl?溶 验证Fe3+和I的反应有一定的
C 液充分反应后,再加2 mLCCl?振荡、静置后取上层 限度
清液滴加少量KSCN溶液,观察溶液颜色变化
向 NaBr溶液中滴加过量的氯水,再加入淀粉碘化钾 比较Cl?、Br?和I?的氧化性强
D
溶液,观察溶液颜色变化 弱
13.某温度下,利用CO?生产甲醇主要涉及以下反应。
反应I. CO?(g)+3H?(g)=CH?OH(g)+H?O(g) △H?=-49.4 kJ·mol1
反应Ⅱ. CO?(g)+H?(g)=CO(g)+H?O(g) △H?
反应Ⅲ. CO(g)+2H?(g)=CH?OH(g) △H?=-90.6kJ·mol
在恒压密闭容器中充入6molH?(g)、2 molCO?(g),分别在1 MPa和10 MPa下反应,分析温度
对平衡体系中CO?、CO、CH?OH的影响,设这三种气体物质的量分数之和为1,CO和CH?OH
的物质的量分数与温度变化关系如题13 图所示。已知:Kp为用分压表示的平衡常数,分压=
总压×物质的量分数。下列说法正确的是 dd0…000
100
A.△H?=-41.2 kJ·mol a
物质的量分数%
bj
B.表示10 MPa时 CH?OH的物质的量分数随温度变化 c
关系的曲线是c
d
C. 590℃时,反应Ⅱ的Kp为0.25
20 (590,30)
D. 200~400℃b、d曲线基本重合的原因是以反应Ⅱ为主, 100200 300 400 500 600 700
加压反应Ⅱ平衡不移动
温度/℃
题13图
高三化学试卷 第3 页共6页
{#{QQABTYqEggggQhBAAAgCEQEyCgCQkgACAYgOAAAIMAAAyAFABCA=}#}二、非选择题:共4题,共61分。
14.(15分)硒化锌(ZnSe)可实现人工光合作用,我国科研团队设计一种以锌矿(主要成分是
ZnS,含FeS?、NiS、SiO?等)为原料制备 ZnSe的工艺流程如下图所示。
空气 细菌 H?O?、NaOH H?Se
ZnSO?
锌矿- 堆浸 堆浸液 除铁 除镍 合成 ZnSe
溶液
堆浸渣 FeOOH 粗镍
。
已知:①“堆浸液”中含ZnSO?、FeSO?、NiSO?;②pH过高时,FeOOH沉淀会转化为胶体;
。
(1)传统用“灼烧”法将锌矿转化为金属氧化物,再酸浸。新工艺采用细菌“堆浸”。
①与传统“灼烧”法相比,采用细菌“堆浸”的优点是 ▲
②能提高“堆浸”时反应效率的措施可能有 ▲
。
(2)“除铁”时需加入 H?O?,并控制溶液 pH为3.2左右。
①生成1 molFeOOH理论上需要H?O?的物质的量为 ▲ mol。
②如果 pH过高会导致溶液中 Zn2+的含量降低,其原因可能是_ ▲
(3)“除镍”有多种方法。
。
①方法一:采用有机净化剂,有机净化剂的基本组分为大分子立体网格结构的聚合物,
净化原理如题14图-1所示。已知 r(Ni2)=69 pm,r(Zn2+)=74 pm,推测Ni2+能发生上述
。
转化而 Zn2+不能的可能原因为 △
②方法二:采用“锑盐净化法”,在酸性含Ni2+溶液中同时加入锌粉和 Sb?O?得到金属Ni
和 Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为 ▲
(4)硒化锌晶胞结构如题14图-2所示,请在题14图-3方框中补全沿x轴方向晶胞投影图。
二
●Zn O Se
zt
O
,
y
题14图-1 题14图-2 题14图-3
15.(15分)化合物H为一种镇痛药物的中间体,其一种合成路线如下:
G H
已知:①R—cNH?O,HR—C?OH(R为烃基或H,下同)
。
②R-ch-&-R+R-&-p.O癌测△R-e-R+HO
(1)A的名称为 ▲
高三化学试卷 第4页共6页
{#{QQABTYqEggggQhBAAAgCEQEyCgCQkgACAYgOAAAIMAAAyAFABCA=}#}。
。
。
(2)B→C的反应类型为 ▲
(3)F的结构简式为 ▲
(4)写出同时满足下列条件的B的一种同分异构体的结构简式 ▲
①遇 FeCl?溶液显紫色;②与新制Cu(OH)?悬浊液加热条件下反应,产生砖红色沉淀;
③核磁共振氢谱中有4个峰。
cHconsc&-a。请写出以cm-c和
(5)已知: 为原料制备 的
合成路线流程(无机试剂和有机溶剂任选,合成路线流程图示例见本题题干)。
16.(16分)碘化亚铜(CuI)是一种白色粉末,不溶于水,能被O?氧化,可用作有机合成催化剂。
(1)实验室采用如题16图所示装置模拟制备CuI。实验步骤如下:
步骤I:关闭K,将CuSO?溶液滴入KI溶液中,并开动电磁搅拌器,一段时间后B中
析出黄色沉淀。
步骤Ⅱ:打开K?,滴入70??H?SO?,将生成的SO?通入B装置中。一段时间后,B中
沉淀变成白色。 员
员
CuSO?
70??
H?SO? o 溶液
k?
单向阀
KI
Na?SO?
溶液 NaOH
粉末 o1 溶液
A B 。 C
题16图
①写出步骤I中所发生的离子方程式: ▲ 。
②70??硫酸的物质的量浓度为11.5 mol· L1,实验中需使用220 mL11.5 mol· L1的硫酸,
配制时除量筒、烧杯和玻璃棒外,还必须使用的玻璃仪器有 ▲
(2)工业上以斑铜矿[Cu?FeS?]为原料制备CuI的流程如下:
稀硫酸 KI溶液
。
。
斑铜矿 焙烧 酸浸 沉铁 转化 洗涤 CuI
①检验“酸浸”溶液中是否含有Fe2+的操作是_ ▲
②“洗涤”时用Na?SO?溶液洗涤沉淀的目的是_ ▲
。
(3)斑铜矿在有氧条件下用氨水浸出,可制得[Cu(NH?)?]SO?H?O,反应的原理为:
Cu?FeS?+NH?H?O+O?+OH-—Fe?O?+[Cu(NH?)4]2++SO?+H?O(未配平)。请设计由
浸取后的滤液制取[Cu(NH?)4]SO?H?O晶体的实验方案: ▲
(4)利用KMnO?测定 CuI样品中CuI质量分数(杂质不参加反应)的方法如下:称取 CuI样
品2.000g,向其中加入足量的 Fe?(SO4)?溶液,待充分反应后,滴加 0.2000 mol·L1KMnO?
溶液至恰好完全反应时消耗 KMnO?溶液的体积为20.00 mL。
已知:Fe3?+CuI—Fe2++Cu2++I?(未配平)
MnO4+Fe2++H*—Mn2++Fe3?+H?O(未配平)
计算该样品中CuI的质量分数(写出计算过程)。
高三化学试卷 第5页共6页
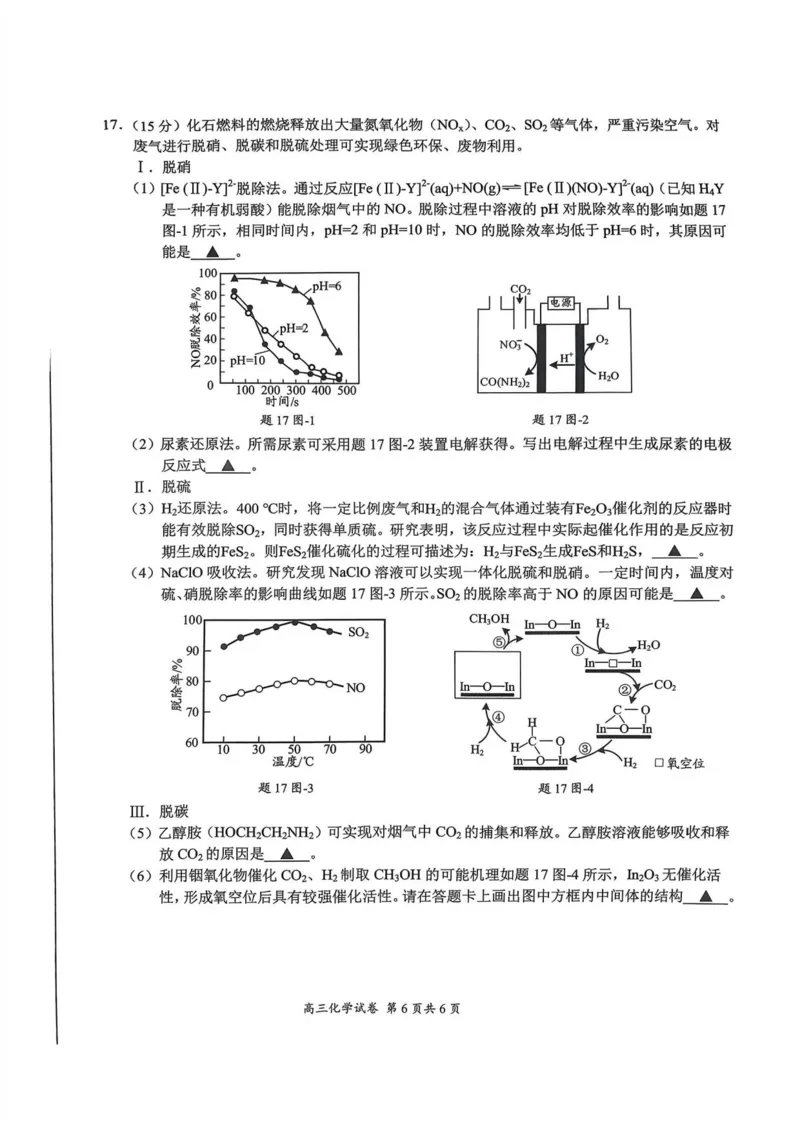
{#{QQABTYqEggggQhBAAAgCEQEyCgCQkgACAYgOAAAIMAAAyAFABCA=}#}17.(15分)化石燃料的燃烧释放出大量氮氧化物(NOx)、CO?、SO?等气体,严重污染空气。对
废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I.脱硝
(1)[Fe(Ⅱ)-Y]2脱除法。通过反应[Fe(Ⅱ)-Y}2(aq)+NO(g)一[Fe(Ⅱ)(NO)-Y}2(aq)(已知H?Y
。
是一种有机弱酸)能脱除烟气中的NO。脱除过程中溶液的 pH 对脱除效率的影响如题17
图-1所示,相同时间内,pH=2和 pH=10时,NO的脱除效率均低于 pH=6时,其原因可
能是 ▲
100
pH=6
NO脱除效率%80 & CO?
电源-
60
40 pH=2
O?
NO5
20 pH=10 H
H?O
0 co(NH?)?
100 200 300 400 500
时间/s
题17图-1 题17图-2
(2)尿素还原法。所需尿素可采用题17图-2装置电解获得。写出电解过程中生成尿素的电极
反应式▲。
Ⅱ.脱硫
。
(3)H?还原法。400 ℃时,将一定比例废气和H?的混合气体通过装有Fe?O?催化剂的反应器时
能有效脱除SO?,同时获得单质硫。研究表明,该反应过程中实际起催化作用的是反应初
。
期生成的FeS?。则FeS?催化硫化的过程可描述为:H?与FeS?生成FeS和H?S, ▲
(4)NaClO吸收法。研究发现NaClO溶液可以实现一体化脱硫和脱硝。一定时间内,温度对
硫、硝脱除率的影响曲线如题17图-3所示。SO?的脱除率高于NO的原因可能是 ▲
100 CH?OH In- -O--In H?
SO?
⑤ H?O
90 ①
脱除率% In-—口--In
80
CO?
NO In—0—In ②
70 个 ④ Hc-o C—Q
n- 0-
60
10 305070 90 H? 比可1 ③
温度/℃ -O- H? 口氧空位
题17图-3 题17图-4
。
Ⅲ.脱碳
(5)乙醇胺(HOCH?CH?NH?)可实现对烟气中CO?的捕集和释放。乙醇胺溶液能够吸收和释
。
放CO?的原因是_ ▲
(6)利用铟氧化物催化CO?、H?制取 CH?OH的可能机理如题17图-4所示,In?O?无催化活
性,形成氧空位后具有较强催化活性。请在答题卡上画出图中方框内中间体的结构 ▲
高三化学试卷 第6页共6页
{#{QQABTYqEggggQhBAAAgCEQEyCgCQkgACAYgOAAAIMAAAyAFABCA=}#}2024~2025 学年(上)高三期中质量监测
化学参考答案和评分细则
一、单项选择题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项符合题意。
....
1.A 2.C 3.D 4.B 5.D 6.C 7.B 8.A 9.C 10.B 11.D 12.C 13.C
二、非选择题:共4题,共61分。
14.(1)①常温下反应,不需要耗费能源;不会产生污染性气体SO (2分)
2
②将锌矿粉碎;搅拌;将锌矿充分暴露;延长堆浸时间等 (2分)
(2)①0.5 (2分)
②部分Zn2+转化成Zn(OH) 或[Zn(OH) ]2+;pH过高时,FeOOH沉淀会转化成胶体,
2 4
胶体可能吸附Zn2+,造成含量偏低 (2分)
(3)①Ni2+半径与有机净化剂网格孔径大小匹配,可形成配位键,而 Zn2+不匹配。 (2分)
②Ni2++Sb O +6H++5Zn=NiSb+3H O+5Zn2+。 (3分)
2 3 2
(4) (2分)
【本题共15分】
15.(1)对乙基苯酚或4-乙基苯酚 (2分)
(2)加成反应 (2分)
O ONa
(3) CN (3分)
OH
CH— —CH
(4) 3 3 (3分)
CH— —CH
3 3
CHO
OH OH O
CH3 —C—CN
H2O,H+
CH3 —C—COOH
浓硫
酸
CH2 C—COOH
SOCl2
CH2 C—C—Cl
CH3 CH3 CH3 CH3
(5) OH
O O
I2
AlCl3
OH
催化剂
O
(5分)
【本题共15分】
高三化学试卷 第1页 共8页
{#{QQABTYqEggggQhBAAAgCEQEyCgCQkgACAYgOAAAIMAAAyAFABCA=}#}16.(1)①2Cu2++4I-=2CuI↓+I ↓ (2分)
2
②250mL容量瓶、胶头滴管 (2分)
(2)①取少量酸浸液于试管中,滴加酸性高锰酸钾溶液(或铁氰化钾) (2分)
②除去附着在CuI上面的碘单质,防止CuI被氧气氧化。 (2分)
(3)将浸出液中加入无水乙醇析出[Cu(NH ) ]SO ·H O晶体,过滤,用无水乙醇洗涤,低温
3 4 4 2
干燥。 (4分)
(4)参加反应的n(KMnO )=0.2000 mol·L-1×20.00 mL×10—3 L·mL—1=4.000×10—3 mol
4
5CuI ~ 10Fe2+ ~ 2MnO-
4
5 2
n(CuI) 4.000×10—3 mol
∴ n(CuI)= 1.000×10—2 mol
1.000102mol 191g mol1
∴样品中CuI的质量分数= ×100%=95.5% (4分)
2.000g
【本题共16分】
17.(1)pH=2时,[Fe (Ⅱ)-Y]2-与H+反应,导致[Fe (Ⅱ)-Y]2-浓度减小,NO脱除效率降低,pH=10
时,可能生成Fe(OH) 沉淀,也会导致[Fe (Ⅱ)-Y]2-浓度降低,NO脱除效率降低。
2
(2分)
(2)2NO- +16e−+CO +18H+=CO(NH ) +7H O (3分)
3 2 2 2 2
(3)H S与SO 反应生成S,最后生成的S再与FeS反应转化为FeS (2分)
2 2 2
(4)SO 在水中的溶解度大于NO;SO 在溶液中的还原性强于NO;SO 与NaClO溶液的反
2 2 2
应速率大于NO (3分)
(5)醇胺含有羟基和氨基,具有很好的亲水性;乙醇胺含有氨基,有碱性,可与二氧化碳和
水反应生成盐;该盐在较低温度下又可以充分分解为乙醇胺和二氧化碳 (3分)
H
H
(6) C — O—H (2分)
H
In—O—In
【本题共15分】
非选择题合理答案酌情给分
高三化学试卷 第2页 共8页
{#{QQABTYqEggggQhBAAAgCEQEyCgCQkgACAYgOAAAIMAAAyAFABCA=}#}