文档内容
澄宜六校阶段性联合测试试题
高 三 化 学
2024.12
一、选择题(共13题,每题3分,共39分。每题只有一个选项最符合题意。)
1.习总书记强调:积极培育和发展新质生产力。下列与科技成就相关的描述正确的是
A.“朱雀二号”遥二成为全球首枚成功入轨的液氧甲烷运载火箭,甲烷作助燃剂
B.“神舟十七号”发动机的耐高温结构材料Si N 是一种分子晶体
3 4
C.挑战马里亚纳海沟的自供电软体机器人所用的硅树脂是新型无机非金属材料
D.铁磁流体液态机器人中驱动机器人运动的磁铁的主要成分是Fe O
2 3
2.侯德榜制碱法的重要反应 NaCl+CO +NH+H O=NaHCO ↓+NHCl。下列说法正确的是
2 3 2 3 4
A. 离子半径:r(N3-) H O> NH
2 2 3
C. 键角:NF >NCl >NBr D. 共价键的极性:H-O>H-N
3 3 3
3.氮化镓是新型半导体材料。工业制备氮化镓的常用方法是GaCl + NH ===== GaN +
3 3 3
3HCl。下列叙述正确的是
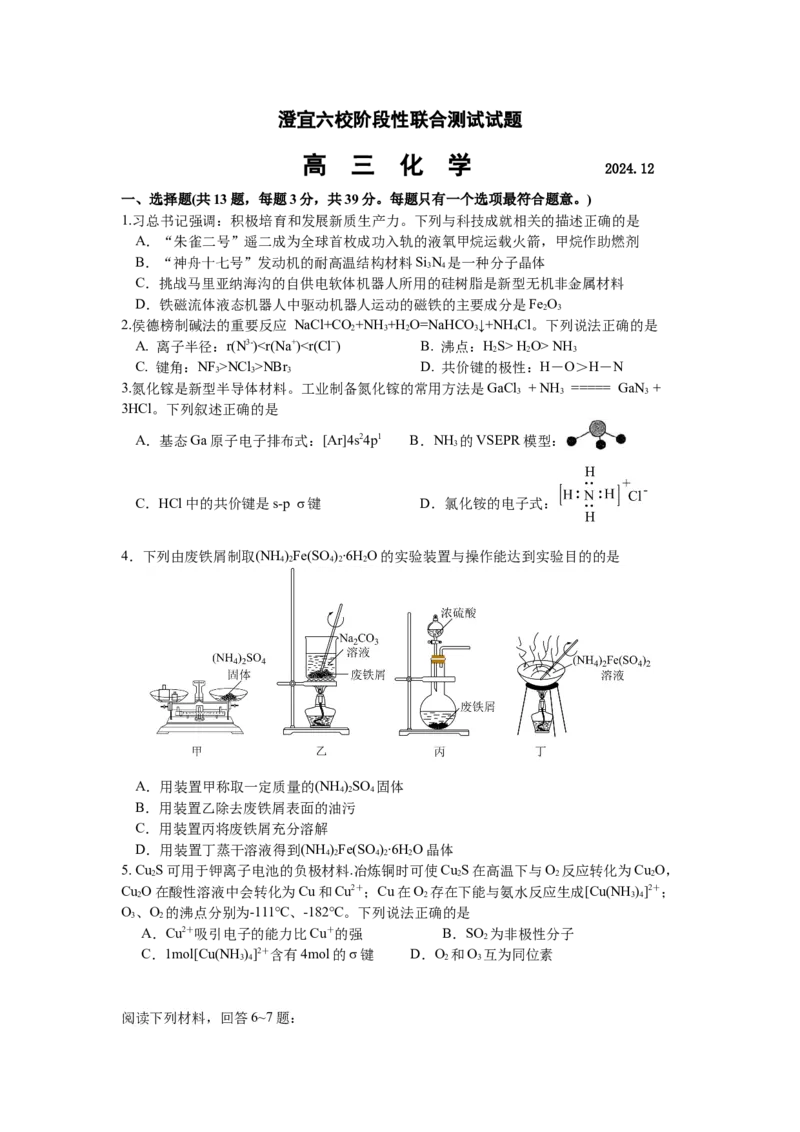
A.基态Ga原子电子排布式:[Ar]4s24p1 B.NH 的VSEPR模型:
3
C.HCl中的共价键是s-p σ键 D.氯化铵的电子式:
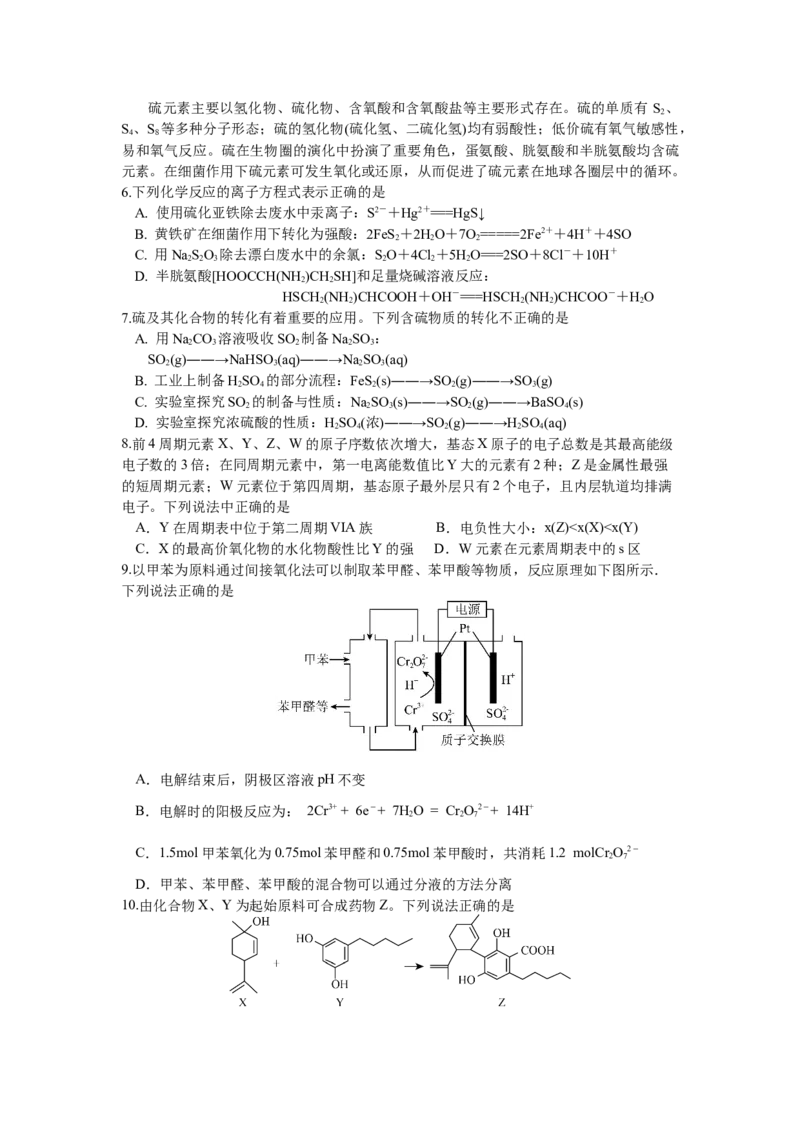
4.下列由废铁屑制取(NH )Fe(SO )∙6H O的实验装置与操作能达到实验目的的是
4 2 4 2 2
A.用装置甲称取一定质量的(NH )SO 固体
4 2 4
B.用装置乙除去废铁屑表面的油污
C.用装置丙将废铁屑充分溶解
D.用装置丁蒸干溶液得到(NH )Fe(SO )∙6H O晶体
4 2 4 2 2
5. Cu S可用于钾离子电池的负极材料.冶炼铜时可使Cu S在高温下与O 反应转化为Cu O,
2 2 2 2
Cu O在酸性溶液中会转化为Cu和Cu2+;Cu在O 存在下能与氨水反应生成[Cu(NH )]2+;
2 2 3 4
O、O 的沸点分别为-111℃、-182℃。下列说法正确的是
3 2
A.Cu2+吸引电子的能力比Cu+的强 B.SO 为非极性分子
2
C.1mol[Cu(NH)]2+含有4mol的σ键 D.O 和O 互为同位素
3 4 2 3
阅读下列材料,回答6~7题:硫元素主要以氢化物、硫化物、含氧酸和含氧酸盐等主要形式存在。硫的单质有 S 、
2
S、S 等多种分子形态;硫的氢化物(硫化氢、二硫化氢)均有弱酸性;低价硫有氧气敏感性,
4 8
易和氧气反应。硫在生物圈的演化中扮演了重要角色,蛋氨酸、胱氨酸和半胱氨酸均含硫
元素。在细菌作用下硫元素可发生氧化或还原,从而促进了硫元素在地球各圈层中的循环。
6.下列化学反应的离子方程式表示正确的是
A. 使用硫化亚铁除去废水中汞离子:S2-+Hg2+===HgS↓
B. 黄铁矿在细菌作用下转化为强酸:2FeS+2HO+7O=====2Fe2++4H++4SO
2 2 2
C. 用NaSO 除去漂白废水中的余氯:SO+4Cl+5HO===2SO+8Cl-+10H+
2 2 3 2 2 2
D. 半胱氨酸[HOOCCH(NH )CHSH]和足量烧碱溶液反应:
2 2
HSCH (NH )CHCOOH+OH-===HSCH (NH )CHCOO-+HO
2 2 2 2 2
7.硫及其化合物的转化有着重要的应用。下列含硫物质的转化不正确的是
A. 用NaCO 溶液吸收SO 制备NaSO :
2 3 2 2 3
SO (g)――→NaHSO(aq)――→NaSO (aq)
2 3 2 3
B. 工业上制备HSO 的部分流程:FeS(s)――→SO (g)――→SO (g)
2 4 2 2 3
C. 实验室探究SO 的制备与性质:NaSO (s)――→SO (g)――→BaSO(s)
2 2 3 2 4
D. 实验室探究浓硫酸的性质:HSO (浓)――→SO (g)――→HSO (aq)
2 4 2 2 4
8.前4周期元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级
电子数的3倍;在同周期元素中,第一电离能数值比Y大的元素有2种;Z是金属性最强
的短周期元素;W元素位于第四周期,基态原子最外层只有2个电子,且内层轨道均排满
电子。下列说法中正确的是
A.Y在周期表中位于第二周期VIA族 B.电负性大小:x(Z) c(HS−)
2
B.“除锌镍”后所得上层清液中c(Ni2+)c(S2−)> K (NiS)
sp
C.“沉锰”后的溶液中存在c(NH
4
+)+ c(NH
3∙
H
2
O) =c(H
2
CO
3
) + c(HCO
3
−) + c(CO
3
2−)
D.0.1 mol·L-1NH HCO 溶液中存在 c(H+)+ 2c(HCO) > c(CO2−) + c(OH−) +
4 3 2 3 3
c(NH HO)
3∙ 2
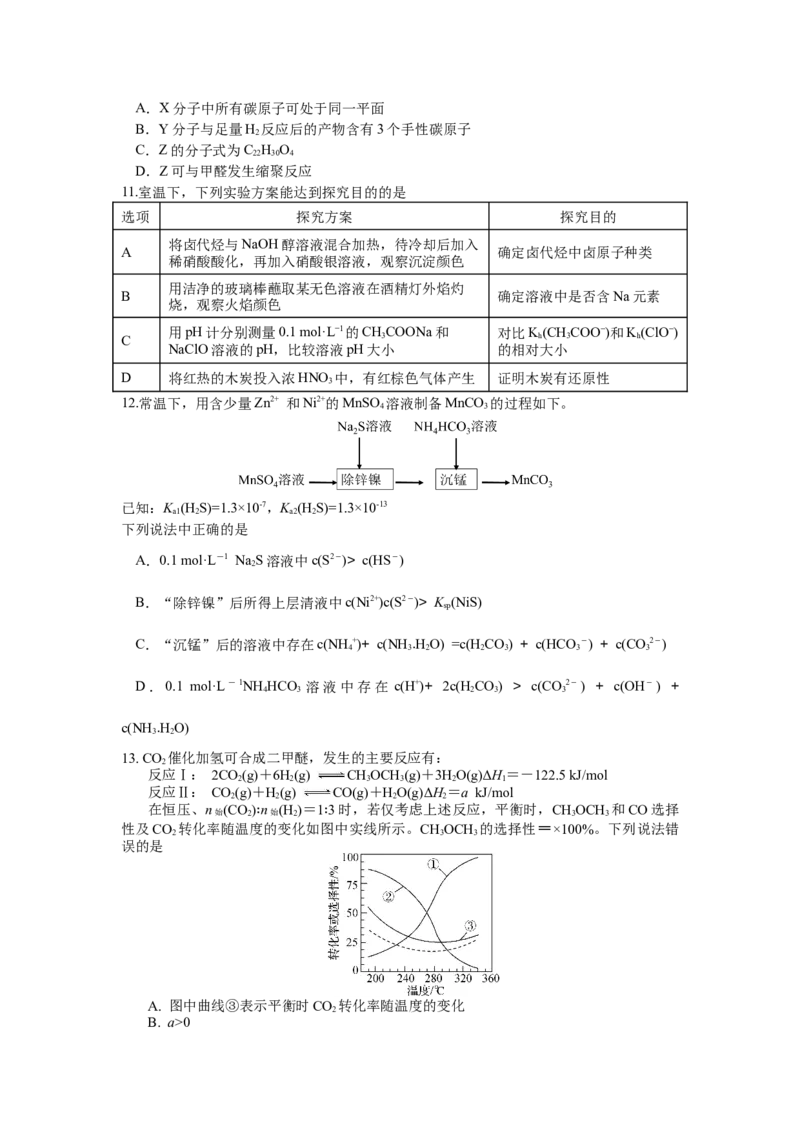
13. CO 催化加氢可合成二甲醚,发生的主要反应有:
2
反应Ⅰ: 2CO(g)+6H(g) CHOCH (g)+3HO(g)ΔH=-122.5 kJ/mol
2 2 3 3 2 1
反应Ⅱ: CO(g)+H(g) CO(g)+HO(g)ΔH=a kJ/mol
2 2 2 2
在恒压、n (CO) n (H )=1 3时,若仅考虑上述反应,平衡时,CHOCH 和CO选择
始 2 始 2 3 3
性及CO 转化率随温度的变化如图中实线所示。CHOCH 的选择性=×100%。下列说法错
2 3 3
误的是 ∶ ∶
A. 图中曲线③表示平衡时CO 转化率随温度的变化
2
B. a>0C. 平衡时,H 转化率随温度的变化可能如图中虚线所示
2
D. 200 ℃时,使用对反应Ⅰ选择性高的催化剂可提高CHOCH 的生产效率
3 3
二、非选择题(共4题,共61分。)
14. (15分)以软锰矿[主要成分为MnO ,还含有钙镁碳酸盐及少量的有机物(C H O )]为原
2 12 22 11
料制备硫酸锰,进而进一步制备MnO 、Mn O 。
3 4 12 19
(1)制备硫酸锰的流程如下:
已知: “酸洗”时,MnO 与有机物发生反应使锰元素产生损耗。 使用相同浓度硝酸或
➀ 2 ➁
磷酸进行“酸洗”时,锰元素损耗率:硝酸大于磷酸。
①写出用硝酸“酸洗”时,有机物与MnO 反应生成CO 的离子方程式________________
2 2
______________________________________________________。
②工业上常采用硝酸酸洗而不采用磷酸酸洗的主要原因是__________________________
______________________________________________________。
③ “还原”过程中会得到副产物MnS O,其形成过程如下:
2 6
pH在4~6范围内,随溶液pH增大,MnS O 的生成速率减小,其主要原因是___________
2 6
_____________________________________________________________________________。
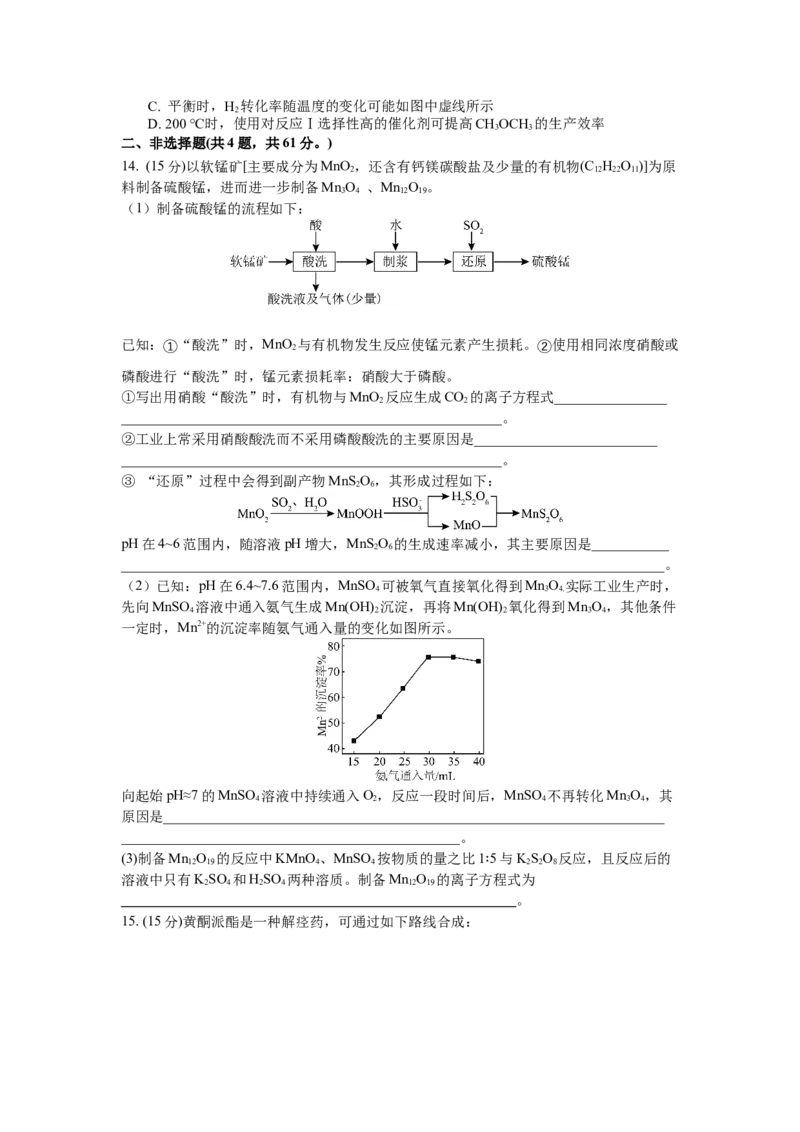
(2)已知:pH在6.4~7.6范围内,MnSO 可被氧气直接氧化得到MnO 实际工业生产时,
4 3 4.
先向MnSO 溶液中通入氨气生成Mn(OH) 沉淀,再将Mn(OH) 氧化得到MnO,其他条件
4 2 2 3 4
一定时,Mn2+的沉淀率随氨气通入量的变化如图所示。
向起始pH≈7的MnSO 溶液中持续通入O,反应一段时间后,MnSO 不再转化MnO,其
4 2 4 3 4
原因是_______________________________________________________________________
________________________________________________。
(3)制备Mn O 的反应中KMnO 、MnSO 按物质的量之比1 5与KSO 反应,且反应后的
12 19 4 4 2 2 8
溶液中只有KSO 和HSO 两种溶质。制备Mn O 的离子方程式为
2 4 2 4 12 19
∶
。
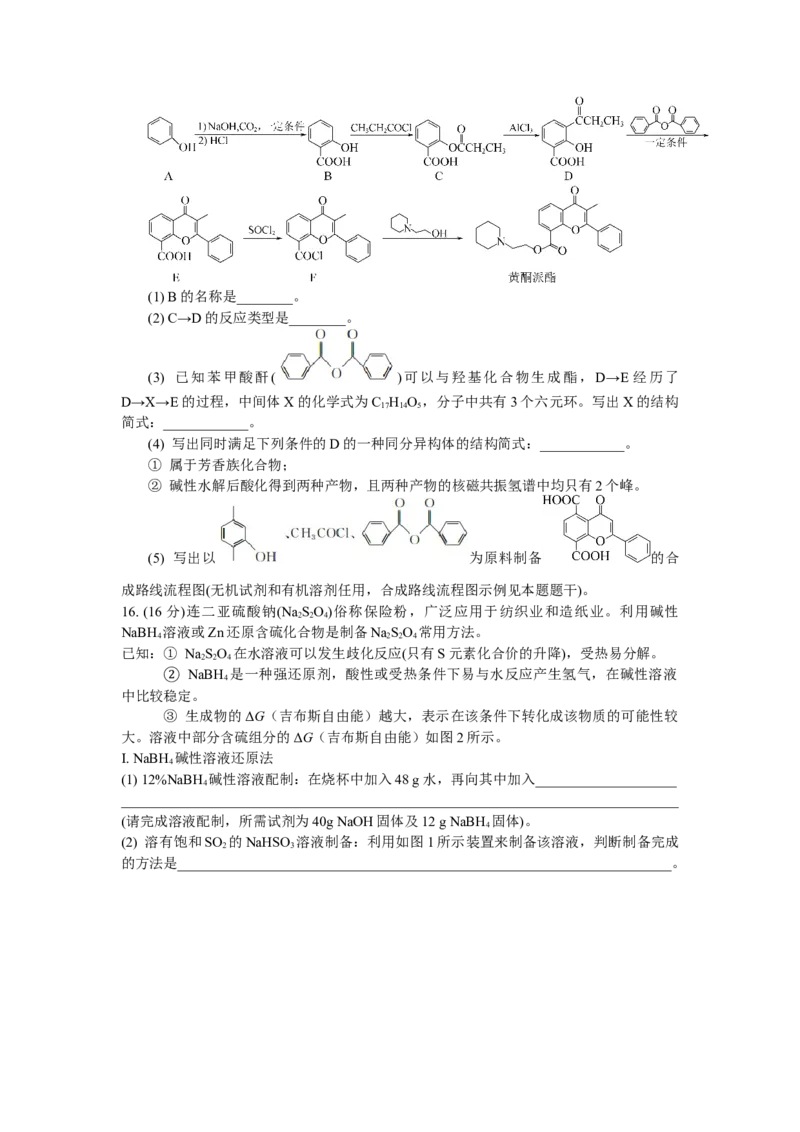
15. (15分)黄酮派酯是一种解痉药,可通过如下路线合成:(1) B的名称是________。
(2) C→D的反应类型是________。
(3) 已知苯甲酸酐( )可以与羟基化合物生成酯,D→E 经历了
D→X→E的过程,中间体X的化学式为C H O ,分子中共有3个六元环。写出X的结构
17 14 5
简式:____________。
(4) 写出同时满足下列条件的D的一种同分异构体的结构简式:____________。
① 属于芳香族化合物;
② 碱性水解后酸化得到两种产物,且两种产物的核磁共振氢谱中均只有2个峰。
(5) 写出以 为原料制备 的合
成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
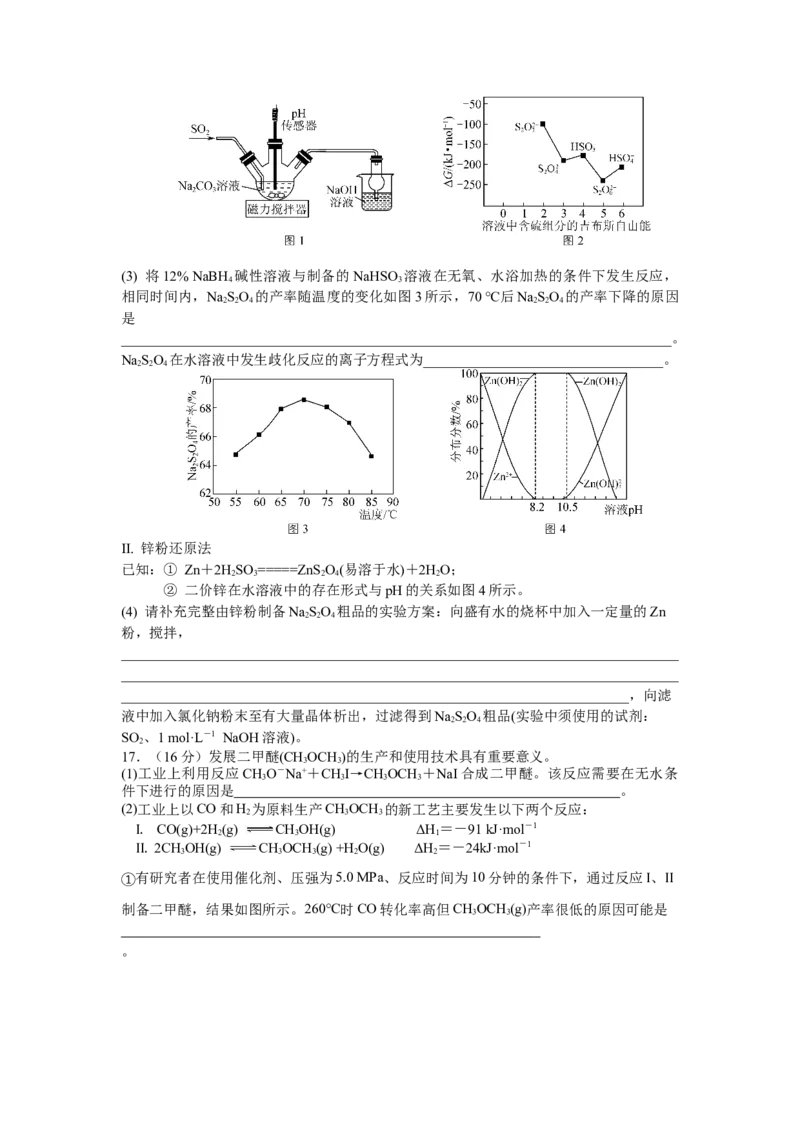
16. (16分)连二亚硫酸钠(Na SO)俗称保险粉,广泛应用于纺织业和造纸业。利用碱性
2 2 4
NaBH 溶液或Zn还原含硫化合物是制备NaSO 常用方法。
4 2 2 4
已知:① NaSO 在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
2 2 4
NaBH 是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液
4
中比较稳定。
②
③ 生成物的ΔG(吉布斯自由能)越大,表示在该条件下转化成该物质的可能性较
大。溶液中部分含硫组分的ΔG(吉布斯自由能)如图2所示。
Ⅰ. NaBH 碱性溶液还原法
4
(1) 12%NaBH 碱性溶液配制:在烧杯中加入48 g水,再向其中加入____________________
4
_______________________________________________________________________________
(请完成溶液配制,所需试剂为40g NaOH固体及12 g NaBH 固体)。
4
(2) 溶有饱和SO 的NaHSO 溶液制备:利用如图1所示装置来制备该溶液,判断制备完成
2 3
的方法是______________________________________________________________________。(3) 将12% NaBH 碱性溶液与制备的NaHSO 溶液在无氧、水浴加热的条件下发生反应,
4 3
相同时间内,NaSO 的产率随温度的变化如图3所示,70 ℃后NaSO 的产率下降的原因
2 2 4 2 2 4
是
______________________________________________________________________________。
NaSO 在水溶液中发生歧化反应的离子方程式为__________________________________。
2 2 4
Ⅱ. 锌粉还原法
已知:① Zn+2HSO =====ZnS O(易溶于水)+2HO;
2 3 2 4 2
② 二价锌在水溶液中的存在形式与pH的关系如图4所示。
(4) 请补充完整由锌粉制备NaSO 粗品的实验方案:向盛有水的烧杯中加入一定量的Zn
2 2 4
粉,搅拌,
_______________________________________________________________________________
_______________________________________________________________________________
________________________________________________________________________,向滤
液中加入氯化钠粉末至有大量晶体析出,过滤得到NaSO 粗品(实验中须使用的试剂:
2 2 4
SO 、1 mol·L-1 NaOH溶液)。
2
17.(16分)发展二甲醚(CHOCH )的生产和使用技术具有重要意义。
3 3
(1)工业上利用反应CHO-Na++CHI→CHOCH +NaI合成二甲醚。该反应需要在无水条
3 3 3 3
件下进行的原因是 。
(2)工业上以CO和H 为原料生产CHOCH 的新工艺主要发生以下两个反应:
2 3 3
CO(g)+2H(g) CHOH(g) ΔH=-91 kJ·mol-1
2 3 1
2CHOH(g) CHOCH (g) +H O(g) ΔH=-24kJ·mol-1
3 3 3 2 2
I.
➀I有I.研究者在使用催化剂、压强为5.0 MPa、反应时间为10分钟的条件下,通过反应 、
制备二甲醚,结果如图所示。260℃时CO转化率高但CHOCH (g)产率很低的原因可能I是I I
3 3
。②Al O 催化CHOH形成二甲醚的过程可表示为
2 3 3
控制起始温度为 250℃,以固定流速向装有催化剂的反应器中分别通入纯甲醇和
[m(CH OH)∶m(H O)]=4∶1的甲醇溶液,得到甲醇转化率、反应器温度随通入液体时长
3 2
的关系如图所示。通入甲醇溶液的反应器中,甲醇转化率逐渐降低的原因是
。
(3)利用二甲醚可通过以下途径制取氢气。
途径Ⅰ:2CHOCH (g)+3O(g)=4CO(g)+6H(g) ΔH=-25 kJ·mol-1
3 3 2 2 2
途径Ⅱ:CHOCH (g)+3HO (g)=2CO(g)+6H(g) ΔH=+135 kJ·mol-1
3 3 2 2 2
①“自热重整”可看做是途径Ⅰ和途径Ⅱ相结合的一种制氢方法:向二甲醚、水蒸气的
混合气中通入少量氧气。通入氧气最主要的目的是
。
②途径Ⅱ中主要包括三个ΔH>0的基本反应:CHOCH +HO=2CHOH;
3 3 2 3
CHOH+HO=CO+3H;CO+H=CO+HO。
3 2 2 2 2 2 2
下列措施一定可以提高单位时间内H 产率的是 (填序号)。
2
A.升高温度 B.增大反应器中压强 C.使用甲醇水解的高效催化剂
③在“Cu0/Cu+双位点”催化作用下,CHOH与水反应的反应路径如图所示,在答题卡上
3
画出图中方框内中间体的结构: 。