文档内容
绝密★启用前
2023 年高考考前押题密卷【五省新高考】
化 学
(考试时间:50分钟 试卷满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 B 11 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5
K39 Ca 40 V 51 Mn 55 Fe 56 Cu 64 Pd 106 I 127 Pb 207
评卷人 得分
一、选择题:本题共7个小题,每小题6分。共42分,在每小题给出的四个选项
中,只有一项是符合题目要求的。
7.(原创)化学与生活、科技、社会发展息息相关。下列有关说法错误的是
A.《汉书》中“高奴县有洧水,可燃”,这里的“洧水”指的是石油。
B.“熬胆矾(CuSO ·5H O)铁釜,久之亦化为铜”,涉及的反应类型为置换反应。该过程为化学变化。
4 2
C.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
D.“凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之”中“瓦”的主要成分为硫酸盐
【答案】D
【详解】A.《汉书》中“高奴县有洧水,可燃”,这里的“洧水”指的是石油。
A正确;
B.“熬胆矾(CuSO ·5H O)铁釜,久之亦化为铜”,涉及的反应类型为置换反应。该过程为化学变化。B
4 2
正确;
C.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应C正确;
D.“凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之”中“瓦”的主要成分为硅酸盐,D错误;
故答案为:D。
8.(原创)设 为阿伏加德罗常数的值.下列说法正确的是
A. (标准状况)与水充分反应转移 电子
试卷第1页,共3页
学科网(北京)股份有限公司B. 2.3 g C HO中含有的C- H共价键数目一定为 0.3 N
2 6 A
C.标准状况下,11.2LCHCHOH中含有的分子数目为0.5N
3 2 A
D. 与足量的 反应转移的电子数约为
【答案】D
【详解】A.由于溶于水中的Cl 只有部分与HO反应,故 (标准状况)与水充分反应转移电子数目
2 2
小于 ,A错误;
B.2.3 g C HO的物质的量为0.05mol,C HO可以是甲醇也可以是二甲醚,两种分子中含有的C- H共价
2 6 2 6
键数目分别为5和6,则C-H共价键总数不一定为 0.3 N ,故B错误。
A
C.标准状况下,CHCHOH为液体,则11.2LCHCHOH的物质的量大于0.5mol,则含有的分子数目大于
3 2 3 2
0.5N ,C说法错误;
A
D.氯气与Fe反应生成氯化铁,Cl元素化合价从0降低到-1价,1mol氯气参与反应得2mol电子,则
与足量的 反应,氯气全部参与反应,则转移的电子数约为 ,故D正确,
故选D。
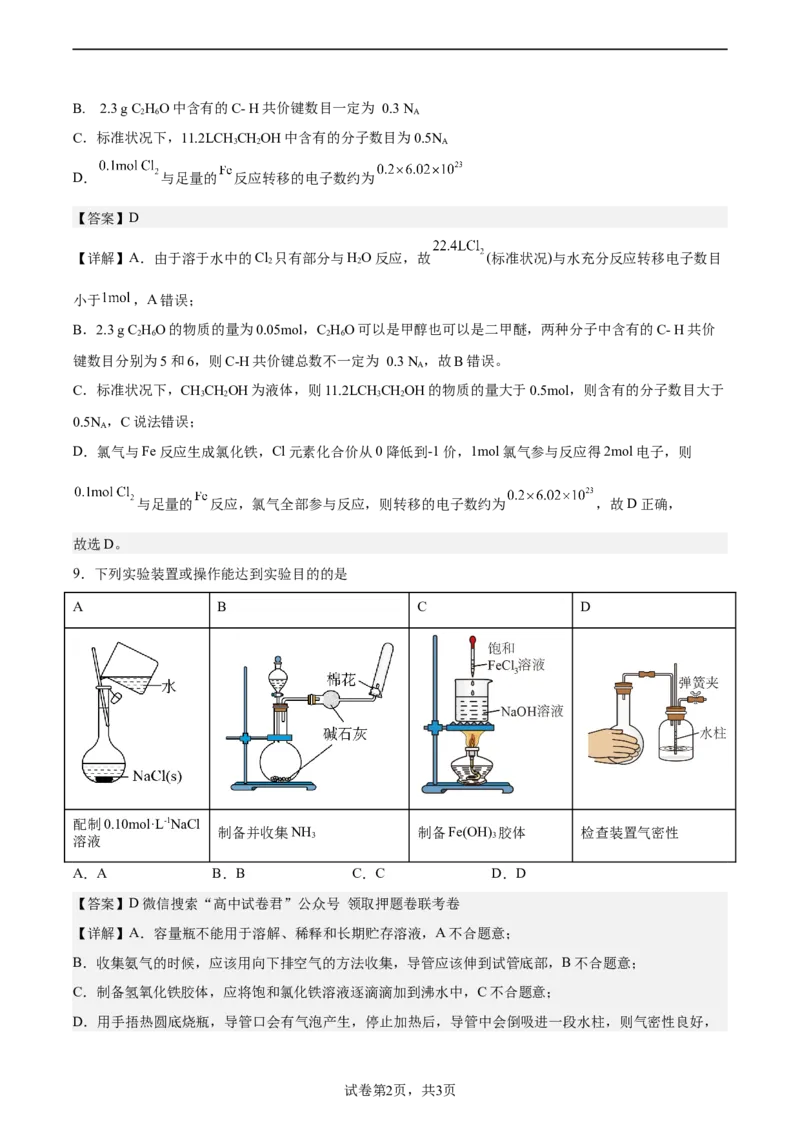
9.下列实验装置或操作能达到实验目的的是
A B C D
配制0.10mol·L-1NaCl
制备并收集NH 制备Fe(OH) 胶体 检查装置气密性
溶液 3 3
A.A B.B C.C D.D
【答案】D微信搜索“高中试卷君”公众号 领取押题卷联考卷
【详解】A.容量瓶不能用于溶解、稀释和长期贮存溶液,A不合题意;
B.收集氨气的时候,应该用向下排空气的方法收集,导管应该伸到试管底部,B不合题意;
C.制备氢氧化铁胶体,应将饱和氯化铁溶液逐滴滴加到沸水中,C不合题意;
D.用手捂热圆底烧瓶,导管口会有气泡产生,停止加热后,导管中会倒吸进一段水柱,则气密性良好,
试卷第2页,共3页D符合题意;
故选D。
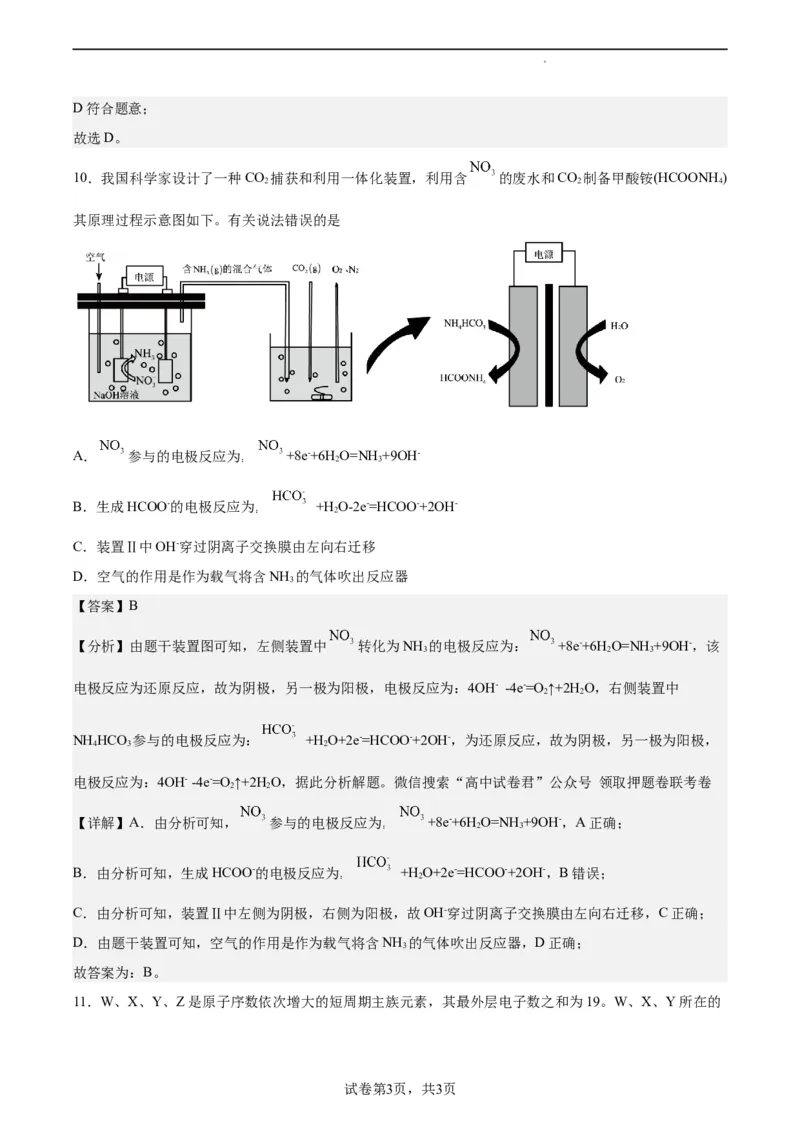
10.我国科学家设计了一种CO 捕获和利用一体化装置,利用含 的废水和CO 制备甲酸铵(HCOONH )
2 2 4
其原理过程示意图如下。有关说法错误的是
A. 参与的电极反应为 +8e-+6H O=NH +9OH-
: 2 3
B.生成HCOO-的电极反应为 +H O-2e-=HCOO-+2OH-
: 2
C.装置Ⅱ中OH-穿过阴离子交换膜由左向右迁移
D.空气的作用是作为载气将含NH 的气体吹出反应器
3
【答案】B
【分析】由题干装置图可知,左侧装置中 转化为NH 的电极反应为: +8e-+6H O=NH +9OH-,该
3 2 3
电极反应为还原反应,故为阴极,另一极为阳极,电极反应为:4OH- -4e-=O ↑+2H O,右侧装置中
2 2
NH HCO 参与的电极反应为: +H O+2e-=HCOO-+2OH-,为还原反应,故为阴极,另一极为阳极,
4 3 2
电极反应为:4OH- -4e-=O ↑+2H O,据此分析解题。微信搜索“高中试卷君”公众号 领取押题卷联考卷
2 2
【详解】A.由分析可知, 参与的电极反应为 +8e-+6H O=NH +9OH-,A正确;
: 2 3
B.由分析可知,生成HCOO-的电极反应为 +H O+2e-=HCOO-+2OH-,B错误;
: 2
C.由分析可知,装置Ⅱ中左侧为阴极,右侧为阳极,故OH-穿过阴离子交换膜由左向右迁移,C正确;
D.由题干装置可知,空气的作用是作为载气将含NH 的气体吹出反应器,D正确;
3
故答案为:B。
11.W、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19。W、X、Y所在的
试卷第3页,共3页
学科网(北京)股份有限公司族均不相邻,族序数按Y、W、X、Z的顺序依次增大。下列说法不正确的是
A.简单离子半径X>Y>Z
B.W的简单氢化物的沸点小于X的简单氢化物的沸点
C.W、X、Z可形成共价化合物
D.一定条件下,Y的单质能将W从WX 置换出来
2
【答案】A
【分析】根据“W、X、Y、Z是原子序数依次增大的短周期主族元素”与“W、X、Y所在的族均不相邻,
族序数按Y、W、X、Z的顺序依次增大”,根据“最外层电子数之和为19”,经枚举分析,四种元素所在
主族序数:Ⅱ、Ⅳ、Ⅵ、Ⅶ,因此W、X、Y、Z分别是碳、氧、镁、氯。
【详解】A.X、Y的简单离子分别是 、 ,具有相同的电子层结构,Z的简单离子是 ,比X、
Y多一个电子层,根据同一周期内的阴离子半径大于阳离子半径,电子层结构相同时,核电荷数大,离子
半径小,离子半径大小关系为:Z>X>Y,A错误;
B.W的简单氢化物是 ,X的简单氢化物是 , 分子间存在氢键, 分子间没有氢键,故
的沸点小于 ,B正确;
C.W、X、Z可形成共价化合物碳酰氯 ,C正确;
D.镁在二氧化碳中燃烧生成氧化镁和炭黑,D正确;
故选A。
12.硫元素的价类二维图如图所示。下列说法不正确的是
A.C可用于葡萄酒工业 B.F溶液久置于空气中会生成E,溶液的pH减小
C.A、C和D都可以通过单质间化合制得 D.E的浓溶液可用于干燥C但不能干燥A
【答案】C
试卷第4页,共3页【详解】A.C为二氧化硫,可用于葡萄酒中杀菌消毒,还能起抗氧化的作用,可用于葡萄酒工业,A正
确;
B.F溶液即HSO 溶液,久置于空气中会被氧化生成HSO ,亚硫酸是弱酸,硫酸是强酸,故溶液的pH
2 3 2 4
减小,B正确;
C.A、C、D分别是HS、SO 、SO ,氢气和S单质加热条件下反应生成HS,硫单质与氧气反应只能生
2 2 3 2
成二氧化硫,三氧化硫只能由二氧化硫在氧气中再次氧化而得到,故三氧化硫不能通过两种单质直接化合
生成,C错误;
D.E为HSO ,浓硫酸可以干燥二氧化硫但不能干燥硫化氢气体,二者会发生氧化还原反应,D正确;
2 4
故选C。
13. 是易溶二元弱碱( , ),常温下,向 溶液中通入 ,
溶液中 随 [ ]变化的曲线如图所示,下列说法错误的是
A. 溶液:
B.当 时,
C.水的电离程度:
D.当 时, 大于3.5
【答案】D
【详解】A. 是易溶二元弱碱,而BOH+的水解平衡常数 ,则说明
BOH+的水解程度大于电离程度,水解和电离都是微弱的,故 溶液:
试卷第5页,共3页
学科网(北京)股份有限公司,A正确;
B.当 时, , ,则 ,B正确;
C.向 溶液中通入 ,发生反应生成更多的B2+,B2+越多,水解程度越大,水的电离程
度越大,则水的电离程度: ,C正确;微信搜索“高中试卷君”公众号 领取押题卷联考卷
D. ,当 时, , ,则
, 小于3.5,D错误;
故选D。
评卷人 得分
二、非选择题:化学部分为第27-30题,共58分。
27.炭粉、CO、H 均可作为实验室还原CuO的还原剂,实验小组对CuO的还原反应及还原产物组成进行
2
探究。
查阅资料: PdCl 溶液能吸收CO,生成黑色Pd沉淀、一种氢化物和一种氧化物。
2
回答下列问题:
(1)铜元素的焰色试验呈绿色,下列三种波长为橙、黄、绿色对应的波长,则绿色对应的辐射波长为
___________。
A.577~492 nm B.597~577 nm C. 622~597 nm
(2)基态Cu+的价电子轨道表示式为___________。
(3)小组同学用如图所示装置探究炭粉与CuO反应的产物。
①实验结束后,打开开关K通氮气,其目的是___________。
②试剂X的作用为___________。
试卷第6页,共3页③若气体产物中含有CO,则观察到的现象为______, 其中反应的化学方程式为_______。
(4)某小组同学为测定炭粉还原CuO后固体混合物(仅有C和Cu O)两种杂质)中单质Cu的质量分数,设计
2
如下实验:准确称取反应管中残留固体8.000g,溶于足量稀硝酸(恰好使固体溶解达到最大值),过滤、洗
涤、干燥,所得沉淀的质量为0.160g;将洗涤液与滤液合并,配成500mL溶液;量取所配溶液25. 00
mL,加入适当过量的KI溶液;以淀粉为指示剂,用0.5000 mol· L-1 Na SO 标准溶液滴定,达到滴定终点
2 2 3
时,消耗标准溶液的体积为12. 00 mL。已知:2Cu2++5I-=2CuI↓ + , +2 = +3I-。
①还原后固体混合物中单质Cu的质量分数为___________%。
②若CuI吸附部分 ,会导致所测Cu单质的质量分数___________ (填“偏大”、“偏小”或“无影
响”)。
【答案】(1)A
(2)
(3) 将生成的气体赶出,使其被装置C、D吸收 检验是否有CO 生成 装置D中产生黑色沉
2
淀 PdCl +CO+ H O=Pd↓+CO +2HCl
2 2 2
(4) 80 偏小
【分析】本实验的目的是探究CuO与碳的混合物高温条件下反应的产物,题给信息显示,产物中含有
Cu、Cu O、CO,可用澄清石灰水检验CO 的存在,用PdCl 氧化CO从而除去CO气体,再用NaOH吸收
2 2 2 2
反应生成的CO 等。固体产物可先用硝酸溶解,再用KI还原、NaSO 标准溶液滴定,从而确定固体产物
2 2 2 3
的组成,以此解答。
【详解】(1)绿色波长介于577~492 nm之间,故选B。
(2)基态Cu原子核外有4个电子层,价电子排布式为3d104s1,Cu原子失去1个电子生成Cu+,Cu+的价电
子排布式为3d10,轨道表示式为 。
(3)①实验结束后,打开开关K通氮气,其目的是将生成的气体赶出,使其被装置C、D吸收;
②为判断反应是否发生,需检验产物CO 的存在,所以试剂X为澄清石灰水,作用为检验是否有CO 生成;
2 2
③试剂Y为PdCl 溶液,它能将CO氧化为CO,同时自身被还原为黑色的Pd,所以若气体产物中含有
2 2
CO,则观察到的现象为D瓶中产生黑色沉淀;其中反应的化学方程式为PdCl +CO+ H O=Pd↓+CO
2 2 2
试卷第7页,共3页
学科网(北京)股份有限公司+2HCl。
(4)①硝酸有强氧化性,加入稀硝酸后,铜及铜的氧化物均被稀硝酸溶解生成硝酸铜,但碳不能溶于稀
硝酸,则0.16g固体为过量的碳的质量,从而得出含Cu和Cu O的总质量为8.000g-0.160g=7.84g;已知:
2
2Cu2++5I-=2CuI↓ + , +2 = +3I-,可建立如下关系式:Cu2+~ ,达到滴定终点时,消耗
标准溶液的体积为12. 00 mL,则样品中含铜元素的物质的量为 =0.12mol,假
设样品中Cu的物质的量为xmol,Cu O的物质的量为ymol,则144y+64x=7.84,x+2y=0.12,解得x=0.1,
2
y=0.01,还原后固体混合物中单质Cu的质量分数为 =80%;
②若CuI吸附部分 ,会导致所用NaSO 标准溶液的体积小,铜元素的质量偏小,产品中氧元素的含量
2 2 3
偏大,Cu O的含量偏高,Cu单质的含量偏小,所测Cu单质的质量分数偏小。
2
28.煤的间接液化是先把煤转化为一氧化碳和氢气,再在催化剂作用下合成甲醇等
(1)已知反应:①
②
③
则反应③的 _______ 。
(2)在 时,向体积为 的一个刚性容器中加入一定量的 和 ,只发生下列反应:
、 ,达平衡时测得
,则平衡时 _______ (用含a、b、c的代数式表示)。
(3)已知:在一定条件下可发生反应:
试卷第8页,共3页①下列说法正确的是_______。
A.使用高效催化剂可以加快化学反应速率,提高 和 的平衡转化率
B. 时说明反应已经达到化学平衡状态
C.升高温度,化学反应速率加快,说明该反应的正反应是吸热反应
D.恒温恒容下,向平衡体系中再充入适量的 ,平衡正向移动,平衡常数不变
E.恒温恒容下,再加入氨气压强增大可以提高 和 的平衡转化率
②已知:催化剂并不是所有部位都有催化作用,真正起催化作用的那些部位称为活性点位,也称活性中心。
恒温恒容条件下发生反应 ,若 不变时, 过多,反应速率减
慢,可能的原因是_______。
③若一定温度范围内该反应的化学平衡常数为K, 与 (温度的倒数)的关系如图所示:则
_______0(填“大于”或“小于”)
④ 时,在体积为 的刚性容器充入 和 合成甲醇,假设只发生反应:
,5分钟末达到平衡,测得 的体积分数为 ,求5分钟内的
平均反应速率 _______ , 的平衡转化率为_______。
⑤ 的沸点由高到低的顺序是_______,原因是_______。
【答案】(1)+131.3
(2) mol
试卷第9页,共3页
学科网(北京)股份有限公司(3) D 过多的 占用活性点位过多,使反应速率减慢 小于 0.1 50%
、 、 均为分子晶体,甲醇分子间存在氢键沸点最高: 为极性分
子并且相对分子质量大于 ,分子间作用力大于 ,故 沸点比 高
【详解】(1)已知:①
②
根据盖斯定律,由① -② 得反应③
则反应③的 +131.3 ;
(2)令碳与水反应生成的氢气的物质的量为xmol,则生成的CO为xmol,令CO与水反应生成氢气的物
质的量为ymol,则生成的二氧化碳的物质的量为ymol,消耗的CO的物质的量为ymol,平衡时氢气的物
质的量为bmol,则xmol + ymol = bmol,平衡时CO的物质的量为cmol,则xmol - ymol = cmol,联立解得
x = ,y= ,故CO 的物质的量为y= mol;
2
(3)①A.使用高效催化剂可以加快化学反应速率,但催化剂不能使平衡移动,故 和 的平衡转化率
不变,选项A错误;
B. 才能体现正逆反应速率相等,而 时正逆反应速率不相等,
反应没有达到化学平衡状态,选项B错误;
C. 温度升高,分子活化能降低,活化分子的百分数增加,单位体积内活化分子碰撞的有效次数增加,反
应速率加快,不能说明该反应的正反应是吸热反应,选项C错误;
D.恒温恒容下,向平衡体系中再充入适量的 ,平衡正向移动,但温度不变,平衡常数不变,选项D正
确;
E.恒温恒容下,再加入氨气压强增大但反应物的浓度均不变, 和 的平衡转化率均不变,选项E错误;
试卷第10页,共3页答案选D;
②恒温恒容条件下发生反应 ,若 不变时, 过多,过多的 占
用活性点位过多,使反应速率减慢,反应速率减慢;
③根据图中曲线可知,随着 增大, 增大,即温度降低,K值增大,故该反应的正反应为放热反应,
小于0;
④设 的平衡转化率为x,根据三段式可知:
5分钟末达到平衡,测得 的体积分数为 ,则 ,解得
x=50%,5分钟内的平均反应速率 0.1 ;
⑤ 、 、 均为分子晶体,甲醇分子间存在氢键沸点最高: 为极性分子并且相对分子质量大
于 ,分子间作用力大于 ,故 沸点比 高,故 的沸点由高到低的顺序是
。微信搜索“高中试卷君”公众号 领取押题卷联考卷
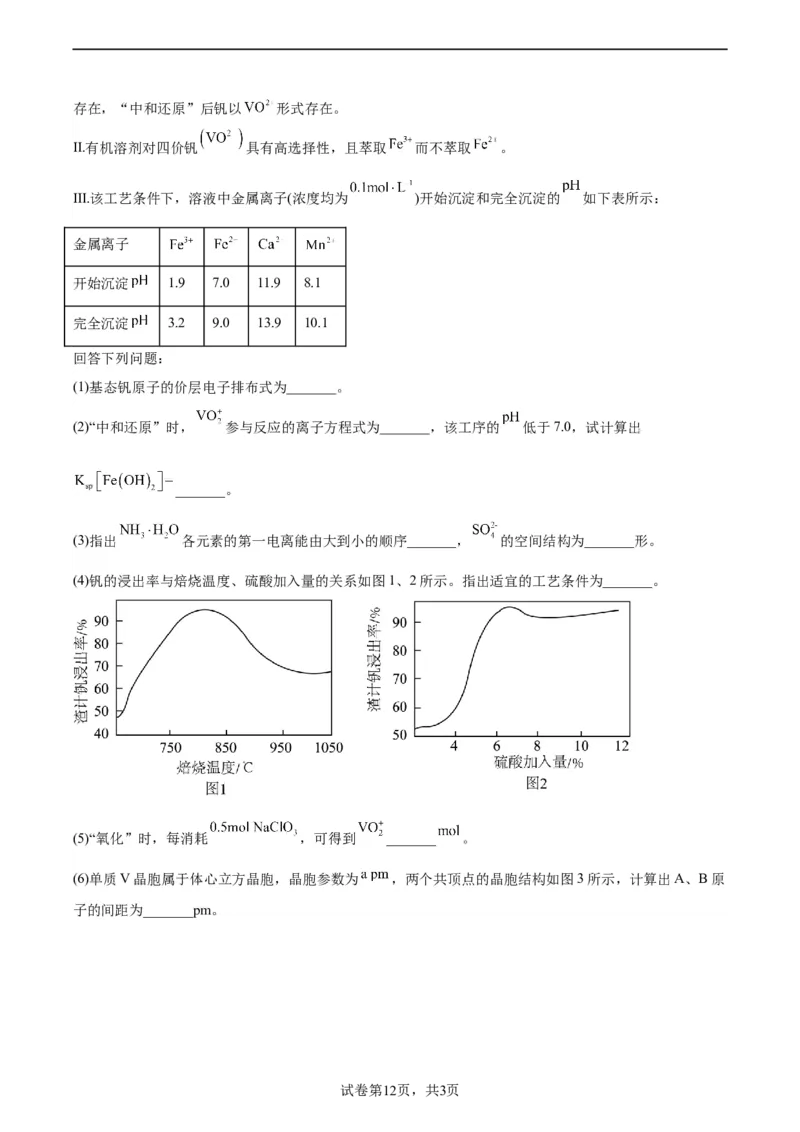
29. 广泛用于冶金、化工等行业,主要用于冶炼钒铁。以钒矿石为原料制备 的工艺如下:
已知:
I.“焙烧”后,固体中主要含有 、 、 、 ;“酸浸”后钒以 形式
试卷第11页,共3页
学科网(北京)股份有限公司存在,“中和还原”后钒以 形式存在。
Ⅱ.有机溶剂对四价钒 具有高选择性,且萃取 而不萃取 。
Ⅲ.该工艺条件下,溶液中金属离子(浓度均为 )开始沉淀和完全沉淀的 如下表所示:
金属离子
开始沉淀 1.9 7.0 11.9 8.1
完全沉淀 3.2 9.0 13.9 10.1
回答下列问题:
(1)基态钒原子的价层电子排布式为_______。
(2)“中和还原”时, 参与反应的离子方程式为_______,该工序的 低于7.0,试计算出
_______。
(3)指出 各元素的第一电离能由大到小的顺序_______, 的空间结构为_______形。
(4)钒的浸出率与焙烧温度、硫酸加入量的关系如图1、2所示。指出适宜的工艺条件为_______。
(5)“氧化”时,每消耗 ,可得到 _______ 。
(6)单质V晶胞属于体心立方晶胞,晶胞参数为 ,两个共顶点的晶胞结构如图3所示,计算出A、B原
子的间距为_______pm。
试卷第12页,共3页答案:(1)
(2)
(3) N、O、H 正四面体
(4)温度:820℃左右(800~830均可) 硫酸加入量:6%(6~6.5均可)
(5)3
(6)
【详解】(1)V是23号元素,核外有23个电子,基态V原子的核外电子排布式为1s22s22p63s23p63d34s2,
则其价层电子排布式为3d34s2。
(2)根据题给信息,“中和还原”后钒以 形式存在,则“中和还原”时, 被还原为 ,Fe
为还原剂,反应的离子方程式为 ;由表格数据可知, 在
时开始沉淀,则 。
(3) 所含元素为N、O和H,同周期元素从左至右,第一电离能呈增大趋势,但N原子2p能级
轨道半充满,比较稳定,其第一电离能大于相邻原子,则第一电离能由大到小的顺序为N、O、H;
中心S原子价层电子对数= ,则中心S原子为sp3杂化,其空间结构为正四面体形。
(4)由图1可知,焙烧温度在820℃左右时浸出率最高,由图2可知,硫酸加入量为6%时浸出率最高,
试卷第13页,共3页
学科网(北京)股份有限公司则最适宜的工艺条件为:温度:820℃左右、硫酸加入量:6%。
(5)“氧化”时, 转化为 ,根据得失电子守恒可得关系式 ,则每消耗
,可得到3mol 。
(6)由图可知,A、B原子的间距等于晶胞体对角线长度,晶胞参数为 ,则间距为 pm。
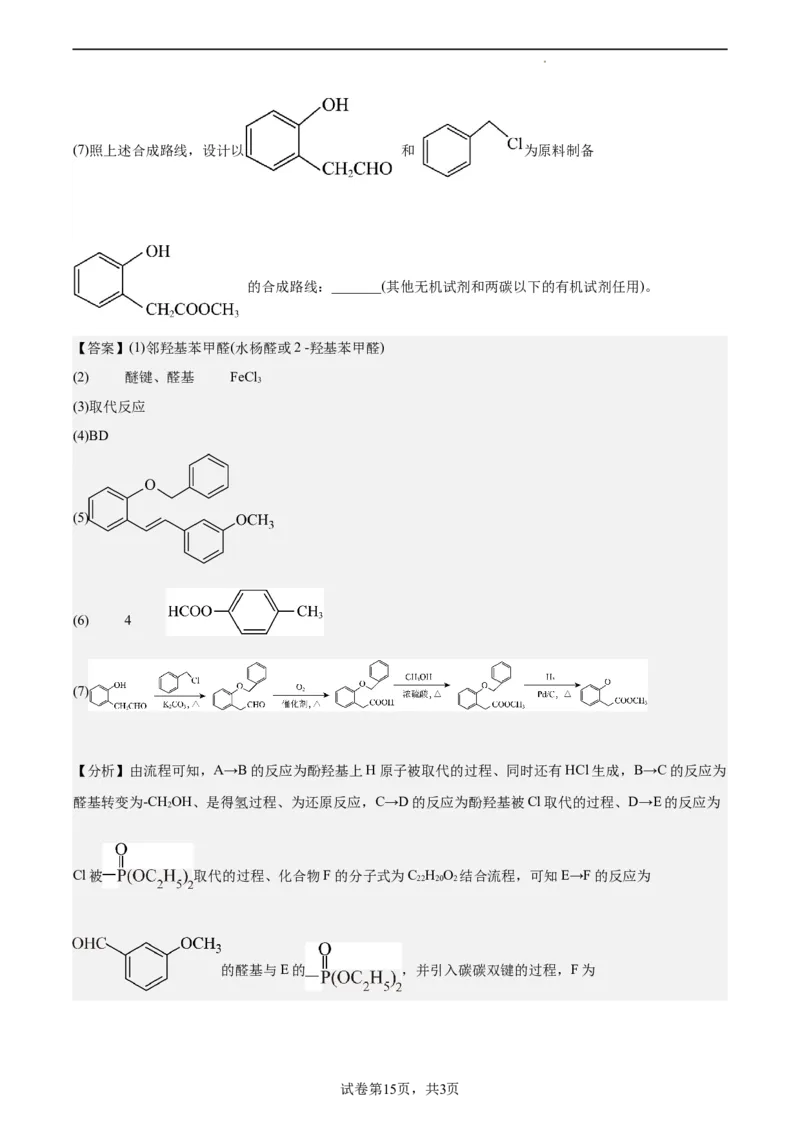
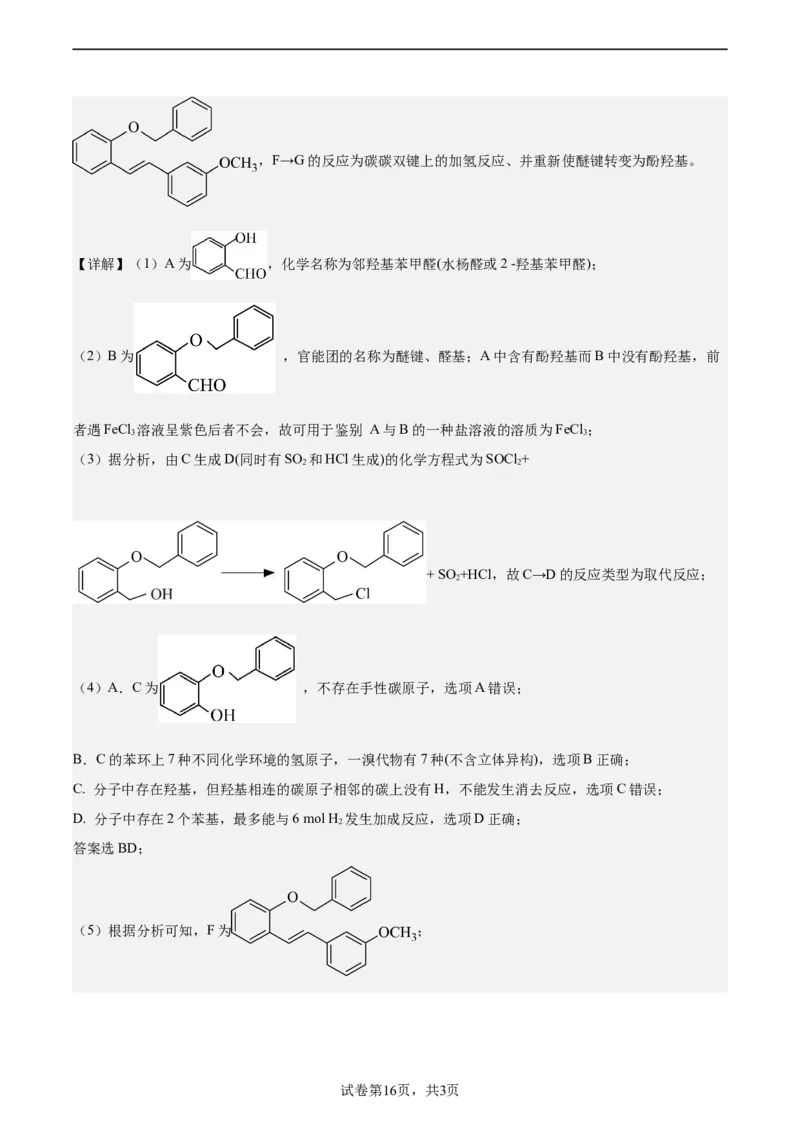
30.化合物G是合成药物盐酸沙格雷酯的重要中间体,其合成路线如下:
回答下列问题:
(1)A的化学名称为_______(-OH为取代基)。
(2)B中官能团的名称为_______ ;可用于鉴别 A与B的一种盐溶液的溶质为_______(填化学式)。
(3)C→D的反应类型为_______。
(4)下列关于C的相关说法正确的是_______(填字母)。
A.分子中含有手性碳原子
B.苯环上一溴代物有7种(不含立体异构)
C.能发生消去反应
D.最多能与6 mol H 发生加成反应
2
(5)已知F的分子式为C H O,其结构简式为_______。
22 20 2
(6)能发生银镜反应和水解反应的 的芳香化合物的同分异构体有___种(不含立体
异构) ,写出核磁共振氢谱有4组峰,且峰面积之比为3: 2: 2: 1的结构简式:____。
试卷第14页,共3页(7)照上述合成路线,设计以 和 为原料制备
的合成路线:_______(其他无机试剂和两碳以下的有机试剂任用)。
【答案】(1)邻羟基苯甲醛(水杨醛或2 -羟基苯甲醛)
(2) 醚键、醛基 FeCl
3
(3)取代反应
(4)BD
(5)
(6) 4
(7)
【分析】由流程可知,A→B的反应为酚羟基上H原子被取代的过程、同时还有HCl生成,B→C的反应为
醛基转变为-CHOH、是得氢过程、为还原反应,C→D的反应为酚羟基被Cl取代的过程、D→E的反应为
2
Cl被 取代的过程、化合物F的分子式为C H O 结合流程,可知E→F的反应为
22 20 2
的醛基与E的 ,并引入碳碳双键的过程,F为
试卷第15页,共3页
学科网(北京)股份有限公司,F→G的反应为碳碳双键上的加氢反应、并重新使醚键转变为酚羟基。
【详解】(1)A为 ,化学名称为邻羟基苯甲醛(水杨醛或2 -羟基苯甲醛);
(2)B为 ,官能团的名称为醚键、醛基;A中含有酚羟基而B中没有酚羟基,前
者遇FeCl 溶液呈紫色后者不会,故可用于鉴别 A与B的一种盐溶液的溶质为FeCl ;
3 3
(3)据分析,由C生成D(同时有SO 和HCl生成)的化学方程式为SOCl +
2 2
+ SO +HCl,故C→D的反应类型为取代反应;
2
(4)A.C为 ,不存在手性碳原子,选项A错误;
B.C的苯环上7种不同化学环境的氢原子,一溴代物有7种(不含立体异构),选项B正确;
C. 分子中存在羟基,但羟基相连的碳原子相邻的碳上没有H,不能发生消去反应,选项C错误;
D. 分子中存在2个苯基,最多能与6 mol H 发生加成反应,选项D正确;
2
答案选BD;
(5)根据分析可知,F为 ;
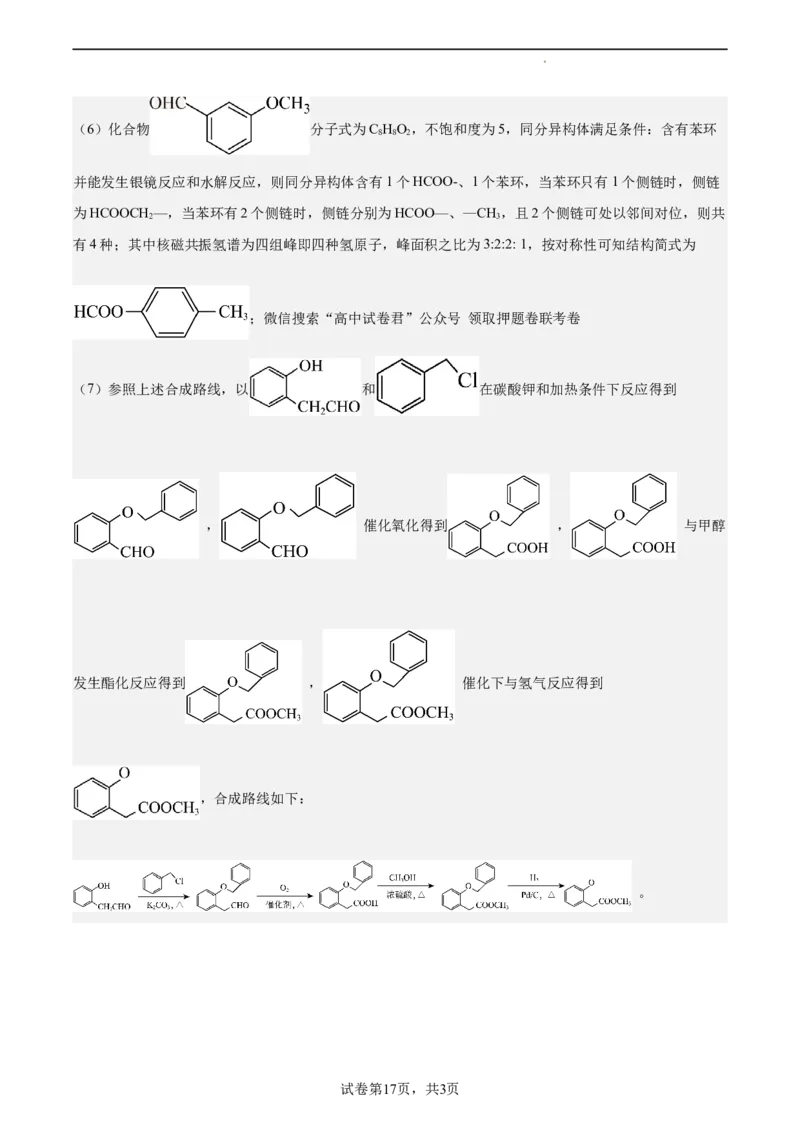
试卷第16页,共3页(6)化合物 分子式为C HO,不饱和度为5,同分异构体满足条件:含有苯环
8 8 2
并能发生银镜反应和水解反应,则同分异构体含有1个HCOO-、1个苯环,当苯环只有1个侧链时,侧链
为HCOOCH —,当苯环有2个侧链时,侧链分别为HCOO—、—CH,且2个侧链可处以邻间对位,则共
2 3
有4种;其中核磁共振氢谱为四组峰即四种氢原子,峰面积之比为3:2:2: 1,按对称性可知结构简式为
;微信搜索“高中试卷君”公众号 领取押题卷联考卷
(7)参照上述合成路线,以 和 在碳酸钾和加热条件下反应得到
, 催化氧化得到 , 与甲醇
发生酯化反应得到 , 催化下与氢气反应得到
,合成路线如下:
。
试卷第17页,共3页
学科网(北京)股份有限公司试卷第18页,共3页