文档内容
… … … …
… … … …
… … … …
○ … ○ …
2024-2025 学年高一化学上学期期中模拟卷 (3)在胶体中加入电解质溶液或带有相反电荷的胶体粒子能使胶体粒子沉淀出来。丁同学利用制得的
… … … …
…
… … … … Fe(OH) 胶体进行下列实验:
学 校 3
… … (考试时间:60分钟 试卷满分:100分)
_____ ①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的液体颜色逐渐变
外 … 内 …
… … _____ … … 注意事项: 深,这表明Fe(OH) 胶体微粒带 (填“正”或“负”)电荷。
____ 3
… … … …
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
… 姓 名 … ②实验证明,电解质的凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚
_____
○ … ○ … 2.选出小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选
力越大。向Fe(OH) 胶体加入下列电解质时,其凝聚能力最强的为 。
_____ 3
… … … …
… … ___ 班 … … 涂其他答案标号。写在本试卷上无效。 A.NaCl B.FeCl C.KSO D.NaPO
3 2 4 3 4
级 :
… … 3.回答时,将答案写在答题卡上。写在本试卷上无效。
_____ (4)2023年11月21日晚第十二届广州国际灯光节亮灯,光影作品透过云层展示广州绚丽的城市夜景
装 … 装 …
_____ 4.测试范围:第1~2章(沪科版2020)。
… … … … 与文化魅力。下列说法正确的是 。
… …_____ … … 5.难度系数:0.60。
… 考 号 … A.这些光柱都源于丁达尔效应
○ …_____ ○ … 6.考试结束后,将本试卷和答题卡一并交回。
B.夜空中云层的分散质粒子的直径大于100nm
… …_____ … …
可能用到的相对原子质量:H1 C12 N14 O16 Na23 Mg24 Al27 S32 Cl35.5
… …_____ … … C.将NaOH溶液滴入饱和FeCl 溶液可制得液溶胶
3
… _____ … 一、阿伏伽德罗定律及其应用(16 分)
订 …__ 订 … D.“纳米级”NaCl放入水中所得分散系也能产生丁达尔效应
…
…
…
…
…
…
…
…
1.I.用N
A
表示阿伏加德罗常数的值,按要求填空: (5)可用如图所示的装置除去Fe(OH)
3
胶体中的杂质离子来提纯Fe(OH)
3
胶体,实验过程中需不断更换烧
… … (1)在标准状况下,①6.72LCH 4 ;②3.01×1023个HCl分子;③13.6gH 2 S;④0.2molNH 3 。下列关系表达 杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入AgNO 3 溶液,若
○ … ○ …
… … … … 正确的是 。 (填实验现象),则说明该Fe(OH) 3 胶体中的杂质离子已经完全除去。
… … … … a.体积②>①>③>④ b.密度②>③>④>①
… …
线 … 线 …
c.质量②>①>③>④ d.氢原子个数①>③>④>②
… … … …
(2)8.4gN 与9.6gR 的分子数目之比为3:2,原子数目相同。则:9.6gR 的物质的量为 mol。x值
… … … … 2 x x
… … 为 ,R的相对原子质量是 。
○ … ○ …
II.同温同压下,100mLX 气体与50mLY 气体恰好完全反应,得到100mLZ气体。
… … … … 2 2 三、实验室配制一定物质的量浓度的氢氧化钠溶液(16 分)
… … … … (3)Z的化学式为 。
… …
3.实验室用固体烧碱配制500mL0.10mol·L-1的NaOH溶液。
III.
(1)需称量 g的烧碱固体,固体应该放在 中称量。
(4)将2.3钠投入足量水中,完全反应。冷却到标准状况,得到 L气体。
(2)配制过程中,一定不需要使用的仪器是 (填写代号)。
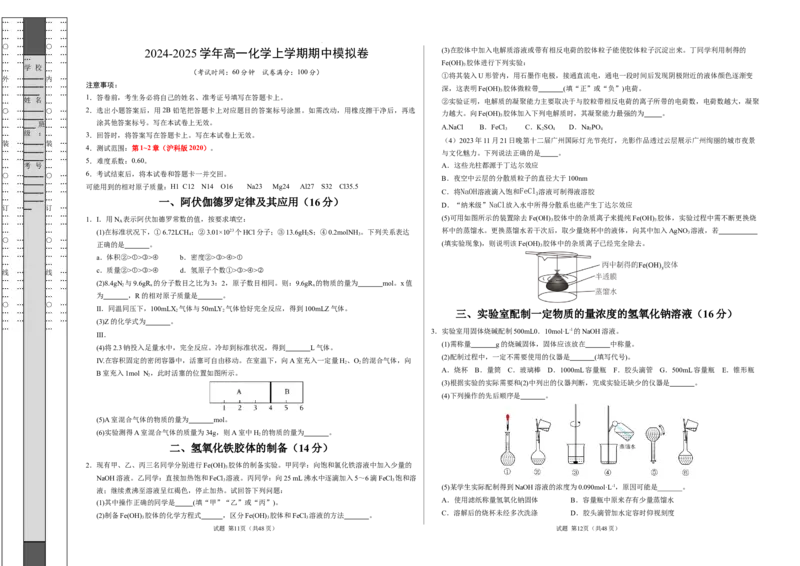
IV.在容积固定的密闭容器中,活塞可自由移动。在室温下,向A室充入一定量H、O 的混合气体,向
2 2
A.烧杯 B.量筒 C.玻璃棒 D.1000mL容量瓶 F.胶头滴管 G.500mL容量瓶 E.锥形瓶
B室充入1mol N,此时活塞的位置如图所示。
2
(3)根据实验的实际需要和(2)中列出的仪器判断,完成实验还缺少的仪器是 。
(4)下列操作的先后顺序是 。
(5)A室混合气体的物质的量为 mol。
(6)实验测得A室混合气体的质量为34g,则A室中H 的物质的量为 。
2
二、氢氧化铁胶体的制备(14 分)
2.现有甲、乙、丙三名同学分别进行Fe(OH) 胶体的制备实验。甲同学:向饱和氯化铁溶液中加入少量的
3
NaOH溶液。乙同学:直接加热饱和FeCl 溶液。丙同学:向25 mL沸水中逐滴加入5~6滴FeCl 饱和溶
3 3
(5)某学生实际配制得到NaOH溶液的浓度为0.090mol·L-1,原因可能是_______。
液;继续煮沸至溶液呈红褐色,停止加热。试回答下列问题:
A.使用滤纸称量氢氧化钠固体 B.容量瓶中原来存有少量蒸馏水
(1)其中操作正确的同学是 (填“甲”“乙”或“丙”)。
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时仰视刻度
(2)制备Fe(OH) 胶体的化学方程式 ,区分Fe(OH) 胶体和FeCl 溶液的方法 。
3 3 3
试题 第11页(共48页) 试题 第12页(共48页)
学科网(北京)股份有限公司… … … …
… … … …
… … … …
○ … ○ …
… … … …
… … … …
… …
外 … 内 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
装 … 装 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
订 … 订 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
线 … 线 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
… … … …
… … … …
… … … …
(6)下图是我校化学实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。求该浓硫酸的物质的量浓 B.m g即是锥形瓶的质量 ○ … ○ …
1
… … … …
度。(要求写出简要计算过程) C.对E进行称量时,应缓缓取出导管,再塞上橡胶塞至标记处,称量 … … … …
此
… …
D.通过对E反复称量,对比质量的变化,即可判断CO
2
是否集满
内 …
卷
外 …
只
(5)通过向锥形瓶装水至橡胶塞塞至的标记处,用托盘天平称量,质量(水+瓶+塞子):m
3
g,此时,水 …
…
…
… 装
…
…
…
…
订
的质量远大于空气,可测定锥形瓶的体积:V = mL.若体积折算成标准状况,则M (CO )= … …
r 2 不
○ … ○ …
密
(用m 、m 、m 的计算式表示,无需化简)。 … … … …
1 2 3 封
… … … …
五、氯元素的“价-类”二维图(24 分) … …
装 … 装 …
5.“价-类”二维图是以元素为核心,从物质类别和化合价两个角度认识物质的性质及其转化关系,下图是 … … … …
… … … …
四、利用相对密度法测定CO
2
的相对分子质量(16 分)
含氯元素的价类二维图,试讨论以下问题: … …
○ … ○ …
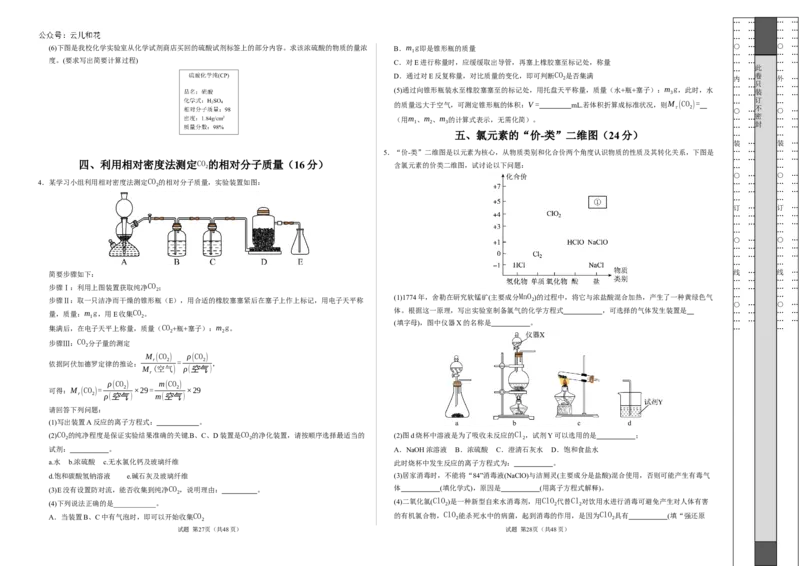
4.某学习小组利用相对密度法测定CO 的相对分子质量,实验装置如图: … … … …
2
… … … …
… …
订 … 订 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
简要步骤如下: 线 … 线 …
… … … …
步骤Ⅰ:利用上图装置获取纯净CO 2 ; … … … …
(1)1774年,舍勒在研究软锰矿(主要成分MnO )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气 … …
步骤Ⅱ:取一只洁净而干燥的锥形瓶(E),用合适的橡胶塞塞紧后在塞子上作上标记,用电子天平称 2
○ … ○ …
量,质量:m g,用E收集CO 。 体。根据这一原理,写出实验室制备氯气的化学方程式 ,可选择的气体发生装置是 … … … …
1 2
(填字母),图中仪器X的名称是 。 … … … …
集满后,在电子天平上称量,质量(CO +瓶+塞子):m g。 … …
2 2
步骤Ⅲ:CO 分子量的测定
2
M (CO ) ρ(CO )
依据阿伏加德罗定律的推论: r 2 = 2 ,
M (空气) ρ(空气)
r
ρ(CO ) m(CO )
可得:M (CO )= 2 ×29= 2 ×29
r 2 ρ(空气) m(空气)
请回答下列问题:
(1)写出装置A反应的离子方程式: 。
(2)CO 的纯净程度是保证实验结果准确的关键.B、C、D装置是CO 的净化装置,请按顺序选择最适当的 (2)图d烧杯中溶液是为了吸收未反应的Cl ,试剂Y可以选用的是 ;
2 2 2
试剂: 。 A.NaOH浓溶液 B.浓硫酸 C.澄清石灰水 D.饱和食盐水
a.水 b.浓硫酸 c.无水氯化钙及玻璃纤维 此时烧杯中发生反应的离子方程式为: 。
d.饱和碳酸氢钠溶液 e.碱石灰及玻璃纤维 (3)居家消毒时,不能将“84”消毒液(NaClO)与洁厕灵(主要成分是盐酸)混合使用,否则可能产生有毒气
(3)E没有设置防对流,能否收集到纯净CO ,说明理由: 。 体 (填化学式),原因是 (用离子方程式解释)。
2
(4)下列说法正确的是____________。 (4)二氧化氯( ClO 2 )是一种新型自来水消毒剂,用ClO 2 代替Cl 2 对饮用水进行消毒可避免产生对人体有害
A.当装置B、C中有气泡时,即可以开始收集CO
2
的有机氯合物,ClO
2
能杀死水中的病菌,起到消毒的作用,是因为ClO
2
具有 (填“强还原
试题 第27页(共48页) 试题 第28页(共48页)… … … …
… … … …
… … … …
○ … ○ …
… … … …
… … … …
… …
内 … 外 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
装 … 装 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
订 … 订 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
线 … 线 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
… … … …
… … … …
… … … …
○ … ○ …
… … … … 性”或“强氧化性”)。 查阅资料:I−+I 2 ⇌ I− 3 ,I− 3 在溶液中显棕黄色,能使淀粉变蓝色;碘单质可以被氯气氧化为ICl− 2 (红色)
…
… …
学 校
… … (5)二维图中物质①常用于实验室制取O
2
,则①的化学式是 ;该物质充分反应后,分离实验 和ICl−
(黄色)。
… … 4
外 … _____ 内 … 所得混合物的方法和步骤如下,请补充完整:先在盛有混合粉末的烧杯中加入适量的水溶解;然后
_____
…
…
…
… ____
…
…
…
…
、洗涤、干燥,得到MnO
2
;将所得溶液 、 ,即得到KCl固体(提示:KCl的溶 实验操作 实验现象
姓 名
… … 解度受温度的影响变化比较大)。 Ⅰ.取反应后B中的溶液10mL,分成两等份,第一份滴入 第一份溶液变蓝色;第二份溶液颜色没有变
_____
○ … ○ … 1滴碘水;第二份滴入1滴淀粉溶液 化
… …
_____
… …
六、实验室设计实验探究I−(14 分)
___ 班
… … … …
级 :
Ⅱ.另取1mL碘水,滴加1滴淀粉溶液 溶液变蓝色
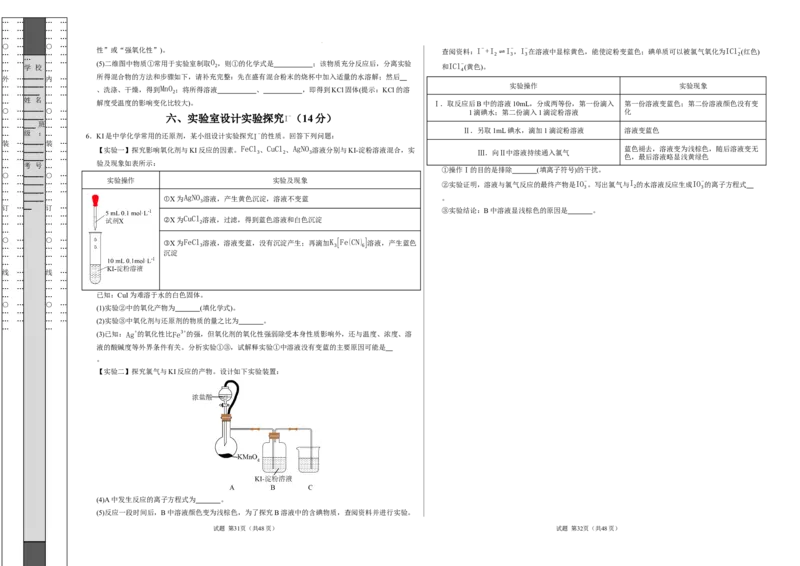
… … 6.KI是中学化学常用的还原剂,某小组设计实验探究I−的性质。回答下列问题:
_____
装 … 装 …
… … _____ … … 【实验一】探究影响氧化剂与KI反应的因素。FeCl 3 、CuCl 2 、AgNO 3 溶液分别与KI-淀粉溶液混合,实 Ⅲ.向Ⅱ中溶液持续通入氯气 蓝色褪去,溶液变为浅棕色,随后溶液变无
… …_____ … … 色,最后溶液略显浅黄绿色
验及现象如表所示:
… 考 号 …
①操作Ⅰ的目的是排除 (填离子符号)的干扰。
○ …_____ ○ …
… …_____ … … 实验操作 实验及现象 ②实验证明,溶液与氯气反应的最终产物是IO− 。写出氯气与I 的水溶液反应生成IO− 的离子方程式
… …_____ … … 3 2 3
… _____ … ①X为AgNO 溶液,产生黄色沉淀,溶液不变蓝 。
3
订 …__ 订 …
③实验结论:B中溶液显浅棕色的原因是 。
… … … …
②X为CuCl 溶液,过滤,得到蓝色溶液和白色沉淀
… … … … 2
… …
○ … ○ … ③X为FeCl 溶液,溶液变蓝,没有沉淀产生;再滴加K [Fe(CN) ]溶液,产生蓝色
… … … … 3 3 6
沉淀
… … … …
… …
线 … 线 …
… … … …
… … … …
… … 已知:CuI为难溶于水的白色固体。
○ … ○ …
(1)实验②中的氧化产物为 (填化学式)。
… … … …
… … … … (2)实验③中氧化剂与还原剂的物质的量之比为 。
… …
(3)已知:Ag+的氧化性比Fe3+的强,但氧化剂的氧化性强弱除受本身性质影响外,还与温度、浓度、溶
液的酸碱度等外界条件有关。分析实验①③,试解释实验①中溶液没有变蓝的主要原因可能是
。
【实验二】探究氯气与KI反应的产物。设计如下实验装置:
(4)A中发生反应的离子方程式为 。
(5)反应一段时间后,B中溶液颜色变为浅棕色,为了探究B溶液中的含碘物质,查阅资料并进行实验。
试题 第31页(共48页) 试题 第32页(共48页)
学科网(北京)股份有限公司