文档内容
2024-2025 学年高一化学上学期期中模拟卷
(考试时间:90分钟 试卷满分:100分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证
号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
4.测试范围:第1章~第2章(鲁科版2019必修第一册)。
5.难度系数:0.65
6.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5
第Ⅰ卷(选择题 共 40 分)
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.下列关于物质分类的叙述中,不正确的是
A.硫酸属于酸 B.纯碱属于碱
C.SO 属于酸性氧化物 D.NaHCO 属于盐
2 3
【答案】B
【解析】A.硫酸在水中电离出的阳离子只有氢离子,属于酸,A项正确;
B.纯碱是碳酸钠,由金属阳离子和酸根阴离子构成,属于盐类,B项错误;
C.SO 和碱反应只生成盐和水,属于酸性氧化物,C项正确;
2
D.NaHCO 由金属阳离子和酸根阴离子构成,属于盐类,D项正确;
3
故选B。
2.下列关于分散系的说法中,不正确的是
A.分散系的稳定性:溶液>胶体>浊液
B.分散质粒子的大小:溶液>胶体>浊液
C.利用丁达尔效应可以区分溶液与胶体
D.Fe(OH) 胶体的分散质能透过滤纸
3
【答案】B
【解析】A.溶液均一稳定,胶体具有介稳定性,浊液不能稳定存在,所以分散系的稳定性比较:溶液>
胶体>浊液,故A正确;
B.溶液、胶体、浊液的本质区别是分散质粒子的直径,胶体粒子的微粒直径在1-100nm之间,分散质微
粒直径小于1nm的是溶液,大于100nm的是浊液, 则分散质粒子的大小:浊液>胶体>溶液,故B错
误;
学科网(北京)股份有限公司 学科网(北京)股份有限公司C.胶体有丁达尔效应,溶液没有,故利用丁达尔效应可以区分溶液和胶体,故C正确;
D.胶体和溶液都能透过滤纸,所以Fe(OH) 胶体的分散质能透过滤纸故,故D正确;
3
故符合题意的为B选项。
3.氯化镁是一种盐。下列途径,不能得到氯化镁的是
A.金属单质与非金属单质反应 B.酸性氧化物与碱反应
C.酸与碱发生中和反应 D.金属与酸反应
【答案】B
【解析】A. ,A不符合题意;
B.酸性氧化物与碱反应不能得到氯化镁,B符合题意;
C.2HCl+Mg(OH) =MgCl +2H O,C不符合题意;
2 2 2
D. ,D不符合题意;
故答案为:B。
4.下列物质在水溶液中的电离方程式书写正确的是
A. B.
C. D.
【答案】A
【解析】A.NaHSO 的电离方程式为: ,A正确;
4
B.Ba(OH) 的电离方程式为: ,B错误;
2
C.FeCl 的电离方程式为: ,C错误;
3
D.HCO 是多元弱酸,故NaHCO 的电离方程式为: ,D错误;
2 3 3
故答案为:A。
5.下列有关金属钠及其化合物的叙述中,正确的是
A.金属钠硬度大、熔点高
B.钠具有强还原性,可用于冶炼金属钛
C.钠在空气中久置表面会变暗,是因为生成了过氧化钠
D.氧化钠可用于为潜水艇供氧
【答案】B
【解析】A.钠硬度小,熔点低,故A错误;
B.钠原子最外层1个电子,易失去电子达到稳定结构,具有强的还原性,所以可用于冶炼金属钛,故B
正确;
C.钠与氧气常温反应生成氧化钠,加热才生成过氧化钠,故C错误;
D.过氧化钠与水、二氧化碳反应都生成氧气,所以过氧化钠可用于供氧剂,氧化钠不具有此性质,故D
错误;
学科网(北京)股份有限公司 学科网(北京)股份有限公司故选:B。
6.如图装置用来检验氯气的部分性质,下列说法不正确的是
A.装置A的作用是除去氯气中的水蒸气
B.该实验必须在通风橱中进行
C.装置C中溶液可换为澄清石灰水
D.装置B的现象是干燥布条不褪色,湿润布条褪色
【答案】C
【解析】A.装置A中浓硫酸具有强吸水性,可除去氯气中的水蒸气,A正确;
B.氯气有毒,为防止中毒须在通风橱中进行实验,B正确;
C.装置C的作用为吸收多余的氯气,澄清石灰水中氢氧化钙的浓度较低,无法完全除去氯气,C错误;
D.干燥的氯气不具有漂白性,干燥布条不褪色,氯气与水反应生成的HClO具有漂白性,湿润布条褪
色,D正确;
故答案选C。
7.下列离子方程式书写正确的是
A.铁与稀盐酸反应:
B. 粉末加入到硫酸溶液中:
C.向澄清石灰水中滴加过量 :
D.向 溶液中加入少量的NaOH溶液:
【答案】C
【解析】A.铁与稀盐酸反应生成亚铁离子,离子方程式为Fe+2H+=Fe2++H ↑,A错误;
2
B. 粉末加入到硫酸溶液中有硫酸钡沉淀生成,离子方程式为BaCO +2H++
3
=BaSO ↓+H O+CO↑,B错误;
4 2 2
C.澄清石灰水中加入过量NaHCO ,钙离子、氢氧根离子和碳酸氢根离子反应生成碳酸钙沉淀、碳酸根离
3
子和水,离子方程式正确,C正确;
D.向 溶液中加入少量NaOH溶液,离子方程式为: ,D错
误;
故答案选C。
8.氢化钠可以作为生氢剂(其中NaH中氢元素为-1价),反应方程式如下: ,其
中水的作用是
学科网(北京)股份有限公司 学科网(北京)股份有限公司A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
【答案】B
【解析】 中, → ,H元素化合价降低,发生还原反应, 作氧化剂,
答案选B。
9.下列溶液与20mL1mol·L-1NaNO 溶液中NO 物质的量浓度相等的是
3
A.10mL1mol·L-1Mg(NO) 溶液 B.5mL0.8mol·L-1Al(NO ) 溶液
3 2 3 3
C.10mL2mol·L-1AgNO 溶液 D.10mL0.5mol·L-1Cu(NO ) 溶液
3 3 2
【答案】D
【分析】20mL1mol·L-1NaNO 溶液中 的物质的量浓度为1mol/L;
3
【解析】A.10mL1mol·L-1Mg(NO) 溶液中, 的物质的量浓度为2mol/L,A不同;
3 2
B.5mL0.8mol·L-1Al(NO ) 溶液中, 的物质的量浓度为2.4mol/L,B不同;
3 3
C.10mL2mol·L-1AgNO 溶液中, 的物质的量浓度为2mol/L,C不同;
3
D.10mL 0.5mol·L-1Cu(NO ) 溶液中, 的物质的量浓度为1mol/L,D相同;
3 2
故答案为:D。
10.在两个密闭容器中,分别充有64 g SO 和48 g O,若两容器的温度和压强均相同。下列说法正确的
2 3
是
A.两种气体的体积之和为44.8 L B.SO 和O 的气体密度比为4∶3
2 3
C.SO 和O 分子数之比为4∶3 D.SO 和O 的氧原子数目比为1∶1
2 3 2 3
【答案】B
【解析】A.题干未告知气体所处的状态,故无法计算两种气体的体积,A错误;
B.在同温同压下,气体的密度之比等于其摩尔质量之比也等于相对分子质量之比,故SO 和O 的气体密
2 3
度比为64:48=4∶3,B正确;
C.SO 和O 分子数之比为 =1∶1,C错误;
2 3
D.SO 和O 的氧原子数目比为 =2∶3,D错误;
2 3
故答案为:B。
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得
4分,选对但不全的得2分,有选错的得0分。
11. 为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4 L空气中含有的单质分子数为
B.12.0 g熔融的 中含有的阳离子数为
学科网(北京)股份有限公司 学科网(北京)股份有限公司C.1 mol 溶于水,此过程中转移电子数为
D.常温下,1 L 0.5 mol⋅L 溶液中含有的 数为
【答案】D
【解析】A.标准状况下,22.4 L空气中气体的总物质的量为1 mol,含有的单质有 、 、稀有气体
等,但还含有 、二氧化氮等化合物,所以单质分子数小于 ,A错误;
B.12.0 g熔融的 的物质的量为0.1 mol,熔融硫酸氢钠电离出0.1 mol钠离子和0.1 mol硫酸氢根离
子,所以含有的阳离子数为 ,B错误;
C. ,该反应为可逆反应,转移电子数小于 ,C错误;
D.常温下,1 L 0.5 mol⋅L 溶液中含有的 数为 ,D正确;
故答案为:D。
12.为除去括号内的杂质,所选用的试剂或方法错误的是
A. 固体 :加热至不再产生气体
B. 气体(HCl):饱和 溶液
C. 溶液 :通过量
D. 溶液 :加入适量 溶液,过滤
【答案】BD
【解析】A. 碳酸氢钠加热分解生成碳酸钠,碳酸钠受热不分解,则加热法可除杂,故A正确;
B. 二氧化碳与碳酸钠也反应生成碳酸氢钠,故B错误;
C. 碳酸钠溶液吸收二氧化碳转化为碳酸氢钠,则用二氧化碳能除去碳酸氢钠溶液中的碳酸钠,故C正
确;
D. 二者都与氢氧化钡反应生成沉淀,主要物质也被除去了,故D错误;
故选BD。
13.二氧化氯( )是国际上公认的安全、低毒的绿色消毒剂。制取 的微观过程如图所示。下列说法
正确的是
A.该反应属于置换反应
B.该反应中所有含氯物质均具有杀菌消毒作用
C.制取1 mol 需消耗11.2 L(标准状况)
学科网(北京)股份有限公司 学科网(北京)股份有限公司D.该反应的离子方程式为
【答案】CD
【解析】A.根据微观过程示意图可知,反应的化学方程式: ,根据置换反
应定义可知,该反应不属于置换反应,A错误;
B.反应中并不是所有含氯物质都具有杀菌消毒作用,如氯化钠无氧化性,不能杀菌消毒,B错误;
C.根据化学方程式可知,生成1 mol ,消耗0.5 mol ,标准状况下对应体积为11.2 L,C正确;
D.由该反应的化学方程式可知,反应的离子方程式: ,D正确;
故答案为CD。
14.粗盐中除含有少量混沙外,还含有一些可溶性硫酸盐及 等杂质。下图是某兴趣小组进行
粗盐提纯的实验流程。
下列说法正确的是
A.步骤③中 的主要作用是除去 、少量 和过量的
B.步骤①和⑤均为过滤
C.步骤⑥加盐酸的目的是除去过量的 和 ,所以可以用硝酸代替
D.完成步骤⑦需要的玻璃仪器有两种
【答案】D
【分析】粗盐先溶解,再加入过量氯化钡溶液沉淀硫酸根,再加入过量氢氧化钠溶液沉淀镁离子,再加入
过量碳酸钠溶液沉淀钙离子和钡离子,过滤,向滤液中加入适量盐酸除掉氢氧根和碳酸根,再蒸发、结
晶、烘干得到精盐。
【解析】A.步骤③中 的主要作用是除去 ,A错误;
B.步骤①是将粗盐加水溶解,步骤⑤将溶液和沉淀分离,其操作是过滤,B错误;
C.不能用硝酸代替盐酸,会引入新杂质硝酸根,C错误;
D.步骤⑦需要到的玻璃仪器有玻璃棒和酒精灯两种,D正确;
答案选D。
15.已知 Co O、Cl、FeCl 和 I 的氧化性依次减弱。在酸性溶液中,Co O 发生氧化还原反应时其还原产
2 3 2 3 2 2 3
物为 ,下列说法正确的是
A.酸性溶液中Co O 与KI发生反应时,氧化产物与还原产物的物质的量之比为2∶1
2 3
B.向 FeCl 溶液中滴加 KI溶液,可发生反应:
3
C.Co O 与浓盐酸反应时,HCl体现还原性和酸性
2 3
学科网(北京)股份有限公司 学科网(北京)股份有限公司D.向酸性FeCl 溶液中加入足量Co₂O₃,仅Cl⁻被氧化
2
【答案】BC
【解析】A.酸性溶液中 Co₂O₃ 与 KI发生反应时,生成 1 mol Co²⁺转移 1 mol eˉ,生成 1 mol I₂ 转移2
mol e-,因此氧化产物与还原产物的物质的量之比为1∶2,A 错误;
B.由于 Fe³⁺的氧化性比 I₂ 强,能发生该反应,B正确;
C.Co₂O₃ 与浓盐酸反应生成 CoCl₂ 和 Cl₂,HCl体现还原性和酸性,C正确;
D.根据信息可知,氧化性 ,加入足量 Co₂O₃,Fe²⁺和 Cl⁻均被氧化,D错误;故选
BC。
第 II 卷(非选择题 共 60 分)
三、非选择题:本题共5小题,共60分。
16.(12分)生活中离不开化学,家庭厨卫中有许多中学化学常见的物质,括号内为厨卫商品的主要成
分:
①食盐(NaCl);②料酒(乙醇);③食醋(乙酸);④碱面( );⑤小苏打( );⑥84消毒液
(NaClO);⑦洁厕灵(HCl);⑧净水剂(明矾);⑨铁锅(Fe)
回答下列问题:
(1)明矾的化学式为 ,属于 (填“纯净物”或“混合物”)。
(2)小苏打的主要成分 ,在水溶液的电离方程式为 。
(3)厨卫用品的主要成分(括号内的物质)是电解质的有 (填序号,下同),是非电解质的有 ,
能够导电的有 。
(4)⑥和⑦不能混用,原理为 (用化学反应方程式表示)。
(5)已知 和碱反应生成 ,故 为酸性氧化物, 与酸反应生成 ,故 为碱性氧化
物. 可以形成两种盐: 、 (微溶物),则 属于 氧化物(填“酸性”或“碱
性”、“两性”、“不成盐”)。写出 与浓NaOH溶液反应的化学反应方程式: 。
【答案】(除标明外,每空2分)
(1)纯净物(1分)
(2)
(3)①③④⑤⑥⑦⑧(1分) ②(1分) ⑨(1分)
(4)NaClO+2HCl=NaCl+Cl ↑+H O
2 2
(5)两性 TiO+2NaOH=Na TiO+H O
2 2 3 2
【解析】(1)明矾是一种复盐,为纯净物。
(2) 为弱酸的酸式盐,因此电离方程式为: 。
(3)在水溶液中或熔融状态下能导电的化合物为电解质,在水溶液中和熔融状态下都不能导电的化合物
学科网(北京)股份有限公司 学科网(北京)股份有限公司为非电解质,因此①③④⑤⑥⑦⑧为电解质,②为非电解质,⑨可以导电。
(4)84消毒液是次氯酸钠(NaClO),洁厕灵的主要成分是盐酸(HCl),氯离子和次氯酸跟离子在酸性
作用下可以发生氧化还原反应生成氯气,化学方程式为:NaClO+2HCl=NaCl+Cl ↑+H O。
2 2
(5)由于 既能与酸反应,又能与碱反应,因此为两性氧化物; 与浓NaOH溶液反应的化学方程
式为:TiO+2NaOH=Na TiO+H O。
2 2 3 2
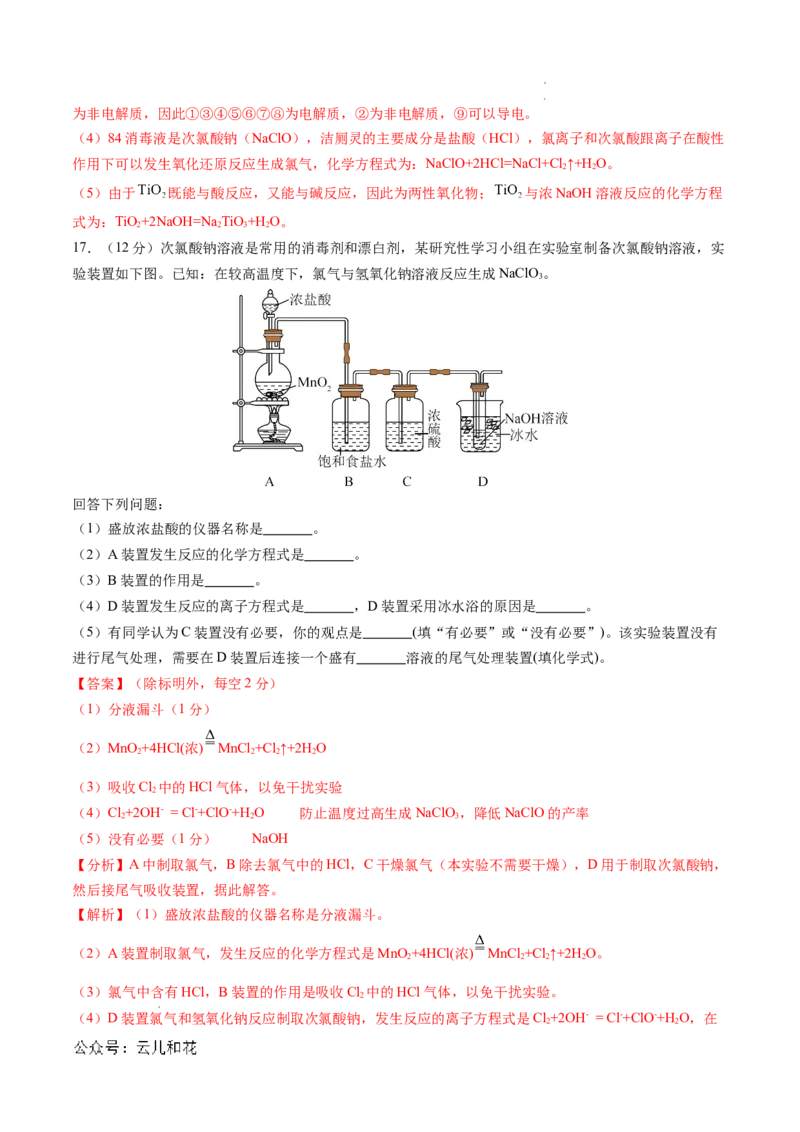
17.(12分)次氯酸钠溶液是常用的消毒剂和漂白剂,某研究性学习小组在实验室制备次氯酸钠溶液,实
验装置如下图。已知:在较高温度下,氯气与氢氧化钠溶液反应生成NaClO。
3
回答下列问题:
(1)盛放浓盐酸的仪器名称是 。
(2)A装置发生反应的化学方程式是 。
(3)B装置的作用是 。
(4)D装置发生反应的离子方程式是 ,D装置采用冰水浴的原因是 。
(5)有同学认为C装置没有必要,你的观点是 (填“有必要”或“没有必要”)。该实验装置没有
进行尾气处理,需要在D装置后连接一个盛有 溶液的尾气处理装置(填化学式)。
【答案】(除标明外,每空2分)
(1)分液漏斗(1分)
(2)MnO +4HCl(浓) MnCl +Cl↑+2H O
2 2 2 2
(3)吸收Cl 中的HCl气体,以免干扰实验
2
(4)Cl+2OH- = Cl-+ClO-+H O 防止温度过高生成NaClO,降低NaClO的产率
2 2 3
(5)没有必要(1分) NaOH
【分析】A中制取氯气,B除去氯气中的HCl,C干燥氯气(本实验不需要干燥),D用于制取次氯酸钠,
然后接尾气吸收装置,据此解答。
【解析】(1)盛放浓盐酸的仪器名称是分液漏斗。
(2)A装置制取氯气,发生反应的化学方程式是MnO +4HCl(浓) MnCl +Cl↑+2H O。
2 2 2 2
(3)氯气中含有HCl,B装置的作用是吸收Cl 中的HCl气体,以免干扰实验。
2
(4)D装置氯气和氢氧化钠反应制取次氯酸钠,发生反应的离子方程式是Cl+2OH- = Cl-+ClO-+H O,在
2 2
学科网(北京)股份有限公司 学科网(北京)股份有限公司较高温度下,氯气与氢氧化钠溶液反应生成NaClO,D装置采用冰水浴的原因是防止温度过高生成
3
NaClO,降低NaClO的产率。
3
(5)D装置为氢氧化钠溶液,存在水,C装置没有必要。该实验装置没有进行尾气处理,一般用碱液吸收
氯气,则需要在D装置后连接一个盛有NaOH溶液的尾气处理装置。
18.(12分)利用氯元素价一类二维图可以从不同角度研究含氯物质的性质及其转化关系。图中①~⑨均
含氯元素。回答下列问题:
(1)⑤的化学式是 ,⑥的电离方程式是 。
(2)工业制漂白粉是将①通入 中制成的,漂白粉放置时间长了就会失效,原因是(用化学用语
解释) 。
(3) 可用于自来水消毒,工业上常用 制备 ,该反应的化学方程式为
,氧化剂与还原剂的物质的量之比为 ,每消耗
,转移电子数为 ( 为阿伏加德罗常数的值); 还可将水中的 转化为
,说明 具有 性, 进一步生成 胶体,检验有胶体生成的简便方法为
。
【答案】(除标明外,每空2分)
(1)HClO(1分)
(2)石灰乳(1分) Ca(ClO) +H O+CO=CaCO ↓+2HClO,
2 2 2 3
(3)1:4 氧化(1分) 丁达尔效应(1分)
【分析】由氯元素价一类二维图,可推知 Cl、 HCl、 ClO 、 ClO、 HClO、 HClO、
2 2 2 7 4
NaCl、 NaClO、 NaClO,由此分析回答;
3 ① ② ③ ④ ⑤ ⑥
【解析】(1)由分析可知,⑤为次氯酸,化学式为HClO; 为HClO,强电解质,在水中完全电离,电
⑦ ⑧ ⑨ 4
离方程式为 ; ⑥
(2)工业制漂白粉将氯气通入石灰乳中生成氯化钙、次氯酸钙和水;漂白粉失效是次氯酸钙与空气中的
二氧化碳、水蒸气反应生成次氯酸,次氯酸在光照条件下分解成盐酸和氧气而失效,用化学用语表示为
Ca(ClO) +H O+CO=CaCO ↓+2HClO, ;
2 2 2 3
学科网(北京)股份有限公司 学科网(北京)股份有限公司(3)在 反应中,Cl原子有一个从+3价得4个电子变成-1价,作
氧化剂,4个从+3价升高到+4价,作还原剂,故氧化剂与还原剂的物质的量之比为1:4;反应方程式中消
耗5mol 转移4mol电子,故消耗 ,转移电子数为 ; 转化为 被氧化,故
具有氧化性; 进一步生成 胶体,检验有胶体生成的简便方法为丁达尔效应。
19.(12分)钠是一种活泼金属,其化合物在生产生活中具有广泛应用。回答下列问题:
(1)下列有关钠及其化合物的说法正确的是___________(填代号)。
A.钠元素在自然界中都以化合物的形式存在
B.在实验室中少量钠保存在煤油中
C. 常用来治疗胃酸过多
D.热稳定性:
(2)将一小块钠迅速投入到热坩埚中,发生反应的化学方程式为 。
(3)向酸性 溶液中加入 粉末,观察到溶液紫色褪去,说明 具有一定的
(填“氧化性”、“还原性”或“漂白性”)。
(4)下列试剂可以鉴别 溶液和 溶液的是 (填代号)。
A. 溶液 B. 溶液 C.稀盐酸
(5)在标准状况下,将 的 通入到 溶液中。
其中 的质量为 g,NaOH的物质的量为 ,反应的离子方程式为
。
【答案】(除标明外,每空2分)
(1)AB
(2)
(3)还原性(1分)
(4)C
(5)22(1分) 1
【解析】(1)A.钠是活泼金属,自然界中钠元素都以化合物的形式存在,A项正确;
B.钠不与煤油反应,密度比煤油大,在实验室中少量钠可以保存在煤油中,B项正确;
C.氢氧化钠具有强腐蚀性,不能用来治疗胃酸过多,C项错误;
D.碳酸钠的热稳定性比碳酸氢钠强,D项错误;
故选AB。
(2)将一小块钠迅速投入到热坩埚中,钠会与氧气反应生成过氧化钠,发生反应的化学方程式为
。
学科网(北京)股份有限公司 学科网(北京)股份有限公司(3)高锰酸钾具有强氧化性,高锰酸钾溶液褪色,说明高锰酸钾被还原, 具有一定的还原性。
(4)A.NaOH溶液和 溶液不反应,NaOH溶液和 溶液反应但无现象,无法鉴别,A项错
误;B. 和两者反应均生成沉淀,无法鉴别,B项错误;C.稀盐酸滴入 溶液中,一开始
无现象,继续滴加会产生气泡,稀盐酸滴入 溶液中立即会有气泡产生,可以鉴别,C项正确;故
选C。
(5)①标准状况下,11.2L 的质量为
= ;
②NaOH的物质的量为 ;
③二氧化碳为0.5mol,NaOH为1mol,NaOH过量,反应的离子方程式为: 。
20.(12分)某化学小组在实验室用63%的浓 HNO (其密度为1.39g/cm³,已知 ,配制480 mL
3
0.50 mol/L 稀 HNO,并探究稀 HNO 与一些物质的反应。回答下列问题:
3 3
(1)该浓硝酸的物质的量浓度为 mol/L。
(2)用该浓 HNO 配制480 mL0.50 mol/L 稀 HNO 需要使用的玻璃仪器有量筒、烧杯、玻璃棒、
3 3
和 mL容量瓶,应量取浓硝酸的体积为 mL(保留三位有效数字)。
(3)如图为溶液配制过程,正确的操作顺序为 (用字母表示),操作 d 为洗涤烧杯和玻璃榨并
将洗涤液转入容量瓶的过程,若省略该操作将会导致配制的稀硝酸的浓度 (填“偏低”“偏
高”或“无影响”)。
(4)基于HNO 的类别推测,其能与碳酸氢钠发生反应,写出稀硝酸与碳酸氢钠溶液反应的离子方程式:
3
。
(5)该小组同学推测稀 HNO 可与二氧化硫反应,其将一定量二氧化硫通入3mL稀HNO 中并在反应后
3 3
学科网(北京)股份有限公司 学科网(北京)股份有限公司的溶液中检出了 ,查阅资料知稀硝酸被还原为 NO,试写出该反应的离子方程式: 。
【答案】(除标明外,每空2分)
(1)13.9
(2)胶头滴管(1分) 500(1分) 18.0(1分)
(3)acbdfe 偏低(1分)
(4)
(5)
【解析】(1)浓 HNO₃ 的 物 质 的 量 浓 度 为 =13.9mol/L,故答案为:
13.9;
(2)用该 浓 HNO₃ 配 制 480 mL 0.50 mol/L 稀HNO₃需要使用的玻璃仪器有量筒、烧杯、玻璃棒、胶
头滴管和500 mL容量瓶,根据稀释过程中溶质的物 质 的 量 不 变, c (HNO)V (HNO)= c (HNO)V
浓 3 浓 3 稀 3
(HNO),代入数据 13.9mol/L×V (HNO)=500mL×0.50mol/L,,计 算 可 得 V (HNO)≈18.0mL,故答
稀 3 浓 3 稀 3
案为:胶头滴管;500;18.0;
(3)配制过程中,正确的操作顺序为量取→稀释→转移→洗涤→定容→摇匀,即acbdfe,若省略操作d,
没有将溶质全部转移至容量瓶中,将会导致配制的稀硝酸的浓度偏低,故答案为:acbdfe;偏低;
(4)稀硝酸与碳酸氢钠溶液反应的离子方程式为 ,故答案为:
;
(5)二氧化硫与稀 HNO₃ 反应生成 和 NO,根据氧化还原反应配平可得该反应的离子方程式为:
,故答案为: 。
学科网(北京)股份有限公司 学科网(北京)股份有限公司