文档内容
第五章 化工生产中的重要非金属元素
第1节 硫及其化合物
(第1课时 硫与二氧化硫 )
一、选择题
1.下列物质中,不能与 反应的是
A.盐酸 B. C. D.
【答案】A
【详解】
A.二氧化硫是酸性氧化物,不能与盐酸反应,故A正确;
B.二氧化硫具有还原性,能与氧气反应生成三氧化硫,故B错误;
C.二氧化硫是酸性氧化物,能与碱性氧化物氧化钙反应生成亚硫酸钙,故C错误;
D.二氧化硫是酸性氧化物,能与氢氧化钠反应生成亚硫酸钠和水,故D错误;
故选A。
2.下列说法中正确的是
A.根据化合价可知,S在化学反应中只能作还原剂
B.试管内壁上的硫黄可用CS 清洗
2
C.S+O SO ,S被氧化,作氧化剂
2 2
D.硫只以化合态存在于自然界中
【答案】B
【详解】
A.0价是S的中间价态,所以S既可作氧化剂,又可作还原剂,A错误;
B.S易溶于CS,所以可以用CS 清洗试管内壁的硫粉,B正确;
2 2
C.S被氧化,化合价升高,作还原剂,C错误;
D.硫在自然界中既有游离态又有化合态,D错误;
故选:B。
学科网(北京)股份有限公司3.下列关于 的叙述正确的是
A. 是无色、无味、有毒的气体
B. 与NaOH溶液反应生成
C. 能使紫色的 溶液褪色
D. 有毒,不能用作食品添加剂
【答案】C
【详解】
A.二氧化硫是无色,但具有刺激性气味的有毒气体,故A错误;
B.SO 与NaOH溶液反应生成NaSO ,不是NaSO ,故B错误;
2 2 3 2 4
C.SO 具有还原性,能与KMnO 溶液发生氧化还原反应而使紫色的KMnO 溶液褪色,故
2 4 4
C正确;
D.二氧化硫具有还原性,可用作葡萄酒抗氧化剂,少量能用作食品添加剂,故D错误。
答案选C。
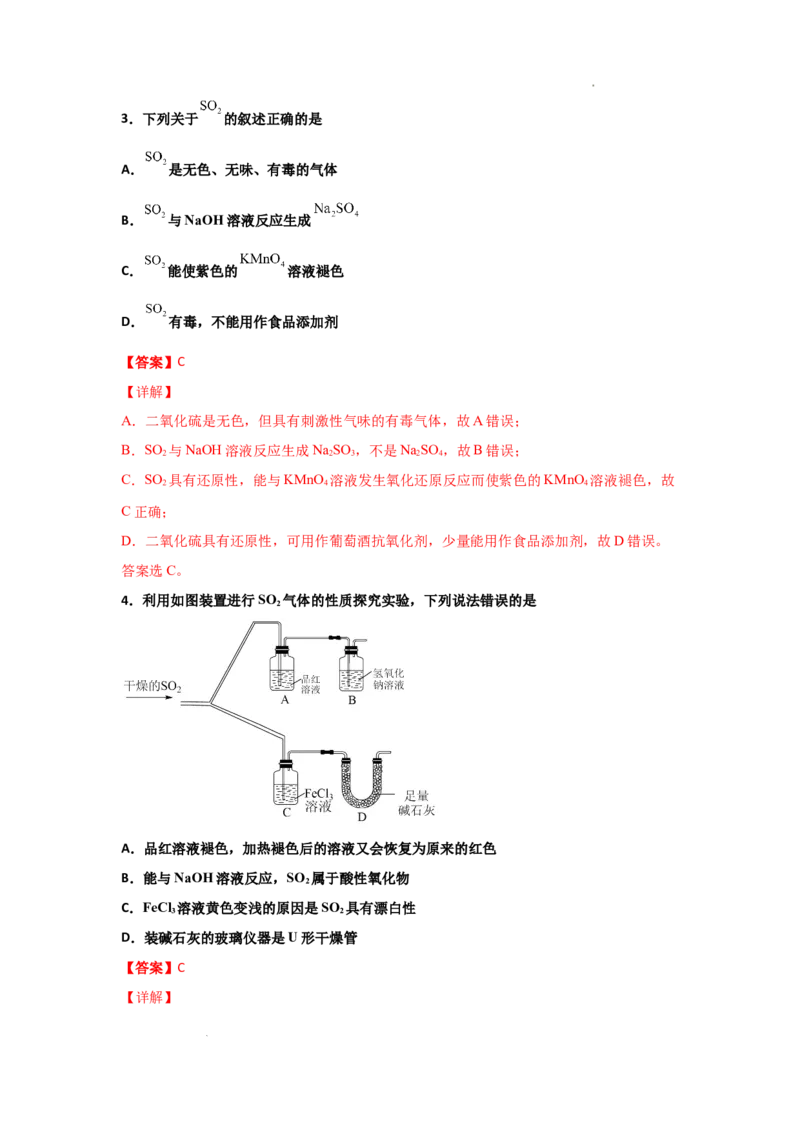
4.利用如图装置进行SO 气体的性质探究实验,下列说法错误的是
2
A.品红溶液褪色,加热褪色后的溶液又会恢复为原来的红色
B.能与NaOH溶液反应,SO 属于酸性氧化物
2
C.FeCl 溶液黄色变浅的原因是SO 具有漂白性
3 2
D.装碱石灰的玻璃仪器是U形干燥管
【答案】C
【详解】
学科网(北京)股份有限公司A.SO 具有漂白性,能够使某些有色物质如可以使品红溶液褪色,但产生的无色物质不稳
2
定,受热分解,SO 气体逸出,物质恢复原来的颜色,因此加热褪色后的溶液又会恢复为
2
原来的红色,A正确;
B.SO 能与NaOH溶液反应产生NaSO 、HO,因此SO 属于酸性氧化物,B正确;
2 2 3 2 2
C.SO 气体通入FeCl 溶液中,溶液黄色变浅是由于发生反应:SO +2Fe3++2H O=2Fe2+
2 3 2 2
+4H++ ,该反应体现了SO 的还原性,C错误;
2
D.根据装置图可知:装碱石灰的玻璃仪器名称是U形干燥管,D正确;
故合理选项是C。
5.下列叙述中,不正确的是
A.正交硫和单斜硫互为同素异形体
B.铁粉与水蒸气高温下反应生成FeO
3 4
C.浓硫酸有强氧化性,不可储存在铝、铁的容器中
D.向饱和Na CO 溶液中通入足量CO ,溶液变浑浊,析出了NaHCO
2 3 2 3
【答案】C
【详解】
A.正交硫和单斜硫是由同种元素构成的不同单质,互为同素异形体,A正确;
B.铁粉与水蒸气高温下反应生成四氧化三铁和氢气,B正确;
C.浓硫酸有强氧化性,常温下可使金属铝、铁钝化,可储存在铝、铁的容器中,C错误;
D.向饱和NaCO 溶液中通入足量CO,反应生成碳酸氢钠,碳酸氢钠的溶解度小于碳酸
2 3 2
钠的溶解度,析出了NaHCO ,溶液变浑浊,D正确;
3
故选C。
6.下列反应中体现二氧化硫还原性的是
A.SO +2HO+Cl =H SO +2HCl
2 2 2 2 4
B.SO +2HS=2H O+3S↓
2 2 2
C.SO +2NaOH=Na SO +HO
2 2 3 2
D.SO +Na CO =Na SO +CO
2 2 3 2 3 2
【答案】B
【详解】
A.反应SO +2HO+Cl===HSO +2HCl中,硫元素的化合价由+4价升高为+6价,则
2 2 2 2 4
SO 被氧化,A错误;
2
学科网(北京)股份有限公司B.反应SO +2HS===2HO+3S↓中,SO 中硫元素的化合价由+4价降低为0价,则SO
2 2 2 2 2
被还原,B正确;
C.反应中均没有元素化合价发生变化,不是氧化还原反应,SO 既未被氧化也未被还原,
2
C错误;
D.反应中均没有元素化合价发生变化,不是氧化还原反应,SO 既未被氧化也未被还原,
2
D错误;
故选:B。
7.下列关于硫的叙述中不正确的是
A.硫是一种难溶于水的黄色固体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫在自然界中只能以硫化物和硫酸盐的形态存在
D.硫的燃烧产物二氧化硫是大气污染物之一
【答案】C
【详解】
A.硫俗称硫黄,是一种黄色固体,难溶于水,微溶于酒精,易溶于二硫化碳,常用二硫
化碳除去试管内壁附着的硫单质,A正确;
B.硫在自然界中能以化合态(主要为硫化物和硫酸盐)的形式存在,B正确;
C.硫在自然界中能以游离态(火山喷口附近或地壳岩层) 的形式存在,C错误;
D.硫的燃烧产物二氧化硫会造成酸雨,是大气污染物之一,D正确;
故选:C。
8.将 分别通入下列溶液中,对现象的分析正确的是
选项 溶液 现象 分析
A 含酚酞的 溶液 红色消失 是酸性氧化物
B 溴水 橙色消失 具有漂白性
C 溶液 变为浅绿色溶液
D 溶液 产生淡黄色浑浊
A.A B.B C.C D.D
【答案】A
学科网(北京)股份有限公司【详解】
A.将SO 气体通入含有酚酞的氢氧化钠溶液中,二氧化硫是酸性氧化物,和氢氧化钠发
2
生反应形成NaSO 和水,所以溶液褪色,故A正确;
2 3
B.将SO 气体通入溴水中,二氧化硫和溴发生氧化还原反应生成硫酸和溴化氢使溴水褪色,
2
而不是因为 具有漂白性,故B错误;
C.将SO 气体通入氯化铁溶液中, 二氧化硫和氯化铁发生氧化还原反应,离子方程式为:
2
,溶液变为浅绿色溶液,故C错误;
D.将SO 气体通入 溶液中,SO 和 反应生成黄色沉淀硫单质,其离子方程式为
2 2
,故D错误;
答案选A。
9.下列化合物中,能用相应的单质直接化合得到的是
①CuS ②FeS ③HCl ④SO ⑤SO ⑥FeCl ⑦CuCl
2 3 2 2
A.全部 B.①②③④⑤⑦ C.②④⑤⑦ D.②③④⑦
【答案】D
【详解】
氯气有强氧化性,与变价金属反应生成最高价态的化合物,与铁反应生成FeCl ,与铜反应
3
生成CuCl ;硫的氧化性较弱,与变价金属反应生成低价态的化合物,与铜反应生成
2
Cu S,与铁反应生成FeS;氯气和氢气可以反应生成氯化氢,硫和氧气反应可以生成二氧
2
化硫。综上所述,②③④⑦正确,故选:D。
10.我国的环境空气质量标准中对空气中SO 的浓度限值规定如下表所示。
2
标准等级 一级标准 二级标准 三级标准
浓度限值(mg·m-3) 0~0.15 0.15~0.50 0.50~0.70
研究人员测定受污染空气中SO 含量的实验方法如下:用NaOH溶液吸收2m3空气,用
2
0.1mo·L-1硫酸调节pH,然后用I 溶液将其氧化,测得恰好完全反应时消耗I2.54mg。下
2 2
列推断中,不正确的是
A.恰好完全反应时消耗I 的物质的量为1×10-5mol
2
B.反应中转移电子的物质的量为2×10-5mol
学科网(北京)股份有限公司C.被吸收的空气中SO 的质量为0.64mg
2
D.被测空气样品中SO 的浓度达到了三级标准
2
【答案】D
【详解】
A.恰好完全反应时消耗I 的物质的量为 =1×10-5mol,A正确;
2
B.根据反应SO +I +2H O=2HI+HSO 可知,反应中转移电子的物质的量为2×10-5mol,B
2 2 2 2 4
正确;
C.根据反应SO +I +2H O=2HI+HSO 可知,被吸收的空气中SO 的质量为0.64mg,C正
2 2 2 2 4 2
确;
D.由C项分析可知,被测空气样品中SO 的浓度为: =0.32 mg·m-3,故达到了二级
2
标准,D错误;
故答案为:D。
二、非选择题
11.汞蒸气有毒,万一把汞洒出,可以在有汞滴的部位撒一层硫粉,这时发生反应的化学
方程式是______________________________。室内有汞蒸气时应进行通风以降低汞蒸气的
浓度,这时通风口装在墙的________(填“上”或“下”)部效率高。
【答案】Hg+S=HgS 下
【解析】
汞蒸气有毒,万一把汞洒出,可以在有汞滴的部位撒一层硫粉,这时二者发生反应产生
HgS,发生反应的化学方程式是:Hg+S=HgS;
室内有汞蒸气时应进行通风以降低汞蒸气的浓度,由于Hg的密度比空气大,这时通风口
装在墙的下部效率高。
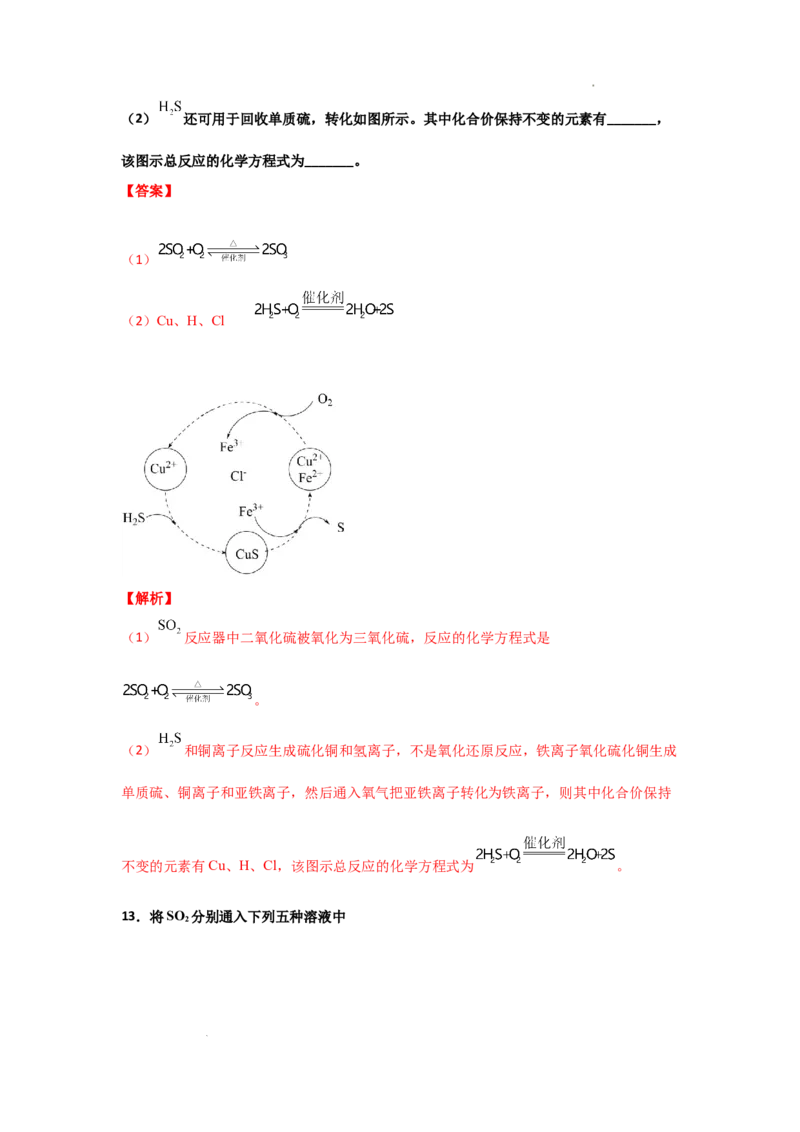
12.煤液化过程中产生的 可生产硫酸,部分过程如图所示:
反应器中的化学方程式是_______。
学科网(北京)股份有限公司(2) 还可用于回收单质硫,转化如图所示。其中化合价保持不变的元素有_______,
该图示总反应的化学方程式为_______。
【答案】
(1)
(2)Cu、H、Cl
【解析】
(1) 反应器中二氧化硫被氧化为三氧化硫,反应的化学方程式是
。
(2) 和铜离子反应生成硫化铜和氢离子,不是氧化还原反应,铁离子氧化硫化铜生成
单质硫、铜离子和亚铁离子,然后通入氧气把亚铁离子转化为铁离子,则其中化合价保持
不变的元素有Cu、H、Cl,该图示总反应的化学方程式为 。
13.将SO 分别通入下列五种溶液中
2
学科网(北京)股份有限公司回答下列问题:
(1)试管①中的实验现象:KMnO 酸性溶液________,证明SO 具有________性。
4 2
(2)试管②中的实验现象:溶液________,证明SO 具有________性。
2
(3)试管③中的实验现象:溶液________,证明SO 能中和NaOH,具有酸性氧化物的性
2
质,写出该反应的离子方程式:
____________________________________________________。
(4)试管④中能产生________沉淀。
(5)试管⑤中能产生________沉淀。
【答案】
(1)褪色 还原
(2)褪色 漂白
(3)褪色 SO +2OH-=S +H O或SO +OH-=HS
2 2 2
(4)BaSO
3
(5)BaSO
4
【解析】
(1)SO 具有还原性,能与KMnO 酸性溶液发生氧化还原反应,使其褪色;化学反应方
2 4
程式为:5SO +2KMnO +2H O=KSO +2MnSO +2H SO ;
2 4 2 2 4 4 2 4
(2)SO 具有漂白性,能使品红溶液褪色;
2
(3)将 SO 气体通入含有酚酞的氢氧化钠溶液中,SO 为酸性氧化物,溶于水后生成亚硫
2 2
酸,进而与NaOH溶液发生反应形成NaSO 或NaHSO 和水,溶液的碱性减弱,所以溶液
2 3 3
褪色;
(4)将SO 气体通入NaOH和BaCl 的混合液中,反应生成BaSO 白色沉淀,发生的反应
2 2 3
方程式如下:SO +2NaOH=Na SO +H O;NaSO +BaCl =2NaCl+BaSO ↓;
2 2 3 2 2 3 2 3
(5)将SO 气体通入HO 和BaCl 的混合液中,HO 具有强氧化性,所以SO 溶于含有
2 2 2 2 2 2 2
HO 水溶液形成硫酸,进一步 与BaCl 反应生成BaSO 白色沉淀,发生的反应方程式如下:
2 2 2 4
SO + H O = H SO ;BaCl + H SO = BaSO↓+2HCl;
2 2 2 2 4 2 2 4 4
学科网(北京)股份有限公司学科网(北京)股份有限公司学科网(北京)股份有限公司