文档内容
专题 01 硫及其化合物
专项训练
1.早在古代,我国人民就积累了不少对化学物质变化的认识。例如,晋代炼丹家、医学家葛洪所著《抱
朴子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这句话中的丹砂指的是HgS,下列有关说法
正确的是( )
A.这个过程只涉及物理变化
B.“积变又还成丹砂”过程中发生反应:HgS Hg+S
C.实验室中不慎洒落的水银可用硫黄处理
D.“丹砂烧之成水银”过程中还可能产生SO
3
2.下列关于硫的叙述中不正确的是( )
A.试管内壁附着的硫可用二硫化碳溶解除去
B.硫在自然界中只能以硫化物和硫酸盐的形态存在
C.化石燃料的大量燃烧是空气中二氧化硫含量升高的原因
D.分离黑火药中的硝酸钾、木炭、硫要用到二硫化碳、水及过滤操作
3.下列说法正确的是( )
A.因SO 具有漂白性,所以能使品红溶液、溴水、酸性KMnO 溶液、石蕊试液褪色
2 4
B.能使品红溶液褪色的物质不一定是SO
2
C.SO 、漂白粉、活性炭、NaO 都能使红墨水褪色,且原理相同
2 2 2
D.等物质的量的SO 和Cl 混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
2 2
4.硫酸是一种重要的化工原料,下列关于硫酸的说法中不正确的是( )
A.硫酸可用于生产化肥、农药和炸药等
B.硫黄和黄铁矿可以作为制备硫酸的原料
C.工业制备硫酸时,SO 转化为SO 的反应需要在加热和催化剂存在的条件下进行
2 3
D.反应生成的SO 可以用水直接吸收来制备硫酸
3
5.下列叙述或操作中正确的是( )
A.浓硫酸能使硫酸铜晶体失去结晶水,体现了浓硫酸的脱水性
B.浓硫酸对有机物的腐蚀性是浓硫酸脱水性和强氧化性的综合体现
C.浓硫酸具有氧化性,稀硫酸无氧化性
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上稀NaOH溶液
6.下列溶液能用来区分 和 气体的是
①澄清石灰水 ② 溶液 ③酸性 溶液 ④新制氯水 ⑤品红溶液 ⑥紫色石蕊溶液
A.①②③⑤ B.①⑥ C.②③④⑥ D.②③④⑤
7.浓硫酸与稀硫酸性质差异较大,具有吸水性,脱水性和强氧化性三大特性,下列有关浓硫酸的叙述正确的是( )
A.浓硫酸可做干燥剂,能够干燥氢气、氧气、氨气等气体
B. ↑,浓硫酸既表现了其强氧化性又表现了其酸性
C.常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸不与铁、铝反应
D.取少量蔗糖于烧杯中,加入浓硫酸,蔗糖变黑,体现浓硫酸具有吸水性
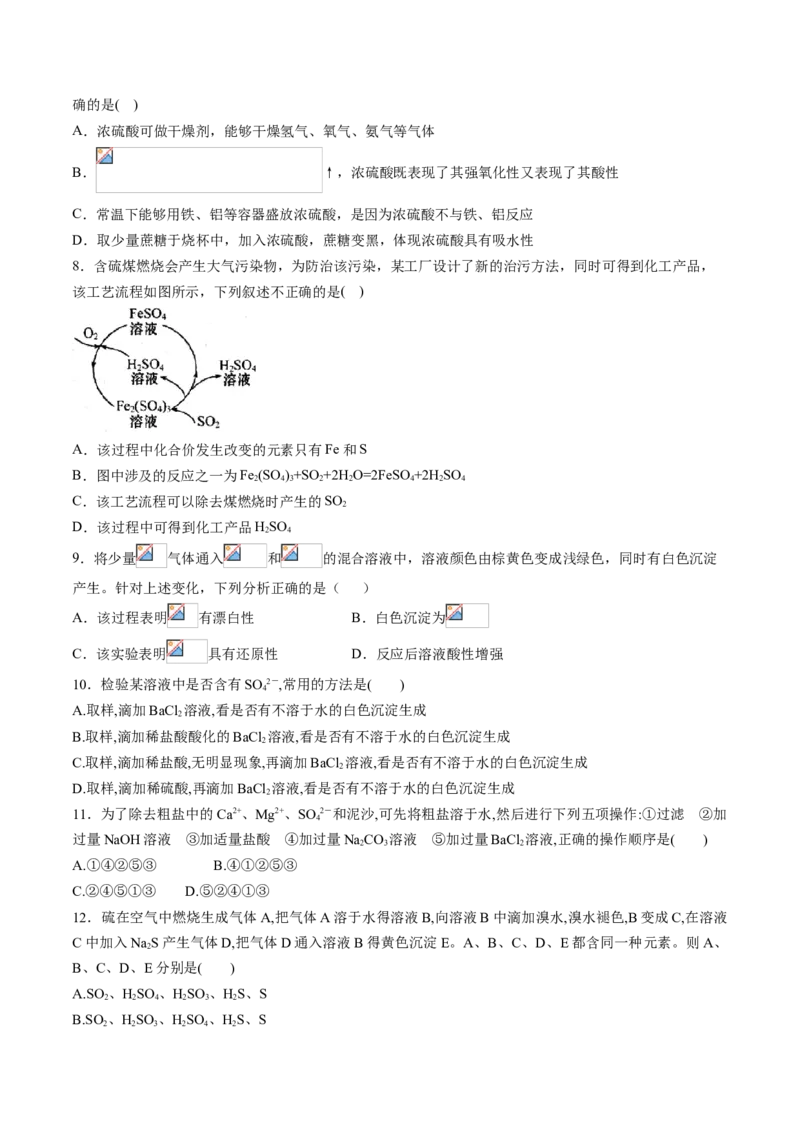
8.含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,
该工艺流程如图所示,下列叙述不正确的是( )
A.该过程中化合价发生改变的元素只有Fe和S
B.图中涉及的反应之一为Fe (SO )+SO+2H O=2FeSO +2H SO
2 4 3 2 2 4 2 4
C.该工艺流程可以除去煤燃烧时产生的SO
2
D.该过程中可得到化工产品HSO
2 4
9.将少量 气体通入 和 的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀
产生。针对上述变化,下列分析正确的是( )
A.该过程表明 有漂白性 B.白色沉淀为
C.该实验表明 具有还原性 D.反应后溶液酸性增强
10.检验某溶液中是否含有SO 2-,常用的方法是( )
4
A.取样,滴加BaCl 溶液,看是否有不溶于水的白色沉淀生成
2
B.取样,滴加稀盐酸酸化的BaCl 溶液,看是否有不溶于水的白色沉淀生成
2
C.取样,滴加稀盐酸,无明显现象,再滴加BaCl 溶液,看是否有不溶于水的白色沉淀生成
2
D.取样,滴加稀硫酸,再滴加BaCl 溶液,看是否有不溶于水的白色沉淀生成
2
11.为了除去粗盐中的Ca2+、Mg2+、SO 2-和泥沙,可先将粗盐溶于水,然后进行下列五项操作:①过滤 ②加
4
过量NaOH溶液 ③加适量盐酸 ④加过量NaCO 溶液 ⑤加过量BaCl 溶液,正确的操作顺序是( )
2 3 2
A.①④②⑤③ B.④①②⑤③
C.②④⑤①③ D.⑤②④①③
12.硫在空气中燃烧生成气体A,把气体A溶于水得溶液B,向溶液B中滴加溴水,溴水褪色,B变成C,在溶液
C中加入NaS产生气体D,把气体D通入溶液B得黄色沉淀E。A、B、C、D、E都含同一种元素。则A、
2
B、C、D、E分别是( )
A.SO 、HSO 、HSO 、HS、S
2 2 4 2 3 2
B.SO 、HSO 、HSO 、HS、S
2 2 3 2 4 2C.SO 、HSO 、HSO 、SO 、NaSO
2 2 3 2 4 3 2 2 3
D.SO 、HSO 、HSO 、SO 、NaSO
3 2 4 2 3 2 2 2 3
13.下列离子方程式或化学方程式正确的是( )
A.SO 通入少量NaClO溶液中:SO +ClO-+HO===SO+Cl-+2H+
2 2 2
B.足量的SO 通入NaCO 溶液中:CO+SO ===CO +SO
2 2 3 2 2
C.铁与硫混合加热:2Fe+3S═══Fe S
2 3
D.浓硫酸与FeS混合:FeS+HSO (浓)===FeSO+H S↑
2 4 4 2
14.把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是( )
A.反应物微粒是S、SO 2-、OH-
3
B.该反应可能在酸性条件下进行
C.氧化剂与还原剂的物质的量之比为2∶1
D.2 mol S参加反应时,转移的电子数为3N
A
15.已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件
及部分产物均已略去,则下列有关说法正确的是( )
A.X使蔗糖变黑的现象只体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.工业上,B转化为D的反应条件为适当温度、常压、使用催化剂
D.若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到有白色沉淀产生
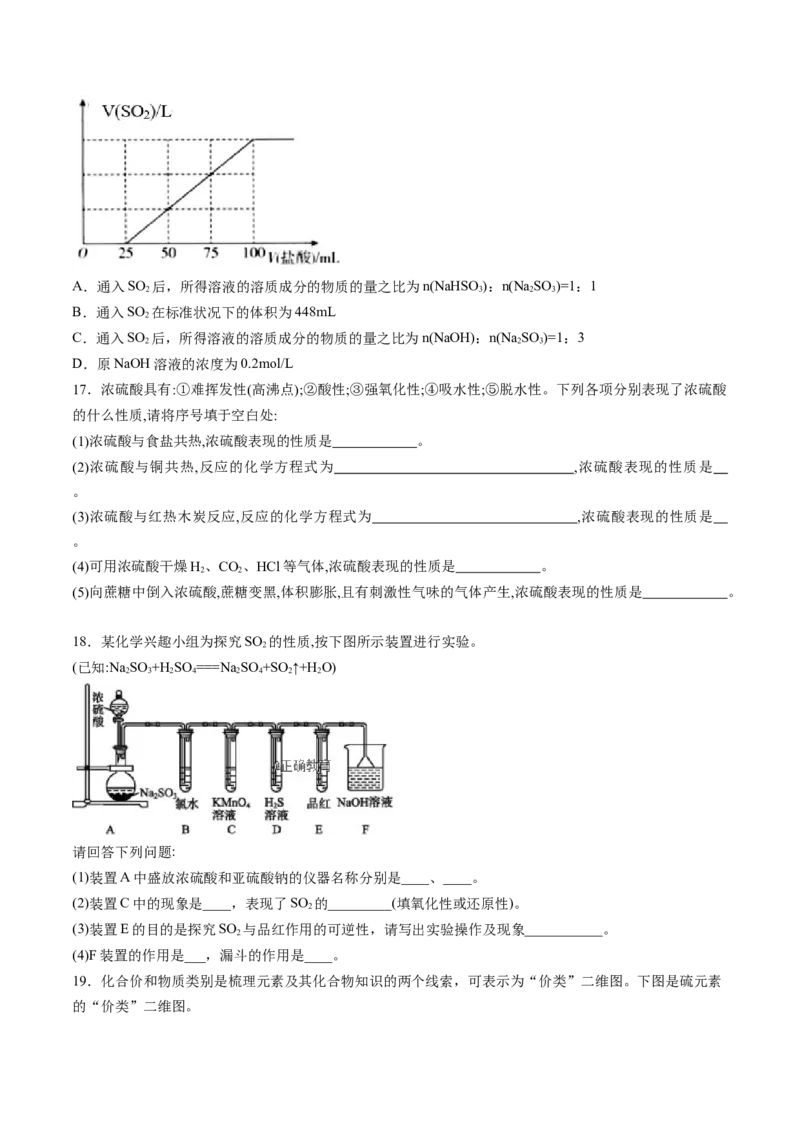
16.向100mlNaOH溶液中通入一定量的SO 气体,充分反应后,再向所得溶液中逐滴加入0.2mol/L的盐
2
酸,产生SO 的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
2A.通入SO 后,所得溶液的溶质成分的物质的量之比为n(NaHSO):n(Na SO )=1:1
2 3 2 3
B.通入SO 在标准状况下的体积为448mL
2
C.通入SO 后,所得溶液的溶质成分的物质的量之比为n(NaOH):n(Na SO )=1:3
2 2 3
D.原NaOH溶液的浓度为0.2mol/L
17.浓硫酸具有:①难挥发性(高沸点);②酸性;③强氧化性;④吸水性;⑤脱水性。下列各项分别表现了浓硫酸
的什么性质,请将序号填于空白处:
(1)浓硫酸与食盐共热,浓硫酸表现的性质是 。
(2)浓硫酸与铜共热,反应的化学方程式为 ,浓硫酸表现的性质是
。
(3)浓硫酸与红热木炭反应,反应的化学方程式为 ,浓硫酸表现的性质是
。
(4)可用浓硫酸干燥H、CO、HCl等气体,浓硫酸表现的性质是 。
2 2
(5)向蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,浓硫酸表现的性质是 。
18.某化学兴趣小组为探究SO 的性质,按下图所示装置进行实验。
2
(已知:Na SO +H SO ===Na SO +SO↑+H O)
2 3 2 4 2 4 2 2
请回答下列问题:
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是____、____。
(2)装置C中的现象是____,表现了SO 的_________(填氧化性或还原性)。
2
(3)装置E的目的是探究SO 与品红作用的可逆性,请写出实验操作及现象___________。
2
(4)F装置的作用是___,漏斗的作用是____。
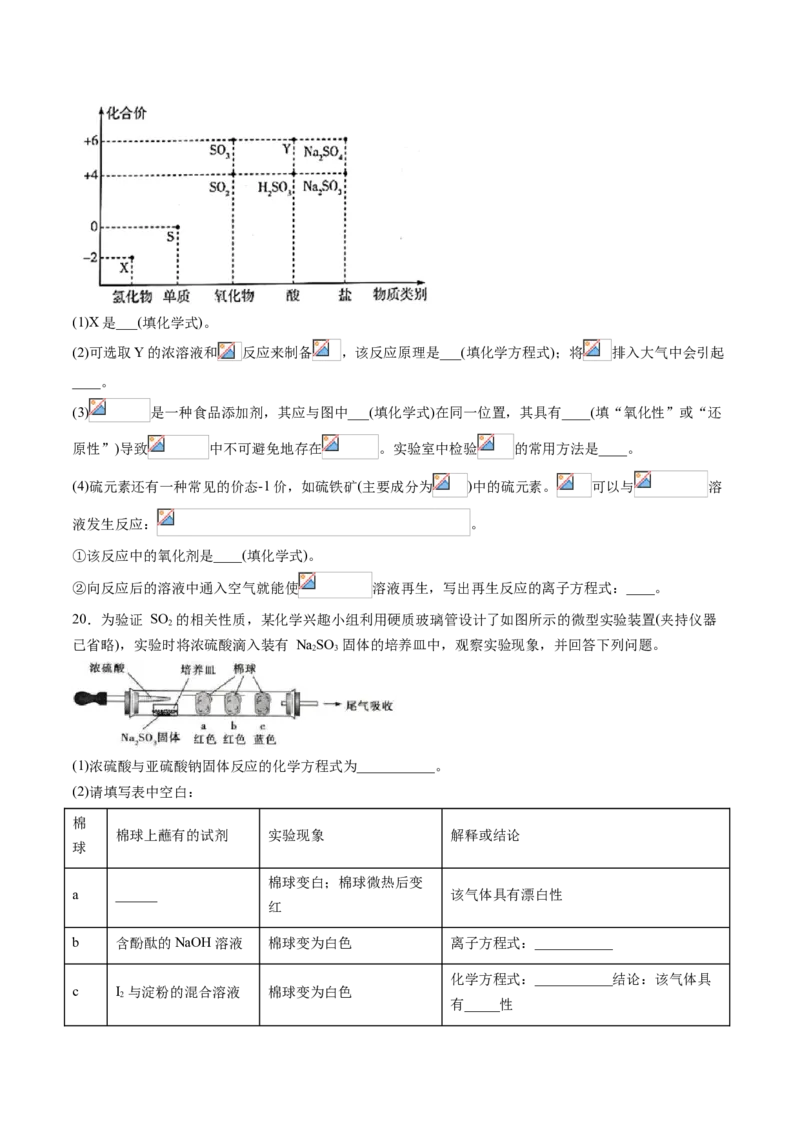
19.化合价和物质类别是梳理元素及其化合物知识的两个线索,可表示为“价类”二维图。下图是硫元素
的“价类”二维图。(1)X是___(填化学式)。
(2)可选取Y的浓溶液和 反应来制备 ,该反应原理是___(填化学方程式);将 排入大气中会引起
____。
(3) 是一种食品添加剂,其应与图中___(填化学式)在同一位置,其具有____(填“氧化性”或“还
原性”)导致 中不可避免地存在 。实验室中检验 的常用方法是____。
(4)硫元素还有一种常见的价态-1价,如硫铁矿(主要成分为 )中的硫元素。 可以与 溶
液发生反应: 。
①该反应中的氧化剂是____(填化学式)。
②向反应后的溶液中通入空气就能使 溶液再生,写出再生反应的离子方程式:____。
20.为验证 SO 的相关性质,某化学兴趣小组利用硬质玻璃管设计了如图所示的微型实验装置(夹持仪器
2
已省略),实验时将浓硫酸滴入装有 NaSO 固体的培养皿中,观察实验现象,并回答下列问题。
2 3
(1)浓硫酸与亚硫酸钠固体反应的化学方程式为___________。
(2)请填写表中空白:
棉
棉球上蘸有的试剂 实验现象 解释或结论
球
棉球变白;棉球微热后变
a ______ 该气体具有漂白性
红
b 含酚酞的NaOH 溶液 棉球变为白色 离子方程式:___________
化学方程式:___________结论:该气体具
c I 与淀粉的混合溶液 棉球变为白色
2
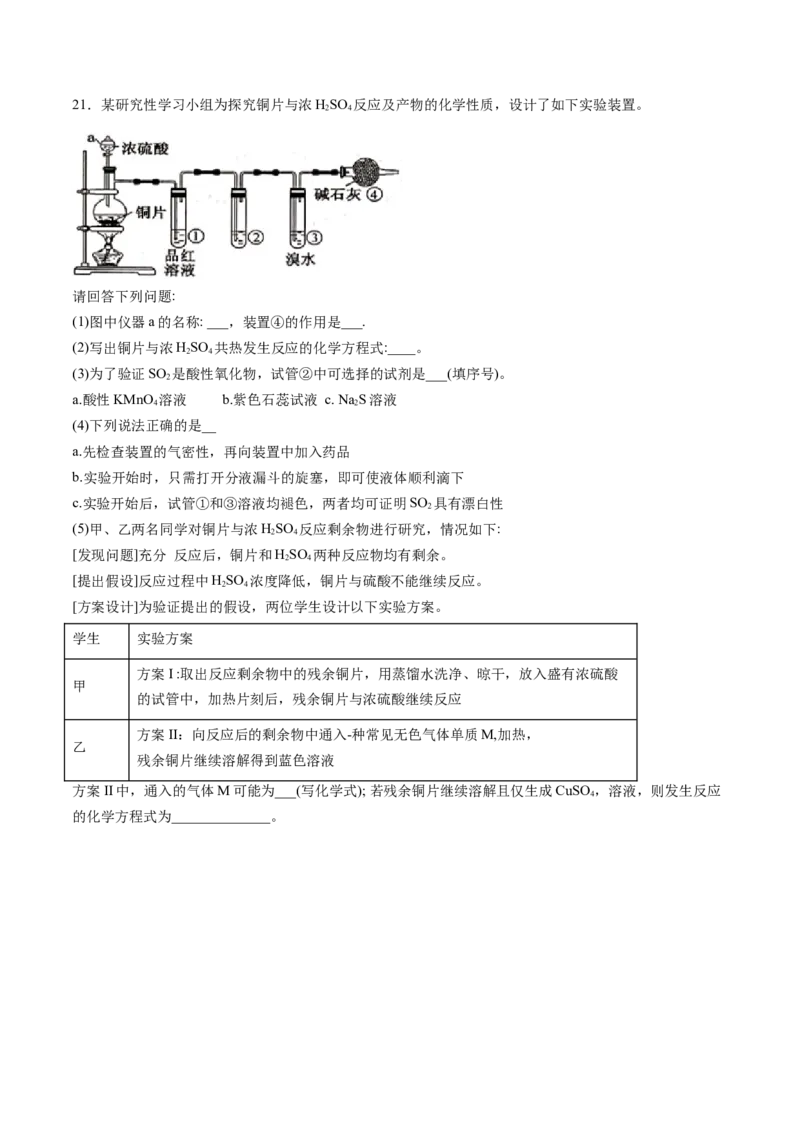
有_____性21.某研究性学习小组为探究铜片与浓HSO 反应及产物的化学性质,设计了如下实验装置。
2 4
请回答下列问题:
(1)图中仪器a的名称: ___,装置④的作用是___.
(2)写出铜片与浓HSO 共热发生反应的化学方程式:____。
2 4
(3)为了验证SO 是酸性氧化物,试管②中可选择的试剂是___(填序号)。
2
a.酸性KMnO 溶液 b.紫色石蕊试液 c. Na S溶液
4 2
(4)下列说法正确的是__
a.先检查装置的气密性,再向装置中加入药品
b.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
c.实验开始后,试管①和③溶液均褪色,两者均可证明SO 具有漂白性
2
(5)甲、乙两名同学对铜片与浓HSO 反应剩余物进行研究,情况如下:
2 4
[发现问题]充分 反应后,铜片和HSO 两种反应物均有剩余。
2 4
[提出假设]反应过程中HSO 浓度降低,铜片与硫酸不能继续反应。
2 4
[方案设计]为验证提出的假设,两位学生设计以下实验方案。
学生 实验方案
方案I :取出反应剩余物中的残余铜片,用蒸馏水洗净、晾干,放入盛有浓硫酸
甲
的试管中,加热片刻后,残余铜片与浓硫酸继续反应
方案II:向反应后的剩余物中通入-种常见无色气体单质M,加热,
乙
残余铜片继续溶解得到蓝色溶液
方案II中,通入的气体M可能为___(写化学式); 若残余铜片继续溶解且仅生成CuSO ,溶液,则发生反应
4
的化学方程式为______________。