文档内容
河南省实验中学 2024—2025 学年高一年级上期月考一
化学
考试时间:75 分钟 分值:100 分 出题人:郭淑芬 审题人: 王丹
可能用到的相对原子量:
H-1 C-12 O-16 Na-23 K-39 Cl-35.5 Al-27 N-14 S-32
一、选择题:(本大题共14小题,每小题3分,共42分,每小题只有一个正确选项)
1.下列说法中,不
.
正
.
确
.
的是 ( )
A.研究物质的性质时,常用到观察、实验、分类、比较等方法
B.1965年,我国化学家首次人工合成了具有生理活性的结晶牛胰岛素
C.俄国化学家门捷列夫提出了原子学说,为近代化学的发展奠定了基础
D.化学家可以在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器
2. 化学与生活密切相关,下列物质与其用途不 . 符 . 合 . 的是 ( )
A. 过氧化钠:呼吸面具的供氧剂 B. 漂白粉:可用于环境的杀菌消毒
C. 纯碱:治疗胃酸过多症 D. 小苏打:制作馒头和面包的膨松剂
3. 下列叙述中,正确的是( )
A.Na O和 Na O 均能使酚酞溶液先变红后褪色
2 2 2
B. 可以用pH试纸测定新制氯水的pH
C. 酒精、钠等着火,均可以用二氧化碳灭火器扑灭
D. 氯水的颜色呈浅黄绿色,说明氯水中含有Cl 分子
2
4. 用N 代表阿伏加德罗常数的数值,下列说法正确的是( )
A
A. 等质量的氧气和臭氧中,所含电子数相同
B.标准状况下,11.2LH O所含分子数为0.5N
2 A
C. 含有N 个氦原子的氦气在标准状况下的体积为11.2L
A
D.0.5mol•L-1的NaCl溶液中Cl-的个数为0.5N
A
高一 化学 第 1 页 (共6页)5. 下列有关Na CO 和NaHCO 的叙述中正确的是( )
2 3 3
A. 向Na CO 溶液中通入等物质的量的HCl,生成的CO 与原Na CO 的物质的量之比为1:2
2 3 2 2 3
B. 向Na CO 饱和溶液中通入足量CO ,有NaHCO 晶体析出
2 3 2 3
C. 利用NaOH可以鉴别Na CO 和NaHCO
2 3 3
D. 等质量的NaHCO 和Na CO 分别与足量盐酸反应,在同温同压下生成的CO 体积相同
3 2 3 2
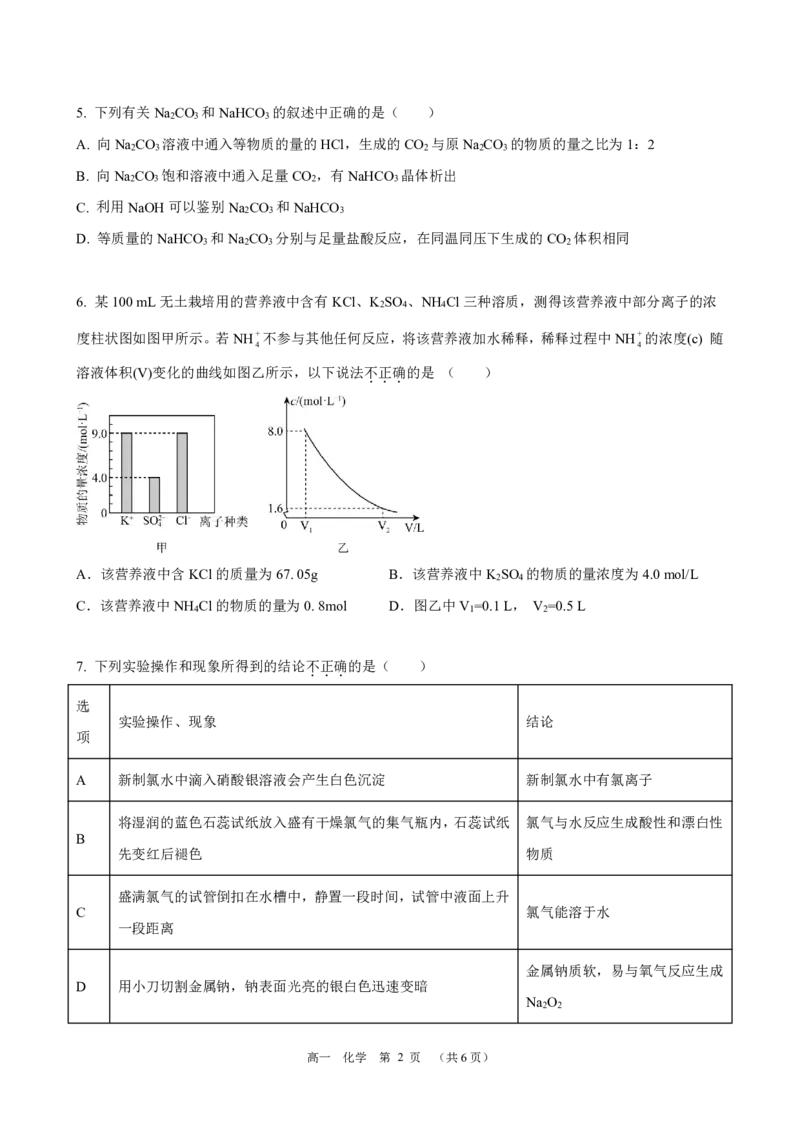
6. 某100mL无土栽培用的营养液中含有KCl、K SO 、NH Cl三种溶质,测得该营养液中部分离子的浓
2 4 4
度柱状图如图甲所示。若NH+不参与其他任何反应,将该营养液加水稀释,稀释过程中NH+的浓度(c) 随
4 4
溶液体积(V)变化的曲线如图乙所示,以下说法不
.
正
.
确
.
的是 ( )
A.该营养液中含KCl的质量为67.05g B.该营养液中K SO 的物质的量浓度为4.0mol/L
2 4
C.该营养液中NH Cl的物质的量为0.8mol D.图乙中V =0.1L, V =0.5L
4 1 2
7. 下列实验操作和现象所得到的结论不 . 正 . 确 . 的是( )
选
实验操作、现象 结论
项
A 新制氯水中滴入硝酸银溶液会产生白色沉淀 新制氯水中有氯离子
将湿润的蓝色石蕊试纸放入盛有干燥氯气的集气瓶内,石蕊试纸 氯气与水反应生成酸性和漂白性
B
先变红后褪色 物质
盛满氯气的试管倒扣在水槽中,静置一段时间,试管中液面上升
C 氯气能溶于水
一段距离
金属钠质软,易与氧气反应生成
D 用小刀切割金属钠,钠表面光亮的银白色迅速变暗
Na O
2 2
高一 化学 第 2 页 (共6页)8.(教材习题)4℃时,100mL 水中溶解了22.4L氯化氢气体(在标准状況下测得)。下列关于所形成溶液
的说法中,正确的是 ( )
A.该溶液溶质的物质的量浓度为10mol•L-1
B.该溶液溶质的物质的量浓度因溶液的密度未知而无法求得
C.该溶液溶质的质量分数因溶液的密度未知而无法求得
D. 该溶液的体积为22.5L
9. 下列溶液的物质的量浓度的相关计算正确的是 ( )
A. 同浓度的三种物质的溶液:Na SO 、MgSO 、Al (SO ) 溶液体积之比为3∶2∶1,则SO 2浓度之比为
2 4 4 2 4 3 4
3∶2∶3
B. 将1mol·L-1的NaCl溶液和0.5mol·L-1的BaCl 溶液等体积混合后,忽略溶液体积变化,c(Cl-)=0.75mol·L-1
2
C. 将100mL5mol·L-1的盐酸加水稀释至1L,再取出5mL,这5mL溶液的物质的量浓度为0.5mol·L-1
D. 配制500mL0.1mol·L-1的CuSO 溶液时,用托盘天平称取胆矾8.0g
4
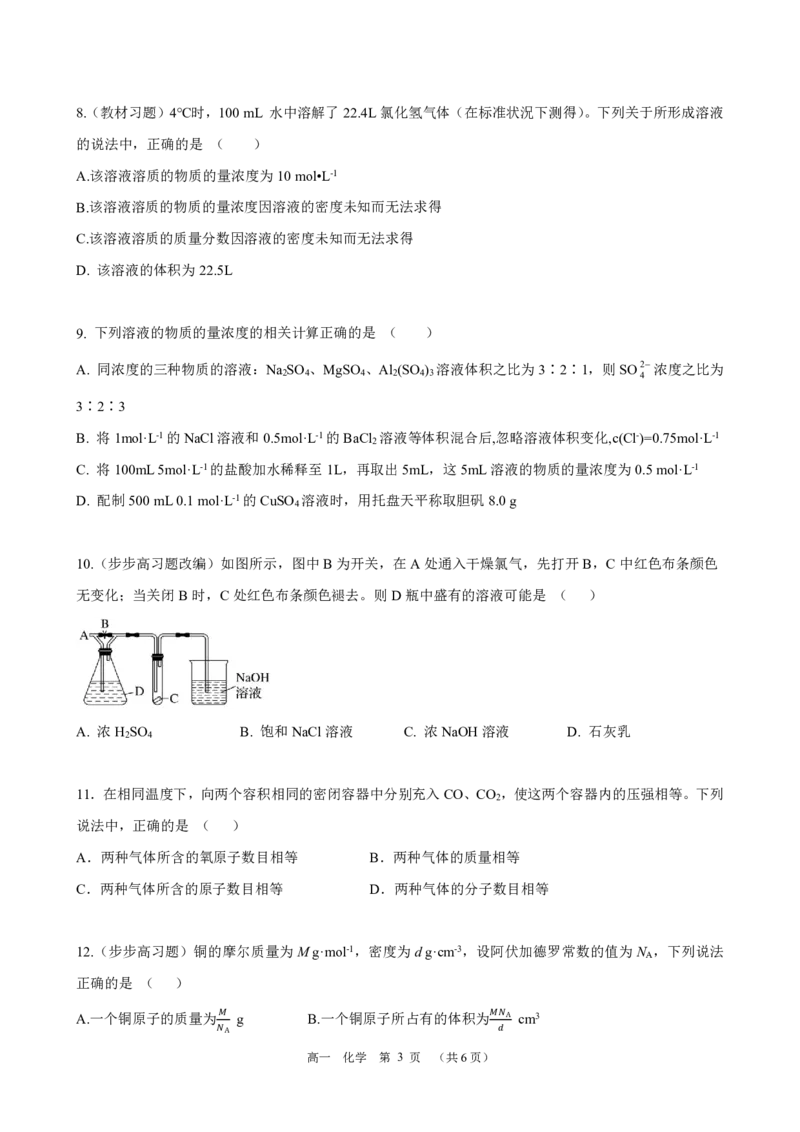
10.(步步高习题改编)如图所示,图中B为开关,在A处通入干燥氯气,先打开B,C中红色布条颜色
无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液可能是 ( )
A. 浓H SO B. 饱和NaCl溶液 C. 浓NaOH溶液 D. 石灰乳
2 4
11.在相同温度下,向两个容积相同的密闭容器中分别充入CO、CO ,使这两个容器内的压强相等。下列
2
说法中,正确的是 ( )
A.两种气体所含的氧原子数目相等 B.两种气体的质量相等
C.两种气体所含的原子数目相等 D.两种气体的分子数目相等
12.(步步高习题)铜的摩尔质量为Mg·mol-1,密度为dg·cm-3,设阿伏加德罗常数的值为N ,下列说法
A
正确的是 ( )
A.一个铜原子的质量为 g B.一个铜原子所占有的体积为 cm3
A
A
高一 化学 第 3 页 (共6页)C.1kg铜所含原子的数目为dN D.dm3铜所含有的原子数为
A
A
13. 下列说法正确的是 ( )
A.20%NaOH溶液中NaOH的物质的量浓度,是10%NaOH 溶液中 NaOH 的物质的量浓度的二倍
m
B.VL硫酸铝溶液中含Al3+的质量为mg,则溶液中的SO2-物质的量浓度为 mol/L
4 18V
C.同温同压下,20mLCH 和60mLO 所含的原子数之比为1:3
4 2
D.镁原子的摩尔质量等于它的相对原子质量
14. 某班同学对一定物质的量浓度溶液配制进行实验。甲组:用碳酸钠晶体(Na CO •10H O)来配制
2 3 2
1.0mol•L-1Na CO 溶液480mL;乙组:用98%的浓硫酸(密度为1.84g/ml)配制0.5mol•L-1稀硫酸500mL。
2 3
假如其他操作都准确无误,下列说法正确的是 ( )
A. 定容后,将容量瓶振荡摇匀、静置发现液面低于刻度线,又加少量水至刻度线
B. 甲组需称取碳酸钠晶体(Na CO •10H O)53.0g;乙组需用量筒量取浓硫酸13.6mL
2 3 2
.
C 使用前容量瓶中有水珠,需用烘箱烘干后使用
D. 甲组定容时仰视刻度线,配制浓度偏低;乙组量筒量取时俯视刻度线,配制浓度偏低
二、非选择题(本大题共4小题,共58分)
15.(16分) 根据所学知识填写下列空白。
(1) 钠投入硫酸铜溶液中,反应的化学反应方程式为 。
(2) 向碳酸氢钠溶液中滴加氢氧化钠溶液,反应的化学反应方程式为 。
(3) 在标准状况下,1.7g氨气与同条件下___________molH S含有相同的氢原子数。
2
(4) 已知某气态氧化物化学式为RO ,在标准状况下,1.28g该氧化物的体积是448mL,则R的摩尔质量
2
为___________,含有的氧原子数为___________。
(5) 将18.7gNa O和Na O 的混合物加入足量的水中充分反应后,生成标准状况下的气体2.24L,计算:原
2 2 2
混合物中Na O的物质的量为___________mol。
2
(6) 密度为1.18g•mL-1、氯化氢的质量分数为36.5%的浓盐酸的物质的量浓度为___________mol·L-1。
高一 化学 第 4 页 (共6页)16.(14分)某实验室需要配制240mL0.1molL−1NaOH溶液,配制过程如下。请回答下列问题:
I.实验仪器:
(1) 除玻璃棒、量筒、胶头滴管外,从下图中选择配制溶液还需使用的玻璃仪器 (填仪器名称)。
II.溶液配制:
①计算所需NaOH固体的质量,并用托盘天平称取NaOH固体。
②将配制好的溶液倒入试剂瓶中,贴好标签。
③向容量瓶中继续加蒸馏水,当液面离容量瓶的刻度线1~2cm时,改用胶头滴管滴加蒸馏水直到溶
液的凹液面与刻度线相切。盖好容量瓶瓶塞,反复上下颠倒,摇匀。
④将烧杯中溶液冷却后沿玻璃棒转移入容量瓶,并用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗
涤液也全部注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
⑤把称取的NaOH固体放入烧杯中,加入适量蒸馏水溶解。
(2) 步骤①中称取的NaOH质量为 g;以上步骤的正确操作顺序为 (填序号)。
(3) 使用容量瓶前需进行的操作是 。
(4) 整个配制过程中,玻璃棒的作用是搅拌和 。
III. 结果分析:
(5) 若其它操作均正确,造成所配溶液浓度偏 . 高 . 的操作是 。
A.定容时俯视刻度线
B.转移溶液前,容量瓶中有少量蒸馏水
C.NaOH溶解后,未冷却就立即转移到容量瓶
D.未洗涤溶解NaOH时用过的烧杯和玻璃棒
17.(14分) 某工厂在山坡坑道的仓库里贮有氯气钢瓶。某天,有一只贮有氯气的钢瓶损坏,造成氯气泄漏,
在场工人采取以下措施,请选择。
(1) ①处理该钢瓶的方法正确的是 。
A.钢瓶推到坡下的小河里 B.把钢瓶丢到深坑里,用石灰填埋 C.把钢瓶扔到农田中
②若在场工人没有防毒面具,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该
物质是 。
A.NaOH B.NaCl C.Na CO
2 3
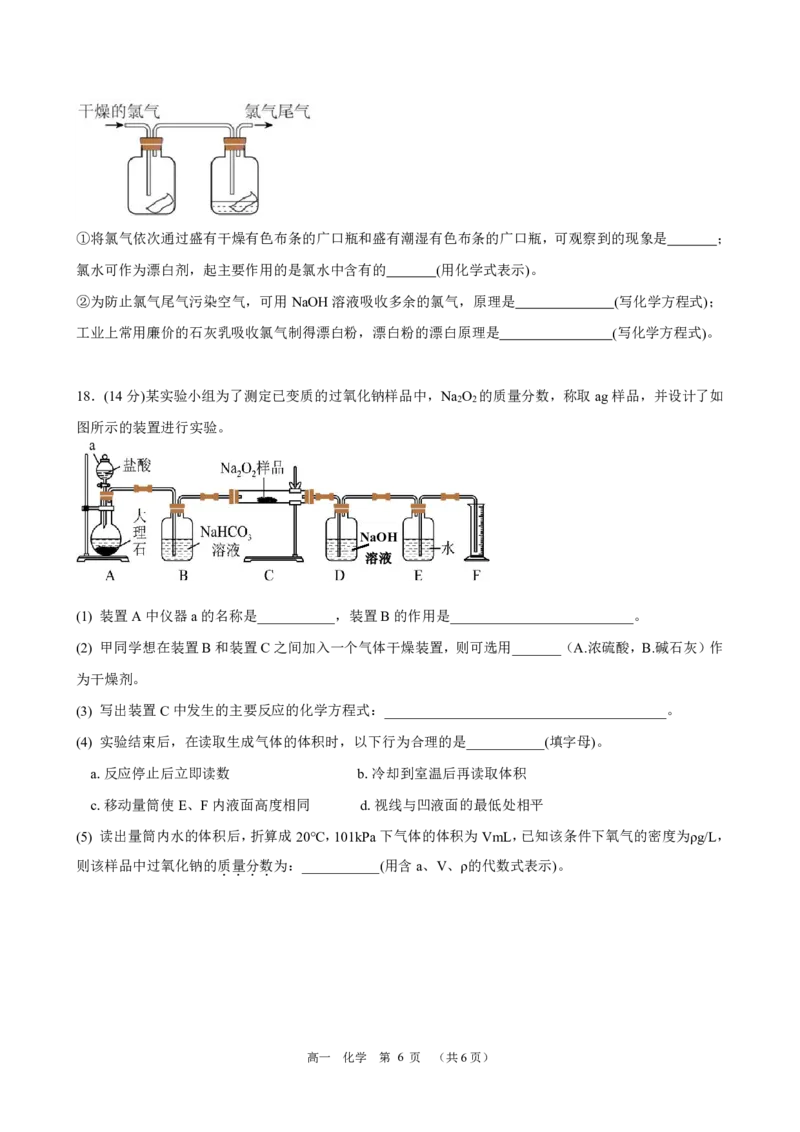
(2) 为了探究HClO的漂白性,某同学设计了如图的实验:
高一 化学 第 5 页 (共6页)①将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 ;
氯水可作为漂白剂,起主要作用的是氯水中含有的 (用化学式表示)。
②为防止氯气尾气污染空气,可用NaOH溶液吸收多余的氯气,原理是 (写化学方程式);
工业上常用廉价的石灰乳吸收氯气制得漂白粉,漂白粉的漂白原理是 (写化学方程式)。
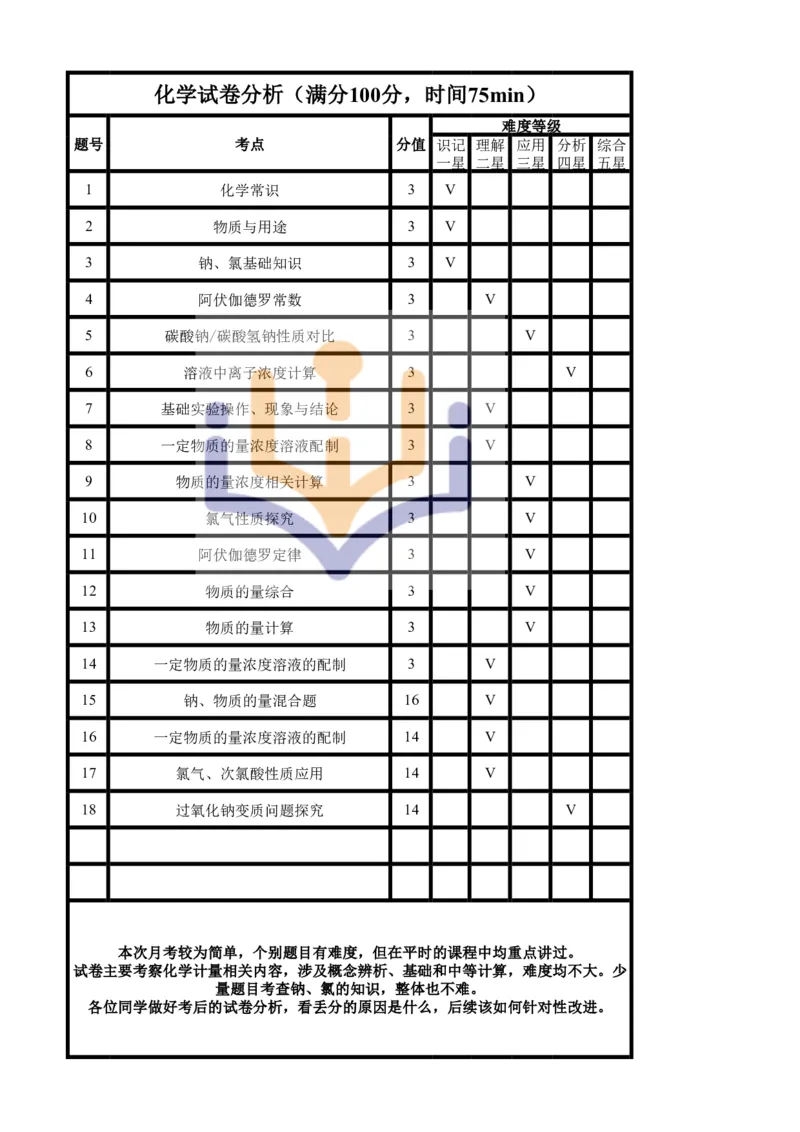
18.(14分)某实验小组为了测定已变质的过氧化钠样品中,Na O 的质量分数,称取ag样品,并设计了如
2 2
图所示的装置进行实验。
NaOH
溶液
(1) 装置A中仪器a的名称是___________,装置B的作用是__________________________。
(2) 甲同学想在装置B和装置C之间加入一个气体干燥装置,则可选用_______(A.浓硫酸,B.碱石灰)作
为干燥剂。
(3) 写出装置C中发生的主要反应的化学方程式:________________________________________。
(4) 实验结束后,在读取生成气体的体积时,以下行为合理的是___________(填字母)。
a.反应停止后立即读数 b.冷却到室温后再读取体积
c.移动量筒使E、F内液面高度相同 d.视线与凹液面的最低处相平
(5) 读出量筒内水的体积后,折算成20℃,101kPa下气体的体积为VmL,已知该条件下氧气的密度为ρg/L,
则该样品中过氧化钠的质
.
量
.
分
.
数
.
为:___________(用含a、V、ρ的代数式表示)。
高一 化学 第 6 页 (共6页)河南省实验中学2023-2024 上期月考1答案
一、选择题(共42分):
1.C 2.C 3.D 4.A 5.B 6.A 7.D 8.B 9.C 10.B 11.D 12.A 13.B 14.D
二、非选择题(共58分,除标注外每空2分)
15、(16分)
(1)2Na+2H
2
O+CuSO
4
===Na
2
SO
4
+Cu(OH)
2
↓+H
2
↑ (3分)
(2)NaHCO
3
+NaOH===Na
2
CO
3
+H
2
O (3分)
(3)0.15
(4)32g/mol 0.04N 或2.408×1022
A
(5) 0.05
(6)11.8
16、(14分)
(1)烧杯、250mL容量瓶 (4分)
(2)1.0 ①⑤④③②
(3)检查是否漏水
(4)引流
(5)AC
17、(14分)
(1)①B C ②潮湿有色布条褪色而干燥有色布条不褪色 HClO
(2)2NaOH+Cl =NaClO+NaCl+H O ( 3分)
2 2
Ca(ClO) +CO +H O===CaCO +2HClO ( 3分)
2 2 2 3
18、(14分)
(1)分液漏斗 除去CO 中的HCl杂质
2
(2)A
(3)2Na O +2CO =2Na CO +O (3分)
2 2 2 2 3 2
(4)bcd (3分)
39V
(5) %
80a化学试卷分析(满分100分,时间75min)
难度等级
题号 考点 分值 识记 理解 应用 分析 综合
一星 二星 三星 四星 五星
1 化学常识 3 V
2 物质与用途 3 V
3 钠、氯基础知识 3 V
4 阿伏伽德罗常数 3 V
5 碳酸钠/碳酸氢钠性质对比 3 V
6 溶液中离子浓度计算 3 V
7 基础实验操作、现象与结论 3 V
8 一定物质的量浓度溶液配制 3 V
9 物质的量浓度相关计算 3 V
10 氯气性质探究 3 V
11 阿伏伽德罗定律 3 V
12 物质的量综合 3 V
13 物质的量计算 3 V
14 一定物质的量浓度溶液的配制 3 V
15 钠、物质的量混合题 16 V
16 一定物质的量浓度溶液的配制 14 V
17 氯气、次氯酸性质应用 14 V
18 过氧化钠变质问题探究 14 V
本次月考较为简单,个别题目有难度,但在平时的课程中均重点讲过。
试卷主要考察化学计量相关内容,涉及概念辨析、基础和中等计算,难度均不大。少
量题目考查钠、氯的知识,整体也不难。
各位同学做好考后的试卷分析,看丢分的原因是什么,后续该如何针对性改进。