文档内容
_
_
_ 湖南高一年级期中考试
_
_
_
_
_ 化学
_
_
_
_ 本试卷满分 100分,考试用时 75 分钟。
_
_
_ 注意事项:
_
_
_
_
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
_
_ 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需
:
号 改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。
考 写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
_ _ 4.本试卷主要考试内容:人教版必修第一册第一章至第二章。
_
_ _ 题 5.可能用到的相对原子质量:
_
_
_
_
_ _
_ 答
_
_
_
_ _
_ _ 要
_
_
:
名
姓 不
_
_ 内
_
_ _
_
_
_
_ 线
_ _
_
_
_
_
_ 封
_
_
_ _
_
:
密
级
班
_
_
_
_
_
_
_
_
_
_
_
_
_
_
_
_
_
_ _ _ _
:
校
学
高一化学 第 1 页 共 4 页 高一化学 第 2 页 共 4 页
H 1 C 12 N 14 O 16 N a 23 S 32 C l 35.5
C a 40 C u 64
一、选择题:本题共 14小题,每小题 3分,共 42分。在每小题给出的四个选项中,只有一项
是符合题目要求的。
1.化学与生活密切相关。下列物质的用途利用了其还原性的是( )
A.食品袋中铁粉作除氧剂 B.醋酸用于除去水壶中的水垢
C.臭氧作自来水消毒剂 D.铜用于制作电线
2.分类是化学学科常见的思想方法之一,下列对相关物质的分类正确的是( )
A.氨水属于电解质 B. N a H S O
4
属于酸
C.云属于胶体 D. C O 属于酸性氧化物
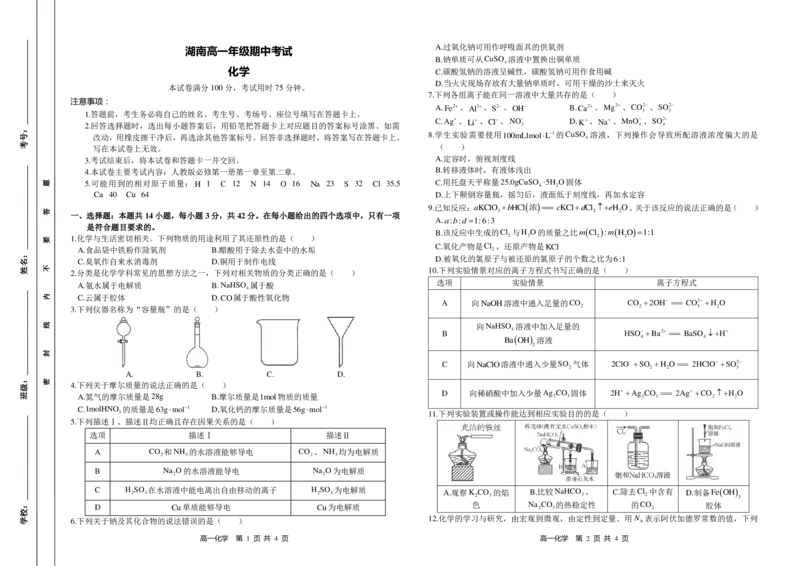
3.下列仪器名称为“容量瓶”的是( )
A. B. C. D.
4.下列关于摩尔质量的说法正确的是( )
A.氮气的摩尔质量是 2 8 g B.摩尔质量是 1 m o l 物质的质量
C.1molHNO 的质量是63gmol1 D.氧化钙的摩尔质量是56gmol1
3
5.下列描述Ⅰ、描述Ⅱ均正确且存在因果关系的是( )
选项 描述Ⅰ 描述Ⅱ
A C O
2
和NH 的水溶液能够导电
3
C O
2
A.过氧化钠可用作呼吸面具的供氧剂
B.钠单质可从CuSO 溶液中置换出铜单质
4
C.碳酸氢钠的溶液呈碱性,碳酸氢钠可用作食用碱
D.当火灾现场存放有大量钠单质时,可用干燥的沙土来灭火
7.下列各组离子能在同一溶液中大量共存的是( )
A.Fe2、Al3、S2、OH B.Ca2、Mg2、CO2、SO2
3 3
C.Ag、Li、Cl、
、NH 均为电解质
3
B Na O的水溶液能导电 Na O为电解质
2 2
C H SO 在水溶液中能电离出自由移动的离子 H SO 为电解质 2 4 2 4
D Cu单质能够导电 Cu为电解质
6.下列关于钠及其化合物的说法错误的是( )
N O 3 D.K、Na、MnO、SO2
4 4
8.学生实验需要使用100mL1molL1的CuSO 溶液,下列操作会导致所配溶液浓度偏大的是
4
( )
A.定容时,俯视刻度线
B.转移液体时,有液体浅出
C.用托盘天平称量 2 5 . 0 g C u S O 4 5 H 2 O 固体
D.上下颠倒容量瓶,摇匀后,液面低于刻度线,再加水定容
9.已知反应: a K C l O
3
b H C l 浓 c K C l d C l
2
e H
2
O 。关于该反应的说法正确的是( )
A. a : b : d 1 : 6 : 3
B.该反应中生成的 C l
2
与 H
2
O 的质量之比 m C l
2
: m H
2
O 1 : 1
C.氧化产物是 C l
2
,还原产物是 K C l
D.被氧化的氯原子与被还原的氯原子的个数之比为 6 : 1
10.下列实验情景对应的离子方程式书写正确的是( )
选项 实验情景 离子方程式
A 向 N a O H 溶液中通入足量的 C O
2
C O
2
2 O H C O 23 H
2
O
向
B
N a H S O
4
溶液中加入足量的
B a O H
2
溶液
H S O 4 B a 2 B a S O
4
H
C 向 N a C l O 溶液中通入少量 S O
2
气体 2 C l O S O
2
H
2
O 2 H C l O S O 23
D 向稀硝酸中加入少量 A g 2 C O 3 固体 2 H A g 2 C O 3 2 A g C O 2 H 2 O
11.下列实验装置或操作能达到相应实验目的的是( )
A.观察K CO 的焰 B.比较NaHCO 、 C.除去Cl 中含有 D.制备FeOH 2 3 3 2 3
色 Na CO 的热稳定性 的CO 胶体 2 3 2
12.化学的学习与研究,由宏观到微观,由定性到定量。用N 表示阿伏加德罗常数的值,下列
A定量分析正确的是( )
高一化学 第 3 页 共 6 页 高一化学 第 4 页 共 6 页A.标准状况下,22.4LHH O的质量为18g
2
B.等物质的量的O 、CO 含有的O原子数均为2N
2 2 A
C.1L0.5molL1NaHCO 溶液中含有的H原子数为0.5N
3 A
D.通常状况下,7.8gNa O 固体中含有的阴离子数为0.1N
2 2 A
13.实验室中,将17g在空气中部分变质的Na O 粉末样品溶于20mL水中,收集到2.4g干燥的
2 2
气体,然后向水溶液中加入200g质量分数为 7.3%的盐酸恰好完全反应,则m (发生变质的
Na O ):m(未变质的Na O )为( )
2 2 2 2
A.1:1 B.3:1 C.1:3 D.无法确定
14.甲、乙、丙、丁四种可溶性盐,其阳离子分别是Na、Ba2、
题
答
要
不
内
线
封
密
高一化学 第 3 页 共 4 页 高一化学 第 4 页 共 4 页
C u 2 、Ag中的某一种,阴
离子分别是Cl、SO2、CO2、
4 3
N O 3 中的某一种。已知:每种离子均不重复出现。现做以
下实验:
①各取少量四种盐,分别溶于盛有 5 m L 蒸馏水的 4支试管中,只有乙盐溶液呈蓝色。
②分别向 4 支试管中加入 2 m L 稀盐酸,发现甲盐溶液中产生白色沉淀,丙盐溶液中有较多
气泡产生,而丁盐溶液中无明显现象。
下列说法正确的是( )
A.甲盐溶液中产生的白色沉淀是 A g C l
B.乙盐为 C u N O
3
2
C.若向丙盐溶液中滴加稀盐酸,溶液中立即产生气泡
D.实验②结束后,向盛有丁盐溶液的试管中依次滴加足量的稀硝酸、 A g N O
3
溶液,可检验
丁盐中是否含有 C l
二、非选择题:本题共 4小题,共58分。
15.(15 分)碳纳米管可以看成是由石墨片层卷成的管状物,在力学、电学等方面都具有非凡
的性能。工业上用电弧法合成的碳纳米管中常伴有大量的杂质碳纳米颗粒,这种碳纳米颗
粒 可 用 氧 化 气 化 法 提 纯 , 反 应 的 化 学 方 程 式 为
3 C 2 K
2
C r
2
O
7
8 H
2
S O
4
3 C O
2
2 K
2
S O
4
2 C r
2
S O
4
3
8 H
2
O 。 已 知 氧 化 性 :
K
2
C r
2
O
7
K M n O
4
(1)取出50mL上述盐酸,该50mL溶液中HCl的物质的量浓度为________molL1,将该
盐酸稀释至250mL,稀释后溶液中HCl的物质的量浓度为________molL1。
(2)实验室需要240mL1.0molL1盐酸,用上述盐酸试配制:
①用________(填规格)mL量筒量取上述盐酸,倒入烧杯中,用适量水稀释,待冷
却至室温后,转移到________中,洗涤烧杯内壁和________2~3 次,并转移洗涤液。
②继续加水至离刻度线1~2cm时,改用________滴加蒸馏水至溶液的________,盖好
瓶塞,反复上下颠倒,摇匀;最后装入试剂瓶中,贴上药品标签。
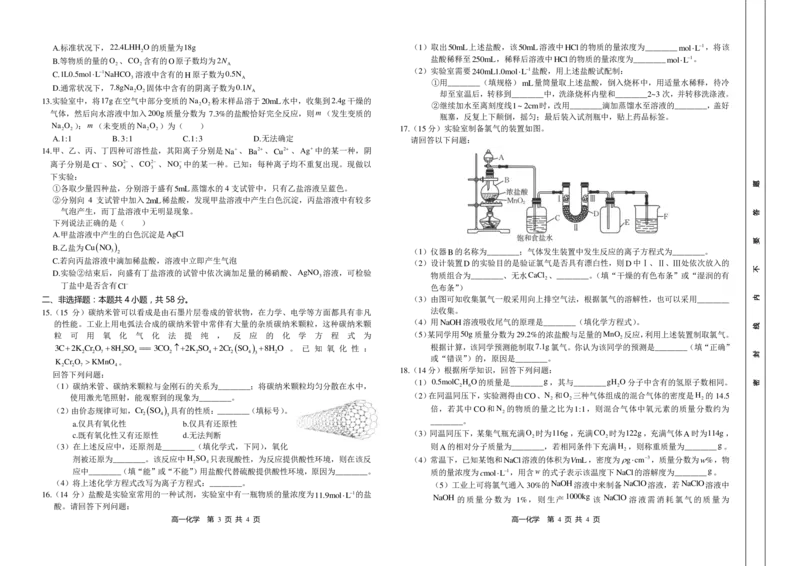
17.(15分)实验室制备氯气的装置如图。
请回答以下问题:
(1)仪器
。
回答下列问题:
(1)碳纳米管、碳纳米颗粒与金刚石的关系为________;将碳纳米颗粒均匀分散在水中,
使用激光笔照射,能观察到的现象为________。
(2)由价态规律可知,Cr SO 具有的性质:________(填标号)。
2 4 3
a.仅具有氧化性 b.仅具有还原性
c.既有氧化性又有还原性 d.无法判断
(3)在上述反应中,还原剂是________(填化学式,下同),氧化
剂被还原为________。该反应中H SO 只表现酸性,为反应提供酸性环境,则在该反
2 4
应中________(填“能”或“不能”)用盐酸代替硫酸提供酸性环境,原因为________。
(4)将上述化学方程式改写为离子方程式:________。
16.(14 分)盐酸是实验室常用的一种试剂,实验室中有一瓶物质的量浓度为11.9molL1的盐
酸。请回答下列问题:
B 的名称为________;气体发生装置中发生反应的离子方程式为________。
(2)设计装置 D 的实验目的是验证氯气是否具有漂白性,则 D 中Ⅰ、Ⅱ、Ⅲ处依次放入的
物质组合为________、无水 C a C l
2
、________。(填“干燥的有色布条”或“湿润的有
色布条”)
(3)由图可知收集氯气一般采用向上排空气法,根据氯气的溶解性,也可以采用________
法收集。
(4)用 N a O H 溶液吸收尾气的原理是________(填化学方程式)。
(5)某同学用 5 0 g 质量分数为29.2%的浓盐酸与足量的 M n O
2
反应,利用上述装置制取氯气。
根据计算,该同学预测能制取 7 .1 g 氯气。你认为该同学的预测是________(填“正确”
或“错误”)的,原因是________。
18.(14分)根据所学知识,回答下列问题:
(1) 0 . 5 m o l C
2
H
6
O 的质量是________ g ,其与________ g H
2
O 分子中含有的氢原子数相同。
(2)在同温同压下,实验测得由 C O 、 N
2
和 O
2
三种气体组成的混合气体的密度是 H
2
的14.5
倍,若其中CO和N 的物质的量之比为1:1,则混合气体中氧元素的质量分数约为
2
________。
(3)同温同压下,某集气瓶充满O 时为116g,充满CO 时为122g,充满气体A时为114g,
2 2
则A的相对分子质量为________,若相同条件下充满H ,则称重质量为________g。
2
(4)常温下,已知某饱和NaCl溶液的体积为VmL,密度为gcm3,质量分数为w%,物
质的量浓度为cmolL1,用含w的式子表示该温度下NaCl的溶解度为________g。
(5)工业上可将氯气通入 30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中
NaOH 的质量分数为 1%,则生产 1000kg 该 NaClO 溶液需消耗氯气的质量为kg
________ (保留整数)。
高一化学 第 13 页 共 10 页 高一化学 第 14 页 共 10 页
学科网(北京)股份有限公司