文档内容
5.2.2 氨和铵盐 练习(解析版)
1.下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
A.①③ B.②③
C.①④ D.②④
【答案】A
【解析】①NH Cl固体受热分解生成NH 和HCl,而当温度降低时,NH 和HCl又重新化合成固体
4 3 3
NH Cl,不能用来制备氨气,故①错误;②向CaO中滴加浓氨水,CaO遇水生成Ca(OH) ,同时放
4 2
出大量热量,使浓氨水中的氨气逸出,故②正确;③固体加热制气体时,试管口应略向下倾斜,使
产生的水能够流出,以免损坏试管,故③错误;④浓氨水易挥发,浓氨水加热可以制取NH ,故④
3
正确;制取氨气的装置和选用的试剂错误的有①③,故选A。
2.喷泉是一种常见的自然现象,如下图是化学教材中常用的喷泉实验装置,在烧瓶中充满干燥气
体,而胶头滴管及烧杯中分别盛有液体。下列气体和液体的组合中不可能形成喷泉的是
A.HCl和HO B.CO 和NaOH溶液
2 2
C.NH 和HO D.O 和HO
3 2 2 2
【答案】D
【详解】
A.HCl极易溶于水,则可形成喷泉,A不符合题意;
B.二氧化碳极易与NaOH反应,产生压强差,形成喷泉,B不符合题意;
C.氨气极易溶于水,可形成喷泉,C不符合题意;
D.氧气不溶于水,则不能形成喷泉,D符合题意;
3.取三张湿润的蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加98.3%的硫酸、新制氯水、浓
氨水,三张试纸最后呈现的颜色是
A.红、白、蓝 B.黑、白、蓝
C.白、白、蓝 D.黑、红、蓝
【答案】B
【详解】
浓硫酸具有脱水性,能使试纸变黑,氯水中含有HClO,能漂白试纸,浓氨水显碱性,能使试纸变
蓝,答案选B。4.将O 和NH 的混合气体448mL通过加热的三氧化二铬(催化剂),充分反应后,再通过足量的
2 3
水,最终收集到44.8mL O 。原混合气体中O 的体积可能是(假设氨全部被氧化;气体体积均已换
2 2
算成标准状况)( )
A.134.4mL B.313.6mL
C.287.5mL D.268.8mL
【答案】B
【详解】
最终收集到44.8mL气体为氧气,发生反应有:4NH +5O 4NO+6H O、
3 2 2
4NO+3O +2H O=4HNO ,设氧气总体积为y,氨气总体积为x,则:①x+y=448mL;由于氨气完全
2 2 3
反应,则x体积氨气消耗氧气体积为:x×5/4=5x/4,同时生成NO体积为x,生成的NO完全反应消
耗氧气的体积为:x×3/4=3x/4,则:②5x/4+3x/4+44.8mL=y,联立①②解得:x=134.4mL、
y=313.6mL,即:氧气体积为313.6mL;答案选B。
5.下列有关氮元素的单质及其化合物的说法错误的是( )
①氮气与氧气在放电的条件下可直接生成NO ②铵盐都不稳定,受热分解都生成氨气 ③向
2
Fe(NO ) 溶液中滴加稀盐酸,无明显的变化 ④实验室加热氯化铵固体,用碱石灰除氯化氢的方法
3 2
制备氨气
A.①③④ B.①③
C.①④ D.①②③④
【答案】D
【详解】
①放电条件下,氮气和氧气反应生成一氧化氮而不是二氧化氮,一氧化氮不稳定,易被氧气氧化生
成二氧化氮,①错误;②NH NO 加热到190℃时分解生成一氧化二氮和水,若加热到300℃左右时
4 3
分解生成氮气、硝酸和水,②错误;③向硝酸亚铁溶液中加入稀盐酸,酸性条件下,硝酸根离子具
有强氧化性,能把亚铁离子氧化生成铁离子,同时自身被还原生成一氧化氮,③错误;④氯化铵受
热易分解,冷却时又生成氯化铵,所以得不到氨气,④错误;答案选D。
6.为检验一种氮肥的成分,某学习小组的同学进行了以下实验:①加热氮肥样品生成两种气体,
其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊。②取少量该氮肥
样品溶于水,并加入少量BaCl 溶液,没有明显变化。由此可知该氮肥的主要成分是
2
A.NH HCO B.NH Cl
4 3 4
C.(NH )CO D.NH NO
4 2 3 4 3
【答案】A
【详解】
气体能使湿润的红色石蕊试纸变蓝,说明该气体是氨气,即该氮肥中含有NH +。另一种气体能使
4
澄清石灰水变浑浊,说明该气体是CO。取少量该氮肥样品溶于水,并加入少量氯化钡溶液,没有
2
明显变化,这说明该氮肥中没有SO 2-和CO2-,因此该氮肥应该是碳酸氢铵;
4 3
7.实验室可用下图所示装置干燥、收集某气体R,则R可能是A.SO B.NH
2 3
C.HCl D.Cl
2
【答案】B
【详解】
A、SO 属于酸性氧化物,不能用此装置干燥、收集气体,故A错误;
2
B、NH 是碱性气体且密度小于空气的密度,可以用此装置干燥、收集NH ,故B正确;
3 3
C、HCl是酸性气体,不能用碱石灰干燥,故C错误;
D、Cl 不能用碱石灰干燥,且氯气的密度大于空气的,故D错误;
2
8.氨的催化氧化是制硝酸的主要反应之一,其微观示意图如下。下列说法正确的是( )
A.甲的化学式为NH , 其水溶液呈碱性
3
B.该反应中元素的化合价都发生改变
C.该反应中甲、乙的质量比为17 :32
D.生成物丙、丁的分子个数比为1:2
【答案】A
【详解】
依据图示的分子结构可知,该反应的化学方程式为:4NH +5O 4NO+6H O;
3 2 2
A.通过观察题中的图示可知,甲是氨气,其水溶液是氨水,呈碱性,A正确;
B.由方程式和化合价原则可知,该反应中氢元素的化合价没有发生改变,B错误;
C.由方程式可知,该反应中甲、乙的质量比为(17×4):(32×5)=17:40,C错误;
D.由方程式可知,生成物丙、丁的分子个数比为:4:6=2:3,D错误。
故合理选项是A。
9.起固定氮作用的化学反应是
A.氮气与氢气在一定条件下反应生成氨气
B.一氧化氮与氧气反应生成二氧化氮
C.氨气经催化氧化生成一氧化氮
D.由氨气制碳酸氢铵和硫酸铵
【答案】A
【详解】
A. 氮元素由游离态转化为化合态,故A正确;
B. 氮元素始终是化合态,故B错误;C. 氮元素始终是化合态,故C错误;
D. 氮元素始终是化合态,故D错误;
10.氨水中存在的微粒有
①NH ②NH ·H O ③HO ④OH- ⑤NH + ⑥H+
3 3 2 2 4
A.只有①②③④ B.只有②④⑤⑥
C.只有①②③④⑤ D.全部
【答案】D
【详解】
氨水中存在电离平衡:NH + H O NH ·H O NH ++OH-,存在的三种分子:NH 、NH ·H O、
3 2 3 2 4 3 3 2
HO,三种离子:NH +和OH-和水中少量的H+,①②③④⑤⑥符合题意,D项正确;
2 4
11.氯气是一种重要的工业原料。工业上利用反应3Cl+2NH ===N+6HCl检查氯气管道是否漏气。
2 3 2
下列说法错误的是( )
A.若管道漏气遇氨就会产生白烟
B.该反应利用了Cl 的强氧化性
2
C.该反应中HCl是氧化产物
D.生成1mol N 有6mol电子转移
2
【答案】C
【详解】
A.若管道漏气生成氯化氢,氯化氢与氨气反应生成氯化铵而会产生白烟,A正确;
B.反应中氯元素的化合价从0价降低到—1价,因此该反应利用了Cl 的强氧化性,B正确;
2
C. 该反应中HCl是还原产物,C错误;
D.氮元素的化合价从—3价升高到0价,则生成1molN 有6mol电子转移,D正确;
2
12.检验铵盐时,可将少许待测物放入试管中,然后( )
A.加热,将湿润的红色石蕊试纸放置于试管口检验
B.加水溶解,加入酸溶液观察现象
C.加入碱溶液,加热,滴入酚酞溶液
D.加入NaOH溶液,加热,将湿润的红色石蕊试纸放在试管口检验
【答案】D
【详解】
A.铵盐受热分解生成氨气的同时,往往也会生成酸性气体,如NH Cl、NH HCO 等,所以无法用湿
4 4 3
润的红色石蕊试纸放置于试管口检验,故A错误;
B.铵盐遇酸无明显变化,故B错误;
C.铵盐与碱溶液混合后溶液呈碱性,滴入酚酞溶液变红证明溶液中有OH-,不能证明生成了氨分子,
故C错误;
D.若加热,生成的氨气逸出,使湿润的红色石蕊试纸变蓝,则可说明有氨分子生成,故D正确;
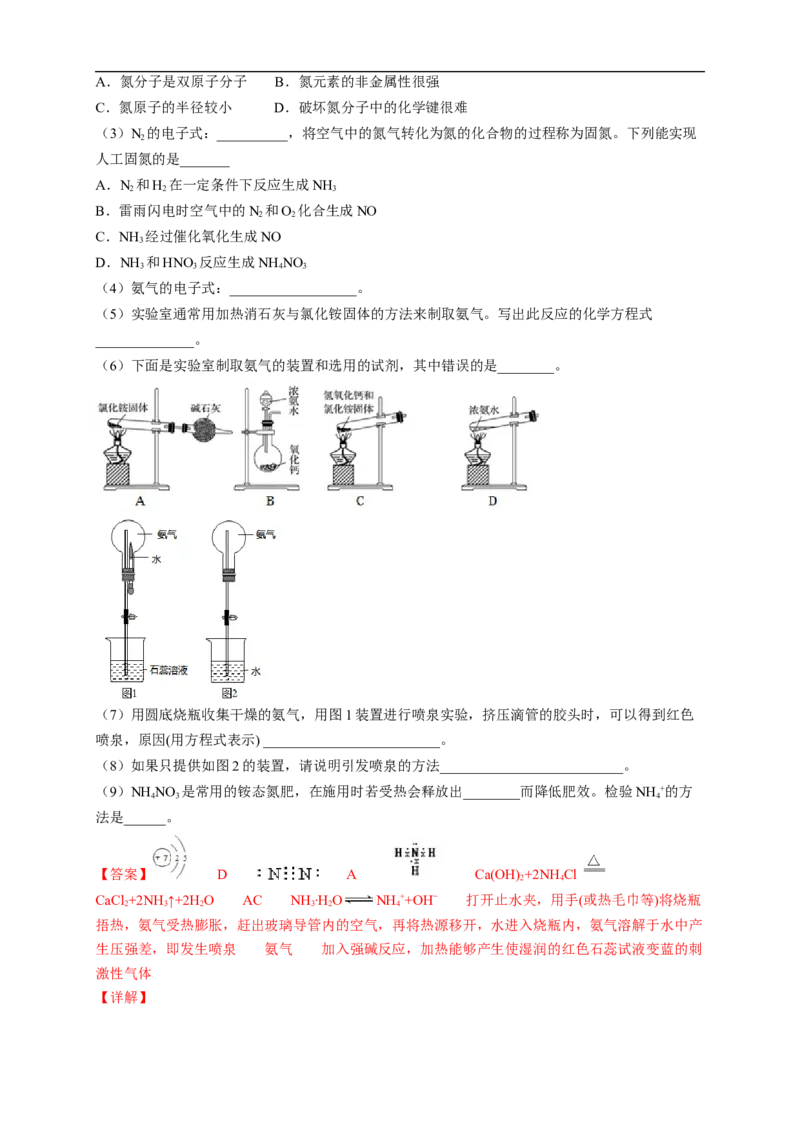
13.氮元素是地球大气中含量最多的元素,请完成下列有关问题:
(1)写出氮元素的原子结构示意图:_____________。
(2)通常情况下,氮气性质不活泼,其原因是__________。A.氮分子是双原子分子 B.氮元素的非金属性很强
C.氮原子的半径较小 D.破坏氮分子中的化学键很难
(3)N 的电子式:__________,将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现
2
人工固氮的是_______
A.N 和H 在一定条件下反应生成NH
2 2 3
B.雷雨闪电时空气中的N 和O 化合生成NO
2 2
C.NH 经过催化氧化生成NO
3
D.NH 和HNO 反应生成NH NO
3 3 4 3
(4)氨气的电子式:__________________。
(5)实验室通常用加热消石灰与氯化铵固体的方法来制取氨气。写出此反应的化学方程式
______________。
(6)下面是实验室制取氨气的装置和选用的试剂,其中错误的是________。
(7)用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,挤压滴管的胶头时,可以得到红色
喷泉,原因(用方程式表示) _________________________。
(8)如果只提供如图2的装置,请说明引发喷泉的方法__________________________。
(9)NH NO 是常用的铵态氮肥,在施用时若受热会释放出________而降低肥效。检验NH +的方
4 3 4
法是______。
【答案】 D A Ca(OH) +2NHCl
2 4
CaCl +2NH↑+2H O AC NH ∙HO NH ++OH− 打开止水夹,用手(或热毛巾等)将烧瓶
2 3 2 3 2 4
捂热,氨气受热膨胀,赶出玻璃导管内的空气,再将热源移开,水进入烧瓶内,氨气溶解于水中产
生压强差,即发生喷泉 氨气 加入强碱反应,加热能够产生使湿润的红色石蕊试液变蓝的刺
激性气体
【详解】(1)N原子核外有7个电子,核外电子排布是2、5,则N原子结构示意图为: ;
(2)A.氮分子是双原子分子,但双原子分子组成的物质可能活泼,如Cl,N 不容易反应与是否是
2 2
双原子分子无关,故A错误;
B.氮元素的非金属性很强,原子获得电子能力强,氮气要参加反应,首先应该变为单个原子,因
此不能证明氮气性质不活泼,故B错误;
C.氮原子的半径较小,原子获得电子能力强,与氮气性质不活泼无关,故C错误;
D.N 是双原子分子,2个N原子共用三对电子,断裂N≡N需要消耗很高的能量,因此氮气不容易
2
参加化学反应,D故正确;
故答案是D;
(3)N 分子中2个N原子形成3个共价键,使每个N原子都达到稳定结构,所以N 的电子式:
2 2
;将空气中的氮气转化为氮的化合物的过程称为固氮。
A.N 和H 在一定条件下反应生成NH ,氮元素的单质变为化合物,属于人工固氮,故A正确;
2 2 3
B.雷雨闪电时空气中的N 和O 化合生成NO,氮元素的单质变为化合物,属于氮的固定,是自然
2 2
固氮,故B错误;
C.NH 经过催化氧化生成NO,是N元素的化合物的转化,不是氮的固定,故C错误;
3
D.NH 和HNO 反应生成NH NO ,是N元素的化合物的转化,不是氮的固定,故D错误;
3 3 4 3
故答案为A;
(4)在NH 中,N原子最外层有5个电子,N原子与三个H原子形成3个共价键,从而使每个原子都
3
达到稳定结构,NH 的电子式:结合形成NH ,所以NH 的电子式为 ;
3 3 3
(5)消石灰与氯化铵固体混合加热产生氨气、氯化钙和水,此反应的化学方程式为:
Ca(OH) +2NHCl CaCl +2NH↑+2H O;
2 4 2 3 2
(6)A.氯化铵不稳定受热易分解,但是氨气与氯化氢遇冷又极易反应生成氯化铵固体,不能用于制
备氨气,故A错误;
B.向CaO中滴加浓氨水,CaO遇水生成Ca(OH) ,同时放出大量热量,有利于浓氨水中的氨气逸
2
出,故B正确;
C.固体加热制气体时,试管口应略向下倾斜,使产生的水能够流出,以免损坏试管,所以利用氯
化铵和氢氧化钙固体加热制取氨气需试管口应略向下倾斜,故C错误;
D.浓氨水易挥发,加热能够促进氨气的逸出,可以用来制备氨气,故D正确;
故答案为AC;
(7)用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,当挤压滴管的胶头时,水进入烧瓶中,
氨气溶于水,使烧瓶内气体压强减小,烧杯内的水不断进入烧瓶,由于氨气溶于水形成的一水合氨
电离产生NH +、OH−,水溶液显碱性,因此可以得到红色喷泉,用方程式表示为:NH ∙HO
4 3 2
NH ++OH−;
4
(8)如果只提供如图2的装置,引发喷泉的方法是打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气
受热膨胀,赶出玻璃导管内的空气,再将热源移开,水进入烧瓶内,氨气溶解于水中产生压强差,即发生喷泉;
(9)NH NO 是常用的铵态氮肥,在施用时若受热,就会发生分解反应释放出氨气而降低肥效;检验
4 3
NH +的方法是加入强碱反应,加热能够产生使湿润的红色石蕊试液变蓝的刺激性气体。
4
14.实验室中可用如图所示的装置合成NH 。试回答下列问题:
3
(1)请写出装置甲的三个作用:①________、②_______、③________。
(2)从乙导出的气体是________,检验产物的简单化学方法是________。
【答案】干燥氮气和氢气速 使氮气和氢气混合均匀 通过观察气泡控制气体比例和流速
N、H、NH 用红色的石蕊试纸放在导气管口,如果湿润的红色石蕊试纸变蓝,则有氨气
2 2 3
【详解】
(1)装置甲的三个作用:干燥氮气和氢气;使氮气和氢气混合均匀;通过观察气泡控制气体比例
和流速,故答案为干燥氮气和氢气;使氮气和氢气混合均匀;通过观察气泡控制气体比例和流速;
(2)氮气和氢气合成氨反应为可逆反应,不能进行到底,所以从乙装置出来的气体有未反应的
N、H 和生成的NH , 氨气为碱性气体,与水反应生成一水合氨,一水合氨显碱性,能够使红色
2 2 3
石蕊试纸变蓝,检验产物的简单化学方法:用红色的石蕊试纸放在导气管口,如果湿润的红色石蕊
试纸变蓝,则有氨气,故答案为N、H、NH ;用红色的石蕊试纸放在导气管口,如果湿润的红色
2 2 3
石蕊试纸变蓝,则有氨气。