文档内容
6.1.1 化学反应与热能 练习(解析版)
1.下列说法中,不正确的是
A.若形成化学键释放的能量大于断裂化学键所吸收的能量,则是放热反应
B.若反应物的总能量大于生成物的总能量,则是放热反应
C.化学反应中能量变化的大小与反应物的质量多少无关
D.化学反应必然伴随着能量的变化和化学键的变化
【答案】C
【详解】
A.反应的焓变=断裂化学键吸收的热能量-形成化学键放出的能量,若形成化学键释放的能量大于
断裂化学键所吸收的能量,△H<0,则反应是放热反应,故A正确;
B.反应前后能量守恒,若反应物的总能量大于生成物的总能量,则是放热反应,B正确;
C.化学反应中能量变化的大小与反应物的物质的量成正比,反应物的质量与物质的量成正比,因
此化学反应中能量变化的大小与反应物的质量成正比,C错误;
D.化学反应过程中一定伴随能量变化,化学反应的实质是化学键的断裂与形成,所以化学反应必
然伴随着能量的变化和化学键的变化,D正确;
答案选C。
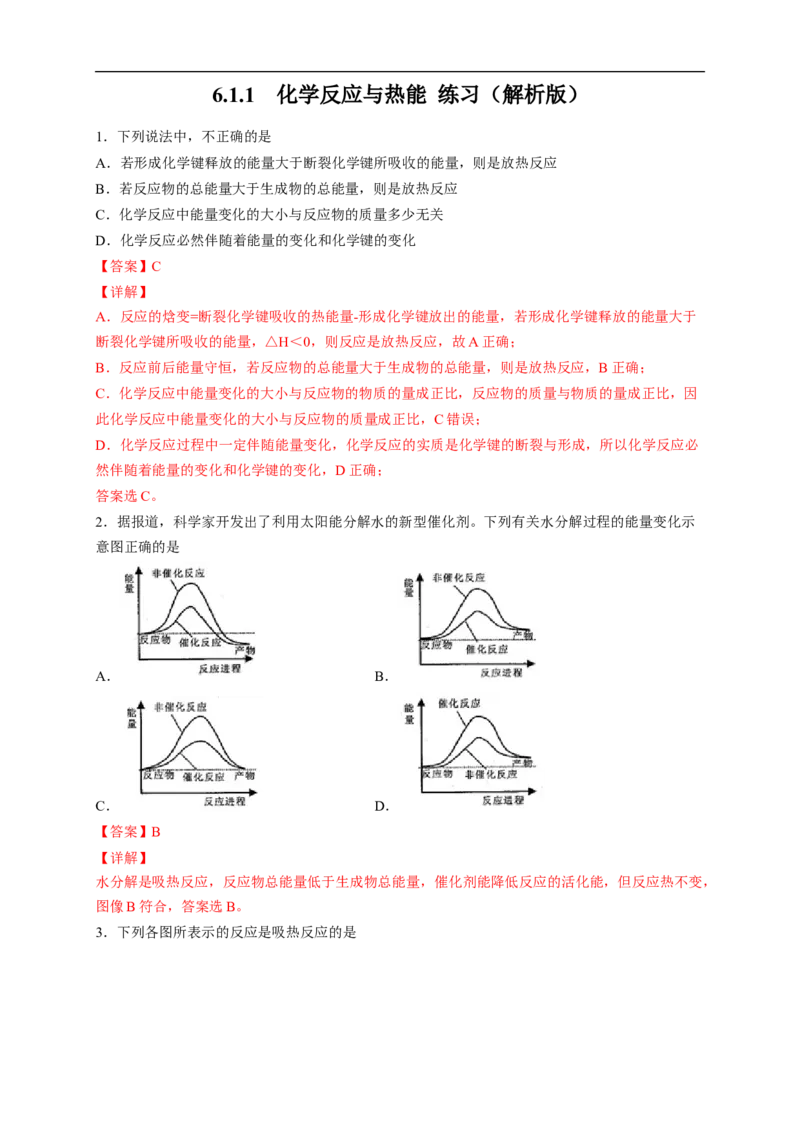
2.据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示
意图正确的是
A. B.
C. D.
【答案】B
【详解】
水分解是吸热反应,反应物总能量低于生成物总能量,催化剂能降低反应的活化能,但反应热不变,
图像B符合,答案选B。
3.下列各图所表示的反应是吸热反应的是A. B.
C. D.
【答案】A
【详解】
若反应物的总能量>生成物的总能量,则反应为放热反应,若反应物的总能量<生成物的总能量,
则反应为吸热反应,选项A符合题意,故答案为A。
4.下列说法中错误的是( )
A.化学反应中的能量变化通常表现为热量的变化
B.需要加热才能发生的反应一定是吸热反应
C.化学键的断裂和形成是化学反应中能量变化的主要原因
D.反应物总能量和生成物总能量的相对大小决定了反应是放热还是吸热
【答案】B
【解析】
A、反应物分子发生反应有一个活化的过程,即吸收能量的过程,而能量变化通常表现为热量的变
化,选项A正确;B、任何反应发生都需要有活化的过程,一些吸热反应即使不加热也可以发生。
如NH Cl与BaCl ·8H O混合就可以发生,但是该反应为吸热反应,选项B不正确;C、化学反
4 2 2
应的过程就是原子重新组合的过程。在这个过程中断裂旧化学键要吸收能量,形成新化学键要放出
能量。所以化学键的断裂和形成是化学反应中能量变化的主要原因,选项C正确;D、若反应物总
能量大于生成物总能量的总能量,则该反应为放热反应;若反应物的总能量小于生成物的总能量,
则该反应为吸热反应。所以二者总能量的相对大小决定了反应是放出还是吸收能量,选项D正确。
答案选B。
5.下列说法错误的是
A.任何化学反应都伴随着能量变化
B.化学反应中能量变化的大小与反应物的质量多少无关
C.化学变化中的能量变化主要是由化学键变化引起的
D.能量变化是化学反应的基本特征之一
【答案】B
【详解】
A. 化学反应的实质是旧键断裂,新键形成,断裂旧键要吸收能量,形成新键要放出能量,所以任何化学反应都伴随着能量变化,故A正确;
B. 化学反应中能量变化的大小与反应物的质量有关,物质的质量越大,反应吸收或放出的热量越
多,故B错误;
C. 化学反应中断键要吸收能量,成键要放出能量,若化学键形成时释放的能量小于旧化学键被破
坏时需要吸收的能量,反应吸收能量,故C正确;
D. 化学反应伴随着旧键的断裂和新键的形成,则一定伴随着能量的变化,故D正确。
故选:B。
6.已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
【答案】D
【详解】
A、反应吸热,但X的能量不一定低于M的,Y的能量不一定低于N的,A错误;
B、反应的吸、放热,与反应条件无关,B错误;
C、反应吸热,破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,C错
误;
D、反应吸热,因此反应物总能量高于产物总能量,即X和Y的总能量一定低于M和N的总能量,
故D正确;
答案选D。
7.下列变化中,一定不存在化学能与热能相互转化的是 ( )
A.铝热反应 B.金属钝化
C.燃放爆竹 D.干冰气化
【答案】D
【详解】
只有在化学反应中才存在化学能和热能的相互转化,D是物理变化,一定不存在化学能与热能相互
转化,其余均是化学变化,存在化学能与热能相互转化。所以答案选D。
8.下列过程一定释放能量的是( )
A.化合反应
B.分解反应
C.分子拆成原子
D.原子组成分子
【答案】D
【详解】
A.有些化合反应是吸热反应,如碳和二氧化碳反应制一氧化碳,故A错误;
B.大多数分解反应是吸热反应,如碳酸钙分解,故B错误;
C.化学键的断裂要吸收能量,所以分子拆成原子一定不释放出能量,故C错误;D.化学键的形成要放出能量,所以原子组成分子一定释放出能量,故D正确;
答案选D。
9.已知1 g H 完全燃烧生成水蒸气放出热量121 kJ,且O 中1 mol O=O键完全断裂时吸收热量496
2 2
kJ,水蒸气中形成1 mol H—O键时放出热量463 kJ,则H 中1 mol H—H键断裂时吸收的热量为
2
A.188 kJ B.557 kJ
C.920 kJ D.436 kJ
【答案】D
【详解】
氢气完全燃烧生成水蒸气是放热反应,化学反应为2H+O =2H O,所以化学反应放出的热量=新键
2 2 2
生成释放的能量-旧键断裂吸收的能量,设氢气中1molH-H键断裂时吸收热量为x,根据方程式可
列方程为4×121kJ=463kJ×4-(2x+496kJ),解得x=436kJ。
答案选D。
10.(1)从能量的变化和反应的快慢等角度研究反应:2H + O = 2H O。 已知该反应为放热反
2 2 2
应,下图能正确表示该反应中能量变化的是________。(填“A”或“B”)
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
化学键 H—H O=O H—O
键能kJ/mol 436 496 463
则生成1mol水可以放出热量 _____kJ
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石
灰与水作用制熟石灰 ⑥ Ba(OH) ·8H O与NH Cl ⑦气态水液化,属于放热反应的有:
2 2 4
_________________(填序号),写出反应⑥的化学方程式________。
【答案】 A 242 ③ ④ ⑤ Ba(OH)·8H O+2NH Cl=BaCl + 2NH ↑+ 10H O或2NH
2 2 4 2 3 2 3
·H O + 8HO
2 2
【解析】2H + O = 2H O是放热反应,反应物的总能量大于生成物的总能量,能正确表示该反应
2 2 2
中能量变化的是A;根据2H + O = 2H O,反应放热2×436+496-4×463=484kJ/mol,生成1mol水
2 2 2
可以放出热量242 kJ。(2)放热反应主要有化合反应、中和反应、燃烧反应;吸热反应主要有分
解反应、以C为还原剂的氧化还原反应、铵盐与碱的反应;属于放热反应的有③炸药爆炸 ④酸与
碱的中和反应;Ba(OH) ·8H O与NH Cl反应生成氯化钡、氨气、水,化学方程式为Ba(OH)
2 2 4
·8H O+2NH Cl=BaCl + 2NH ↑+ 10H O。
2 2 4 2 3 2
11.化学反应伴随着能量变化是化学反应的基本特征之一。某同学进行如下实验,以检验化学反应
中的能量变化。请回答下列问题:
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是________
热反应,Ba(OH) ·8H O与NH Cl的反应是________热反应。反应过程________(填“①”或“②”)
2 2 4
的能量变化可用下图表示。
(2)①中发生反应的离子方程式是____________________________;在该反应中,作为还原剂的物质
是________(填化学式)。
【答案】 放 吸 ① 6H++2Al===2Al3++3H↑ Al
2
【解析】(1)本题考查化学反应中能量变化,反应①:反应后温度升高,说明是放热反应,即铝
和盐酸反应属于放热反应,反应②:反应温度降低,此反应是吸热反应,即Ba(OH) ·8H O和
2 2
NH Cl属于吸热反应,反应物总能量大于生成物总能量,说明此反应是放热反应,即属于①;
4
(2)考查离子反应方程式的书写和氧化还原反应概念,反应①的离子方程式为2Al+6H+=2Al3++
3H↑,化合价升高的物质是还原剂,即Al是还原剂。
2
12.在一个小烧杯里,加入20g Ba(OH)·8H O晶体,将小烧杯放在事先已滴有3滴~4滴水的玻璃
2 2
片上。然后加入10gNH Cl晶体,并立即用玻璃棒迅速搅拌。
4
(1)实验中玻璃棒的作用是__________________。
(2)实验中观察到的现象有:玻璃片与小烧杯之间粘结在一起、烧杯中产生_______的气体、反应混
合物成糊状,出现糊状的原因是反应中有_____生成。
(3)写出有关反应的化学方程式_________________。
(4)通过_______现象,说明该反应为________(填“吸热”或“放热”)反应,这是由于反应物的
总能量________(填“小于”或“大于”)生成物的总能量。
【答案】 搅拌使混合物充分接触并反应 刺激性气味 水 Ba(OH) ·8H O+2NH Cl=BaCl +
2 2 4 2
2NH ↑+10HO 结冰 吸热 小于
3 2
【解析】(1)玻璃棒在化学实验中的作用:搅拌和引流,本实验中,根据题意:将20g Ba(OH) •8H O
2 2
晶体与10g NH Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速
4
搅拌,可以知道玻璃棒的作用是:搅拌使混合物充分接触并反应;
(2)氯化铵铵盐和强碱氢氧化钡的反应是吸热反应,温度降低能让水结冰,导致烧杯和玻璃片粘在一
起,同时生成的氨气具有刺激性气味,反应混合物成糊状,原因是生成水的缘故;
(3)氯化铵属于铵盐,能和强碱氢氧化钡反应生成氨气、水、以及氯化钡,化学方程式为
Ba(OH) •8H O+2NH Cl=BaCl +2NH↑+10H O;
2 2 4 2 3 2(4)玻璃片上结冰而与小烧杯粘在一起,说明氢氧化钡和氯化铵的反应是吸热反应,即反应物的总能
量小于生成物的总能量。