文档内容
高一年级考试化学试题
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、
考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米
黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题
卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H1 C12 N14 O16 Na23 Cl 135.5 Br80
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.生活中处处有化学,“衣、食、住、行”中的许多现象都可以用化学知识解释。下列说法错误的是(
)
A.衣:可用灼烧的方法区分羊毛线和棉纱线,羊毛线灼烧能闻到烧焦羽毛的气味
B.食:维生素C能增强人体对疾病的抵抗能力,大米、面粉等富含维生素C
C.住:太阳能热水器能直接利用太阳能获得热能
D.行:城市交通中大力推广新能源汽车能减少城市的空气污染
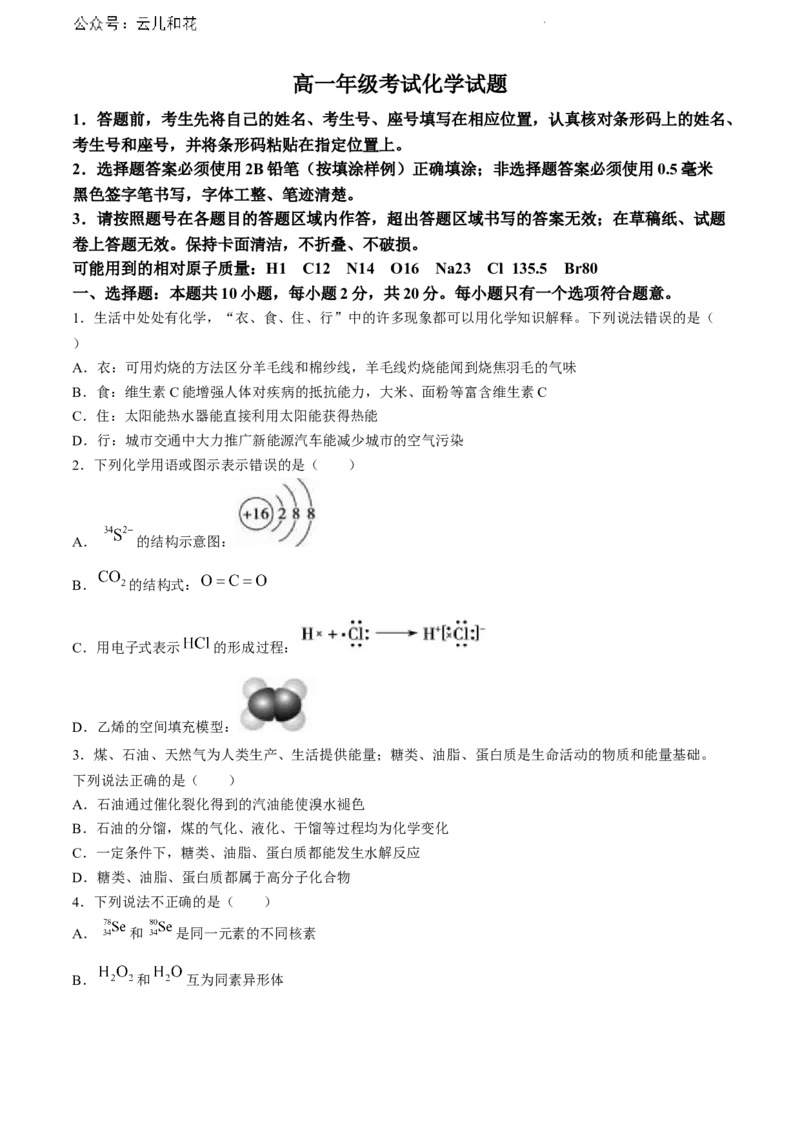
2.下列化学用语或图示表示错误的是( )
A. 的结构示意图:
B. 的结构式:
C.用电子式表示 的形成过程:
D.乙烯的空间填充模型:
3.煤、石油、天然气为人类生产、生活提供能量;糖类、油脂、蛋白质是生命活动的物质和能量基础。
下列说法正确的是( )
A.石油通过催化裂化得到的汽油能使溴水褪色
B.石油的分馏,煤的气化、液化、干馏等过程均为化学变化
C.一定条件下,糖类、油脂、蛋白质都能发生水解反应
D.糖类、油脂、蛋白质都属于高分子化合物
4.下列说法不正确的是( )
A. 和 是同一元素的不同核素
B. 和 互为同素异形体
学科网(北京)股份有限公司C. 和 互为同系物
D. 和 互为同分异构体
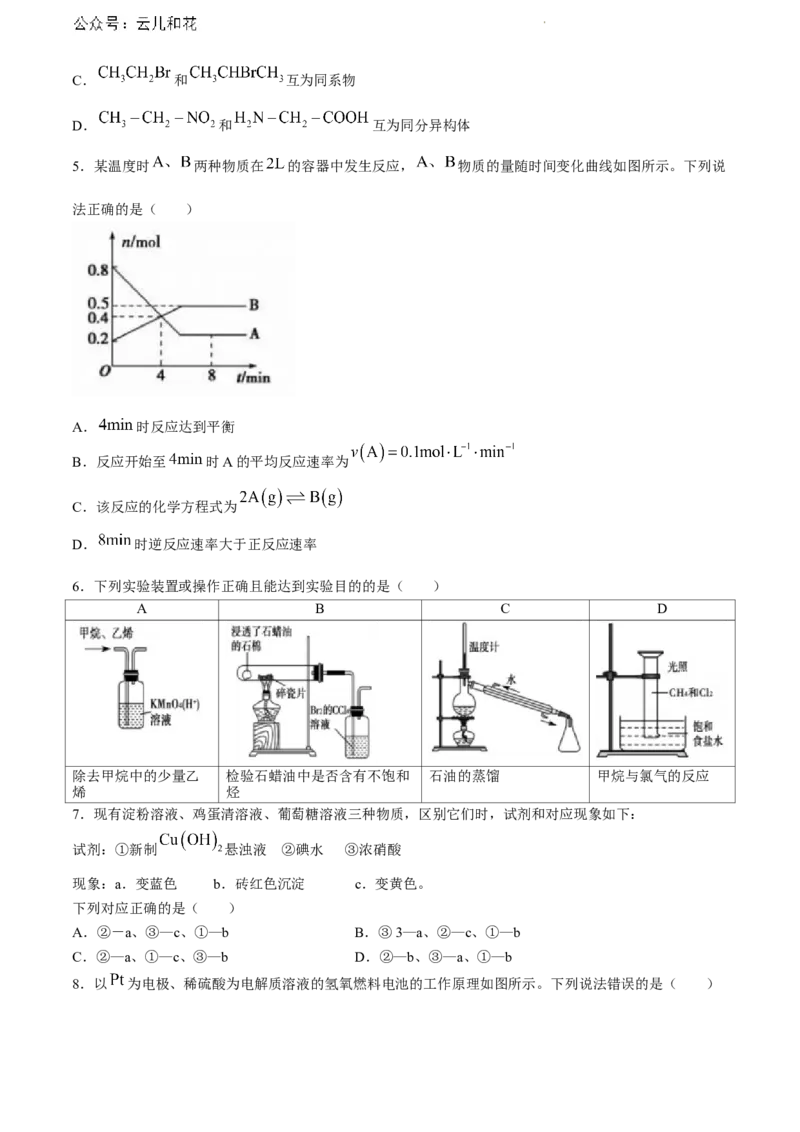
5.某温度时 两种物质在 的容器中发生反应, 物质的量随时间变化曲线如图所示。下列说
法正确的是( )
A. 时反应达到平衡
B.反应开始至 时A的平均反应速率为
C.该反应的化学方程式为
D. 时逆反应速率大于正反应速率
6.下列实验装置或操作正确且能达到实验目的的是( )
A B C D
除去甲烷中的少量乙 检验石蜡油中是否含有不饱和 石油的蒸馏 甲烷与氯气的反应
烯 烃
7.现有淀粉溶液、鸡蛋清溶液、葡萄糖溶液三种物质,区别它们时,试剂和对应现象如下:
试剂:①新制 悬浊液 ②碘水 ③浓硝酸
现象:a.变蓝色 b.砖红色沉淀 c.变黄色。
下列对应正确的是( )
A.②-a、③—c、①—b B.③3—a、②—c、①—b
C.②—a、①—c、③—b D.②—b、③—a、①—b
8.以 为电极、稀硫酸为电解质溶液的氢氧燃料电池的工作原理如图所示。下列说法错误的是( )
学科网(北京)股份有限公司A.a极为负极,电子由a极经外电路流向b极 B.a极的电极反应式为
C.b极的电板反应式为 D.电池工作一段时间后,装置中 增大
9. 时,将 置于 密闭的烧瓶中,然后将烧瓶放入 的恒温槽中,烧瓶内的气体逐
渐变为红棕色。反应的化学方程式为: 。下列结论不能说明上述反应在该条件下
已经达到平衡的是( )
① 的消耗速率与 的生成速率之比为
② 的消耗速率与 的消耗速率之比为
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤烧瓶内 的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A.②③⑤⑥⑦ B.只有⑦⑧ C.只有①④ D.①④⑧
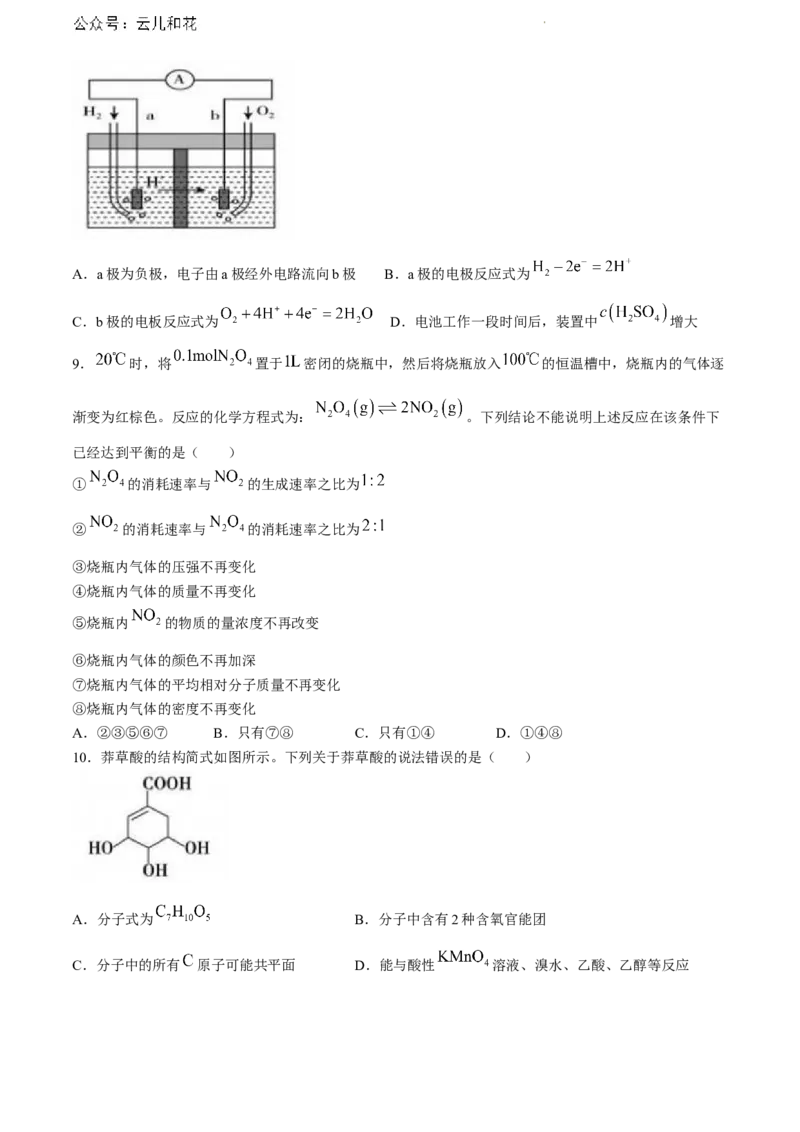
10.莽草酸的结构简式如图所示。下列关于莽草酸的说法错误的是( )
A.分子式为 B.分子中含有2种含氧官能团
C.分子中的所有 原子可能共平面 D.能与酸性 溶液、溴水、乙酸、乙醇等反应
学科网(北京)股份有限公司二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全
部选对得4分,选对但不全的得2分,有选错的得0分。
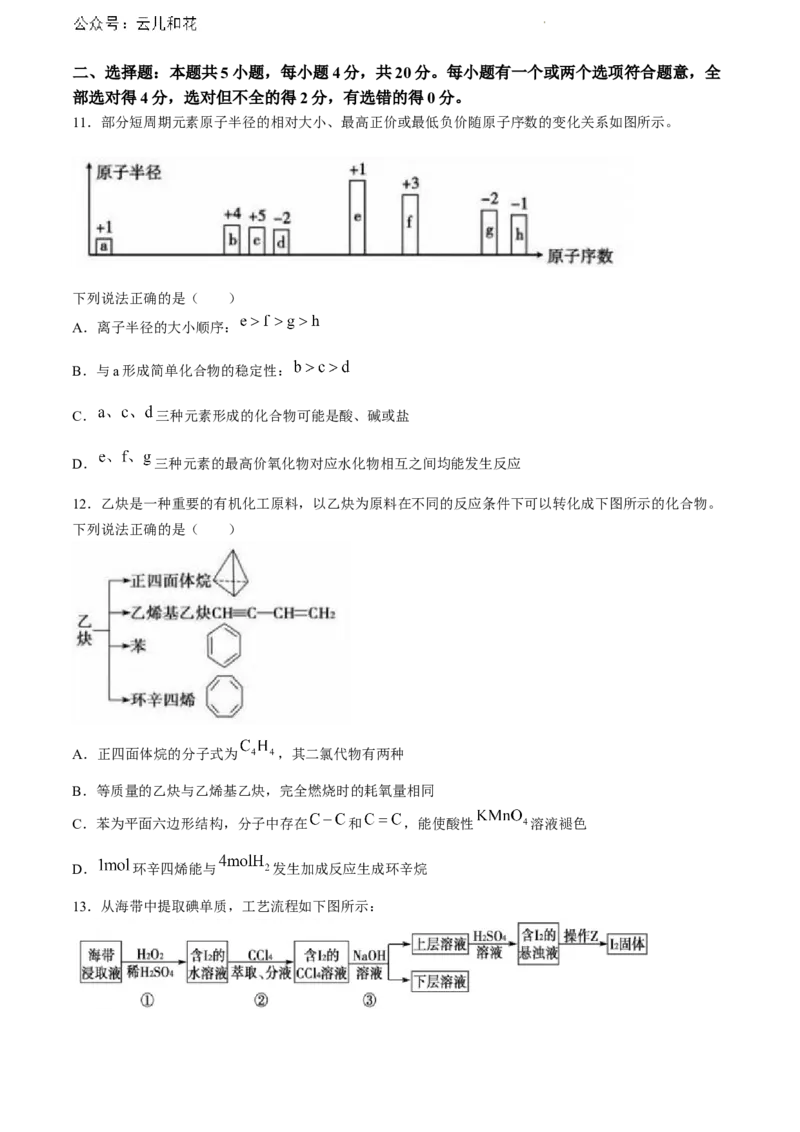
11.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示。
下列说法正确的是( )
A.离子半径的大小顺序:
B.与a形成简单化合物的稳定性:
C. 三种元素形成的化合物可能是酸、碱或盐
D. 三种元素的最高价氧化物对应水化物相互之间均能发生反应
12.乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成下图所示的化合物。
下列说法正确的是( )
A.正四面体烷的分子式为 ,其二氯代物有两种
B.等质量的乙炔与乙烯基乙炔,完全燃烧时的耗氧量相同
C.苯为平面六边形结构,分子中存在 和 ,能使酸性 溶液褪色
D. 环辛四烯能与 发生加成反应生成环辛烷
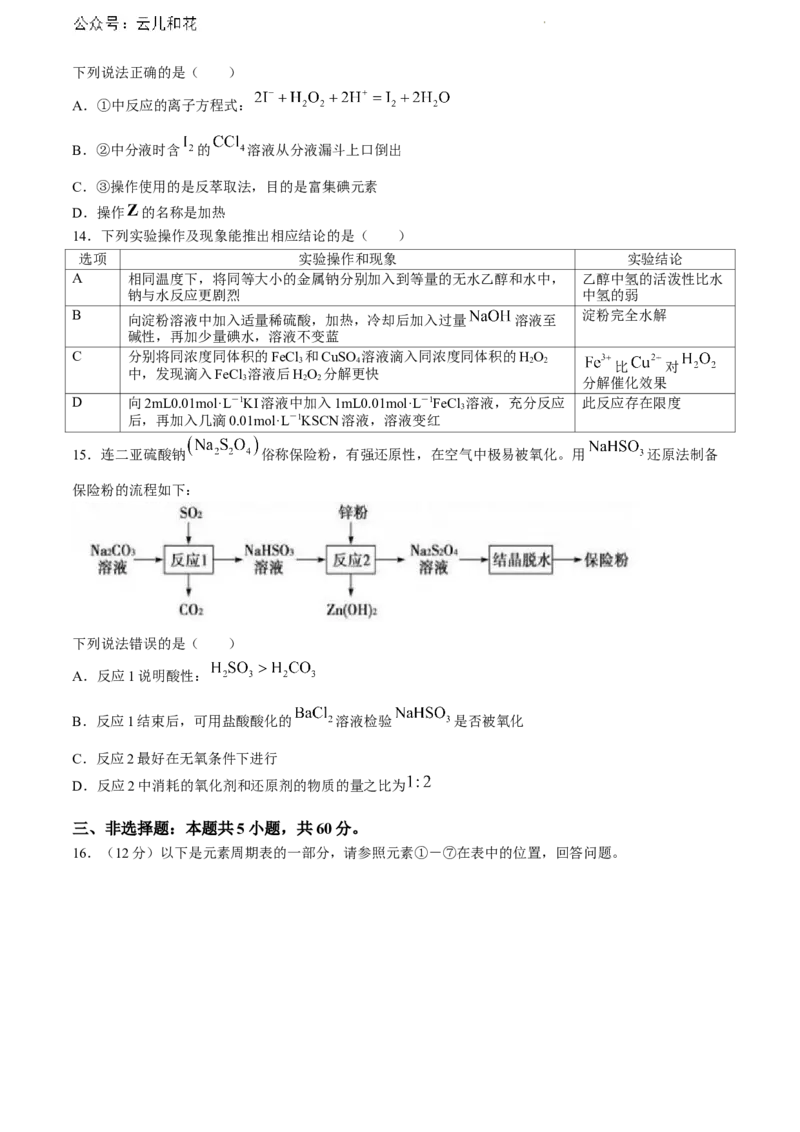
13.从海带中提取碘单质,工艺流程如下图所示:
学科网(北京)股份有限公司下列说法正确的是( )
A.①中反应的离子方程式:
B.②中分液时含 的 溶液从分液漏斗上口倒出
C.③操作使用的是反萃取法,目的是富集碘元素
D.操作 的名称是加热
14.下列实验操作及现象能推出相应结论的是( )
选项 实验操作和现象 实验结论
A 相同温度下,将同等大小的金属钠分别加入到等量的无水乙醇和水中, 乙醇中氢的活泼性比水
钠与水反应更剧烈 中氢的弱
B 淀粉完全水解
向淀粉溶液中加入适量稀硫酸,加热,冷却后加入过量 溶液至
碱性,再加少量碘水,溶液不变蓝
C 分别将同浓度同体积的FeCl 和CuSO 溶液滴入同浓度同体积的HO
3 4 2 2 比 对
中,发现滴入FeCl 溶液后HO 分解更快
3 2 2 分解催化效果
D 向2mL0.01mol·L-1KI溶液中加入1mL0.01mol·L-1FeCl 溶液,充分反应 此反应存在限度
3
后,再加入几滴0.01mol·L-1KSCN溶液,溶液变红
15.连二亚硫酸钠 俗称保险粉,有强还原性,在空气中极易被氧化。用 还原法制备
保险粉的流程如下:
下列说法错误的是( )
A.反应1说明酸性:
B.反应1结束后,可用盐酸酸化的 溶液检验 是否被氧化
C.反应2最好在无氧条件下进行
D.反应2中消耗的氧化剂和还原剂的物质的量之比为
三、非选择题:本题共5小题,共60分。
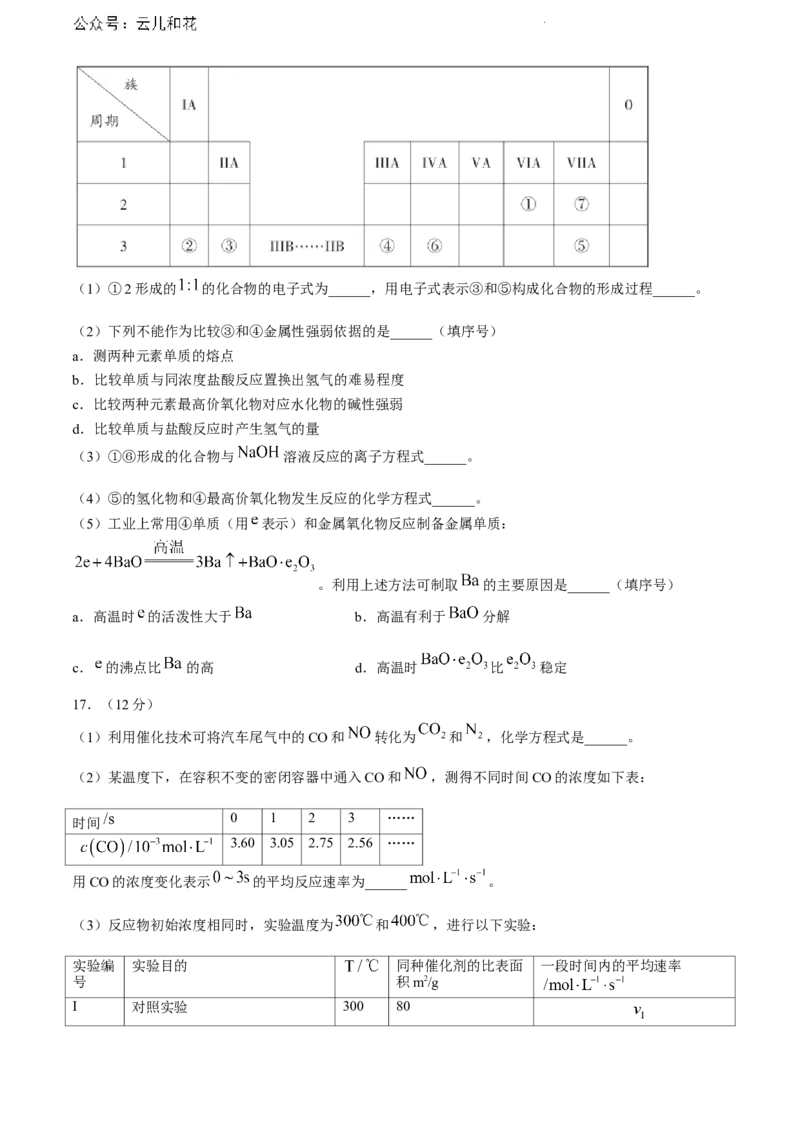
16.(12分)以下是元素周期表的一部分,请参照元素①-⑦在表中的位置,回答问题。
学科网(北京)股份有限公司(1)①2形成的 的化合物的电子式为______,用电子式表示③和⑤构成化合物的形成过程______。
(2)下列不能作为比较③和④金属性强弱依据的是______(填序号)
a.测两种元素单质的熔点
b.比较单质与同浓度盐酸反应置换出氢气的难易程度
c.比较两种元素最高价氧化物对应水化物的碱性强弱
d.比较单质与盐酸反应时产生氢气的量
(3)①⑥形成的化合物与 溶液反应的离子方程式______。
(4)⑤的氢化物和④最高价氧化物发生反应的化学方程式______。
(5)工业上常用④单质(用 表示)和金属氧化物反应制备金属单质:
。利用上述方法可制取 的主要原因是______(填序号)
a.高温时 的活泼性大于 b.高温有利于 分解
c. 的沸点比 的高 d.高温时 比 稳定
17.(12分)
(1)利用催化技术可将汽车尾气中的CO和 转化为 和 ,化学方程式是______。
(2)某温度下,在容积不变的密闭容器中通入CO和 ,测得不同时间CO的浓度如下表:
0 1 2 3 ……
时间
3.60 3.05 2.75 2.56 ……
用CO的浓度变化表示 的平均反应速率为______ 。
(3)反应物初始浓度相同时,实验温度为 和 ,进行以下实验:
实验编 实验目的 同种催化剂的比表面 一段时间内的平均速率
号 积m2/g
I 对照实验 300 80
学科网(北京)股份有限公司实验编 实验目的 同种催化剂的比表面 一段时间内的平均速率
号 积m2/g
II 研究催化剂比表面积对尾气转 a 120
化速率的影响
III b c d
【实验分析与结论】
①补全表格a.______b.______c._______d.______。
②测得 ,对比实验I、II,可得结论:______。
③通过实验可得到“催化剂的比表面积相同时,温度升高,可增大尾气的转化速率”的结论,证据是
______。
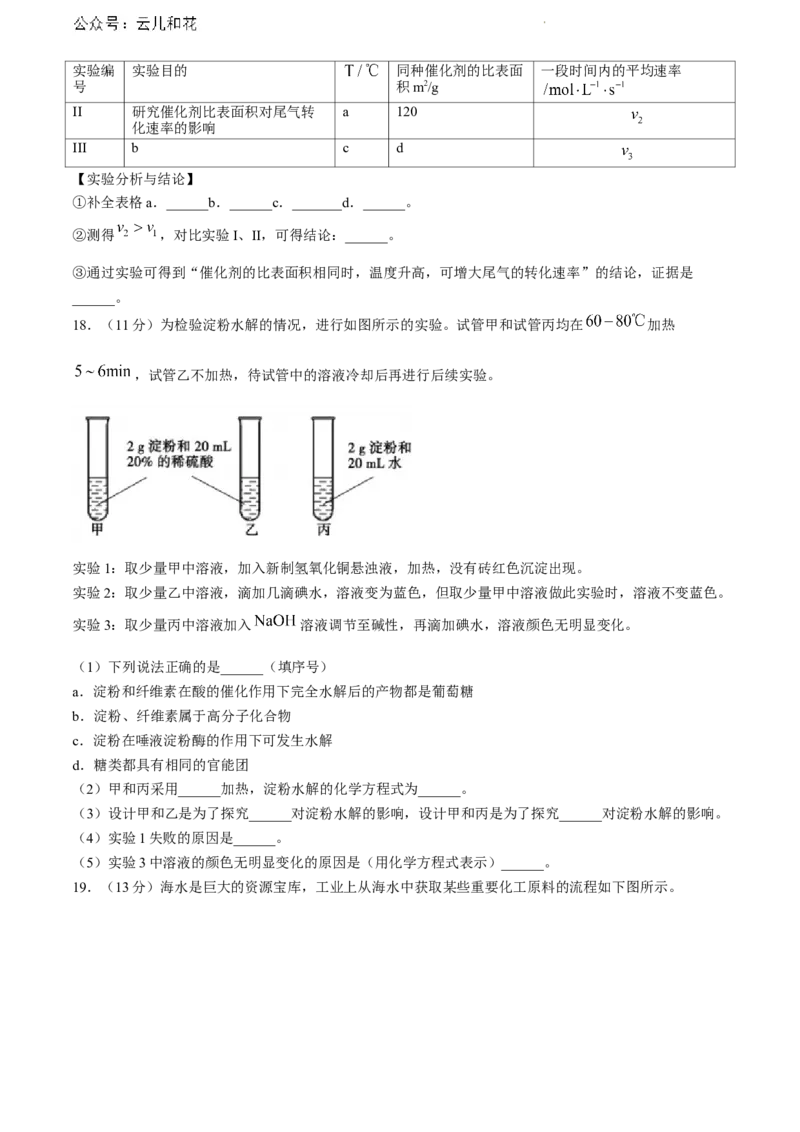
18.(11分)为检验淀粉水解的情况,进行如图所示的实验。试管甲和试管丙均在 加热
,试管乙不加热,待试管中的溶液冷却后再进行后续实验。
实验1:取少量甲中溶液,加入新制氢氧化铜悬浊液,加热,没有砖红色沉淀出现。
实验2:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色。
实验3:取少量丙中溶液加入 溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
(1)下列说法正确的是______(填序号)
a.淀粉和纤维素在酸的催化作用下完全水解后的产物都是葡萄糖
b.淀粉、纤维素属于高分子化合物
c.淀粉在唾液淀粉酶的作用下可发生水解
d.糖类都具有相同的官能团
(2)甲和丙采用______加热,淀粉水解的化学方程式为______。
(3)设计甲和乙是为了探究______对淀粉水解的影响,设计甲和丙是为了探究______对淀粉水解的影响。
(4)实验1失败的原因是______。
(5)实验3中溶液的颜色无明显变化的原因是(用化学方程式表示)______。
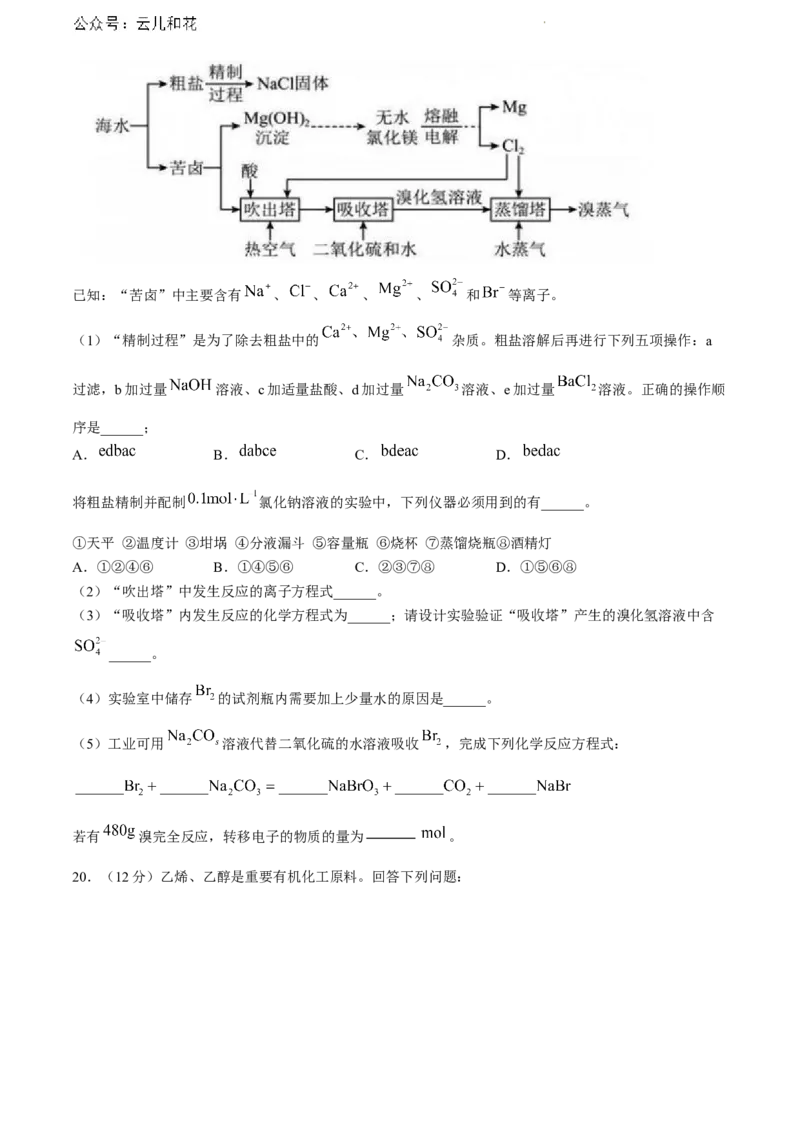
19.(13分)海水是巨大的资源宝库,工业上从海水中获取某些重要化工原料的流程如下图所示。
学科网(北京)股份有限公司已知:“苦卤”中主要含有 、 、 、 、 和 等离子。
(1)“精制过程”是为了除去粗盐中的 杂质。粗盐溶解后再进行下列五项操作:a
过滤,b加过量 溶液、c加适量盐酸、d加过量 溶液、e加过量 溶液。正确的操作顺
序是______;
A. B. C. D.
将粗盐精制并配制 氯化钠溶液的实验中,下列仪器必须用到的有______。
①天平 ②温度计 ③坩埚 ④分液漏斗 ⑤容量瓶 ⑥烧杯 ⑦蒸馏烧瓶⑧酒精灯
A.①②④⑥ B.①④⑤⑥ C.②③⑦⑧ D.①⑤⑥⑧
(2)“吹出塔”中发生反应的离子方程式______。
(3)“吸收塔”内发生反应的化学方程式为______;请设计实验验证“吸收塔”产生的溴化氢溶液中含
______。
(4)实验室中储存 的试剂瓶内需要加上少量水的原因是______。
(5)工业可用 溶液代替二氧化硫的水溶液吸收 ,完成下列化学反应方程式:
若有 溴完全反应,转移电子的物质的量为 。
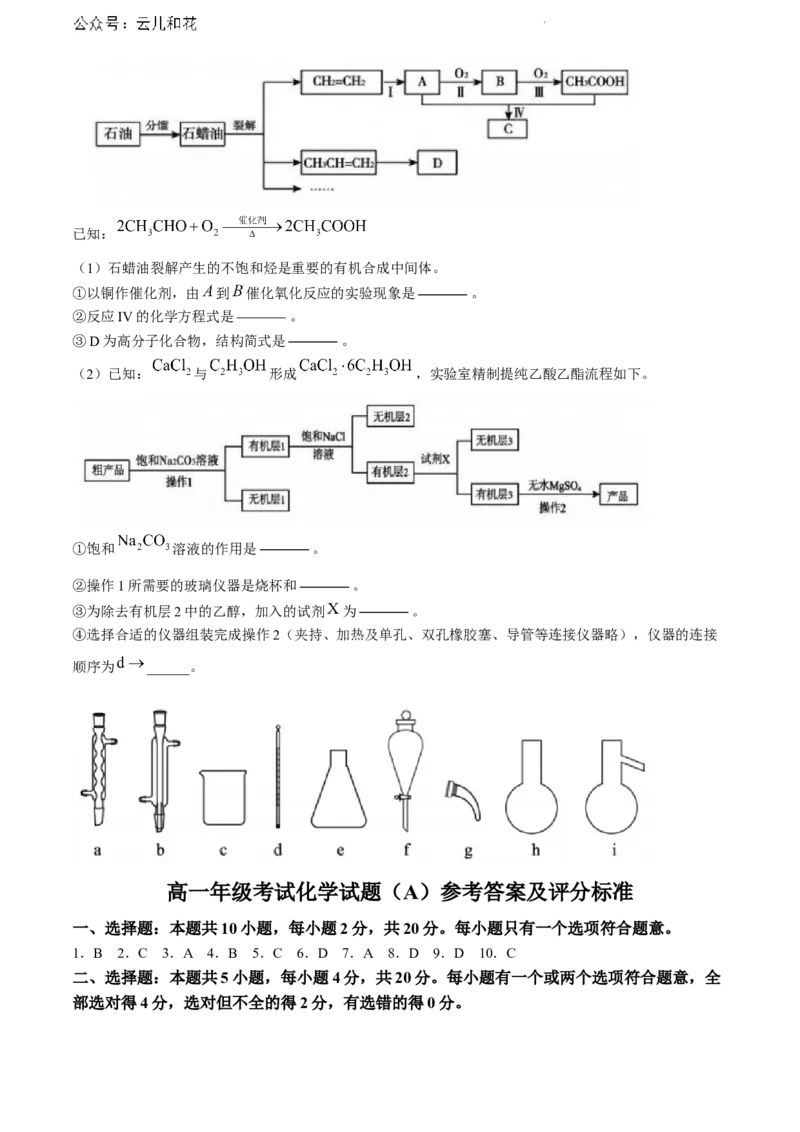
20.(12分)乙烯、乙醇是重要有机化工原料。回答下列问题:
学科网(北京)股份有限公司已知:
(1)石蜡油裂解产生的不饱和烃是重要的有机合成中间体。
①以铜作催化剂,由 到 催化氧化反应的实验现象是 。
②反应IV的化学方程式是 。
③D为高分子化合物,结构简式是 。
(2)已知: 与 形成 ,实验室精制提纯乙酸乙酯流程如下。
①饱和 溶液的作用是 。
②操作1所需要的玻璃仪器是烧杯和 。
③为除去有机层2中的乙醇,加入的试剂 为 。
④选择合适的仪器组装完成操作2(夹持、加热及单孔、双孔橡胶塞、导管等连接仪器略),仪器的连接
顺序为 ______。
高一年级考试化学试题(A)参考答案及评分标准
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.B 2.C 3.A 4.B 5.C 6.D 7.A 8.D 9.D 10.C
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全
部选对得4分,选对但不全的得2分,有选错的得0分。
学科网(北京)股份有限公司11.CD 12.BD 13.AC 14.AD 15.D
三、非选择题:本题共5小题,共60分。
16.(12分)
(1) (2分) (2分)
(2) (2分)
(3) (2分)
(4) (2分)
(5) (2分)
17.(12分)
(1) (2分)
(2) (2分)
(3)①300(1分) 研究温度对尾气转化速率的影响(1分)
400(1分) 80(1分)
②在其他条件相同时,同种催化剂的比表面积越大,反应速率越大(2分)
③ (2分)
18.(11分)
(1) (2分)
(2)水浴(1分) (2分)
(3)温度(1分);催化剂(1分)
(4)没有加入碱中和作为催化剂的稀硫酸(2分)
(5) (2分)
19.(13分)
(1)①AD(2分) ②D(1分)
(2) (2分)
(3) (2分)
取少量溴化氢溶液于试管中,滴加几滴 溶液,若产生白色沉淀,则该溶液中含有 (2分)
(4)防止 挥发(1分)
学科网(北京)股份有限公司(5)3 3 1 3 5(1分) 5(2分)
20.(12分)
(1)①铜丝由黑色变红色,闻到有刺激性气味。(2分)
② (2分)
③ (2分)
(2)①吸收乙醇,中和乙酸,降低乙酸乙酯的溶解度(2分)
②分液漏斗(1分)
③无水 (1分)
④ (2分)
学科网(北京)股份有限公司