文档内容
期中模拟卷1
(时间:90分钟 满分:100分)
可能用到的相对原子质量:H 1 C 12 Si 28 P 31 Cl 35.5
一、选择题(本题包括15个小题,每小题只有一个选项符合题意。每小题2分,共30分)
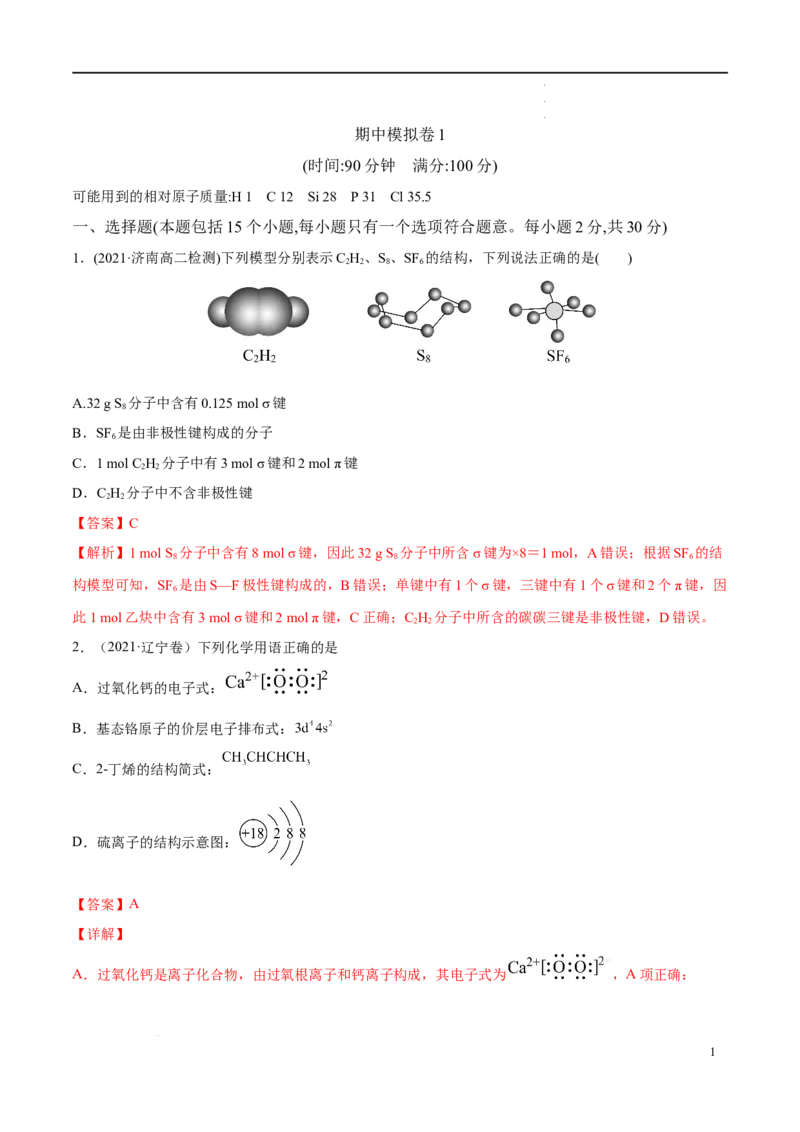
1.(2021·济南高二检测)下列模型分别表示C H、S、SF 的结构,下列说法正确的是( )
2 2 8 6
A.32 g S 分子中含有0.125 mol σ键
8
B.SF 是由非极性键构成的分子
6
C.1 mol C H 分子中有3 mol σ键和2 mol π键
2 2
D.C H 分子中不含非极性键
2 2
【答案】C
【解析】1 mol S 分子中含有8 mol σ键,因此32 g S 分子中所含σ键为×8=1 mol,A错误;根据SF 的结
8 8 6
构模型可知,SF 是由S—F极性键构成的,B错误;单键中有1个σ键,三键中有1个σ键和2个π键,因
6
此1 mol乙炔中含有3 mol σ键和2 mol π键,C正确;C H 分子中所含的碳碳三键是非极性键,D错误。
2 2
2.(2021·辽宁卷)下列化学用语正确的是
A.过氧化钙的电子式:
B.基态铬原子的价层电子排布式:
C.2-丁烯的结构简式:
D.硫离子的结构示意图:
【答案】A
【详解】
A.过氧化钙是离子化合物,由过氧根离子和钙离子构成,其电子式为 ,A项正确:
1
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司B.由洪特规则知,基态铬原子的价层电子排布式应为 ,B项错误;
C.碳碳双键应该表示出来,2-丁烯的结构简式: ,C项错误;
D. 的质子数是16而不是18,D项错误;
选A。
3.(2021·浙江·杭州市余杭高级中学)下列各组原子中彼此化学性质一定相似的是
A.原子核外电子排布式为 的X原子与原子核外电子排布式为 的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上有一个未成对电子的X原子和3p轨道上只有一个未成对电子的Y原子
D.L层上有一个空轨道的元素和M层的p轨道上有一个空轨道的元素
【答案】D
【详解】
A.原子核外电子排布式为1s2结构的原子为He,1s22s2结构为Be,两者性质不相似,A不符合题意;
B.X原子为Mg,Y原子N层上有2个电子的有多种元素,如第4周期中Ca、Fe等都符合,化学性质不
一定相似,B不符合题意;
C.2p轨道上有一个未成对电子的X原子可能是B或F,3p轨道上只有一个未成对电子的Y原子可能是Al
或Cl,彼此化学性质不一定相似,C不符合题意;
D.L层上有一个空轨道的元素只能是1s22s22p1,是B,M层的p轨道上有一个空轨道的元素只能是
1s22s22p63s23p1,是Al,两者位于同一主族,彼此化学性质性质一定相似,D符合题意;
故答案选D。
4.(2021·辽宁实验中学)下列各组元素性质递变情况错误的是
A.Li、Be、B原子的半径依次减小
B.P、S、Cl的第一电离能依次升高
C.N、O、F的电负性依次增大
D.O2-、Na+、Al3+的半径依次减小
【答案】B
【详解】
A.Li、Be、B位于同周期,从左到右,原子半径依次减小,故A正确;
B.P原子的3p轨道电子处于半充满稳定状态,第一电离能大于相邻同周期元素,则S、P、Cl的第一电离
2
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司能依次升高,故B错误;
C.同周期自左向右电负性逐渐增大,则N、O、F的电负性依次增大,故C正确;
D.O2-、Na+、Al3+的核外电子排布相同,离子半径随原子序数的增大而减小,则其离子半径依次减小,故
D正确。
故选B。
5.(2021·全国·)根据下列五种元素的电离能数据(单位:kJ·mol-1),判断下列说法不正确的是
元素代号 I I I I
1 2 3 4
Q 2 080 4 000 6 100 9 400
R 500 4 600 6 900 9 500
S 740 1 500 7 700 10 500
T 580 1 800 2 700 11 600
U 420 3 100 4 400 5 900
A.元素的电负性最大的可能是Q元素
B.R和S均可能与U在同一主族
C.U元素可能在元素周期表的s区
D.原子的价电子排布为ns2np1的可能是T元素
【答案】B
【详解】
A.由表中数据可知,Q元素的第一电离能最大,非金属性强,所以元素的电负性最大,A项正确;
B.根据第一电离能的数据可知,R的最外电子层应该有1个电子,S的最外电子层应该有2个电子,不属
于同一主族的元素,故B错误;
C.U的最外电子层有1个电子,可能属于s区元素,故C正确;
D.T元素最外层有3个电子,价电子排布可能是ns2np1,故D正确;
选B。
6.(2021·四川省绵阳第一中学)下列关于原子结构与元素周期表的说法正确的是
A.电负性最大的元素位于周期表的左下角
B.某基态原子的价电子排布式为4s24p1,该元素位于周期表第四周期IIIA族
C.2s 轨道在空间呈哑铃形
D.原子核外可能有两个电子的运动状态是相同的
3
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司【答案】B
【详解】
A.电负性最大的元素为F元素,位于周期表的右上角,故A错误;
B.某基态原子的价电子排布式为4s24p1,为Ga元素,位于周期表中的第四周期第IIIA族,故B正确;
C.s电子云是球形对称的,在核外半径相同处任一方向上电子出现的几率相同,P轨道电子云图为哑铃型,
故C错误;
D.根据泡利原理和洪特规则,原子核外不可能有两个电子的运动状态是完全相同的,故D错误;
故选:B。
7.(2021·辽宁·沈阳市第一二〇中学)著名的观赏石-崂山璐石主要成分可表示为
,其中W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成
对电子,Z的最高正价与最低负价的代数和为0.下列说法错误的是
A.Y的离子半径在同周期元素中最小
B.Z在它的简单氢化物中显负价
C.W、Y、Z的最高价氧化物的水化物都属于弱电解质
D.三种元素的电负性由大到小的顺序为Z>Y>W
【答案】B
【分析】
由题干信息可知,W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成对电子,Z的最高正
价与最低负价的代数和为0,故W为Mg,Z为Si,则Y为Al,据此分析解题。
【详解】
A.根据上述分析可知,Y是Al,Y的离子即Al3+半径是第三周期元素中最小的,故A正确;
B.根据上述分析可知,Z为Si,Si的简单氢化物即SiH,硅显正价,故B错误;
4
C.根据上述分析可知,W、Y、Z的最高价氧化物的水化物即Mg(OH) 、Al(OH) 、HSiO 都属于弱电解
2 3 2 3
质,故C正确;
D.同一周期从左往右元素的电负性依次增大,故三种元素的电负性由大到小的顺序为Z>Y>W,故D正
确;
故答案:B。
8.(2021·江苏镇江·)X、Y、Z、W为原子序数依次增大的前四周期元素,X的一种单质是天然存在的最
坚硬矿物质,Z原子最外层电子数为次外层电子数的三倍,W基态原子的价电子排布为3d64s2。下列说法
4
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司正确的是
A.原子半径:Z>Y>X
B.元素的第一电离能:Z>Y>X
C.X、Y最简单气态氢化物分子的键角:X>Y
D.W2+价电子轨道表示式:
【答案】C
【分析】
X、Y、Z、W为原子序数依次增大的前四周期元素,X的一种单质是天然存在的最坚硬矿物质,则X是C
元素;Z原子最外层电子数为次外层电子数的三倍,则Z核外电子排布是2、6,故Z是O元素,Y的原子
序数介于6、8之间,所以Y是N元素;W基态原子的价电子排布为3d64s2,则W是26号Fe元素,然后
根据元素周期律及物质的性质分析解答。
【详解】
根据上述分析可知X是C,Y是N,Z是O,W是Fe元素。
A.X是C,Y是N,Z是O,它们是同一周期元素。同一周期元素,原子序数越大,原子半径越小,所以
原子半径大小关系为:X>Y>Z,A错误;
B.一般情况下同一周期元素的第一电离能呈增大趋势,但当元素处于第IIA、第VA的全充满、半充满的
温度状态时,其第一电离能大于同一周期相邻元素,所以元素的第一电离能:Y>Z>X,B错误;
C.X是C,Y是N,它们形成的简单气态氢化物分别是CH、NH ,CH 是正四面体结构,键角是
4 3 4
109°28′,NH 是三角锥形,键角是107°18′,故键角:X>Y,C正确;
3
D.Fe2+是Fe原子失去最外层的2个电子形成的,其价电子轨道表示式为: ,
D错误;
故合理选项是C。
9.(2021·北京·101中学)已知各共价键的键能如表所示,下列说法正确的是
共价键 H—H F—F H—F H—Cl H—I
键能E(kJ/mol) 436 157 568 432 298
5
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司A.键的极性大小顺序:H—I>H—Cl>H—F
B.表中最稳定的共价键是F—F键
C.432kJ/mol>E(H—Br)>298kJ/mol
D.上述键能可以说明热稳定性的顺序是:HF<HCl<HI
【答案】C
【详解】
A.电负性的差值越大,键的极性越强,F、Cl、I与H的电负性差值逐渐减小,因此键的极性大小顺序:
H—I<H—Cl<H—F,故A错误;
B.键能越大,共价键稳定,因此表中最稳定的共价键是H—F键,故B错误;
C.根据表格中数据得到E(H—Br)介于H—I和H—Cl之间即432kJ/mol>E(H—Br)>298kJ/mol,故C正确;
D.键能越大,分子越稳定,因此上述键能可以说明热稳定性的顺序是:HF>HCl>HI,故D错误;
综上所述,答案为C。
10.(2021·北京高二检测)CH、—CH、CH都是重要的有机反应中间体,有关它们的说法正确的是( )
3
A.—CH 与—NH 连接形成的化合物中,碳原子采取sp3杂化
3 2
B.CH与NH 、HO+的立体构型均为正四面体形
3 3
C.CH中的碳原子采取sp3杂化,所有原子不都共面
D.CH与OH-形成的化合物中含有离子键
【答案】A
【解析】CH—NH 碳原子采取sp3杂化,A正确;CH与NH 、HO+三者均为三角锥形,B错误;CH中C
3 2 3 3
的价电子对数为3,为sp2杂化,平面三角形,C错误;CHOH中不含离子键,D错误。
3
11.(2021·天津高二检测)用短线“—”表示共用电子对,用“ ”表示未成键孤电子对的式子叫路易斯结
构式。R分子的路易斯结构式可以表示为 。则以下叙述错误的是( )
A.R为三角锥形 B.R可以是BF
3
C.R是极性分子 D.键角小于109°28′
【答案】B
【解析】在 中含有3个单键和1对孤电子对,价层电子对数为4,空间上为三角锥形,A正确;B
6
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司原子最外层含有3个电子,BF 中B原子形成3个共价键,B原子没有孤电子对,所以R不是BF,B错误;
3 3
R分子的结构不对称,R是极性分子,C正确;三角锥形分子的键角为107°,键角小于109°28′,D正确。
12.(2021·全国·)下列“类比”结果不正确的是
A.浓硫酸与NaCl微热制备HCl,则浓硫酸与 微热可制备
B. 的分子构型为V形,则 的分子构型为V形
C.纯水的电离 ,则液氨的电离
D. 通入 溶液中无沉淀生成,则 通入 溶液中也没有沉淀生成
【答案】D
【详解】
A.浓硫酸与NaCl微热制备HCl,则浓硫酸与 微热可制备 ,均为不挥发性强酸制挥发性酸的
反应,A不符合;
B. 、 的中心原子价层电子对数为2+2=4,孤电子对数均为2,因此分子构型都为V形, B不符
合;
C. 水与氨分子内部均存在强极性键、所含氢原子都是活泼氢原子、水分子与氨分子均能结合氢离子,纯
水的电离 ,则液氨的电离 ,C不符合;
D. 通入 溶液中不发生复分解反应、无沉淀生成,二氧化硫水溶液具有明显酸性、此时硝
酸根离子具有强氧化性,则 通入 溶液中发生氧化还原反应生成硫酸钡沉淀, D符合;
答案选D。
13.(2021·陕西·武功县普集高级中学)氯化亚硫( )是一种很重要的化学试剂,可以作为氯化剂和脱
水剂。下列关于氯化亚硫分子的空间结构和中心原子( )采取何种杂化方式的说法正确的是
A.三角锥形、 B.平面三角形、
7
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司C.平面三角形、 D.三角锥形、
【答案】A
【详解】
根据VSEPR, 的中心原子S原子的价层电子对数为 ,中心原子采用采用 杂化,
其中S原子含有一对孤对电子,空间构型为三角锥形,故选A。
14.下列说法中正确的是( )
A.PCl 分子是三角锥形,这是因为磷原子是sp2杂化的结果
3
B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的4个sp3杂化轨道
C.凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体形
D.AB 型的分子空间结构必为平面三角形
3
【答案】C
【解析】PCl 分子的价层电子对数为4,因此PCl 分子中磷原子为sp3杂化,A项错误;sp3杂化轨道是由原子最
3 3
外电子层上的s轨道和3个p轨道重新形成的能量相等、成分相同的4个轨道,B项错误;sp3杂化所得到的
VSEPR模型为四面体形,C项正确;PCl 分子中1对孤电子对占据了一个杂化轨道,因此PCl 分子是三角锥
3 3
形,D项错误。
15.根据杂化轨道理论和价层电子对互斥模型判断,下列分子或者离子的空间结构的相关描述正确的是 (
)
中心原子 价层电子 分子或离子
选项 分子式
杂化方式 对互斥模型 的空间结构
A SO sp 直线形 直线形
2
B HCHO sp2 平面三角形 三角锥形
C NF sp2 四面体形 平面三角形
3
D N sp3 正四面体形 正四面体形
【答案】D
【解析】SO 分子中的中心原子杂化方式为sp2杂化,价层电子对互斥模型呈平面三角形,分子的空间结构为
2
V形,A项错误;HCHO分子中的中心原子杂化方式为sp2杂化,价层电子对互斥模型呈平面三角形,分子的空间
结构为平面三角形,B项错误;NF 分子中的中心原子杂化方式为sp3杂化,价层电子对互斥模型呈四面体形,分
3
子的空间结构为三角锥形,C项错误。
二、选择题(本题包括5个小题,每小题有1~2个选项符合题意。每小题3分,共15分)
8
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司16.已知M元素原子的价层电子排布式为3s23p1,短周期元素L的原子最外层p轨道为半充满状态,下列叙述
错误的是( )
A.M为金属元素,L为非金属元素
B.M与L为同周期元素
C.L的电负性大于M
D.M的第一电离能大于L
【答案】BD
【解析】由已知信息可得M为铝元素,L为氮元素或磷元素,故A、C项均正确,B错误。第一电离能:N>P>Al,
故D项错误。
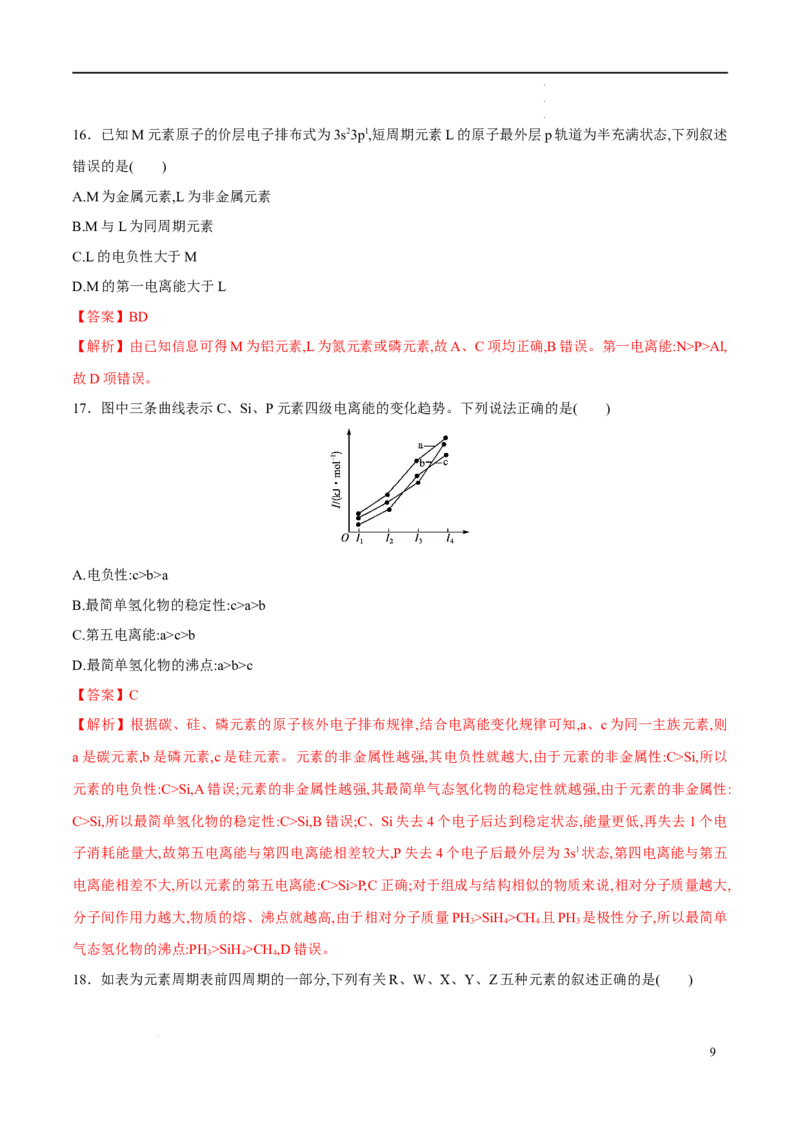
17.图中三条曲线表示C、Si、P元素四级电离能的变化趋势。下列说法正确的是( )
A.电负性:c>b>a
B.最简单氢化物的稳定性:c>a>b
C.第五电离能:a>c>b
D.最简单氢化物的沸点:a>b>c
【答案】C
【解析】根据碳、硅、磷元素的原子核外电子排布规律,结合电离能变化规律可知,a、c为同一主族元素,则
a是碳元素,b是磷元素,c是硅元素。元素的非金属性越强,其电负性就越大,由于元素的非金属性:C>Si,所以
元素的电负性:C>Si,A错误;元素的非金属性越强,其最简单气态氢化物的稳定性就越强,由于元素的非金属性:
C>Si,所以最简单氢化物的稳定性:C>Si,B错误;C、Si失去4个电子后达到稳定状态,能量更低,再失去1个电
子消耗能量大,故第五电离能与第四电离能相差较大,P失去4个电子后最外层为3s1状态,第四电离能与第五
电离能相差不大,所以元素的第五电离能:C>Si>P,C正确;对于组成与结构相似的物质来说,相对分子质量越大,
分子间作用力越大,物质的熔、沸点就越高,由于相对分子质量PH >SiH >CH 且PH 是极性分子,所以最简单
3 4 4 3
气态氢化物的沸点:PH>SiH >CH ,D错误。
3 4 4
18.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述正确的是( )
9
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司A.W、R元素单质分子内都存在非极性键
B.X、Z元素都能形成双原子分子
C.最简单氢化物的熔、沸点:WH X,故键长:W—H>X—H,键长越短,键能越
3
大,故键能W—HX,故键长:W—H>X—H,键长越短,键能越
3
大,故键能W—H (填元素符号);X和Z形成的化合物XZ 为一种液
2
体溶剂,其分子中的σ键和π键数目之比为 ,该化合物 溶于水(填“易”或“难”)。
(3)Y的最简单氢化物分子中含有 共价键(填“极性”或“非极性”,下同),是 分子,该氢化
物易液化,其原因是 。
(4)M的气态氢化物和氟化氢相比(填写化学式,并从微粒间作用力的角度分析原因),稳定性强的是 ,
其原因是 ;沸点高的是 ,其原因是
。
【答案】(除有标注的外,每空1分)(1)[Ar]3d64s2(或1s22s22p63s23p63d64s2)
(2)N O(两空共1分) 1∶1(2分) 难
(3)极性 极性 氨分子间可以形成氢键
1
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司 3(4)HF H—F的键能大于H—Cl HF HF分子间可以形成氢键
【解析】根据题意推知X、Y、Z、M、Q分别是C、N、S、Cl、Fe元素。
(1)铁原子核外有26个电子,基态原子的电子排布式是[Ar]3d64s2或1s22s22p63s23p63d64s2。
(2)N原子的2p能级是半充满状态,较稳定,因此第一电离能:N>O。X和Z形成的化合物XZ 为CS,根据
2 2
结构式S C S可知,分子中σ键和π键数目之比为1∶1,且为非极性分子;根据“相似相溶”规律可判断CS
2
难溶于水。
(3)Y的最简单氢化物为NH ,N—H是极性共价键,分子结构呈三角锥形,结构不对称,为极性分子;氨气易
3
液化的原因是氨分子间可以形成氢键。
(4)由于H—F的键能大于H—Cl,故氢化物的稳定性:HF>HCl;由于HF分子间可以形成氢键,故其沸点比
HCl的高。
24.(11分)卤族元素形成的单质和化合物有很多,我们可以利用所学物质结构与性质的相关知识去认识和理
解它们。
(1)卤族元素位于元素周期表的 区;溴的价层电子排布式为 。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF) 形式存在的,使氢氟酸分子缔合的作用力是 。
2
(3)请根据下表提供的第一电离能数据判断,还原性最强的卤素原子是 (写出名称)。
元 素 氟 氯 溴 碘
第一电离能/(kJ·mol-1) 1 681 1 251 1 140 1 008
(4)已知下列5种羧酸:
①CF COOH ②CHCOOH ③CHFCOOH
3 3 2
④CH ClCOOH ⑤CHCHCOOH
2 3 2
其酸性由强到弱的顺序为 (填序号)。
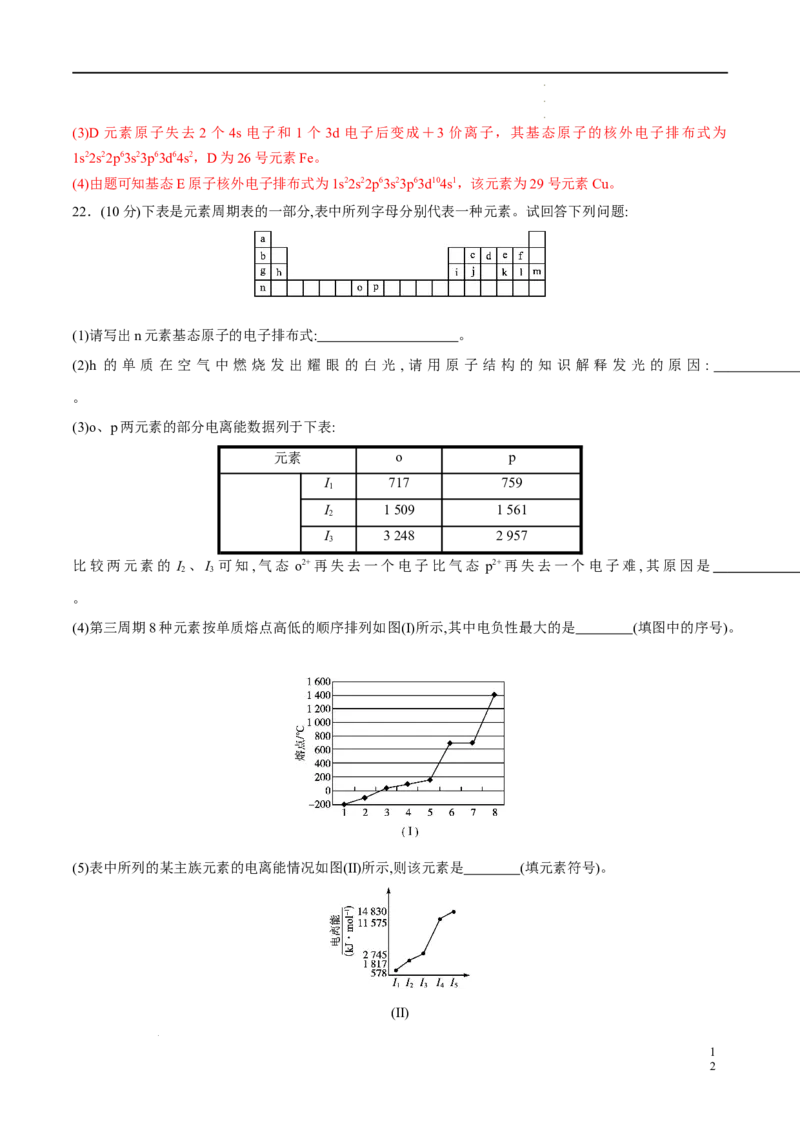
(5)硼酸(H BO)是一种片层状结构的白色晶体,层内的HBO 分子通过氢键相连(如图)。则1 mol H BO 形成
3 3 3 3 3 3
的晶体中有 mol氢键。
硼酸溶于水生成弱电解质一水合硼酸
1
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司 4B(OH) ·H O,它电离生成少量[B(OH) ]-和H+,则[B(OH) ]-的空间结构为 ,其中B原子
3 2 4 4
的杂化方式是 。
【答案】[(1)(2)(3)每空1分,(4)(5)每空2分]
(1)p 4s24p5 (2)氢键 (3)碘 (4)①>③>④>②>⑤ (5)3 正四面体形 sp3
【解析】(3)由表中数据可知,碘的第一电离能最小,即碘失去电子能力最强,其还原性最强。
(4)F原子吸电子能力大于Cl,烃基是推电子基团,烃基中碳原子数越多,其推电子能力越弱,故5种羧酸酸
性由强到弱的顺序为①>③>④>②>⑤。
(5)由硼酸片层结构图可以看出,每个硼酸分子可以形成6个氢键,由于氢键存在于分子之间,故1 mol硼
酸形成的晶体中有3 mol氢键。在[B(OH) ]-中,B原子价层电子对数为4,无孤电子对,故[B(OH) ]-是正四面体
4 4
结构,B原子采取sp3杂化。
25.(11分)(1)肼(N H)分子可视为NH 分子中的一个氢原子被—NH (氨基)取代形成的另一种氮的氢化物。
2 4 3 2
①NH 分子的空间结构是 ;N H 分子中氮原子轨道的杂化类型是 。
3 2 4
②肼可用作火箭燃料,燃烧时发生的反应是
NO(l)+2N H(l) 3N(g)+4HO(g)
2 4 2 4 2 2
ΔH=-1 038.7 kJ·mol-1
若该反应中有4 mol N—H断裂,则形成的π键有 mol。
③肼能与硫酸反应生成NHSO 。NHSO 与硫酸铵化合物类型相同,则NHSO 晶体内不存在 (填标
2 6 4 2 6 4 2 6 4
号)。
a.离子键 b.共价键 c.范德华力
(2)第ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
①HSe的酸性比HS (填“强”或“弱”)。气态SeO 分子的空间结构为 ,SO2-的空间结构为
2 2 3 3
。
②H SeO 的分别为2.7×10-3和2.5×10-7,H SeO 第一步几乎完全电离,为1.2×10-2,请根据结构与性质的关系解
2 3 2 4
释:H SeO 比HSeO 酸性强的原因 。
2 4 2 3
【答案】(除有标注的外,每空1分)(1)①三角锥形 sp3 ②3 ③c(2分)
(2)①强 平面三角形 三角锥形 ②HSeO 和HSeO 可表示为(HO) SeO和(HO) SeO,H SeO 中的Se
2 3 2 4 2 2 2 2 3
为+4价,而HSeO 中的Se为+6价,正电性更高,导致Se—O—H中O的电子更向Se偏移,越易电离出H+(3分)
2 4
【解析】 (1)①NH 分子中氮原子的杂化方式为sp3杂化,其分子的空间构型为三角锥形;氨基(—NH )中
3 2
氮原子的杂化方式也为sp3杂化,其分子的空间构型为Ⅴ形。NH 的结构为HN—NH,相当于2个氨基,
2 4 2 2
所以氮原子的杂化方式也为sp3杂化。
1
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司 5②1个NH 分子含有4个N—H键,即4 mol N—H键断裂同时生成1.5 mol N,N 的结构式为N≡N,含1
2 4 2 2
个σ键和2个π键,所以会形成3 mol π键。
③NHSO 和(NH )SO 都是离子晶体,NH2+和SO 2-之间存在离子键,NH2+中N和H之间形成6个共价
2 6 4 4 2 4 2 6 4 2 6
键(其中2个配位键),N和N之间形成共价键,SO 2-中S和O之间形成共价键,不含范德华力。
4
(2)①Se的原子半径大于S的原子半径,HSe与HS相比,HSe中Se原子对H原子的作用力较弱,HSe在
2 2 2 2
水中更容易电离出H+,所以其酸性较强;SeO 中Se原子采取sp2杂化且有3个配位原子,故其立体构型为
3
平面三角形;SO 2-中S原子采取sp3杂化且有3个配位原子,故其立体构型为三角锥形。②HSeO 中Se为
3 2 3
+4价,而HSeO 中Se为+6价,Se的正电性更高,导致Se—O—H中O原子的电子向Se原子偏移,因
2 4
而在水分子的作用下,也就越容易电离出H+,即酸性越强。
1
学学学科科科网网网(((北北北京京京)))股股股份份份有有有限限限公公公司司司 61
71
8