文档内容
高一化学必修第一册同步单元AB卷(新教材人教版)
高一化学上学期期中模拟卷(一)
说明:本试卷分选择题非选择题,满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 Mn 55 Cu 64
一、选择题:本题共20个小题,每小题2分。共40分,在每小题给出的四个选项中,只有一项是符合题
目要求的。
1. 将下列各组物质分类正确的是
A. 酸:硫酸、醋酸、NaHSO、硝酸
4
B. 碱:纯碱、烧碱、乙醇、熟石灰
C. 盐:生石灰、硝酸钾、CaCO 、苛性钠
3
D. 同素异形体:金刚石、石墨、C 、无定形碳
60
2. 向烧杯中加入25mL蒸馏水,加热至沸腾,向沸水中逐滴加入6滴FeCl 饱和溶液。继续加热至溶液呈
3
红棕色,停止加热,就制得了Fe(OH) 胶体。下列有关胶体的叙述不正确的是
3
A. 胶体是一种分散系,属于混合物
B. 胶体的本质特征是能发生丁达尔现象
C. 胶体粒子直径介于 10-9~10-7m之间
D. 利用丁达尔现象是区分胶体和溶液的一种常用方法
3. 下列说法正确的是
A.BaSO 难溶于水,其水溶液导电能力极弱,所以硫酸钡是弱电解质
4
B.CO 溶于水得到的溶液能导电,所以CO 是电解质
2 2
C.强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
D.导电能力强的溶液一定是强电解质溶液
4. 在碱性溶液中能大量共存且溶液为无色透明的离子组是
A.K+、MnO、Na+、Cl- B.K+、Na+、NO、CO
C.Na+、HCO、NO、SO D.Fe3+、Na+、Cl-、SO
5. 某溶液中只含有Na+、Al3+、Cl-、SO四种离子,已知Na+、Al3+、Cl-的个数之比为3∶2∶1,则溶液
中Al3+与SO的个数之比为
A.1 ∶2 B.1∶4
C.3∶4 D.3∶2
6. 下列离子方程式正确的是A. 将铜插入硝酸银溶液中:
B. 溶液与过量 溶液反应: ===
C. 用食醋除水垢:
D. 稀硫酸和 溶液反应:
7. 日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是
A. 铜铸器件上出现铜绿
B. 充有氢气的气球遇明火爆炸
C. 大理石雕像被酸雨腐蚀毁坏
D. 铁质菜刀生锈
8. 已知:① ,② ,③
在一定条件下 ,分别与足量的 反应,如果在三个反应中电子转移数目相等,则
的物质的量之比为( )
A. B. C. D.
可以发生反应 ,下列说法正确的是
9.
A. 氧气是氧化产物
B. 既是氧化剂,又是还原剂
C. 若生成 ,则转移 电子
D. 还原剂与氧化剂的物质的量之比为
10. (2019山西晋城一中期中)钠及其化合物与人们的生活密切相关,某同学对其认识不正确的是
A.碳酸氢钠常用于治疗胃酸过多症
B.NaO 用作呼吸面具的供氧剂
2 2C.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D.金属钠着火时,使用泡沫灭火器来灭火
11. 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
选项 陈述Ⅰ 陈述Ⅱ 判断
A 碳酸钠溶液可用于治疗胃病 NaCO 可与盐酸反应 Ⅰ对,Ⅱ对,有
2 3
向NaO 与HO反应后的溶液中滴入
B 2 2 2 NaO 与水反应生成氢氧化钠 Ⅰ对,Ⅱ错,无
酚酞,溶液变红色 2 2
C 金属钠应保存在煤油中隔绝空气 常温下,金属钠在空气中会生成过氧化钠 Ⅰ对,Ⅱ对,有
D 过氧化钠可用作航天员的供氧剂 NaO 能和CO、HO反应生成O Ⅰ对,Ⅱ对,有
2 2 2 2 2
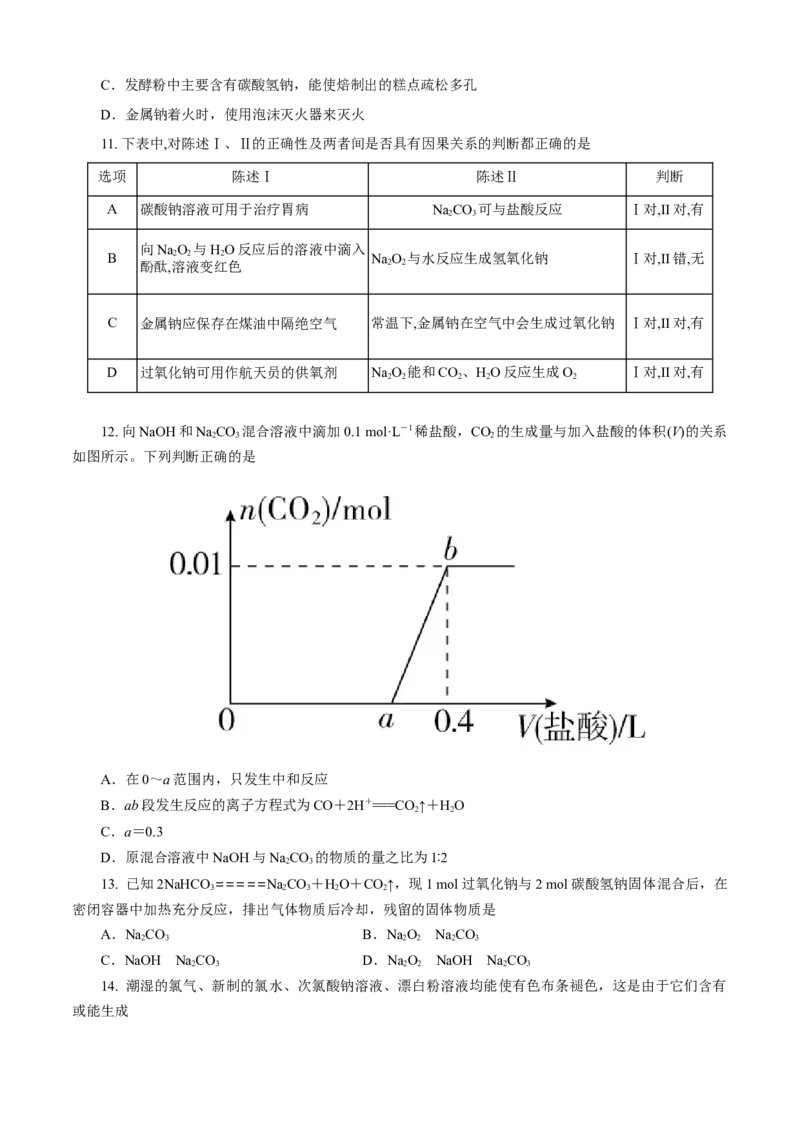
12. 向NaOH和NaCO 混合溶液中滴加0.1 mol·L-1稀盐酸,CO 的生成量与加入盐酸的体积(V)的关系
2 3 2
如图所示。下列判断正确的是
A.在0~a范围内,只发生中和反应
B.ab段发生反应的离子方程式为CO+2H+===CO ↑+HO
2 2
C.a=0.3
D.原混合溶液中NaOH与NaCO 的物质的量之比为1∶2
2 3
13. 已知2NaHCO =====NaCO +HO+CO↑,现1 mol过氧化钠与2 mol碳酸氢钠固体混合后,在
3 2 3 2 2
密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A.NaCO B.NaO NaCO
2 3 2 2 2 3
C.NaOH NaCO D.NaO NaOH NaCO
2 3 2 2 2 3
14. 潮湿的氯气、新制的氯水、次氯酸钠溶液、漂白粉溶液均能使有色布条褪色,这是由于它们含有
或能生成A.氯气 B.次氯酸
C.次氯酸根 D.氯化氢
15. 某溶液中含有较大量的Cl-、CO、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离
子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO) 溶液;②过滤;③滴加AgNO 溶液;④滴加Ba(NO ) 溶液。
3 2 3 3 2
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
16. 水处理包括水的净化、杀菌消毒、蒸馏等。其中常见的杀菌消毒剂包括氯气、臭氧、漂白粉、活
性炭等。游泳场馆往往用臭氧、活性炭对游泳池进行消毒和净化。下列说法中正确的是
A.臭氧、活性炭处理水的原理相同
B.氯气是一种常用的消毒剂,用氯气消毒的水也可以用于配制各种化学试剂
C.氯气和二氧化硫都具有漂白性,等体积的两者混合会提高漂白的效率
D.漂白粉长期露置在空气中会失效
17. 下列有关说法错误的是
A. 22.4 L氯气与足量铁反应一定转移2 mol电子
B. 1 mol氯气通入水中转移的电子少于1 mol
C. 1 mol氯气通入足量NaOH稀溶液中转移1 mol电子
D. 浓盐酸与氯酸钾反应生成3 mol氯气,转移5 mol电子
18. 有一真空瓶质量为m ,充满氨气后总质量为m 。在相同状况下若改为充满某气体A时总质量为
1 2
m,则A的相对分子质量是
3
A. B. C. D.
19. 36.5 g HCl溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为w,
物质的量浓度为c mol/L,N 表示阿伏加德罗常数的值,则下列叙述中正确的是
A
A.所得溶液的物质的量浓度c=1 mol/L
B.所得溶液中含有N 个HCl分子
A
C.36.5 g HCl气体占有的体积为22.4 L
D.所得溶液的质量分数w=
20. 由NO和CO组成的混合气体与同温同压下空气的密度相等(空气的平均相对分子质量为 29),下
列关系正确的是
A.混合气体中,CO与NO质量比为15∶14
B.混合气体中,CO与NO分子个数比为1∶2
C.混合气体中,CO占有的体积大于NO占有的体积D.混合气体中,CO与NO密度比为14∶15
二、非选择题:本题共5个题,共60分。
21. (10分)
有一固体粉末,其中可能含有NaCO、NaCl、NaSO 、CuCl 、Ba(NO ) 、KCO、KSO 中的一种或
2 3 2 4 2 3 2 2 3 2 4
几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀.
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体.
(3)取滤液做焰色反应,可证明滤液中含Na +,不含K +.
由上述现象推断:
(1)该混合物中一定含有__________________________;一定不含有___________________________,
可能含有_________.
(2)如要检验其是否存在,将如何操作
______________________________________________________.
22. (12分)
亚氯酸钠(NaClO)是一种高效氧化剂、漂白剂。在NaOH溶液中ClO 与HO 反应可以得到亚氯酸钠。
2 2 2 2
(1)ClO 中氯元素的化合价是_________;在制备亚氯酸钠的反应中ClO 作___________(填“氧化剂”
2 2
或“还原剂”);若反应中生成1 mol NaClO ,转移电子的物质的量为_________________。
2
(2)该反应的化学方程式为___________________________________________。
(3)科学家经研究发现NaClO 也可用于制取自来水消毒剂ClO 。在一定条件下,将Cl 通入填充有固体
2 2 2
NaClO 的反应柱内二者反应可制得ClO 。还原产物为_____________,当消耗标准状况下1.12 L Cl 时,制
2 2 2
得ClO _________ g。
2
23. (12分)
某校化学实验兴趣小组欲采用如图所示的实验装置制备Cl,同时进行与氯气有关的某些实验,按要求
2
回答问题。
(1)A 是 浓 盐 酸 , B 是 二 氧 化 锰 , 将 A 滴 入 B 中 时 发 生 反 应 的 离 子 方 程 式 为
__________________________。
(2)甲同学用含有146 g HCl的浓盐酸与足量的MnO 反应制Cl,结果制得的Cl 小于71 g,这是由于反
2 2 2
应 过 程 中 盐 酸 浓 度 变 小 造 成 的 。 请 列 举 导 致 盐 酸 浓 度 变 小 的 原 因 :___________________________________。
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则瓶①②中应盛放的试剂分别是:
①________________________,②________________(填试剂名称)。
(4)丙同学将纯净的Cl 通入一定量石灰乳中来制取漂白粉,若通入x个Cl 完全反应,则反应过程中转
2 2
移电子____________个。
24. (16分)
现需要0.2 mol·L−1CuSO 溶液250 mL,实验室除蒸馏水外还提供蓝色胆矾晶体(CuSO ·5H O)和4
4 4 2
mol·L−1CuSO 溶液两种试剂以配制该溶液。
4
(1)无论采用何种试剂进行配制,除烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是
___________,在使用该仪器前必须进行的操作是______________。
(2)若用胆矾晶体进行配制,需用托盘天平称取CuSO ·5H O的质量为_______ g;如果用4 mol/L的
4 2
CuSO 溶液稀释配制,需用量筒量取___________mL 4 mol/L CuSO 溶液。
4 4
(3)用4 mol/L的硫酸铜溶液稀释配制溶液所需的实验步骤有:
a.往烧杯中加入约100 mL水进行初步稀释,冷却至室温
b.用量筒量取一定体积4 mol/L的硫酸铜溶液于一烧杯中
c.计算所需4 mol/L硫酸铜溶液的体积
d.盖好瓶塞,反复上下颠倒摇匀后,将溶液转存于试剂瓶中
e.加水至液面离容量瓶刻度线1~2 cm处改用胶头滴管进行定容
f.洗涤烧杯和玻璃棒2~3次并将洗涤液注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀
g.将溶液转移入容量瓶
其中正确的操作顺序为______________________。
(4)指出配制过程中的以下情形对所得溶液浓度的影响(填“偏高”“偏低”或“无影响”)。
①d步骤摇匀后,发现液面低于刻度线,再加水至刻度线:___________。
②e步骤中,俯视刻度线:___________。
③g步骤前,容量瓶未干燥,有少量蒸馏水:___________。
25. (10分)
现有14.4 g CO和CO 的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
2
(1)该混合气体的平均摩尔质量:___________________________________________。(2)混合气体中碳原子的个数:____________________。(用N 表示阿伏加德罗常数的值)
A
(3)将混合气体依次通过如图装置,最后收集在气球中。
①气球中收集到的气体摩尔质量:__________________;
②标准状况下气球中收集到的气体的体积为__________________;
③气球中收集到的气体的电子总数为_____________________。(用N 表示阿伏加德罗常数的值)
A