文档内容
选择性必修1 第二章 第一节 化学反应速率 测试题
榆次一中 李金虎
一、选择题(每小题只有一个正确选项,每小题4分,共40分)
1. 对于在一个密闭容器中进行的反应C(s)+HO(g) CO(g)+H(g),下列条件的改变对反应速率
2 2
几乎没有影响的是( )
①增加C的量 ②增加CO的量 ③将容器的体积缩小一半
④保持体积不变,充入N 以增大压强 ⑤升高反应体系的温度
2
⑥保持压强不变,充入N 以增大体积
2
A.①④ B.①③ C.②③ D.④⑥
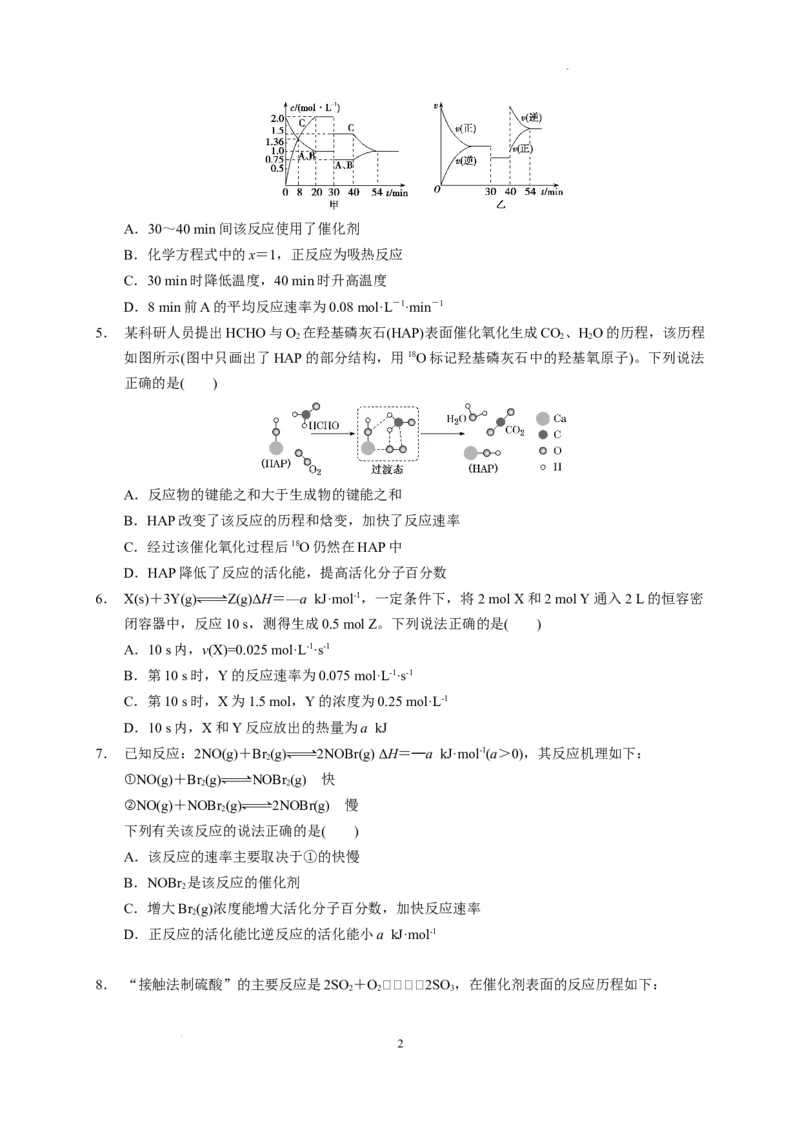
2. 如图安装好实验装置(装置气密性良好),在锥形瓶内盛有 6.5 g锌粒(Zn的相对原子质量为
65),通过分液漏斗加入40 mL 2.5 mol·L-1的稀硫酸,将产生的H 收集在注射器中,10 s时恰
2
好收集到标准状况下的H 44.8 mL。下列说法不正确的是( )
2
A.忽略锥形瓶内溶液体积的变化,用H+表示10 s内该反应的速率为0.01 mol·L-1·s-1
B.忽略锥形瓶内溶液体积的变化,用Zn2+表示10 s内该反应的速率为0.01 mol·L-1·s-1
C.用锌粒表示10 s内该反应的速率为0.013 g·s-1
D.用H 表示10 s内该反应的速率为0.000 2 mol·s-1
2
3. N 分子在催化剂的作用下发生的一系列转化如图所示。下列叙述正确的是( )
2
A. 在反应过程中作催化剂
B.催化剂a表面发生了分解反应和化合反应
C.催化剂a、b增大了该历程中的最大能垒(活化能)
D.催化剂b表面发生的反应为4NH +5O=====4NO+6HO
3 2 2
4. 某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平
衡后,在不同的时间段内反应物的浓度随时间的变化如图甲所示,正逆反应速率随时间的变化
如图乙所示,下列说法中正确的是( )
1
学科网(北京)股份有限公司A.30~40 min间该反应使用了催化剂
B.化学方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1
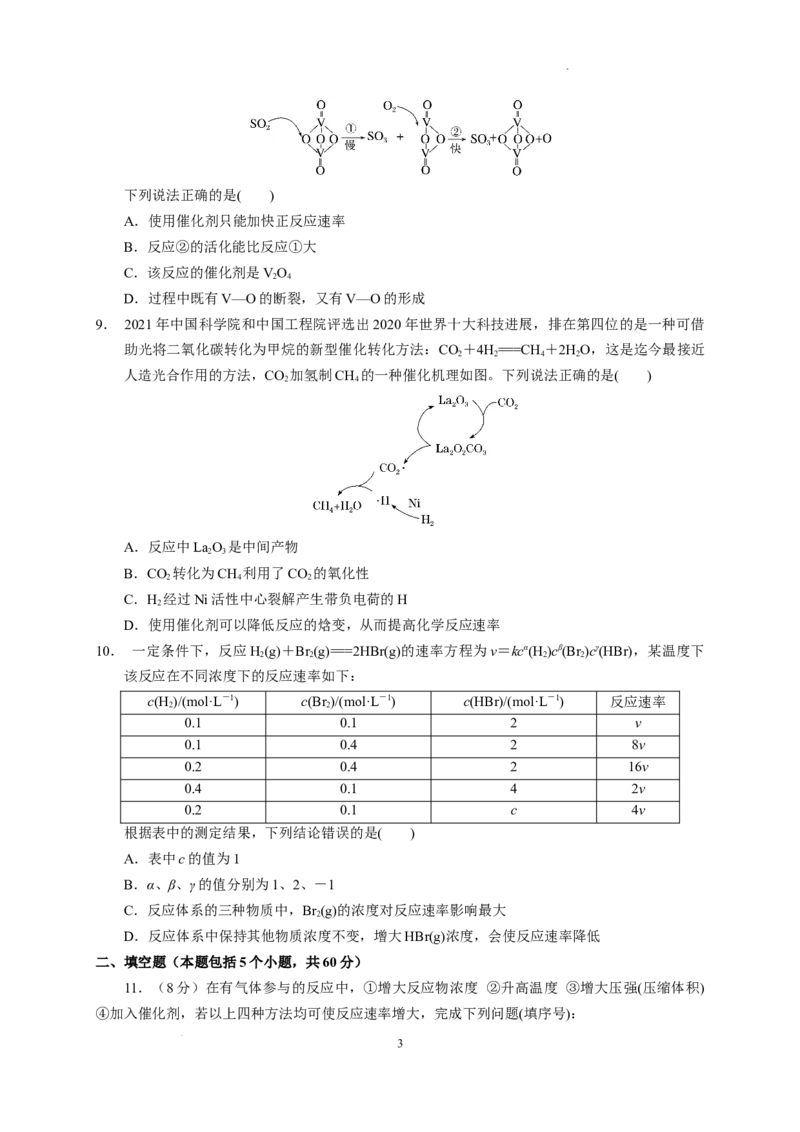
5. 某科研人员提出HCHO与O 在羟基磷灰石(HAP)表面催化氧化生成CO 、HO的历程,该历程
2 2 2
如图所示(图中只画出了HAP的部分结构,用18O标记羟基磷灰石中的羟基氧原子)。下列说法
正确的是( )
A.反应物的键能之和大于生成物的键能之和
B.HAP改变了该反应的历程和焓变,加快了反应速率
C.经过该催化氧化过程后18O仍然在HAP中
D.HAP降低了反应的活化能,提高活化分子百分数
6. X(s)+3Y(g) Z(g)ΔH=—a kJ·mol-1,一定条件下,将2 mol X和2 mol Y通入2 L的恒容密
闭容器中,反应10 s,测得生成0.5 mol Z。下列说法正确的是( )
A.10 s内,v(X)=0.025 mol·L-1·s-1
B.第10 s时,Y的反应速率为0.075 mol·L-1·s-1
C.第10 s时,X为1.5 mol,Y的浓度为0.25 mol·L-1
D.10 s内,X和Y反应放出的热量为a kJ
7. 已知反应:2NO(g)+Br (g) 2NOBr(g) ΔH=─a kJ·mol-1(a>0),其反应机理如下:
2
①NO(g)+Br (g) NOBr (g) 快
2 2
②NO(g)+NOBr (g) 2NOBr(g) 慢
2
下列有关该反应的说法正确的是( )
A.该反应的速率主要取决于①的快慢
B.NOBr 是该反应的催化剂
2
C.增大Br (g)浓度能增大活化分子百分数,加快反应速率
2
D.正反应的活化能比逆反应的活化能小a kJ·mol-1
8. “接触法制硫酸”的主要反应是2SO +O2SO ,在催化剂表面的反应历程如下:
2 2 3
2
学科网(北京)股份有限公司下列说法正确的是( )
A.使用催化剂只能加快正反应速率
B.反应②的活化能比反应①大
C.该反应的催化剂是VO
2 4
D.过程中既有V—O的断裂,又有V—O的形成
9. 2021年中国科学院和中国工程院评选出2020年世界十大科技进展,排在第四位的是一种可借
助光将二氧化碳转化为甲烷的新型催化转化方法:CO +4H===CH +2HO,这是迄今最接近
2 2 4 2
人造光合作用的方法,CO 加氢制CH 的一种催化机理如图。下列说法正确的是( )
2 4
A.反应中LaO 是中间产物
2 3
B.CO 转化为CH 利用了CO 的氧化性
2 4 2
C.H 经过Ni活性中心裂解产生带负电荷的H
2
D.使用催化剂可以降低反应的焓变,从而提高化学反应速率
10. 一定条件下,反应H(g)+Br (g)===2HBr(g)的速率方程为v=kcα(H )cβ(Br)cγ(HBr),某温度下
2 2 2 2
该反应在不同浓度下的反应速率如下:
c(H )/(mol·L-1) c(Br)/(mol·L-1) c(HBr)/(mol·L-1) 反应速率
2 2
0.1 0.1 2 v
0.1 0.4 2 8v
0.2 0.4 2 16v
0.4 0.1 4 2v
0.2 0.1 c 4v
根据表中的测定结果,下列结论错误的是( )
A.表中c的值为1
B.α、β、γ的值分别为1、2、-1
C.反应体系的三种物质中,Br (g)的浓度对反应速率影响最大
2
D.反应体系中保持其他物质浓度不变,增大HBr(g)浓度,会使反应速率降低
二、填空题(本题包括5个小题,共60分)
11.(8分)在有气体参与的反应中,①增大反应物浓度 ②升高温度 ③增大压强(压缩体积)
④加入催化剂,若以上四种方法均可使反应速率增大,完成下列问题(填序号):
3
学科网(北京)股份有限公司(1)能降低反应活化能的是 。
(2)增加活化分子百分比的是________。
(3)未改变活化分子百分比,增加单位体积内分子总数的是________。
(4)增加单位体积内活化分子数的是________。
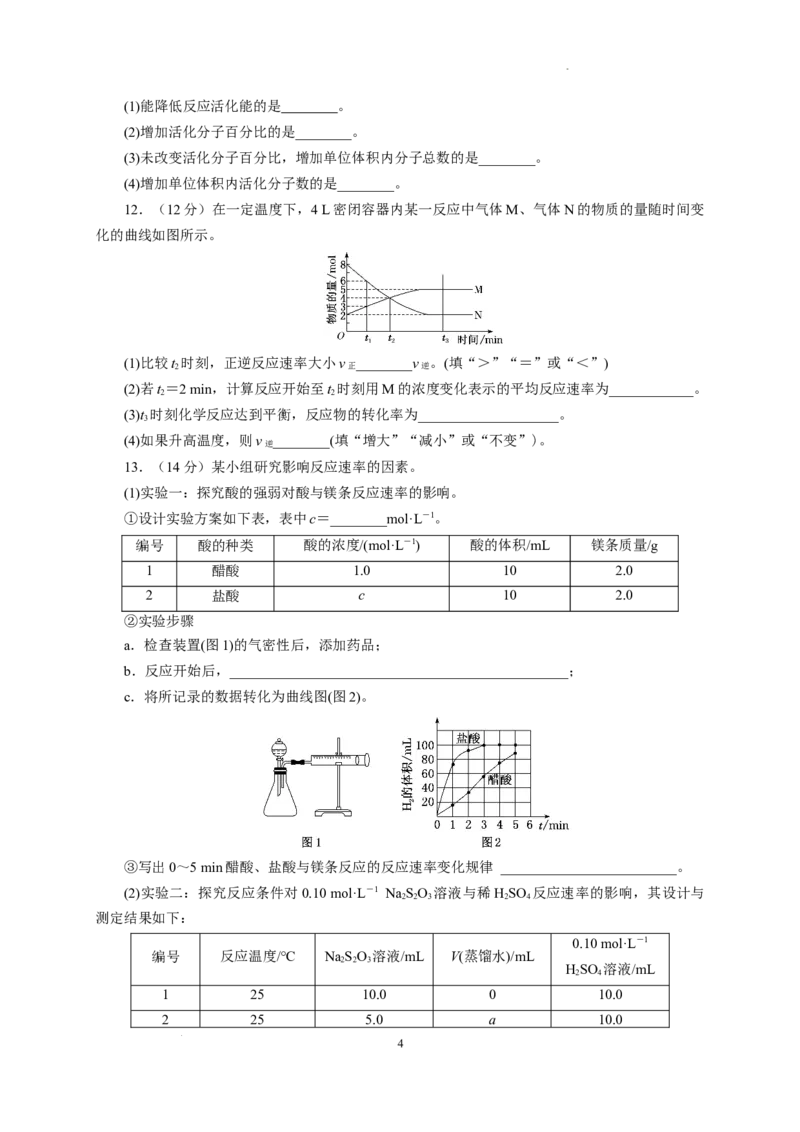
12.(12分)在一定温度下,4 L密闭容器内某一反应中气体M、气体N的物质的量随时间变
化的曲线如图所示。
(1)比较t 时刻,正逆反应速率大小v ________v 。(填“>”“=”或“<”)
2 正 逆
(2)若t=2 min,计算反应开始至t 时刻用M的浓度变化表示的平均反应速率为____________。
2 2
(3)t 时刻化学反应达到平衡,反应物的转化率为____________________。
3
(4)如果升高温度,则v ________(填“增大”“减小”或“不变”)。
逆
13.(14分)某小组研究影响反应速率的因素。
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响。
①设计实验方案如下表,表中c=________mol·L-1。
编号 酸的种类 酸的浓度/(mol·L-1) 酸的体积/mL 镁条质量/g
1 醋酸 1.0 10 2.0
2 盐酸 c 10 2.0
②实验步骤
a.检查装置(图1)的气密性后,添加药品;
b.反应开始后,________________________________________________;
c.将所记录的数据转化为曲线图(图2)。
③写出0~5 min醋酸、盐酸与镁条反应的反应速率变化规律 _________________________。
(2)实验二:探究反应条件对0.10 mol·L-1 Na SO 溶液与稀HSO 反应速率的影响,其设计与
2 2 3 2 4
测定结果如下:
0.10 mol·L-1
编号 反应温度/℃ NaSO 溶液/mL V(蒸馏水)/mL
2 2 3
HSO 溶液/mL
2 4
1 25 10.0 0 10.0
2 25 5.0 a 10.0
4
学科网(北京)股份有限公司3 45 10.0 0 10.0
乙
①写出上述实验原理的离子方程式:__________________________________________。
②上述实验1、3是探究________对化学反应速率的影响;若上述实验1、2是探究浓度对化学
反应速率的影响,则a的值为________;乙是实验需要测量的物理量,则表格中“乙”应填写
__________________________________________________________________。
14.(12分)向某密闭容器中加入0.15 mol·L-1A、0.05 mol·L-1C和一定量的B三种气体。一
定条件下发生反应,各物质浓度随时间变化如甲图所示[t~t 时c(B)未画出,t 时为0.05 mol·L-1]。
0 1 1
乙图为t 时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
2
(1)若t 时改变的条件为减小压强,则B的起始物质的量浓度为________mol·L-1。
4
(2)若t 时改变的条件是升温,此时v >v ,若A的物质的量减少0.03 mol时,容器与外界的
5 正 逆
热交换总量为a kJ,写出反应的热化学方程式:_____________________________。
(3)t 时改变的某一反应条件可能是________(填字母)。
3
a.使用催化剂 b.增大压强 c.增大反应物浓度
(4)在恒温恒压下通入惰性气体,v _________v (填“>”“=”或“<”)。
正 逆
15.(14分)用HO 、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同
2 2
学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:HO +I-===H O+IO-;HO +IO-===H O+O↑+I-。总
2 2 2 2 2 2 2
反应的化学方程式为________________________________________________________。
(2)资料2:HO 分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判
2 2
断正确的是________(填字母)。
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.HO+I-===H O+IO-是放热反应
2 2 2
(3)实验中发现,HO 与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl ,振荡、
2 2 4
静置,气泡明显减少。
5
学科网(北京)股份有限公司资料3:I 也可催化HO 的分解反应。
2 2 2
①加CCl 并振荡、静置后还可观察到__________,说明有I 生成。
4 2
②气泡明显减少的原因可能是:i.H O 浓度降低;ii.__________________________。以下对照
2 2
实验说明i不是主要原因:向HO 溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试
2 2
管中。A试管中加入CCl ,B试管中不加CCl ,分别振荡、静置。观察到的现象是
4 4
。
1.答案 A
解析 ①碳是固体,在一个可逆反应里,增加C的量,不会对反应速率产生影响;④保持体积不变,
充入N 不会影响反应体系物质的浓度,也就不会影响反应速率。
2
2.答案 B
解析 Zn+ 2H+=== Zn2++ H↑
2
65 g 2 mol 1 mol 22.4 L
0.13 g 0.004 mol 0.002 mol 0.044 8 L v(H+)==0.01 mol·L-1·s-1,A正确;
v(Zn2+)=v(H+)=0.005 mol·L-1·s-1,B错误;用锌粒表示10 s内该反应的速率为=
0.013 g·s-1,C正确;用H 表示10 s内该反应的速率为=0.000 2 mol·s-1,D正确。
2
3.答案 D
解析 由题图可知,在催化剂a表面氮气和氢气发生化合反应生成氨气,氨气做生成物,在催化剂
b表面氨气和氧气反应生成一氧化氮和水,氨气做反应物,则氨气在反应过程中做中间产物,A错
误;在催化剂a表面氮气和氢气发生化合反应生成氨气,没有发生分解反应,B错误;催化剂a、
b,降低了反应的活化能,从而提高反应速率,C错误;在催化剂b表面氨气和氧气反应生成一氧
化氮和水,反应的化学方程式为4NH +5O=====4NO+6HO,D正确。
3 2 2
4.答案 D
解析 若使用催化剂,则化学反应速率加快,故A错误;由甲图像可知,A、B的浓度变化相同,
故A、B的化学计量数相同,都为1;由乙图像可知,30 min时改变的条件为减小压强,40 min时
改变的条件为升高温度,且升高温度平衡向逆反应方向移动,则正反应为放热反应,故B、C错误;
8 min前A的平均反应速率为=0.08 mol·L-1·min-1,故D正确。
5.答案 D
解析 根据甲醛的燃烧反应可知甲醛与氧气生成CO 和HO的反应为放热反应,则反应物的键能之
2 2
和小于生成物的键能之和,A项错误;催化剂能够改变反应的历程,但是不能改变反应的焓变,B
项错误;从题图可知,反应结束后18O在HO中,C项错误。
2
6.答案C
解析:根据题意,列三段式:
X(s) + 3Y(g) Z(g)
开始 2 mol 2 mol 0
转化 0.5 mol 1.5 mol 0.5 mol
6
学科网(北京)股份有限公司10 s时 1.5 mol 0.5 mol 0.5 mol
X 是固体,不能表示反应速率,故 A 项错误;10 s 内,Y 的平均反应速率为=0.075
mol·L-1·s-1,不是瞬时速率,故B项错误;第10 s时,X的物质的量为1.5 mol,Y的浓度为0.25
mol·L-1,故C项正确;该反应中,Y消耗3 mol时,反应放出a kJ热量,10 s内,Y消耗了1.5
mol,则反应放出的热量为0.5a kJ,故D项错误。
7.答案 D
解析:反应速率主要取决于慢的一步,所以该反应的速率主要取决于②的快慢,故A错误;增大
Br (g)浓度,活化分子百分数不变,但单位体积内的活化分子数目增多了,所以能加快反应速率,
2
故B错误。NOBr 是反应过程中的中间产物,不是该反应的催化剂,故C错误;由于该反应为放
2
热反应,说明反应物的总能量高于生成物的总能量,所以正反应的活化能比逆反应的活化能小 a
kJ·mol-1,故D正确。
8.答案 D
解析 催化剂能同等幅度地改变正、逆反应速率,加快正反应速率的同时也加快逆反应速率,故A
错误;一般情况下,反应的活化能越小,反应速率越快,故反应②的活化能比反应①的小,故B错
误;催化剂是反应前后质量和化学性质都没有发生变化的物质,从反应历程图中可知,该反应的催
化剂为VO,故C错误;历程中反应①有V—O的断裂,反应②有V—O的形成,故D正确。
2 5
9.答案 B
解析 由催化机理示意图可知,LaO 为反应的催化剂,LaOCO 为中间产物,故A错误;由化学
2 3 2 2 3
方程式可知,反应中二氧化碳中碳元素的化合价降低被还原,二氧化碳是反应的氧化剂,反应利用
了二氧化碳的氧化性,故B正确;由催化机理示意图可知,氢气经过镍活性中心裂解产生电中性的
氢原子(·H),故C错误;催化剂能降低反应的活化能,提高化学反应速率,但不能改变反应的焓变,
故D错误。
10. 答案B
解析 速率方程为v=kcα(H )cβ(Br)cγ(HBr),将H、Br 、HBr的浓度和反应速率都代入速率方程可以
2 2 2 2
得 到 , ① v = k×0.1α×0.1β×2γ 、 ② 8v = k×0.1α×0.4β×2γ 、 ③ 16v = k×0.2α×0.4β×2γ 、 ④ 2v =
k×0.4α×0.1β×4γ、由①②得到 β=,由②③得到 α=1,由①④得到 γ=-1,联立 4v=
k(0.2)α(0.1)βcγ(HBr)与①,将α=1,β=,γ=-1代入,解得c=1,由此分析。根据分析,α、β、γ
的值分别为1、、-1,故A不符合题意,B符合题意;由于v=kcα(H )cβ(Br)cγ(HBr),α、β、γ的值
2 2
分别为1、、-1,由于速率与Br (g)和H(g)的浓度成正比,与HBr(g)的浓度成反比,反应体系的
2 2
三种物质中,Br (g)的浓度对反应速率影响最大,故C不符合题意;由于γ=-1,增大HBr(g)浓度,
2
cγ(HBr)减小,在反应体系中保持其他物质浓度不变,会使反应速率降低,故D不符合题意。
11.答案:(1)④ (2)②④ (3)①③ (4)①②③④
解析:增大反应物的浓度能增大活化分子数和单位体积内的活化分子数;增大压强,不能增加活化
7
学科网(北京)股份有限公司分子数,但由于体积的减小可以增加单位体积活化分子数;这两个条件都不能增大活化分子百分数。
能使反应物中活化分子数和活化分子百分数同时增大,可升高温度、加入催化剂等措施。催化剂之
所以能改变化学反应速率,是因为它能改变化学反应历程,改变反应的活化能。有催化剂的体系,
可以使活化能降低。
(1)降低反应活化能的是④加入催化剂。
(2)增加活化分子百分比的是②升高温度④加入催化。
(3)未改变活化分子百分比,增加单位体积内分子总数的是①增大反应物浓度③增大压强(压
缩体积) 。
(4)增加单位体积内活化分子数的是①增大反应物浓度 ②升高温度 ③增大压强(压缩体
积)④加入催化剂。
12. 答案:(1)> (2)0.25 mol·L-1·min-1 (3)75% (4)增大
解析:(1)t 时刻,反应物逐渐减小,生成物逐渐增多,反应未达到平衡且正向进行,v >v 。(2)v
2 正 逆
===0.25 mol·L-1·min-1。(3)t 时刻化学反应达到平衡,剩余2 mol N,则转化了6 mol N,转化率
3
为×100%=75%。(4)升高温度,反应速率增大。
13. 答案:(1)①1.0 ②每隔1 min记录一次生成H 的体积 ③醋酸与镁条反应的速率随时间变化不
2
明显;盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小
(2)①SO+2H+===S↓+HO+SO ↑
2 2 2
②温度 5.0 出现浑浊的时间/min(或s)
解析:(1)①要探究酸的强弱对酸与镁条反应速率的影响,则必须保持其他影响反应速率的因素一
致,故醋酸和盐酸的浓度应相同,故c也应为1.0 mol·L-1;②据题图可知,要通过测量在相同的时
间段内收集到的氢气体积的大小来测量反应速率,故在反应开始后,应每隔1 min记录一次生成H
2
的体积;③通过题中图像分析可知,单位时间内醋酸与镁条反应生成氢气的体积变化很小,即醋酸
与镁条的反应速率变化不大;而盐酸与镁条的反应一开始很快,一段时间后,单位时间内生成的氢
气的体积明显变小,即反应速率明显减小。
(2)①NaSO 溶液与稀HSO 反应生成二氧化硫和硫单质,其反应的离子方程式为 SO+2H+
2 2 3 2 4 2
===S↓+HO+SO ↑;②当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,通
2 2
过比较实验1、3的反应条件可知,实验 1、3可探究温度对反应速率的影响;实验 1、2中的
NaSO 溶液的加入体积不同,故是探究NaSO 溶液浓度对反应速率的影响,但反应溶液的总体积
2 2 3 2 2 3
需相同,故应加入蒸馏水来确保溶液的总体积相同,a的值为5.0;要准确描述反应速率的快慢,必
须准确测得溶液出现浑浊时间的长短,故乙是出现浑浊的时间/min(或s)。
14.答案:(1)0.02
(2)3A(g) 2C(g)+B(g) ΔH=+100a kJ·mol-1
(3)ab (4)=
解析:(1)t 时,减小压强,v 、v 以同等倍数下降,说明该反应反应前后化学计量数之和相等,
4 正 逆
由A、C浓度变化曲线知,到t 时,A、C的浓度变化量分别为Δc(A)=0.15 mol·L-1-0.06 mol·L-1
1
=0.09 mol·L-1,Δc(C)=0.11 mol·L-1-0.05 mol·L-1=0.06 mol·L-1,即A、C的化学计量数之比为
0.09∶0.06 =3∶2,故反应方程式为3A(g) 2C(g)+B(g),则B的起始浓度为0.05 mol·L-1-0.03
8
学科网(北京)股份有限公司mol·L-1=0.02 mol·L-1。
(2)因升温,v >v ,平衡正向移动,故此反应为吸热反应,其热化学方程式为3A(g)2C(g)
正 逆
+B(g) ΔH=+100a kJ·mol-1。
(3)乙图中t 时刻v 、v 以同等倍数增大,故改变的条件应是增大压强或加入催化剂。
3 正 逆
(4)在恒温恒压下充入惰性气体,各组分浓度以相同倍数减小,相当于减压,因本反应为等气体
体积反应,平衡不移动,故v =v 。
正 逆
15.答案 (1)2H O=====2HO+O↑
2 2 2 2
(2)a
(3)①下层溶液呈紫红色 ②在水溶液中I 的浓度降低 A试管中产生气泡明显变少;B试
2
管中产生气泡速率没有明显减小
(4)①2.5×10-3 ②2c(I)+c(I-)+3c(I)<0.033 mol·L-1
2
解析 (2)加入KI后,一步反应分为两步进行,也就是改变了反应的路径,a正确;加入KI后,反
应物和生成物的能量都没有改变,b不正确;由图可知,反应物的总能量小于生成物的总能量,所
以该反应是吸热反应,c不正确。
9
学科网(北京)股份有限公司10
学科网(北京)股份有限公司