文档内容
第六章 化学反应与能量(单元测试)
一、选择题(本题共16小题,每小题3分,共48分。)
1.(2020·湖南·衡东县实验中学高一期末)根据如图提供的信息,下列所得结论不正确的是( )
A.该反应为吸热反应
B.该反应一定有能量转化成了化学能
C.反应物比生成物稳定
D.因为生成物的总能量高于反应物的总能量,所以该反应不需要加热
【答案】D
【解析】
由图可知,生成物的总能量高于反应物的总能量,故一定有环境能量转化成了生成物的化学能;物质能量
越低,结构越稳定,据此回答问题。
A. 生成物能量高于反应物能量,该反应为吸热反应,A正确;
B. 该反应为吸热反应,一定有能量转化成了化学能,B正确;
C. 生成物能量高,结构不稳定,反应物比生成物稳定,C正确;
D. 加热条件与反应是否吸热无关,是反应发生的条件,D错误;
答案为D。
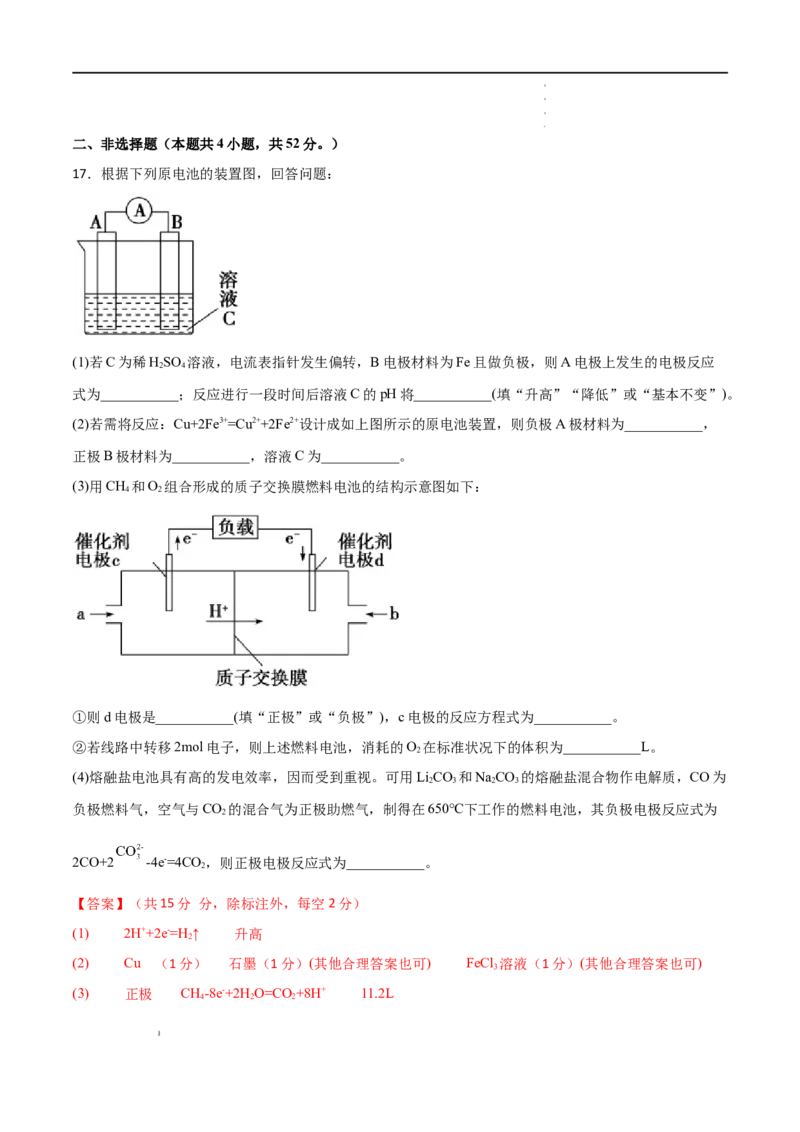
2.(2021·全国·高一期中)关于吸热反应的说法正确的是
A.凡需加热的反应一定是吸热反应
B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应
D.CO 与CaO化合是放热反应,则CaCO 分解是吸热反应
2 3
【答案】D
【解析】
A.有些放热反应如煤的燃烧也需加热才能进行,A项错误;
B.CO +C 2CO,是化合反应,但也是吸热反应,B项错误;
2
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司C.催化剂能够改变化学反应速率,与放热还是吸热反应无关,而无论放热反应还是吸热反应都可能需要用
到催化剂,C项错误;
D.反应:CO +CaO CaCO 是放热反应,则其逆反应:CaCO CaO+CO ↑一定是吸热反应,D项正确。
2 3 3 2
答案选D。
3.(2021·北京师大附中高一期中)关于下图的说法不正确的是( )
A.1 mol I (s)与1 mol H (g)化合生成2 mol HI(g)时,需要吸收5 kJ的能量
2 2
B.2 mol HI(g)分解生成1 mol I (g)与1 mol H (g)时,需要吸收12 kJ的能量
2 2
C.1 mol I (s)变为1 mol I (g)时需要吸收17 kJ的能量
2 2
D.I(g)与H(g)生成2HI(g)的反应是吸热反应
2 2
【答案】D
【解析】
A.由图可知,1 mol I (s)和1 mol H (g)吸收5 kJ热量生成2 mol HI(g),A正确;
2 2
B.由图可知,1 mol I (g)和1 mol H (g)生成2 mol HI(g)放出12 kJ热量,则2 mol HI(g)分解生成1 mol I(g)
2 2
与1 mol H (g)时需要吸收12 kJ的能量,B正确;
2
C.由图可知,1 mol I (g)变为1 mol I (s)放出17 kJ的热量,则1 mol固态碘变为1 mol碘蒸气时需要吸收
2 2
17 kJ的能量,C正确;
D.由图可知,1 mol I (g)+1 mol H (g)生成2 mol HI(g)放出12 kJ热量,应为放热反应,D错误。
2 2
答案为D。
4.(2020·甘肃省庄浪县第一中学高一期中)下列反应既是氧化还原反应,又是放热反应的是
A.Ba(OH) ·8H O与NH Cl的反应 B.灼热的炭与CO 的反应
2 2 4 2
C.铝片与稀硫酸的反应 D.红热的焦炭与水蒸气的反应
【答案】C
【解析】
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司A. 和 发生的是复分解反应不属于氧化还原反应,并且该反应吸热,不符合题意,A
项错误;
B.C与CO 在高温条件下发生氧化还原反应生成CO,该反应是吸热反应,不符合题意,B项错误;
2
C.铝片与稀硫酸发生的是置换反应,属于氧化还原反应,并且也是放热反应,符合题意,C项正确;
D.C与水蒸气在高温下发生的是氧化还原反应,生成CO和H,该反应属于吸热反应,不符合题意,D
2
项错误;
答案选C。
5.(2021·河南商丘·高一期末)金属镁和铝设计成如图所示的原电池。下列说法正确的是
A.铝作该原电池的负极 B.溶液中 向 极移动
C. 电极的电极反应式为 D.电流方向为 A
【答案】D
【解析】
根据原电池构成条件,Mg比Al活泼,因此Mg为负极,Al为正极,据此分析;
A.Mg比Al活泼,且Mg能与硫酸反应,因此Mg为负极,Al为正极,故A错误;
B.根据原电池工作原理,阴离子向负极移动,阳离子向正极移动,即 向Mg极移动,故B错误;
C.根据上述分析,Mg为负极,电极反应式为Mg-2e-=Mg2+,故C错误;
D.电流方向是正电荷定向移动方向,从正极流出,因此电流方向是Al→A→Mg,故D正确;
答案为D。
6.(2019·浙江·绍兴市教育教学研究院高一期末)利用石墨、锌片、铜片、导线、电流计、橙汁、烧杯等
用品探究原电池的组成。下列结论不正确的是
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司A.原电池是将化学能转化成电能的装置
B.原电池由电极、电解质溶液和导线等组成
C.图中电极a为石墨、电极b为锌片时,导线中会产生电流
D.图中电极a为锌片、电极b为铜片时,电子由铜片通过导线流向锌片
【答案】D
【解析】
A.原电池是把化学能转化为电能的装置,A正确;
B.原电池由电解质溶液、电极、导线组成闭合回路,B正确;
C.因为橙汁为酸性,所以图中a极为石墨、b极为锌片时,则Zn作原电池的负极,石墨作原电池的正极,
导线中会产生电流,C正确;
D.图中a极为锌片、b极为铜片时,则Zn为负极,Cu为正极,电子从负极流向正极,所以电子从Zn片
流向Cu片,D错误;
答案选D。
7.(2017·湖北·十堰市教育科学研究院高一期末)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电
解质溶液的这种电池在使用时负极反应如下:2H+4OH–-4e-=4H O,则下列说法中错误的是
2 2
A.产物为无污染的水,属于环境友好电池
B.在使用过程中,电解质溶液浓度会降低
C.正极反应为:O+2H O+4e-=4OH-
2 2
D.电池使用过程中,负极材料的活性一定比正极材料大
【答案】D
【解析】
A.氢氧燃料电池的电池总反应为2H+O ═2H O,产物是水,对环境无污染,且能量转化率高,属于环境
2 2 2
友好电池,故A正确;
B.氢氧燃料电池的电池总反应为2H+O ═2H O,产物是水,所以工作一段时间后电解质溶液的浓度会降
2 2 2
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司低;故B正确;
C.氢氧燃料电池是将化学能转变为电能的装置,工作时,通入氢气的一极为电池的负极,发生氧化反应,
通入氧气的一极为电池的正极,发生还原反应,30%KOH溶液为电解质溶液,所以O 在正极得电子发生
2
还原反应,其电极反应式为O+2H O+4e-=4OH-,故C正确;
2 2
D.氢氧燃料电池的两极材料可以选择石墨电极,即正极和负极均可选择石墨电极,所以负极材料的活性
不一定比正极材料大,故D错误;
答案为D。
8.图1是原电池示意图,图2中x轴表示实验时流入正极的电子的物质的量,y轴表示
A.溶液的质量 B. C. D.锌棒的质量
【答案】A
【解析】
A.图1发生反应Zn+CuSO = ZnSO+Cu,随转移电子的物质的量增多,溶液质量增大,故选A;
4 4
B.图1发生反应Zn+CuSO = ZnSO+Cu,随转移电子的物质的量增多,溶液中 由0逐渐增大,故
4 4
不选B;
C.图1发生反应Zn+CuSO = ZnSO+Cu,随转移电子的物质的量增多,溶液中 逐渐减小,故不选
4 4
C;
D.图1发生反应Zn+CuSO = ZnSO+Cu,随转移电子的物质的量增多,锌棒的质量减小,故不选D;
4 4
选A。
9.(2020·广东·揭阳市揭东区教育局教研室高一期末)可知某可逆反应在密闭容器中进行:A(g)+2B(g)
3C(g)+D(s) ΔH<0,图中曲线b代表一定条件下该反应的进程。若使曲线b变为曲线a,可采取的措施是
⇌
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司①增大A的浓度;②缩小容器的容积;③增大B的浓度;④升高温度;⑤加入合适的催化剂
A.⑤ B.②④ C.②⑤ D.②③
【答案】C
【解析】
①增大A的浓度,平衡正向移动,但A的转化率减小,故不选;
②缩小容器的容积,压强增大,反应速率加快,平衡不移动,故选;
③增大B的浓度,平衡正向移动,A的转化率增大,故不选;
④该反应为放热反应,升高温度,平衡逆向移动,A的转化率减小,故不选;
⑤加入合适的催化剂,反应速率加快,平衡不移动,故选。
故答案选:C。
10.(2021·云南·昆明八中高一期中)一定温度下,在恒容密闭容器中发生反应:
。当 、 、 、 的浓度不再变化时,下列说法正确的是
A. 和 全部转化为 和
B.该反应已达到化学平衡
C.正、逆反应速率相等且等于零
D. 、 、 、 的浓度一定相等
【答案】B
【解析】
A.可逆反应有限度,转化率不可能为100%,故A错误;
B.该反应是可逆反应, 、 、 、 的浓度不再变化时,说明达到平衡状态,故B正确;
C.根据B分析可知该反应达到平衡,正、逆反应速率相等但不等于零,故C错误;
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司D. 、 、 、 的浓度不再变化时,但浓度不一定相等,故D错误;
综上所述,答案为B。
11.(2019·甘肃·兰州一中)化学反应速率和化学反应的限度是化工生产研究的主要问题之一,下列对化
学反应速率和反应限度的认识正确的是
A.决定化学反应速率的主要因素是光照、超声波、压强和催化剂等
B.化学反应速率理论是研究怎样提高原料转化率的
C.可逆反应到一定程度时,会出现正、逆反应速率相等,各物质浓度相等的现象
D.化学限度(即平衡)理论,是研究怎样改变反应条件,提高产品的产率
【答案】D
【解析】
A. 决定化学反应速率的主要因素是反应物本身的性质,A错误;B. 化学反应速率是研究反应快慢的,化学
反应的限度理论是研究怎样提高原料转化率的,B错误;C. 可逆反应到一定程度时,会出现正、逆反应速
率相等的现象,但各物质浓度不一定相等,C错误;D. 化学限度(即平衡)理论,是研究怎样改变反应条
件,提高产品的产率,D正确,答案选D。
12.(2021·广西·钦州一中高一期中)某小组设计如图所示实验探究影响H O 分解速率的因素。下列分析
2 2
错误的是
A.该实验探究的是温度对反应速率的影响
B.该实验要控制MnO 的质量、颗粒大小相同
2
C.实验中,H O 的浓度越大越好
2 2
D.温度相同时,若用FeCl 代替MnO ,反应速率不相同
3 2
【答案】C
【解析】
A.两个装置中的变量是温度,所以该实验探究的是温度对反应速率的影响,A正确;
B.由于二氧化锰是催化剂,且探究的是温度对反应速率的影响,所以该实验要控制MnO 的质量、颗粒大
2
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司小相同,B正确;
C.双氧水浓度过大,反应速率过快,不易控制,所以实验中H O 的浓度不宜过大,C错误;
2 2
D.温度相同时,若用FeCl 代替MnO ,由于改变了催化剂,则反应速率不相同,D正确;
3 2
答案选C。
13.(2021·吉林·延边二中高一期中)在t℃,在4个均为 的密闭容器中分别进行合成氨反应:
。根据在相同时间内测定的结果,判断反应进行快慢的顺序为
a. b.
c. d.
A. B. C. D.
【答案】A
【解析】
将各物质代表的化学反应速率转化为氮气的化学反应速率如下:
a.v(NH )=0.05mol·L-1·min-1,则根据v(NH )=2v(N )可知,v(N )= =0.025 mol·L-1·min-1;
3 3 2 2
b.v(H )=0.03mol·L-1·min-1,则根据v(H )=3v(N )可知,v(N ) = =0.01 mol·L-1·min-1;
2 2 2 2
c.v(N )=0.02mol·L-1·min-1;
2
d.v(H )=0.001mol·L-1·min -1,则根据v(H )=3v(N )可知,v(N ) = =0.0003mol·L-1·min-1;
2 2 2 2
根据上述分析可知,反应速率大小关系为: ,故A项符合题意。
答案选A。
14.(2019·山西·祁县第二中学校高一期末)在一个不传热的固定容积的密闭容器中,发生可逆反应m A(g)
+n B(g) p C(g)+q D(g),当m、n、p、q为任意整数时,反应达到平衡的标志是
①体系的压强不再改变
②体系的温度不再改变
③各组分的物质的量浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A):v(B):v(C):v(D)=m:n:p;q
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司⑥单位时间内m mol A断键反应,同时p mol C也断键反应
A.③④⑤⑥ B.②③④⑥ C.①③④⑤ D.①③④⑥
【答案】B
【解析】
①若m+n=p+q,压强是恒量,体系的压强不再改变,反应不一定达到平衡状态,故不选①;
②化学反应一定伴随能量变化,容器内温度是变量,体系的温度不再改变,反应一定达到平衡状态,故选
②;
③反应达到平衡状态,各物质的浓度保持不变,若各组分的物质的量浓度不再改变,反应一定达到平衡状
态,故选③;
④反应达到平衡状态,各物质的浓度保持不变,各组分的质量分数不再改变,反应一定达到平衡状态,故
选④;
⑤反应速率v(A):v(B):v(C):v(D)=m:n:p:q,不能判断正逆反应速率是否相等,反应不一定达到平衡状态,故不
选⑤;
⑥单位时间内m mol A断键反应,同时p mol C也断键反应,说明正逆反应速率相等,反应一定达到平衡状
态,故选⑥;
反应达到平衡的标志是②③④⑥;
选B。
15.(2021·浙江·诸暨中学高一期中)下列由实验现象所得结论错误的是
A.向浓HNO 中插入红热的炭,产生红棕色气体,证明炭可与浓HNO 反应生成NO
3 3 2
B.向酸性KMnO 溶液中加入Fe O 粉末,紫色褪去,证明Fe O 中含Fe(Ⅱ)
4 3 4 3 4
C.向NaHSO 溶液中滴加氢硫酸,产生淡黄色沉淀,证明 具有氧化性
3
D.取5 mL0.1 mol·L-1KI溶液于试管中,加入1 mL0.1 mol·L-1FeCl 溶液,充分反应后滴入5滴15% KSCN溶液,
3
若溶液变血红色,则KI与FeCl 的反应有一定限度
3
【答案】A
【解析】
A.向浓HNO 中插入红热的炭,产生红棕色气体,该气体可能是浓硝酸与C在加热时发生氧化还原反应产
3
生,也可能是浓硝酸受热分解产生,因此不能证明炭可与浓HNO 反应生成NO ,A错误;
3 2
B.+2价的Fe2+具有还原性,可以被酸性KMnO 溶液氧化为+3价的Fe3+,酸性KMnO 溶液被还原为无色
4 4
Mn2+,从而使溶液紫色褪色。向酸性KMnO 溶液中加入Fe O 粉末,溶液的紫色褪去,可以证明Fe O 中含
4 3 4 3 4
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司Fe(Ⅱ),B正确;
C.向NaHSO 溶液中滴加氢硫酸,产生淡黄色沉淀,H S中-2价的S被氧化变为0价的S单质,从而证明
3 2
具有氧化性,C正确;
D.5 mL0.1 mol·L-1KI溶液中含有的KI的物质的量比1 mL0.1 mol·L-1FeCl 溶液中FeCl 的物质的量多,二者混
3 3
合发生反应:2KI+2FeCl =2KCl+2FeCl +I ,反应的物质的量的比是1:1,可见若上述反应是彻底完全的,反应
3 2 2
后溶液中无Fe3+。向反应后的溶液中加入KSCN溶液,溶液变血红色,说明反应后的溶液中含有Fe3+,从而
证明KI与FeCl 的反应有一定限度,D正确;
3
故合理选项是A。
16.(2021·广东·广州市第八十九中学高一期中)在密闭容器中进行如下反应:2SO (g)+O (g) 2SO (g),已
2 2 3
知反应过程中某一时刻SO 、O 、SO :的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达⇌平衡时,可
2 2 3
能存在的数据是
A.SO 为0.4mol/L B.SO 为0.3mol/L
2 2
C.SO 、SO 均为0.15mol/lL D.SO 为0.4mol/L
2 3 3
【答案】B
【解析】
假设该反应完全转化,列三段式
因为反应为可逆反应,则SO 的浓度范围为0