文档内容
内江六中 2023-2024 学年(上)高 2024 届入学考试
化学试题
考试时间:90分钟 满分:100分
可能用到的相对原子质量:H1 C12 N14 O16 Na23 Mg24 S32 Cl35.5 Zn65
第Ⅰ卷 选择题(满分42分)
一、选择题(每题只有一个正确答案,每题2分,共42分)
1.化学与生活密切相关,下列说法正确的是
A.蔡伦采用碱液蒸煮制浆法造纸,该过程不涉及化学变化
B.豆浆能产生丁达尔效应是由于胶体粒子对光线的散射
C.SO 可用于丝织品漂白是由于其能氧化丝织品中有色成分
2
D.维生素C可用作水果罐头的抗氧化剂是由于其难以被氧化
2.某化学兴趣小组同学对有关物质的分类进行讨论辨析,下列说法正确的是
A.BaSO、CHCOONH4都属于强电解质 B.SiO、NO 都属于酸性氧化物
4 3 2 2
C.NaCl溶液、牛奶都属于溶液 D.CuSO ·5H O、水玻璃都属于纯净物
4 2
3.尾虫信息素是昆虫之间传递信号的化学物质。人工合成信息素可用于诱捕害虫、测报虫情等。其中一种信
息素的结构简式如图,下列关于该化合物说法正确的是
A.该化合物与 互为同系物
B.该化合物的一氯取代物共有6种
C.该化合物在一定条件下能发生取代、加成、氧化反应
D.1mol该化合物在一定条件下与足量H 发生反应,消耗H 的物质的量为2mol
2 2
4.下列离子方程式与所给事实不相符的是
A.Cl 制备84消毒液(主要成分是NaClO):
2
B.食醋去除水垢中的CaCO :
3
C.向次氯酸钙溶液通入足量二氧化碳:
D.NaS去除废水中的Hg2+:
2
学科网(北京)股份有限公司5.下列指定溶液中一定能大量共存的离子组是
A.pH=1的溶液中: 、Na+、Fe3+、
B.含有大量 的溶液中:Na+、K+、 、
C.中性溶液中:K+、Al3+、Cl-、
D.NaS溶液中: 、K+、Cu2+、Cl-
2
6.设 为阿伏加德罗常数的值,下列说法正确的是
A.0.1mol 中含有共价键的数目为
B.25℃时,1LpH=9的CHCOONa溶液中,由水电离的OH-数目为
3
C.0.1molC2H5OH分子中含极性键数目为
D.8.4gNaHCO 和MgCO 混合物中含有阴离子数目为
3 3
7.下列实验能达到目的的是
实验目的 实验方法或操作
A 测定中和反应的反应热 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度
B 探究浓度对化学反应速率的 量取同体积不同浓度的NaClO溶液,分别加入等体积等浓度的NaSO 溶
2 3
影响 液,对比现象
C 判断反应后Ba2+是否沉淀完 将NaCO 溶液与BaCl 溶液混合,反应后静置,向上层清液中再加1滴
2 3 2
全 NaCO 溶液
2 3
D 检验淀粉是否发生了水解 向淀粉水解液中加入碘水
A.A B.B C.C D.D
8.劳动成就梦想。下列校园的劳动与所述的化学知识没有关联的是
劳动项目 化学知识
A 学校食堂阿姨用洗涤剂清洗灶台上的油污 洗涤剂促进油污的挥发
B 实验老师用稀硝酸清洗做过银镜反应的试管 硝酸具有强氧化性
C 消防演习中使用泡沫灭火器模拟灭火 铝离子和碳酸氢根离子在溶液中发生双水解
D 校医开紫外灯给教室消毒 紫外线可以使蛋白质变性
A.A B.B C.C D.D
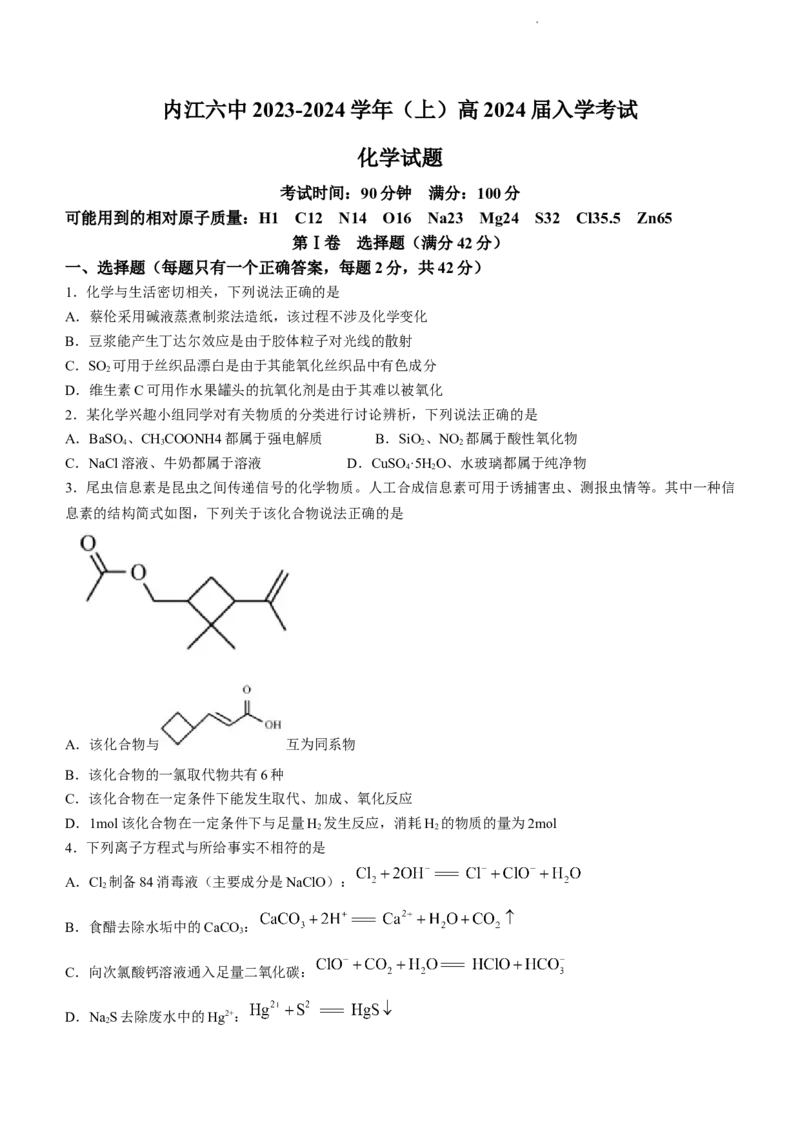
9.某实验小组利用下图装置进行实验。下列说法不正确的是
学科网(北京)股份有限公司A.滴加浓盐酸时需将分液漏斗上端玻璃塞上的凹槽对准漏斗上的小孔
B.蘸有淀粉KI溶液的棉花变蓝,说明氯气的氧化性强于碘
C.蘸有品红溶液的棉花褪色,说明氯气具有漂白性
D.蘸有紫色石蕊溶液的棉花上出现的现象是棉花先变红后褪色
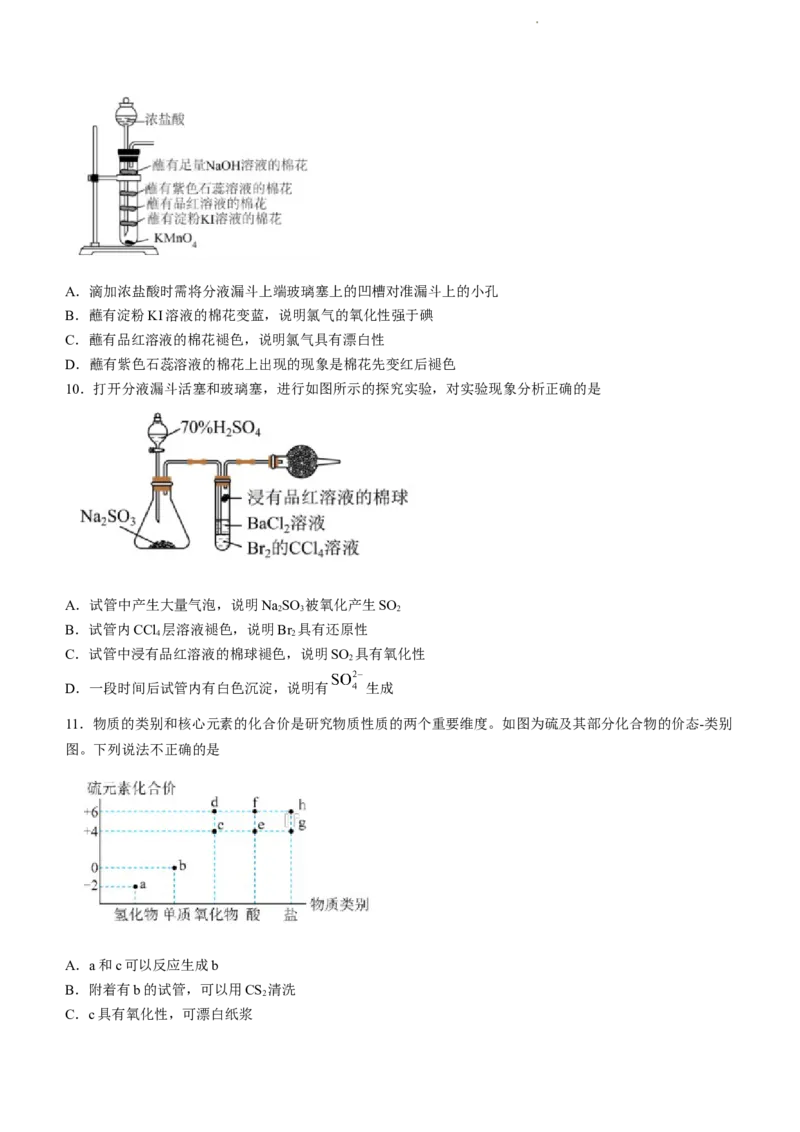
10.打开分液漏斗活塞和玻璃塞,进行如图所示的探究实验,对实验现象分析正确的是
A.试管中产生大量气泡,说明NaSO 被氧化产生SO
2 3 2
B.试管内CCl 层溶液褪色,说明Br 具有还原性
4 2
C.试管中浸有品红溶液的棉球褪色,说明SO 具有氧化性
2
D.一段时间后试管内有白色沉淀,说明有 生成
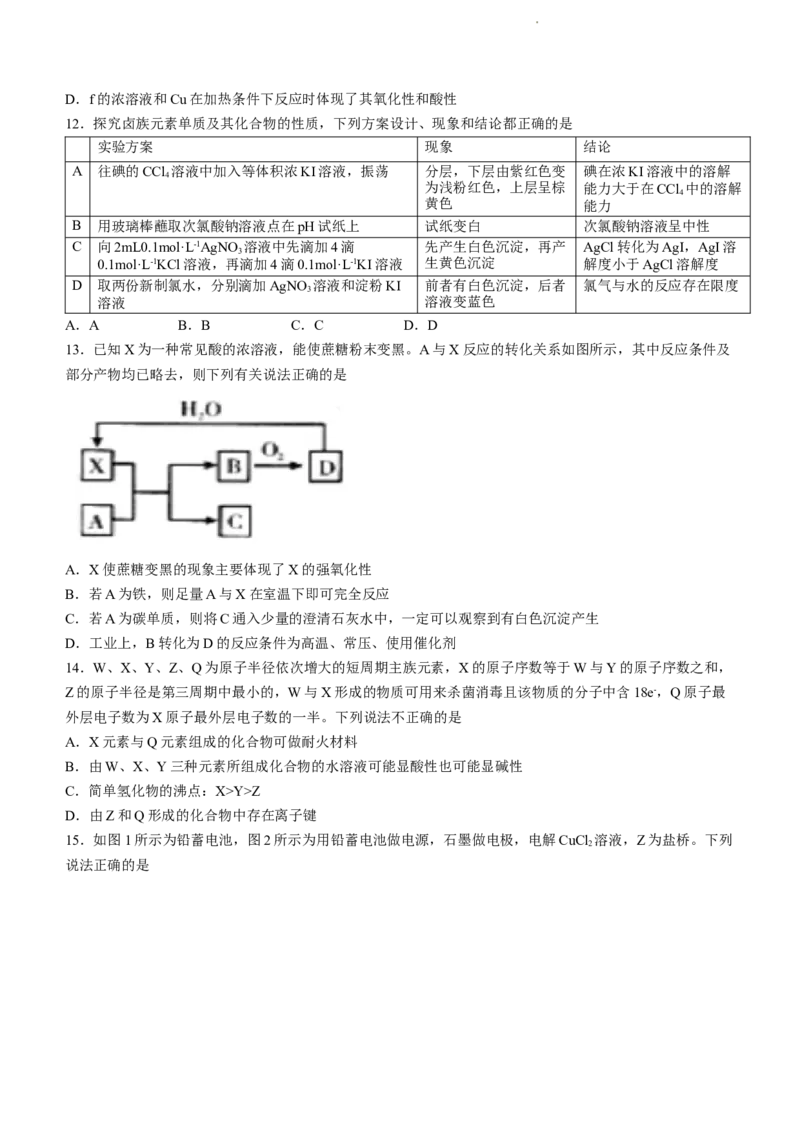
11.物质的类别和核心元素的化合价是研究物质性质的两个重要维度。如图为硫及其部分化合物的价态-类别
图。下列说法不正确的是
A.a和c可以反应生成b
B.附着有b的试管,可以用CS 清洗
2
C.c具有氧化性,可漂白纸浆
学科网(北京)股份有限公司D.f的浓溶液和Cu在加热条件下反应时体现了其氧化性和酸性
12.探究卤族元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是
实验方案 现象 结论
A 往碘的CCl 溶液中加入等体积浓KI溶液,振荡 分层,下层由紫红色变 碘在浓KI溶液中的溶解
4
为浅粉红色,上层呈棕 能力大于在CCl 中的溶解
4
黄色 能力
B 用玻璃棒蘸取次氯酸钠溶液点在pH试纸上 试纸变白 次氯酸钠溶液呈中性
C 向2mL0.1mol·L-1AgNO 溶液中先滴加4滴 先产生白色沉淀,再产 AgCl转化为AgI,AgI溶
3
0.1mol·L-1KCl溶液,再滴加4滴0.1mol·L-1KI溶液 生黄色沉淀 解度小于AgCl溶解度
D 取两份新制氯水,分别滴加AgNO 溶液和淀粉KI 前者有白色沉淀,后者 氯气与水的反应存在限度
3
溶液 溶液变蓝色
A.A B.B C.C D.D
13.已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及
部分产物均已略去,则下列有关说法正确的是
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到有白色沉淀产生
D.工业上,B转化为D的反应条件为高温、常压、使用催化剂
14.W、X、Y、Z、Q为原子半径依次增大的短周期主族元素,X的原子序数等于W与Y的原子序数之和,
Z的原子半径是第三周期中最小的,W与X形成的物质可用来杀菌消毒且该物质的分子中含18e-,Q原子最
外层电子数为X原子最外层电子数的一半。下列说法不正确的是
A.X元素与Q元素组成的化合物可做耐火材料
B.由W、X、Y三种元素所组成化合物的水溶液可能显酸性也可能显碱性
C.简单氢化物的沸点:X>Y>Z
D.由Z和Q形成的化合物中存在离子键
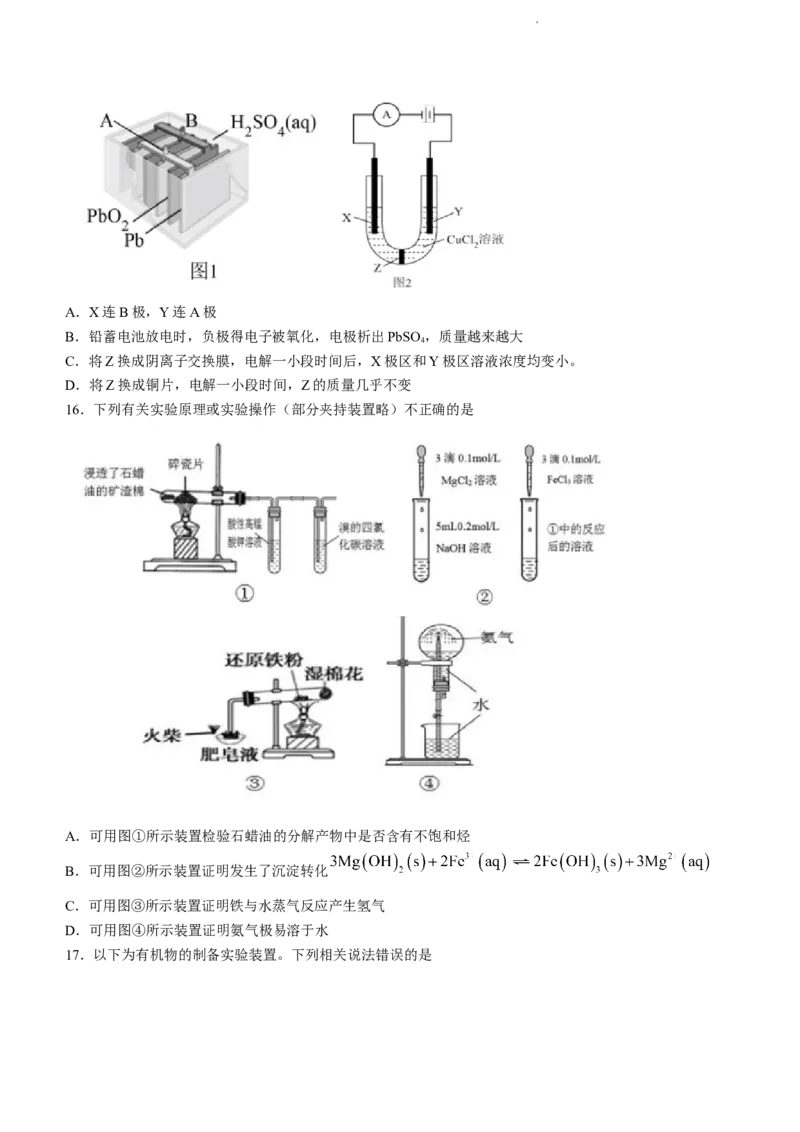
15.如图1所示为铅蓄电池,图2所示为用铅蓄电池做电源,石墨做电极,电解CuCl 溶液,Z为盐桥。下列
2
说法正确的是
学科网(北京)股份有限公司A.X连B极,Y连A极
B.铅蓄电池放电时,负极得电子被氧化,电极析出PbSO ,质量越来越大
4
C.将Z换成阴离子交换膜,电解一小段时间后,X极区和Y极区溶液浓度均变小。
D.将Z换成铜片,电解一小段时间,Z的质量几乎不变
16.下列有关实验原理或实验操作(部分夹持装置略)不正确的是
A.可用图①所示装置检验石蜡油的分解产物中是否含有不饱和烃
B.可用图②所示装置证明发生了沉淀转化
C.可用图③所示装置证明铁与水蒸气反应产生氢气
D.可用图④所示装置证明氨气极易溶于水
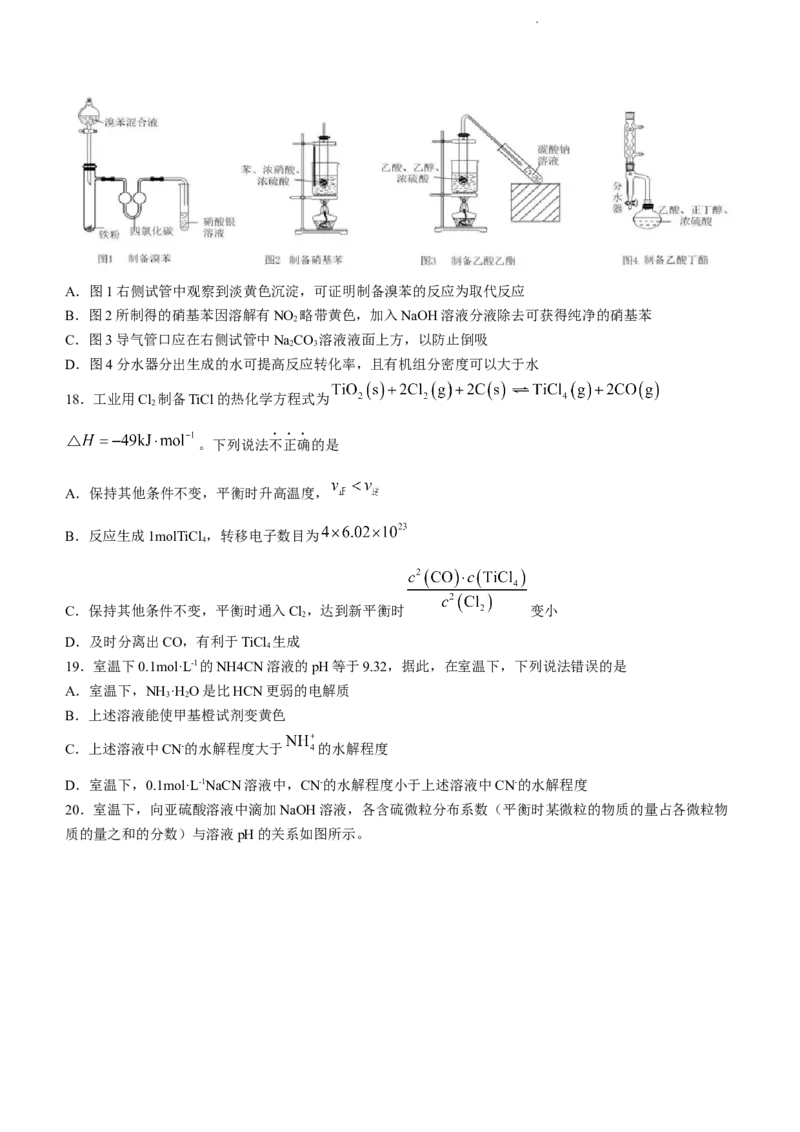
17.以下为有机物的制备实验装置。下列相关说法错误的是
学科网(北京)股份有限公司A.图1右侧试管中观察到淡黄色沉淀,可证明制备溴苯的反应为取代反应
B.图2所制得的硝基苯因溶解有NO 略带黄色,加入NaOH溶液分液除去可获得纯净的硝基苯
2
C.图3导气管口应在右侧试管中NaCO 溶液液面上方,以防止倒吸
2 3
D.图4分水器分出生成的水可提高反应转化率,且有机组分密度可以大于水
18.工业用Cl 制备TiCl的热化学方程式为
2
。下列说法不正确的是
A.保持其他条件不变,平衡时升高温度,
B.反应生成1molTiCl ,转移电子数目为
4
C.保持其他条件不变,平衡时通入Cl,达到新平衡时 变小
2
D.及时分离出CO,有利于TiCl 生成
4
19.室温下0.1mol·L-1的NH4CN溶液的pH等于9.32,据此,在室温下,下列说法错误的是
A.室温下,NH ·H O是比HCN更弱的电解质
3 2
B.上述溶液能使甲基橙试剂变黄色
C.上述溶液中CN-的水解程度大于 的水解程度
D.室温下,0.1mol·L-1NaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度
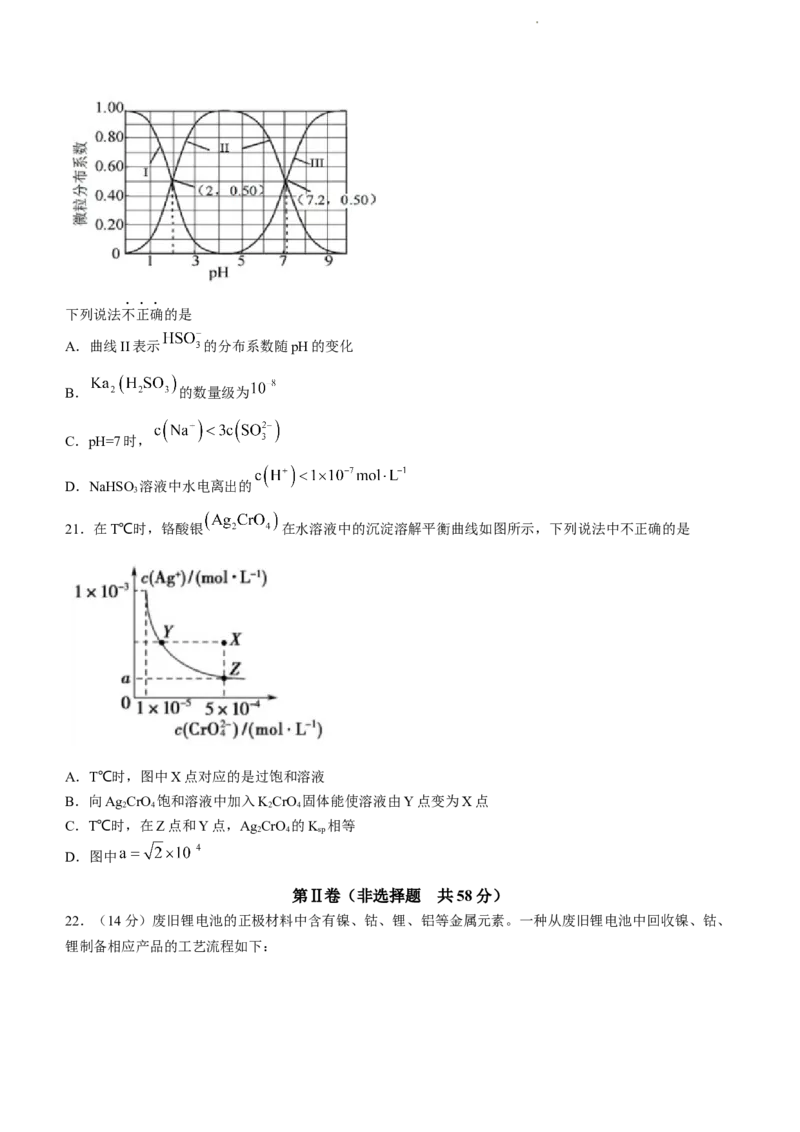
20.室温下,向亚硫酸溶液中滴加NaOH溶液,各含硫微粒分布系数(平衡时某微粒的物质的量占各微粒物
质的量之和的分数)与溶液pH的关系如图所示。
学科网(北京)股份有限公司下列说法不正确的是
A.曲线II表示 的分布系数随pH的变化
B. 的数量级为
C.pH=7时,
D.NaHSO 溶液中水电离出的
3
21.在T℃时,铬酸银 在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是
A.T℃时,图中X点对应的是过饱和溶液
B.向Ag CrO 饱和溶液中加入KCrO 固体能使溶液由Y点变为X点
2 4 2 4
C.T℃时,在Z点和Y点,Ag CrO 的K 相等
2 4 sp
D.图中
第Ⅱ卷(非选择题 共58分)
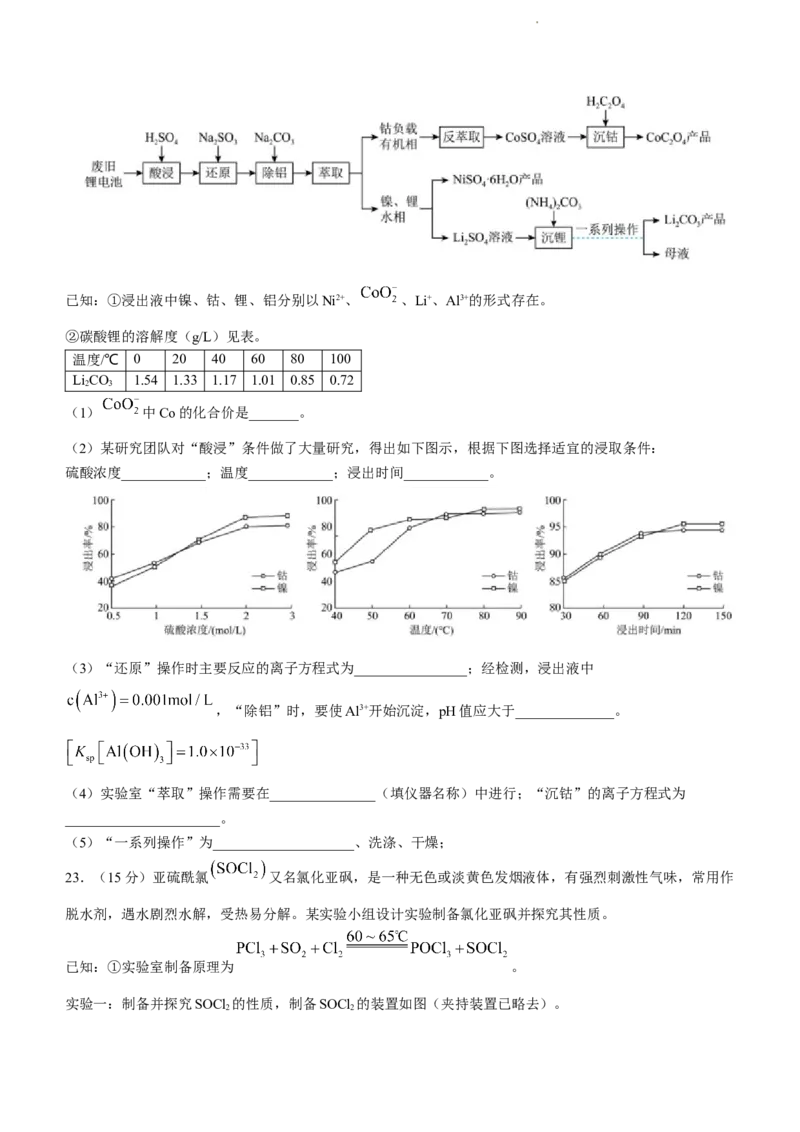
22.(14分)废旧锂电池的正极材料中含有镍、钴、锂、铝等金属元素。一种从废旧锂电池中回收镍、钴、
锂制备相应产品的工艺流程如下:
学科网(北京)股份有限公司已知:①浸出液中镍、钴、锂、铝分别以Ni2+、 、Li+、Al3+的形式存在。
②碳酸锂的溶解度(g/L)见表。
温度/℃ 0 20 40 60 80 100
LiCO 1.54 1.33 1.17 1.01 0.85 0.72
2 3
(1) 中Co的化合价是_______。
(2)某研究团队对“酸浸”条件做了大量研究,得出如下图示,根据下图选择适宜的浸取条件:
硫酸浓度____________;温度____________;浸出时间____________。
(3)“还原”操作时主要反应的离子方程式为________________;经检测,浸出液中
,“除铝”时,要使Al3+开始沉淀,pH值应大于______________。
(4)实验室“萃取”操作需要在_______________(填仪器名称)中进行;“沉钴”的离子方程式为
______________________。
(5)“一系列操作”为____________________、洗涤、干燥;
23.(15分)亚硫酰氯 又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,常用作
脱水剂,遇水剧烈水解,受热易分解。某实验小组设计实验制备氯化亚砜并探究其性质。
已知:①实验室制备原理为 。
实验一:制备并探究SOCl 的性质,制备SOCl 的装置如图(夹持装置已略去)。
2 2
学科网(北京)股份有限公司(1)a仪器的名称为__________,b装置的作用是__________________。
(2)SO 可通过NaSO 固体与70%浓HSO 反应制取,Cl 可通过KMnO 固体与浓盐酸反应制取,则上图中
2 2 3 2 4 2 4
制取Cl 的装置为__________(填字母)。
2
(3)将上述装置制得的SOCl 通过蒸馏方法提取出来(加热及夹持装置略),装置安装顺序为
2
①⑨⑧________________(填序号)。
(4)甲同学认为SOCl 可用作热分解FeCl ·6H O制取无水FeCl的脱水剂,反应的化学方程式为
2 3 2
_______________________;但乙同学认为该实验可能发生副反应使产品不纯,所以乙同学取少量FeCl ·6H O
3 2
在不断通入SOCl 蒸气的条件下加热,充分反应后通入N,加水溶解,取溶解后的溶液少许,加入
2 2
________________________(填写试剂和实验现象),说明发生了副反应。
实验二:测定某SOCl 样品中SOCl 的纯度。
2 2
①准确称量称量瓶和盖的总质量mg,迅速加入0.6mLSOCl 样品,立即盖紧,称量,质量为mg。
1 2 2
②将0.6mLSOCl 样品溶于300mLNaOH溶液中,发生反应: ,
2
将反应后的溶液稀释到500mL。
③量取100ml上面溶液于碘量瓶中,加入两滴指示剂,用适量稀盐酸中和过量的NaOH溶液至恰好完全。
④准确加入50.00mL0.0500mol·L-1碘标准溶液,充分反应后,用淀粉溶液作指示剂,用0.1000mol·L-1的
NaSO 溶液滴定过量的碘,反应为 。平行测定两次,反应消耗
2 2 3
NaSO 溶液的平均体积为VmL。
2 2 3
(5)判断滴定终点的方法为______________,样品中SOCl 的质量分数为_____________;下列情况会导致
2
测定的SOCl 的质量分数偏高的是__________(填标号)。
2
A.实际碘标准溶液浓度偏低
B.实际NaSO 溶液浓度偏低
2 2 3
C.将0.6mlSOCl 样品溶解于300mlNaOH溶液中时,气体吸收不充分,有部分气体逸出
2
24.(14分)我国的能源以煤炭为主,燃煤烟气中CO,SO 等有害气体的排放会污染环境,用CO还原脱除
2
SO 将其转化为单质硫,对工业生产具有重要的意义。
2
(1)已知常温常压下,S(g)的燃烧热为297.2kJ/mol,CO(g)的燃烧热为283.0kJ/mol,则CO还原脱除
SO : __________。
2
(2)在某温度时,进行CO还原脱除SO : 。
2
学科网(北京)股份有限公司①若在刚性容器中进行,下列说法一定能确定反应达到平衡状态的是__________。
A. B.CO与SO 的浓度之比不再改变
2
C.容器内的压强不再改变 D. 的值不再改变
②若控制CO/SO 进料比(物质的量)为4∶1,反应达平衡时,混合气体中SO 的体积分数为5%,则该反应
2 2
在此温度下的平衡常数为__________。
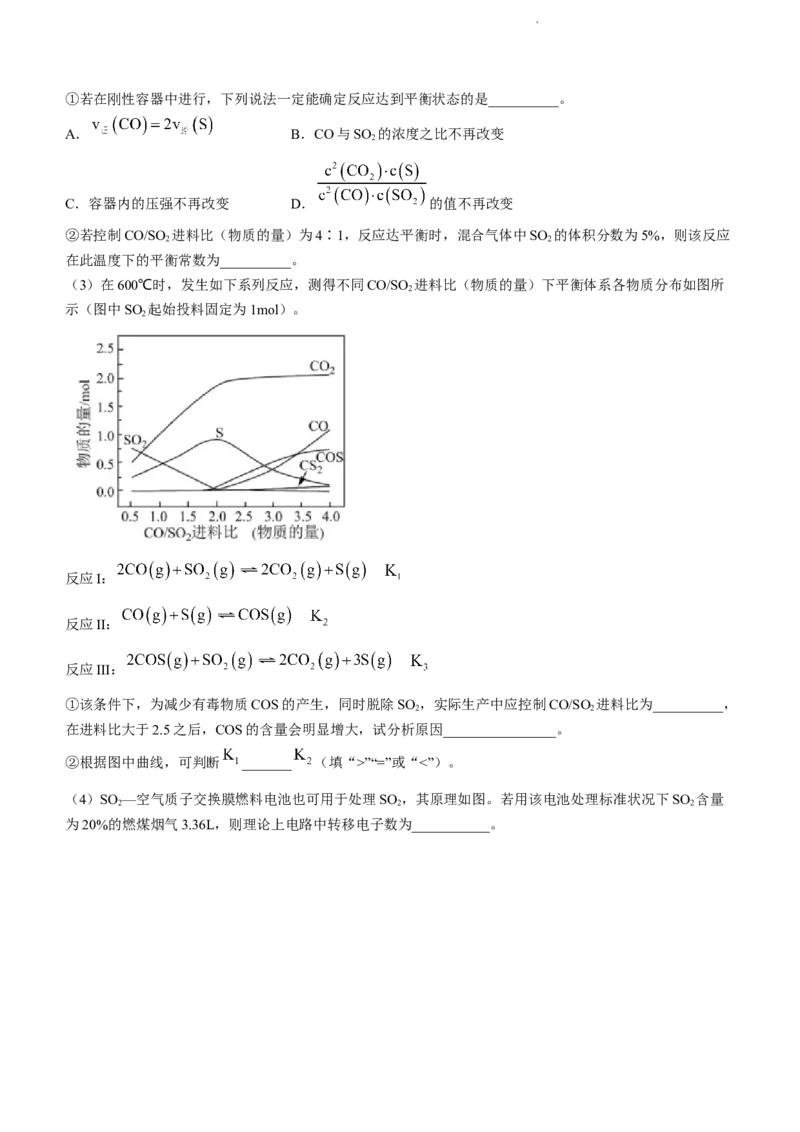
(3)在600℃时,发生如下系列反应,测得不同CO/SO 进料比(物质的量)下平衡体系各物质分布如图所
2
示(图中SO 起始投料固定为1mol)。
2
反应I:
反应II:
反应III:
①该条件下,为减少有毒物质COS的产生,同时脱除SO ,实际生产中应控制CO/SO 进料比为__________,
2 2
在进料比大于2.5之后,COS的含量会明显增大,试分析原因________________。
②根据图中曲线,可判断 _______ (填“>”“=”或“<”)。
(4)SO —空气质子交换膜燃料电池也可用于处理SO ,其原理如图。若用该电池处理标准状况下SO 含量
2 2 2
为20%的燃煤烟气3.36L,则理论上电路中转移电子数为___________。
学科网(北京)股份有限公司25.(15分)第四周期的元素,如:钛( Ti)、铁( Fe)、砷、硒、锌等及其相关化合物在化工、医药、
22 26
材料等领域有着广泛的应用。回答下列问题:
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为___________,与Ti同周期的所有过渡元素的基态原
子中,最外层电子数与钛不同的元素有___________种。
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸
收,避免生成Fe3+,从结构角度来看Fe2+易被氧化成Fe3+的原因是___________。
(3)SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H—S—C≡N)和异硫氰酸(
)。
①写出与SCN-互为等电子体的一种微粒___________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为___________;
③异硫氰酸的沸点比硫氰酸沸点高的原因是___________。
(4)硒化锌的晶胞结构如图所示,图中x和y点所堆积的原子均为___________(填元素符号);若该晶胞
密度为ρg·cm-3,硒化锌的摩尔质量为Mg·mol-1,用NA代表阿伏加德罗常数的值,则晶胞参数a为
___________nm。
内江六中 2023-2024 学年(上)高 2024 届入学考试
化学试题答案
一、选择题
1-5BACBA 6-10DCACD 11-15 CADDD 16-21BBCACB
学科网(北京)股份有限公司22.(14分,除标记外每空2分)
(1)+3(1分)
(2)2.0mol/L、70℃、120min(各1分)
(3) 4
(4)分液漏斗
(5)蒸发结晶、趁热过滤(各1分)
23.(15分,除标记外,每空2分)
(1)(球形)冷凝管(1分)
吸收未反应的Cl、SO 和SOCl 蒸气,防止空气中的水蒸气进入三颈瓶
2 2 2
(2)A(1分)
(3)⑥⑩③⑤
(4)
溶液,产生蓝色沉淀或BaCl 溶液,产生白色沉淀
2
(5)当滴入最后半滴NaSO 溶液时,溶液蓝色褪去,且半分钟内不再发生变化(合理即给分)
2 2 3
A(1分)
24.(14分,每空2分)
(1)-268.8kJ/mol(不带单位扣1分)
(2)①AD ②1.08
(3)①2.0 CO的含量较多,此时反应II的反应程度比反应III的程度大的多(合理即可给分)
②>
(4)0.06NA
25.(15分,除标记外每空2分)
(1)球形(1分) 2
(2)Fe3+价电子排布为3d5,半满状态,构型更稳定
(3)①NO(或CO、CS、OCN-) ②2:3 ③异硫氰酸可以形成分子间氢键
2 2 2
(3)Zn
学科网(北京)股份有限公司