文档内容
泸县普通高中共同体 2024 年秋期高二期中联合考试
化学试题
化学试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,考试时间75分钟,满分100
分。
注意事项:
1.答题前,考生务必将自己的姓名、班级、考号填写在答题卷上相应位置。
2.选择题答案使用2B铅笔填涂在答题卷对应题目号的位置上,填涂在试卷上无效。
3.非选择题答案请使用黑色签字笔填写在答题卷对应题目号的位置上,填写在试卷上无效。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32
第Ⅰ卷选择题(共42分)
一、选择题(本题共14小题,每个小题只有一个选项符合题意,每小题3分,共42分)
1.氢能是一种理想的绿色能源。下列有关说法正确的是
A.地热能、风能、天然气和氢能都属于新能源
B.氢氧燃料电池应用前景广泛,该电池工作时,负极上的 发生还原反应
C.氯碱工业可产生用于金属冶炼、合成甲醇等的 ,该气体在电解池的阴极产生
D.工业合成氨中,适当增加 的浓度来提高原料的转化率,从而降低成本
2.下列关于热化学方程式的叙述正确的是
A. ; ,则
B.在稀溶液中: ,若将 的稀
与 的 溶液等体积混合,放出的热量等于
C.已知 ,则金刚石比石墨稳定
D.已知 ,则 燃烧热为
3.电化学原理在日常生活中应用广泛,下列说法正确的是
A.在电解中与电源正极相连的是阴极
B.电解 溶液可以得到金属
C.任何的氧化还原反应都可以设计成原电池
D.一般来说,带有“盐桥”的原电池比不带“盐桥”的原电池效率高
4. 表示阿伏加德罗常数的值。下列说法正确的是A.常温常压下, 气体中含有的 分子数为
B.足量 与 反应,转移的电子数为
C. 与足量 反应,生成的 分子数为
D.标准状况下, 含有的氧原子数目为
5.平衡常数 能表明化学反应的限度,下列说法正确的是
A. 越大,反应的速率越快,反应进行得越彻底
B.升高温度, 增大
C.当浓度商 大于 时,平衡向逆反应方向移动
D.在一定温度下,反应 达到平衡时,该反应的
6.已知 ,若反应速率分别用 、 、 、
表示,则正确的关系是
A. B.
C. D.
7.关于“活化分子”,下列说法正确的是
A.升高温度可降低反应所需活化能,提高活化分子百分数,反应速率加快
B.增大反应物浓度,使单位体积内活化分子数增加,反应速率加快
C.恒容下,对于有气体参加的反应,加入惰性气体使体系压强增大,活化分子数增加,反应速率加快
D.活化分子的碰撞一定是有效碰撞
8.在密闭容器中,一定量混合气体发生反应: ,平衡时测得 的浓度为
,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得 的浓度为
。下列有关判断正确的是
A. B. 的体积分数下降
C. 的转化率降低 D.平衡向正反应方向移动9. 还原脱除 将其转化为单质硫,对工业生产具有重要的意义。在某温度时,容器中进行如下反
应: 。下列说法正确的是
A.在恒定压强下上述反应达到平衡时,通入 ,该反应的速率及平衡均不发生改变
B.当容器内的压强不再改变时该反应已停止
C.降低温度有利于 的生成
D.当混合气体的平均摩尔质量不再改变时,反应达到平衡
10.生产水煤气的反应 的能量变化如下图,下列说法正确的是
A.该反应过程中既有能量的吸收又有能量的释放
B.
C.容器内充入 、 后充分反应,放出 的热量
D.加入催化剂可以减小(b-a)的值,从而提高反应速率
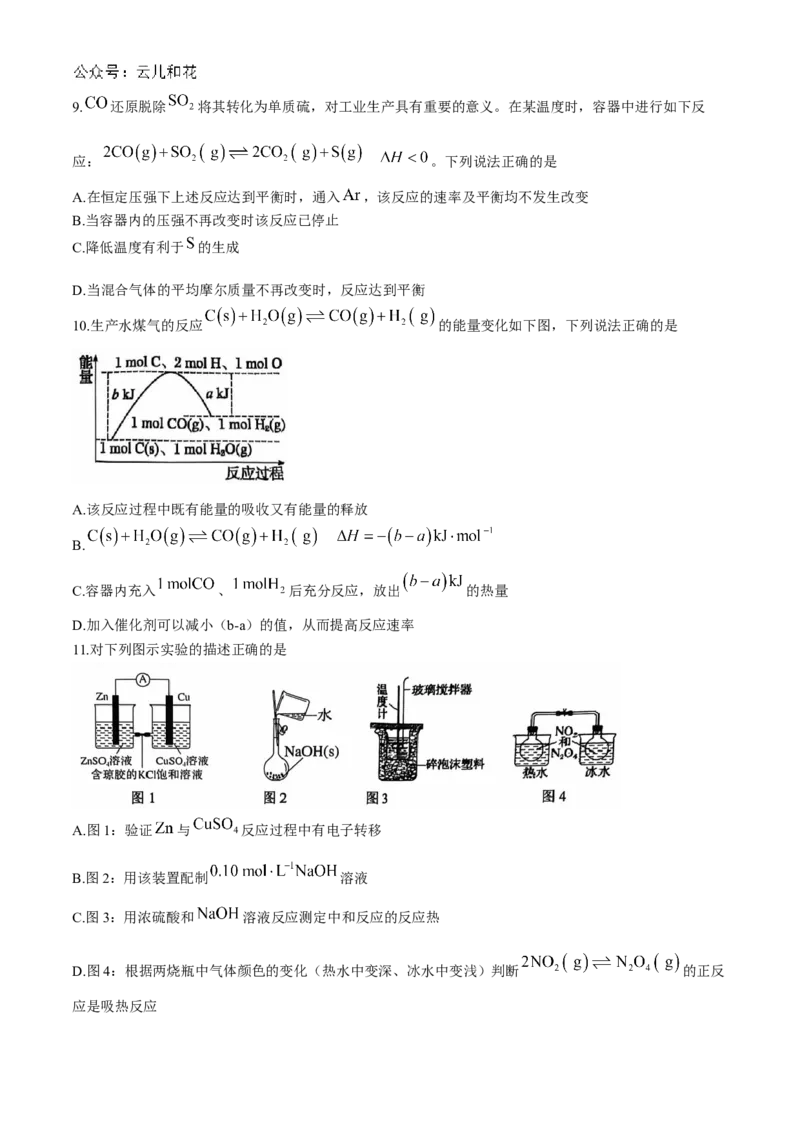
11.对下列图示实验的描述正确的是
A.图1:验证 与 反应过程中有电子转移
B.图2:用该装置配制 溶液
C.图3:用浓硫酸和 溶液反应测定中和反应的反应热
D.图4:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断 的正反
应是吸热反应12. 、 、 、 是原子序数依次增大的四种短周期元素,其中 、 同主族, 原子的最外层电子
数是次外层的3倍, 的最高价氧化物对应水化物的碱性在短周期中最强, 单质是将太阳能转变为电能
的常用材料。下列说法正确的是
A.原子半径:
B. 与 形成的化合物中只含离子键
C.简单氢化物的沸点:
D. 能与碱反应,但不能与任何酸反应
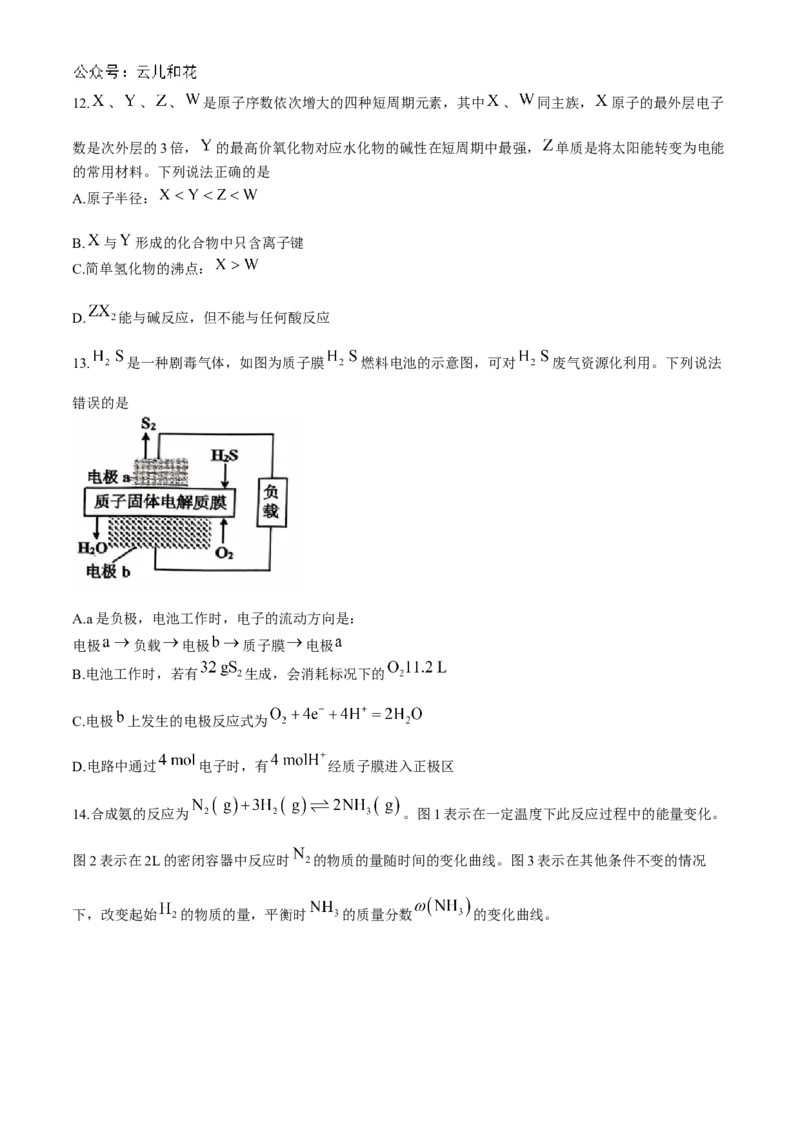
13. 是一种剧毒气体,如图为质子膜 燃料电池的示意图,可对 废气资源化利用。下列说法
错误的是
A.a是负极,电池工作时,电子的流动方向是:
电极 负载 电极 质子膜 电极
B.电池工作时,若有 生成,会消耗标况下的
C.电极 上发生的电极反应式为
D.电路中通过 电子时,有 经质子膜进入正极区
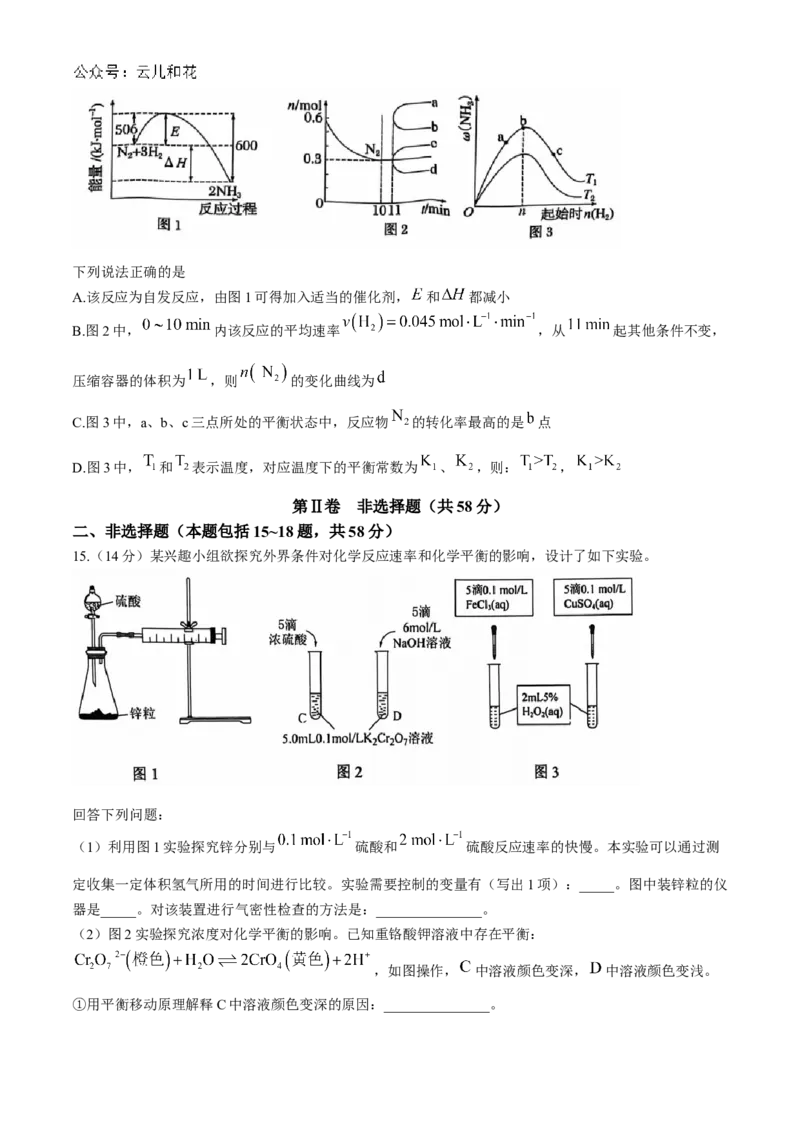
14.合成氨的反应为 。图1表示在一定温度下此反应过程中的能量变化。
图2表示在2L的密闭容器中反应时 的物质的量随时间的变化曲线。图3表示在其他条件不变的情况
下,改变起始 的物质的量,平衡时 的质量分数 的变化曲线。下列说法正确的是
A.该反应为自发反应,由图1可得加入适当的催化剂, 和 都减小
B.图2中, 内该反应的平均速率 ,从 起其他条件不变,
压缩容器的体积为 ,则 的变化曲线为
C.图3中,a、b、c三点所处的平衡状态中,反应物 的转化率最高的是 点
D.图3中, 和 表示温度,对应温度下的平衡常数为 、 ,则: ,
第Ⅱ卷 非选择题(共58分)
二、非选择题(本题包括15~18题,共58分)
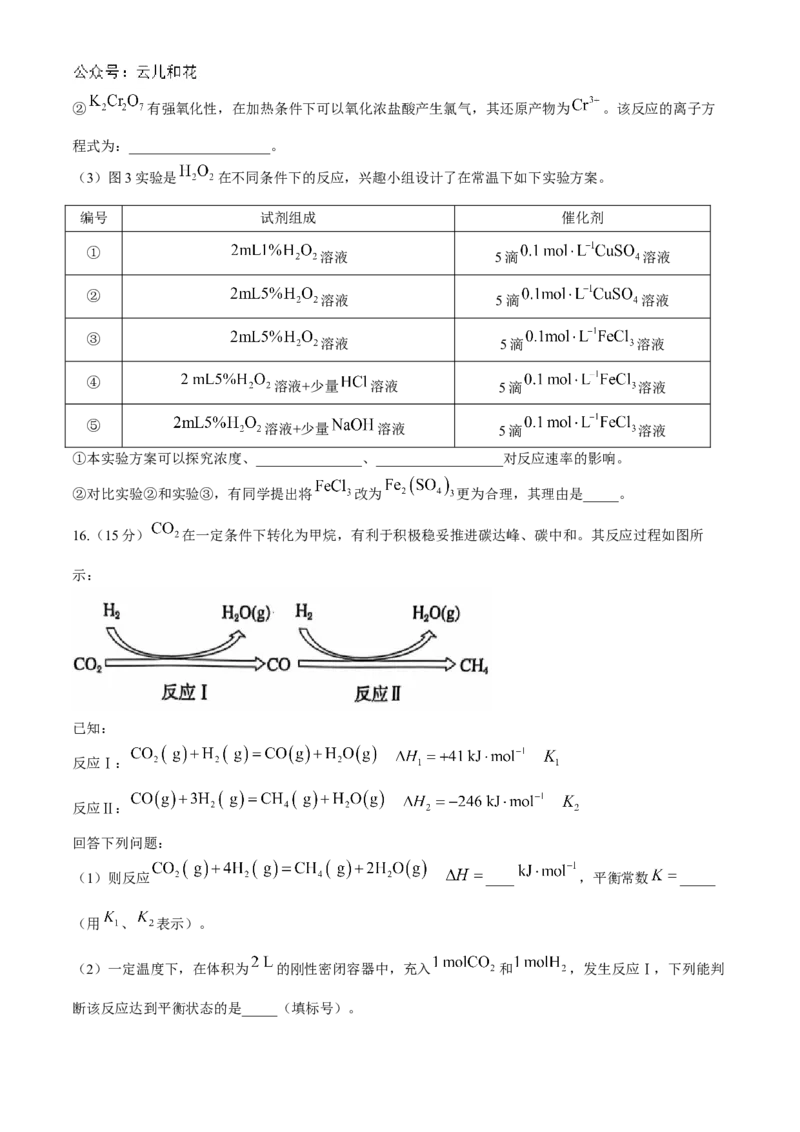
15.(14分)某兴趣小组欲探究外界条件对化学反应速率和化学平衡的影响,设计了如下实验。
回答下列问题:
(1)利用图1实验探究锌分别与 硫酸和 硫酸反应速率的快慢。本实验可以通过测
定收集一定体积氢气所用的时间进行比较。实验需要控制的变量有(写出1项):_____。图中装锌粒的仪
器是_____。对该装置进行气密性检查的方法是:_______________。
(2)图2实验探究浓度对化学平衡的影响。已知重铬酸钾溶液中存在平衡:
,如图操作, 中溶液颜色变深, 中溶液颜色变浅。
①用平衡移动原理解释C中溶液颜色变深的原因:_______________。② 有强氧化性,在加热条件下可以氧化浓盐酸产生氯气,其还原产物为 。该反应的离子方
程式为:____________________。
(3)图3实验是 在不同条件下的反应,兴趣小组设计了在常温下如下实验方案。
编号 试剂组成 催化剂
①
溶液 5滴 溶液
②
溶液 5滴 溶液
③
溶液 5滴 溶液
④ 溶液+少量 溶液 5滴 溶液
⑤ 溶液+少量 溶液 5滴 溶液
①本实验方案可以探究浓度、_______________、__________________对反应速率的影响。
②对比实验②和实验③,有同学提出将 改为 更为合理,其理由是_____。
16.(15分) 在一定条件下转化为甲烷,有利于积极稳妥推进碳达峰、碳中和。其反应过程如图所
示:
已知:
反应Ⅰ:
反应Ⅱ:
回答下列问题:
(1)则反应 ____ ,平衡常数 _____
(用 、 表示)。
(2)一定温度下,在体积为 的刚性密闭容器中,充入 和 ,发生反应Ⅰ,下列能判
断该反应达到平衡状态的是_____(填标号)。a. b.容器内压强不变
c. 不变 d. 和 的质量和不变
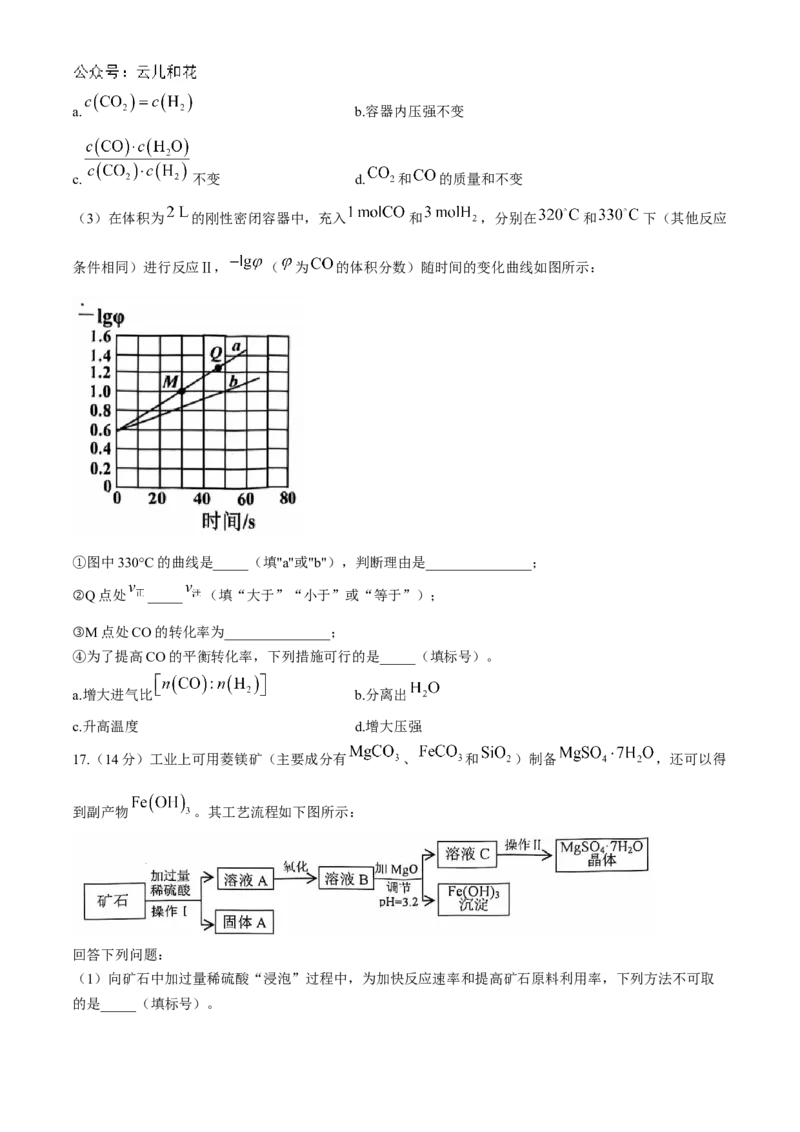
(3)在体积为 的刚性密闭容器中,充入 和 ,分别在 和 下(其他反应
条件相同)进行反应Ⅱ, ( 为 的体积分数)随时间的变化曲线如图所示:
①图中330°C的曲线是_____(填"a"或"b"),判断理由是_______________;
②Q点处 _____ (填“大于”“小于”或“等于”);
③M点处CO的转化率为_______________;
④为了提高CO的平衡转化率,下列措施可行的是_____(填标号)。
a.增大进气比 b.分离出
c.升高温度 d.增大压强
17.(14分)工业上可用菱镁矿(主要成分有 、 和 )制备 ,还可以得
到副产物 。其工艺流程如下图所示:
回答下列问题:
(1)向矿石中加过量稀硫酸“浸泡”过程中,为加快反应速率和提高矿石原料利用率,下列方法不可取
的是_____(填标号)。A.将矿石粉碎 B.适当升高温度 C.适当增大溶液的 D.搅拌
(2)固体A的成分是_____(填化学式)。
(3)由溶液A转化为溶液B适合的氧化剂是_____(填标号),该步反应的离子方程式是_____。
a. b. c. d.
(4)由溶液C通过操作Ⅱ得到 晶体,操作Ⅱ依次是_____、_____、过滤,洗涤、干燥。
(5)镍镁可充电电池使用 为电解质溶液,工作时电池反应为:
,电池放电时 在_____极(填“正”或
“负”)参加反应,写出充电时阳极的电极反应式_______________________。
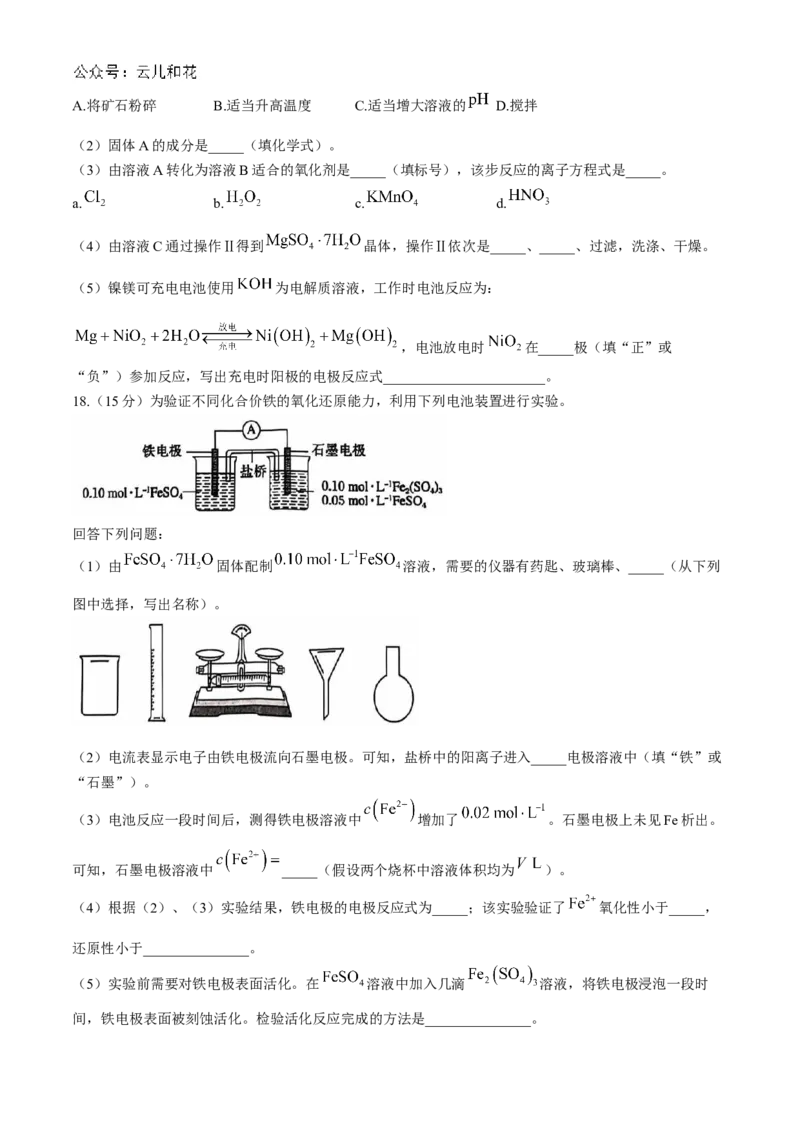
18.(15分)为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:
(1)由 固体配制 溶液,需要的仪器有药匙、玻璃棒、_____(从下列
图中选择,写出名称)。
(2)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入_____电极溶液中(填“铁”或
“石墨”)。
(3)电池反应一段时间后,测得铁电极溶液中 增加了 。石墨电极上未见Fe析出。
可知,石墨电极溶液中 _____(假设两个烧杯中溶液体积均为 )。
(4)根据(2)、(3)实验结果,铁电极的电极反应式为_____;该实验验证了 氧化性小于_____,
还原性小于_______________。
(5)实验前需要对铁电极表面活化。在 溶液中加入几滴 溶液,将铁电极浸泡一段时
间,铁电极表面被刻蚀活化。检验活化反应完成的方法是_______________。泸县普通高中共同体 2024 年秋期高二期中联合考试
化学试题参考答案
1-5 CBDBC 6-10 DBDCA 11-14 ACAB
15.(14分)
(1)温度或锌粒大小(2分)锥形瓶(2分)关闭分液漏斗的活塞,轻轻向外拉动或向里推动注射器的活
塞,一段时间后,若活塞能回到原来的位置,证明装置不漏气。(2分)
(2)①加入 溶液, 增大,平衡逆向移动, 浓度增大,溶液颜色加深(2分)
② (2分)
(3)①催化剂、溶液的酸碱性(每空1分,共2分)
②控制变量,排除干扰离子的影响(2分)
16.(15分)
(1)-205(2分)
(2)cd(2分)(答对一个给1分,有错不给分;大写不扣分)
(3)①a(1分)(大写不扣分)
温度升高,反应速率加快, 减小更快, 增大更多(2分)
②大于(2分)(写为“>”不扣分)
③75%(2分)(答0.75给2分)
④bd(2分)(答对一个给1分,有错不给分;大写不扣分)
17.(14分)
(1) (2分)
(2) (2分)
(3)b(2分) (2分)
(4)蒸发浓缩(1分) 冷却结晶(1分)
(5)正(2分) (2分)
18.(15分)(1)烧杯、量筒、托盘天平(3分)
(2)石墨(2分)(3) (2分)
(4) (2分) (2分) (2分)
(5)取活化后溶液少许于试管中,加入KSCN溶液,若溶液不出现血红色,说明活化反应完成(2分)