文档内容
广东省实验中学 2024 届高三级第一次阶段考试
化 学
本试卷分选择题和非选择题两部分,共8页,满分100分,考试用时75分钟。
相对原子质量H-1 O-16 S-32 Fe-56 Cu-64
一、单选题(本大题共16小题,1-10题每题2分,11-16题每题4分,共44分)
1.下列叙述错误的是( )
A.硅在自然界中主要以单质形式存在 B.硅是应用最为广泛的半导体材料
C.高纯度的硅可用于制造计算机芯片 D.二氧化硅可用于生产玻璃
2.水溶液中能大量共存的一组离子是( )
NH+ CO2- SO2-
A. 4 、Ba2+、Br-、 3 B.Cl-、 3 、Fe2+、H+
SO2- MnO− NO− HCO−
C.K+、Na+、 4 、 4 D.Na+、H+, 3 、 3
3.化学创造美好生活。下列选项中生产活动和化学原理没有关联的是( )
选项 生产活动 化学原理
A 葡萄酒中添加少量SO SO 可杀菌且防止营养物质被氧化
2 2
B 用聚乙烯塑料制作食品保鲜膜 聚乙烯燃烧生成CO 和HO
2 2
C 利用氧化银冶炼金属Ag 氧化银在一定条件下发生分解反应
D 用地沟油为原料制作肥皂 地沟油发生皂化反应
4.1827年,英国科学家法拉第进行了NH 喷泉实验。在此启发下,兴趣小组利用以下装
3
置,
进行如下实验。其中,难以达到预期目的的是( )
5.2023年3月, “三星堆”遗址考古又发掘出大量青铜器。火法炼铜主要发生的反应
Cu S
2
1
学科网(北京)股份有限公司+O 2Cu+SO,下列说法正确的是( )
2 2
A.Cu S中铜的化合价为+2 B.该反应为复分解反应
2
C.SO 是酸性氧化物 D.反应中氧化剂仅为O
2 2
6.下列说法正确的是( )
A.NaO在空气中加热可得固体NaO
2 2 2
B.Mg加入到过量FeCl 溶液中可得Fe
3
C.FeS 在沸腾炉中与O 反应主要生成SO
2 2 3
D.HO 溶液中加入少量MnO 粉末生成H 和O
2 2 2 2 2
7.中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列常见古
诗文对应的化学知识正确的是( )
选
常见古诗文记载 化学知识
项
《梦溪笔谈》中对宝剑的记载:“古人以剂钢为刃,柔 铁的合金硬度比纯铁的大,
A
铁为茎干,不尔则多断折” 熔点比纯铁的高
《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五
B 强水为氢氟酸
金,其水甚强,惟玻璃可盛”
硫指的是硫黄,硝指的是硝
C 《天工开物》中记载:凡火药,硫为纯阳,硝为纯阴
酸钾
《泉州府志》中记载:安南人黄姓者为宅煮糖,墙塌压
D 糖白的过程发生了化学变化
糖,去土而糖白,后人遂效之
8.加碘盐中含有KIO,其能发生反应KIO+5KI+3HSO=3I+3K SO+3H O,下列有关该
3 3 2 4 2 2 4 2
反应的说法正确的是( )
A.HSO 是氧化剂 B.KIO 发生氧化反应
2 4 3
C.I 的还原性大于I- D.每生成0.6 mol I,反应转移电子数为N
2 2 A
9.以下常见元素对应物质之间的每步转化中,都能通过一步反应实现的是( )
①Fe→FeCl →Fe(OH) →Fe(OH) ②Na→NaO→NaCO→NaHCO→NaOH
2 2 3 2 2 3 3
③NaAlO→Al(OH) →Al O→Al ④HS→S→SO→HSO
2 3 2 3 2 3 2 4
⑤N→NH →NO→NO→HNO
2 3 2 3
A.①②③④ B.①③④⑤ C.①②③⑤ D.①②④⑤
10.部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.a可与e反应生成b B.b既可被氧化,也可被还原
2
学科网(北京)股份有限公司C.可将e加入浓碱液中制得d的胶体 D.可存在b→c→d→e→b的循环转化关系
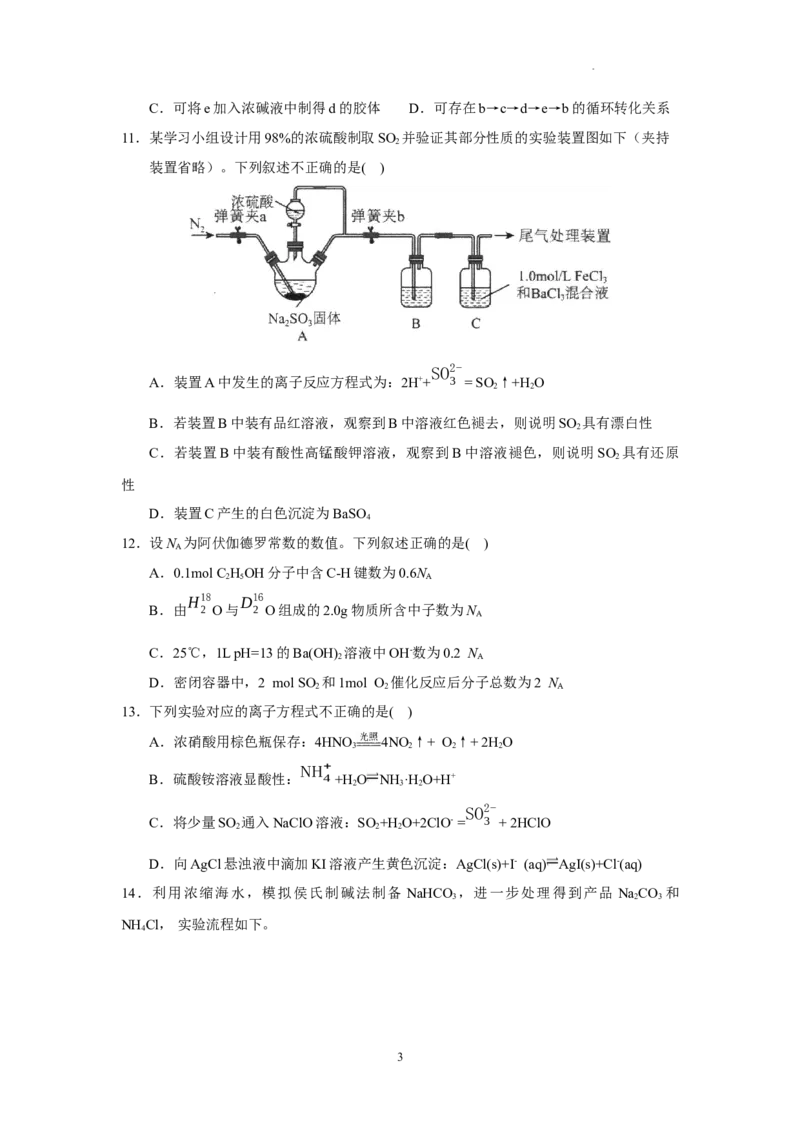
11.某学习小组设计用98%的浓硫酸制取SO 并验证其部分性质的实验装置图如下(夹持
2
装置省略)。下列叙述不正确的是( )
SO2-
A.装置A中发生的离子反应方程式为:2H++ 3 = SO↑+H O
2 2
B.若装置B中装有品红溶液,观察到B中溶液红色褪去,则说明SO 具有漂白性
2
C.若装置B中装有酸性高锰酸钾溶液,观察到B中溶液褪色,则说明SO 具有还原
2
性
D.装置C产生的白色沉淀为BaSO
4
12.设N 为阿伏伽德罗常数的数值。下列叙述正确的是( )
A
A.0.1mol C HOH分子中含C-H键数为0.6N
2 5 A
H18 D16
B.由 2 O与 2 O组成的2.0g物质所含中子数为N
A
C.25℃,1L pH=13的Ba(OH) 溶液中OH-数为0.2 N
2 A
D.密闭容器中,2 mol SO 和1mol O 催化反应后分子总数为2 N
2 2 A
13.下列实验对应的离子方程式不正确的是( )
A.浓硝酸用棕色瓶保存:4HNO 4NO↑+ O↑+ 2H O
3 2 2 2
NH+
B.硫酸铵溶液显酸性: 4 +H O NH ·H O+H+
2 3 2
SO2-
C.将少量SO 通入NaClO溶液:SO+H O+2ClO- = 3 + 2HClO
2 2 2
D.向AgCl悬浊液中滴加KI溶液产生黄色沉淀:AgCl(s)+I- (aq) AgI(s)+Cl-(aq)
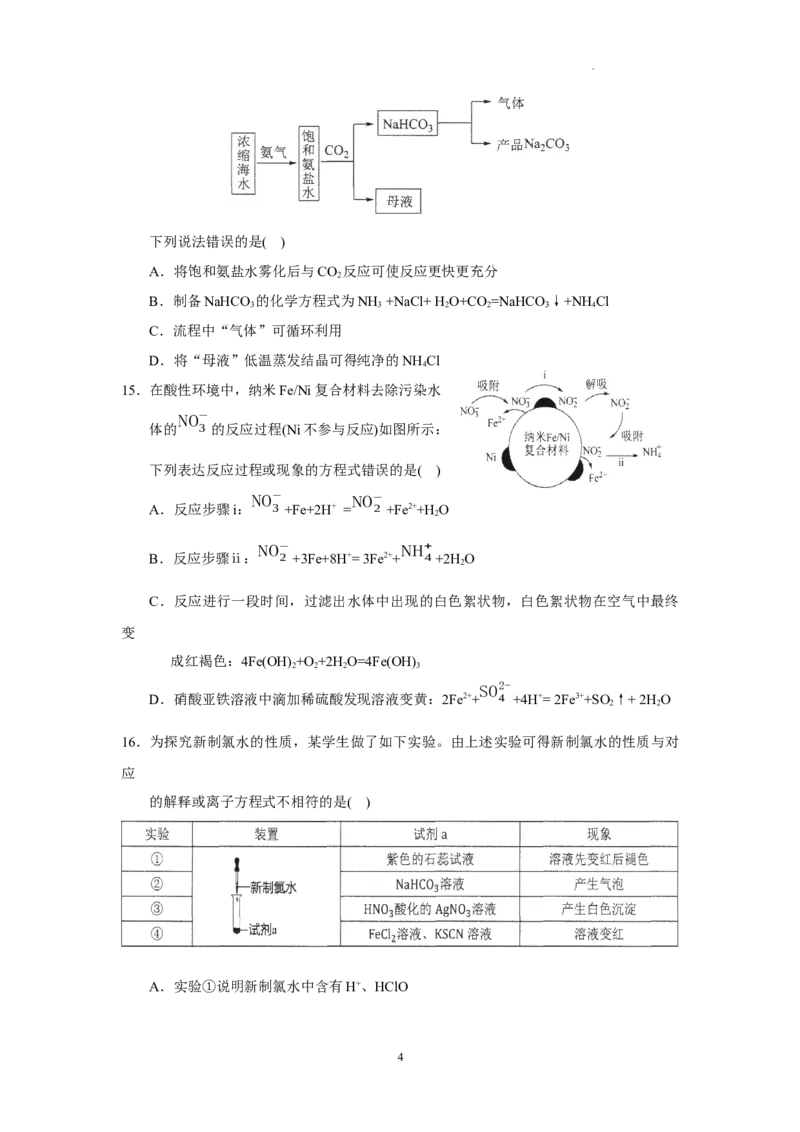
14.利用浓缩海水,模拟侯氏制碱法制备 NaHCO ,进一步处理得到产品 NaCO 和
3 2 3
NH Cl, 实验流程如下。
4
3
学科网(北京)股份有限公司下列说法错误的是( )
A.将饱和氨盐水雾化后与CO 反应可使反应更快更充分
2
B.制备NaHCO 的化学方程式为NH +NaCl+ H O+CO=NaHCO ↓+NHCl
3 3 2 2 3 4
C.流程中“气体”可循环利用
D.将“母液”低温蒸发结晶可得纯净的NH Cl
4
15.在酸性环境中,纳米Fe/Ni复合材料去除污染水
NO−
体的 3 的反应过程(Ni不参与反应)如图所示:
下列表达反应过程或现象的方程式错误的是( )
NO− NO−
A.反应步骤i: 3 +Fe+2H+ = 2 +Fe2++H O
2
NO− NH+
B.反应步骤ⅱ: 2 +3Fe+8H+= 3Fe2++ 4 +2HO
2
C.反应进行一段时间,过滤出水体中出现的白色絮状物,白色絮状物在空气中最终
变
成红褐色:4Fe(OH) +O+2H O=4Fe(OH)
2 2 2 3
SO2-
D.硝酸亚铁溶液中滴加稀硫酸发现溶液变黄:2Fe2++ 4 +4H+= 2Fe3++SO↑+ 2H O
2 2
16.为探究新制氯水的性质,某学生做了如下实验。由上述实验可得新制氯水的性质与对
应
的解释或离子方程式不相符的是( )
A.实验①说明新制氯水中含有H+、HClO
4
学科网(北京)股份有限公司HCO−
B.实验②发生的反应为 3 +HClO=ClO-+CO↑+H O
2 2
C.实验③说明新制氯水中有Cl-,Cl- +Ag+=AgCl↓
D.实验④说明氯气具有强氧化性,Cl+2Fe2+=2Cl-+ 2Fe3+
2
17.(1)书写对应的化学方程式:
①用氯气制备漂白粉: 。
②固体管道疏通剂(主要成分有氢氧化钠和铝粉)的疏通原理: 。
③呼吸面具中过氧化钠与二氧化碳反应: 。
④KClO 可以和草酸(H C O)、硫酸反应生成高效的消毒杀菌剂 ClO 气体,还生成
3 2 2 4 2
CO
2
和KHSO 等物质。写出该反应的化学方程式 。
4
(2)书写对应的离子方程式:
⑤制作印刷电路板时氯化铁溶液腐蚀铜: 。
⑥用高锰酸钾酸性溶液检验溶液中的亚铁离子 (还原产物为 Mn2+):
。
Cr O 2-
⑦在酸性条件下,向含铬废水中加入FeSO,可将 2 7 还原为Cr3+,该过程的离子
4
反应方程式为_____________________________________________________________。
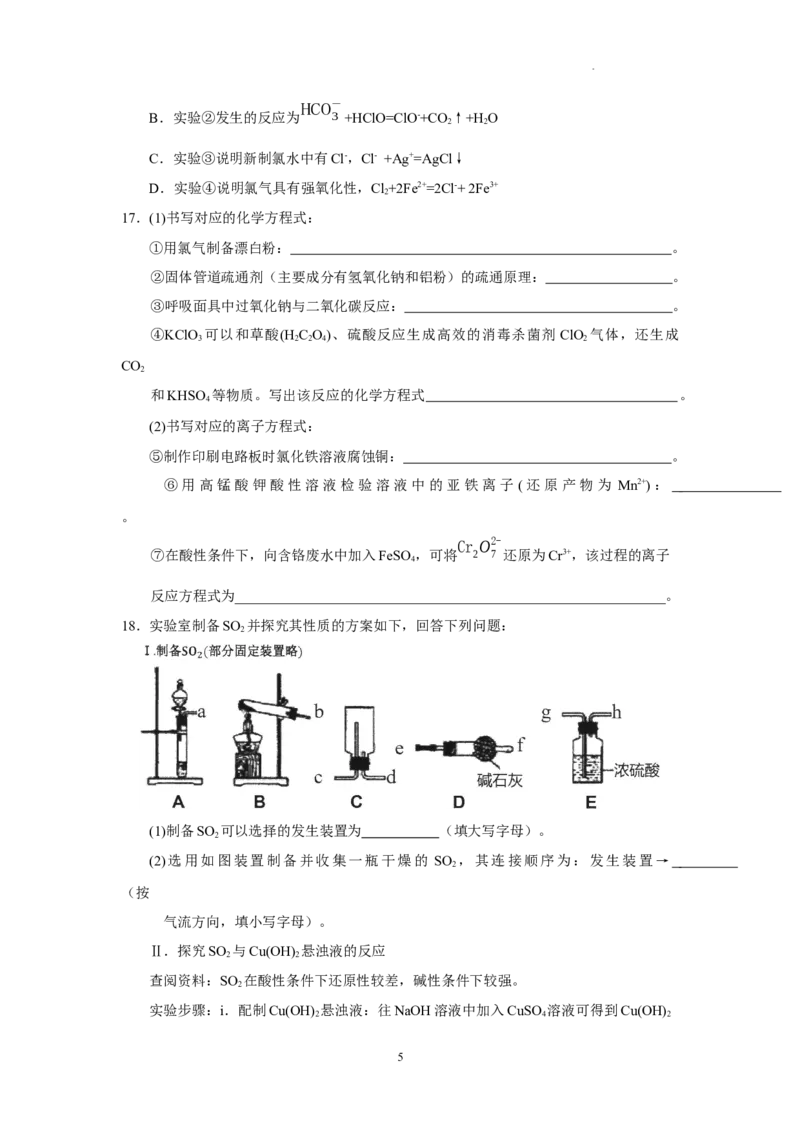
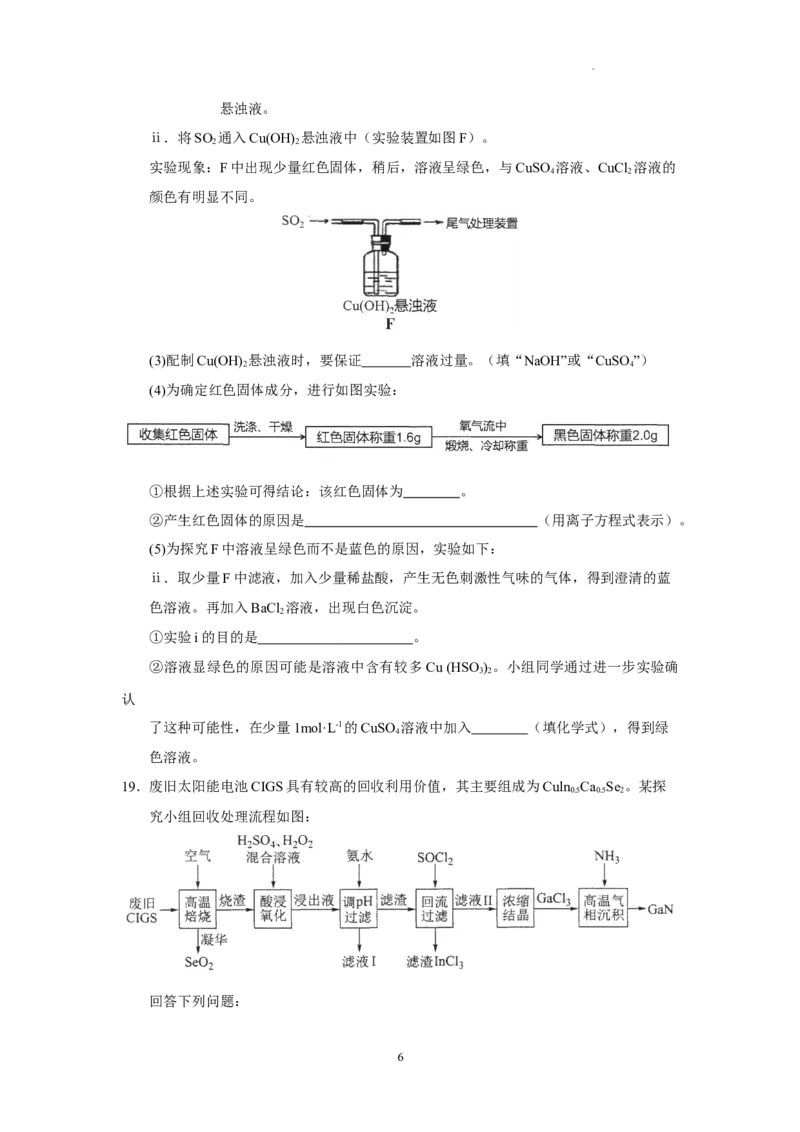
18.实验室制备SO 并探究其性质的方案如下,回答下列问题:
2
(1)制备SO 可以选择的发生装置为 (填大写字母)。
2
(2)选用如图装置制备并收集一瓶干燥的 SO ,其连接顺序为:发生装置→
2
(按
气流方向,填小写字母)。
Ⅱ.探究SO 与Cu(OH) 悬浊液的反应
2 2
查阅资料:SO 在酸性条件下还原性较差,碱性条件下较强。
2
实验步骤:i.配制Cu(OH) 悬浊液:往NaOH溶液中加入CuSO 溶液可得到Cu(OH)
2 4 2
5
学科网(北京)股份有限公司悬浊液。
ⅱ.将SO 通入Cu(OH) 悬浊液中(实验装置如图F)。
2 2
实验现象:F中出现少量红色固体,稍后,溶液呈绿色,与CuSO 溶液、CuCl 溶液的
4 2
颜色有明显不同。
(3)配制Cu(OH) 悬浊液时,要保证 溶液过量。(填“NaOH”或“CuSO”)
2 4
(4)为确定红色固体成分,进行如图实验:
①根据上述实验可得结论:该红色固体为 。
②产生红色固体的原因是 (用离子方程式表示)。
(5)为探究F中溶液呈绿色而不是蓝色的原因,实验如下:
ⅱ.取少量F中滤液,加入少量稀盐酸,产生无色刺激性气味的气体,得到澄清的蓝
色溶液。再加入BaCl 溶液,出现白色沉淀。
2
①实验i的目的是 。
②溶液显绿色的原因可能是溶液中含有较多Cu (HSO) 。小组同学通过进一步实验确
3 2
认
了这种可能性,在少量1mol·L-1的CuSO 溶液中加入 (填化学式),得到绿
4
色溶液。
19.废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为Culn Ca Se 。某探
0.5 0.5 2
究小组回收处理流程如图:
回答下列问题:
6
学科网(北京)股份有限公司(1)硒(Se)与硫为同族元素,Se的最外层电子数为 ;在化合物Culn Ca Se 中镓
0.5 0.5 2
(Ga)和铟(In)均为+3价,则Cu的化合价为____。
(2)“酸浸氧化”得蓝色溶液,则该过程发生的主要氧化还原反应的化学方程式
为 。
(3)氢氧化铜沉淀可溶于氨水,则滤液I中的阴离子主要有 和 两种。
(4)虑渣加入SOCl 混合前需要洗涤、干燥,并用试剂 和 来检验滤渣中
2
SO2-
的 4 是否洗净。
(5)滤渣加入SOCl 可反生反应:2In(OH) +3SOCl =2InCl+3X;对物质X的性质有如下
2 3 2 3
判
断,你认为不正确的是____。
A.有弱酸性 B.可使溴水褪色
C.与CaCl 溶液反应得白色沉淀 D.与烧碱溶液反应可生成两种盐
2
(6)“高温气相沉积”过程中发生的化学反应方程式为 。
20.以某工业废锰渣(含MnO 及少量KOH、MgO、Fe O)为原料制备MnSO 晶体,其工艺
2 2 3 4
流程如下:
该工艺条件下金属离子开始沉淀和完全沉淀(c≤10-5mol/L)的pH如表所示:
金属离子 Fe3+ Fe2+ Mn2+ Mg2+
开始沉淀pH 2.10 7.45 9.27 9.60
完全沉淀pH 3.20 8.95 10.87 11.13
(1)“反应I”中加入硫铁矿(主要成分FeS)将MnO 还原为Mn2+。滤渣1的主要成分除
2 2
FeS 外,还有一种相对分子质量为192的单质,该物质的化学式为 。
2
(2)“反应I”的离子方程式为 。
(3)“某碳酸盐”的化学式 ,加热的目的是 。
(4)为检验MnSO 受热分解是否生成SO 或SO,某同学设计探究实验装置如图所示:
4 2 3
7
学科网(北京)股份有限公司①装置B、C、D中的溶液依次为 (填字母)。
a.Ba(NO) b.BaCl c.品红 d.浓硫酸 e.Ca(OH) f.NaOH
3 2 2 2
②实验结束时,为防止倒吸,正确的操作方法是 。
(5)测定产品纯度。取制得的MnSO 晶体0.1510g,溶于适量水中,加硫酸酸化;用过
4
MnO−
量NaBiO (难溶于水)将Mn2+完全氧化为 4 ,过滤;洗涤未溶解固体2-3次,向
3
滤液中加入 NaC O 固体 0.5360 g,振荡,充分溶解并反应后,用 0.0320
2 2 4
MnO−
mol·L-1KMnO 溶 液 滴 定 ( 4 被 还 原 为 Mn2+) , 用 去 20.00 mL 。 已 知 :
4
Mr(Na C O)=134,
2 2 4
Mr(MnSO)=151。
4
①计算产品中MnSO 的质量分数 (保留两位有效数字)。
4
②为提高测定的精度,应补充的实验操作 。
化学参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
A C B B C A C D C C A B C D D B
【17答案】【14分】
①2Cl+2Ca(OH) =CaCl +Ca(ClO)+2HO【2分】
2 2 2 2 2
②2A1+ 2NaOH+2HO=2NaAlO+3H2↑【2分】
2 2
③2NaO+2CO=2Na CO+O 【2分】
2 2 2 2 3 2
④2KClO+H C O+2H SO=2ClO↑+2CO↑+2KHSO+2HO【2分】
3 2 2 4 2 4 2 2 4 2
⑤2Fe3++Cu=2Fe2++Cu2+ 【2分】
MnO−
⑥ 4 +5Fe2++8H+ =Mn2++5Fe3++4HO 【2分】
2
Cr O 2-
⑦6Fe2++ 2 7 +14H+= 6Fe3++2Cr3++ 7H O 【2分】
2
8
学科网(北京)股份有限公司【18答案】【14分】
(1)A; 【2分】 (2)g→h→d→c→e(f) 【2分】 (3)NaOH 【2分】
SO2-
(4)①Cu(或铜)【2分】;②SO +Cu(OH) +2OH-=Cu+ 4 +2HO 【2分】
2 2 2
(5)①排除溶解的SO、HSO 导致溶液显绿色的可能性【2分】;②Ba(HSO) 【2分】
2 2 3 3 2
【19答案】【12分】
(1)6【1分】 +1 【1分】
(2)CuO+H O+2HSO=2CuSO+3H O 【2分】
2 2 2 2 4 4 2
SO2-
(3) 4 OH-【2分】 (4)HCl溶液 BaCl 溶液【2分】
2
(5)C【2分】 (6)GaCl +NH GaN+3HCl 【2分】
3 3
【20答案】【16分】
(1)S 【2分】
6
(2)3MnO+3FeS +12H+=3Mn2++3Fe2++S +6H O 【2分】
2 2 6 2
(3)MnCO 【2分】 促进Fe(OH) 胶体聚沉,或促进产生Fe(OH) 沉淀【2分】
3 3 3
(4)①b c f 【2分】 ②先停止加热,继续通N 至装置冷却到室温再停止通N 【2分】
2 2
(5)①96% 【2分】②将2~3次洗涤的滤液与过滤所得的滤液合并,重复实验2~3次【2
分】
9
学科网(北京)股份有限公司10
学科网(北京)股份有限公司