文档内容
绝密★启用前(新高考湖北卷)
化学试卷
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦
干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1 C12 N14 O16 Mg24 Si28 S32
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项符合题目要求。
1.我国古代先民在生活、生产过程中积累了丰富的化学知识。下列有关说法中错误的是
A.《天工开物》中记载的琉璃石与水晶的成分相同,二者均为单晶硅
B.《吕氏春秋》中记载了有关青铜的性质,青铜的硬度比铜的硬度大
C.《本草纲目》中记载的有关乙醇和水的分离过程,应用了蒸馏操作
D.《本草经集注》中利用“火烧法”区分KNO 和Na SO ,应用了焰色试验
3 2 4
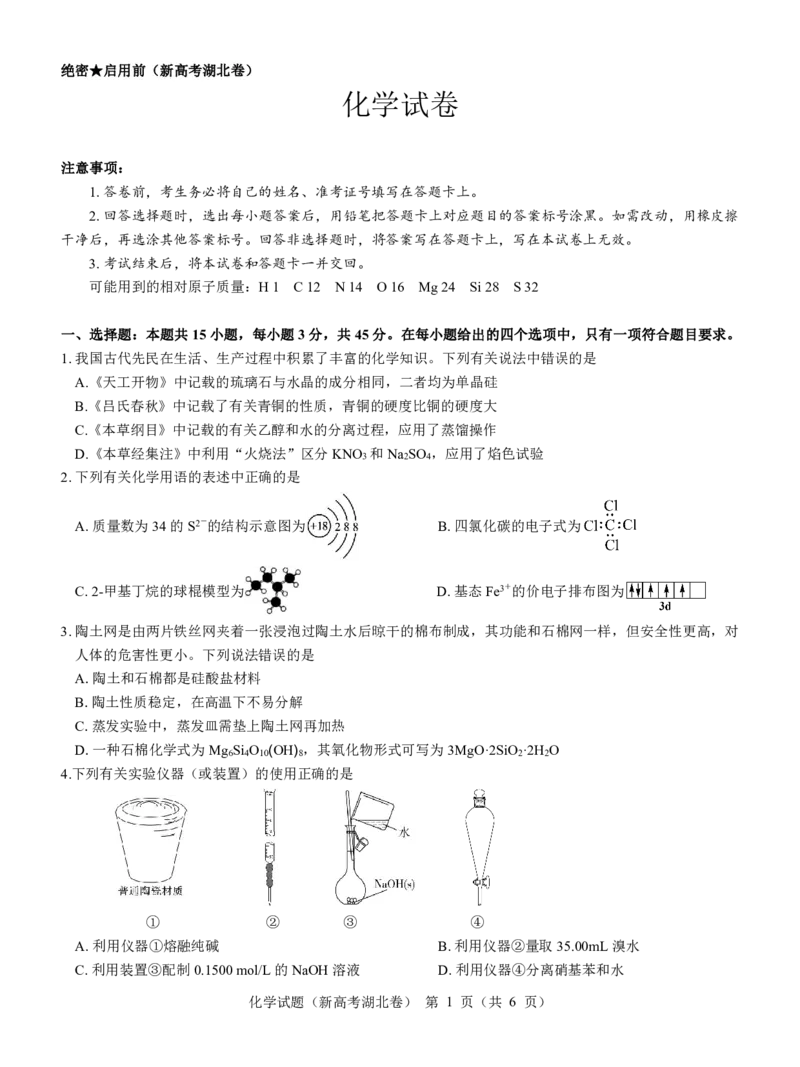
2.下列有关化学用语的表述中正确的是
A.质量数为34的S2-的结构示意图为 B.四氯化碳的电子式为
C.2-甲基丁烷的球棍模型为 D.基态Fe3+的价电子排布图为
3.陶土网是由两片铁丝网夹着一张浸泡过陶土水后晾干的棉布制成,其功能和石棉网一样,但安全性更高,对
人体的危害性更小。下列说法错误的是
A.陶土和石棉都是硅酸盐材料
B.陶土性质稳定,在高温下不易分解
C.蒸发实验中,蒸发皿需垫上陶土网再加热
D.一种石棉化学式为Mg Si O (OH) ,其氧化物形式可写为3MgO·2SiO ·2H O
6 4 10 8 2 2
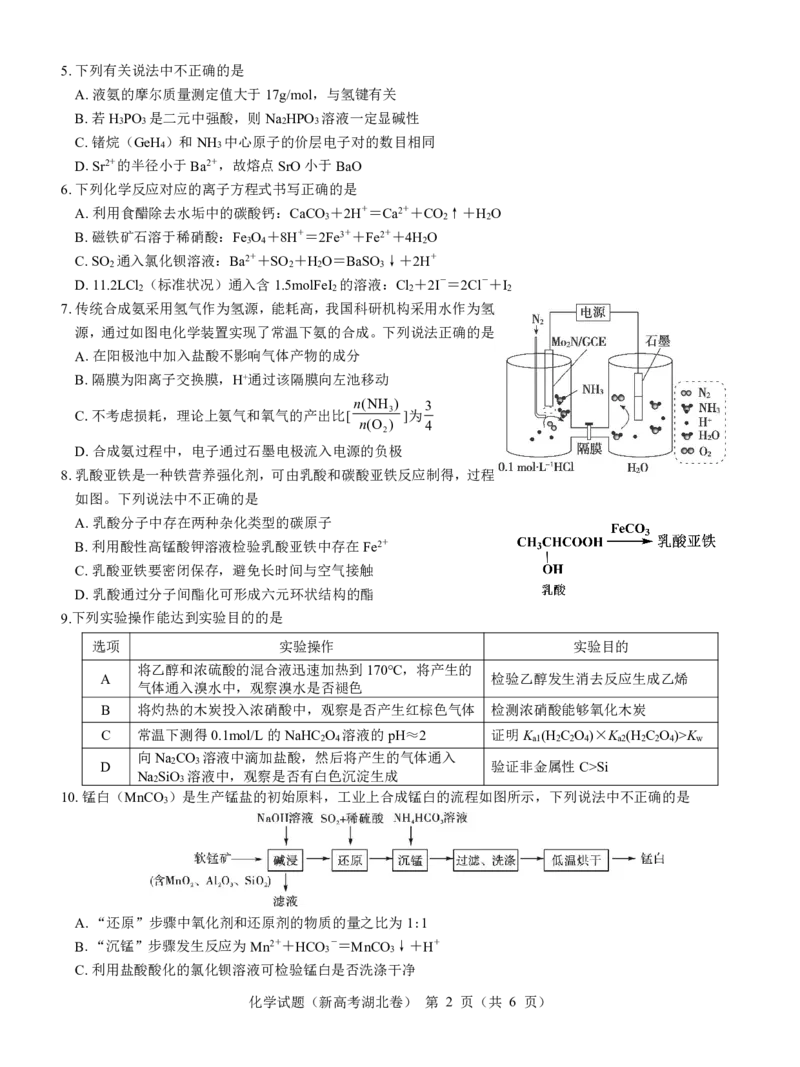
4.下列有关实验仪器(或装置)的使用正确的是
① ② ③ ④
A.利用仪器①熔融纯碱 B.利用仪器②量取35.00mL溴水
C.利用装置③配制0.1500mol/L的NaOH溶液 D.利用仪器④分离硝基苯和水
化学试题(新高考湖北卷) 第 1 页(共 6 页)
{#{QQABbYSUggggAAJAAAhCUwFgCAIQkBECAIoGgAAAMAABARNABAA=}#}5.下列有关说法中不正确的是
A.液氨的摩尔质量测定值大于17g/mol,与氢键有关
B.若H PO 是二元中强酸,则Na HPO 溶液一定显碱性
3 3 2 3
C.锗烷(GeH )和NH 中心原子的价层电子对的数目相同
4 3
D.Sr2+的半径小于Ba2+,故熔点SrO小于BaO
6.下列化学反应对应的离子方程式书写正确的是
A.利用食醋除去水垢中的碳酸钙:CaCO +2H+=Ca2++CO ↑+H O
3 2 2
B.磁铁矿石溶于稀硝酸:Fe O +8H+=2Fe3++Fe2++4H O
3 4 2
C.SO 通入氯化钡溶液:Ba2++SO +H O=BaSO ↓+2H+
2 2 2 3
D.11.2LCl (标准状况)通入含1.5molFeI 的溶液:Cl +2I-=2Cl-+I
2 2 2 2
7.传统合成氨采用氢气作为氢源,能耗高,我国科研机构采用水作为氢
源,通过如图电化学装置实现了常温下氨的合成。下列说法正确的是
A.在阳极池中加入盐酸不影响气体产物的成分
B.隔膜为阳离子交换膜,H+通过该隔膜向左池移动
n(NH ) 3
C.不考虑损耗,理论上氨气和氧气的产出比[ 3 ]为
n(O ) 4
2
D.合成氨过程中,电子通过石墨电极流入电源的负极
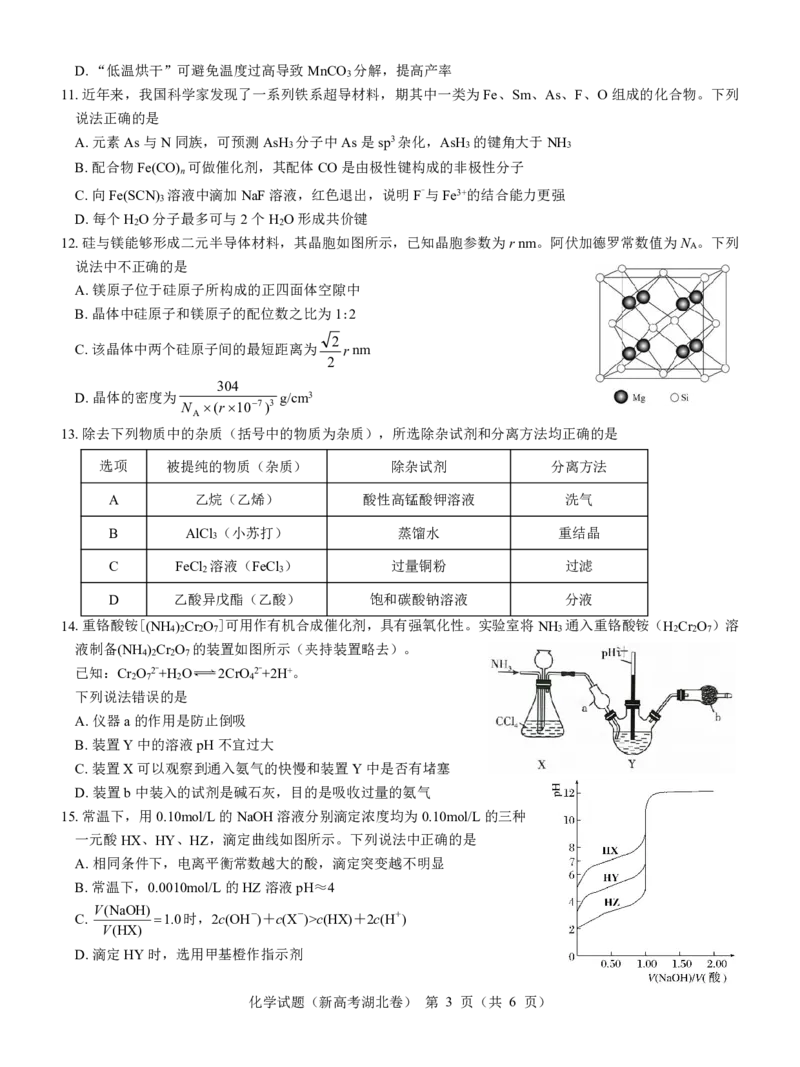
8.乳酸亚铁是一种铁营养强化剂,可由乳酸和碳酸亚铁反应制得,过程
如图。下列说法中不正确的是
A.乳酸分子中存在两种杂化类型的碳原子
B.利用酸性高锰酸钾溶液检验乳酸亚铁中存在Fe2+
C.乳酸亚铁要密闭保存,避免长时间与空气接触
D.乳酸通过分子间酯化可形成六元环状结构的酯
9.下列实验操作能达到实验目的的是
选项 实验操作 实验目的
将乙醇和浓硫酸的混合液迅速加热到170℃,将产生的
A 检验乙醇发生消去反应生成乙烯
气体通入溴水中,观察溴水是否褪色
B 将灼热的木炭投入浓硝酸中,观察是否产生红棕色气体 检测浓硝酸能够氧化木炭
C 常温下测得0.1mol/L的NaHC O 溶液的pH≈2 证明K (H C O )×K (H C O )>K
2 4 a1 2 2 4 a2 2 2 4 w
向Na CO 溶液中滴加盐酸,然后将产生的气体通入
D 2 3 验证非金属性C>Si
Na SiO 溶液中,观察是否有白色沉淀生成
2 3
10.锰白(MnCO )是生产锰盐的初始原料,工业上合成锰白的流程如图所示,下列说法中不正确的是
3
A.“还原”步骤中氧化剂和还原剂的物质的量之比为1:1
B.“沉锰”步骤发生反应为Mn2++HCO -=MnCO ↓+H+
3 3
C.利用盐酸酸化的氯化钡溶液可检验锰白是否洗涤干净
化学试题(新高考湖北卷) 第 2 页(共 6 页)
{#{QQABbYSUggggAAJAAAhCUwFgCAIQkBECAIoGgAAAMAABARNABAA=}#}D.“低温烘干”可避免温度过高导致MnCO 分解,提高产率
3
11.近年来,我国科学家发现了一系列铁系超导材料,期其中一类为Fe、Sm、As、F、O组成的化合物。下列
说法正确的是
A.元素As与N同族,可预测AsH 分子中As是sp3杂化,AsH 的键角大于NH
3 3 3
B.配合物Fe(CO) 可做催化剂,其配体CO是由极性键构成的非极性分子
n
C.向Fe(SCN) 溶液中滴加NaF溶液,红色退出,说明F-与Fe3+的结合能力更强
3
D.每个H O分子最多可与2个H O形成共价键
2 2
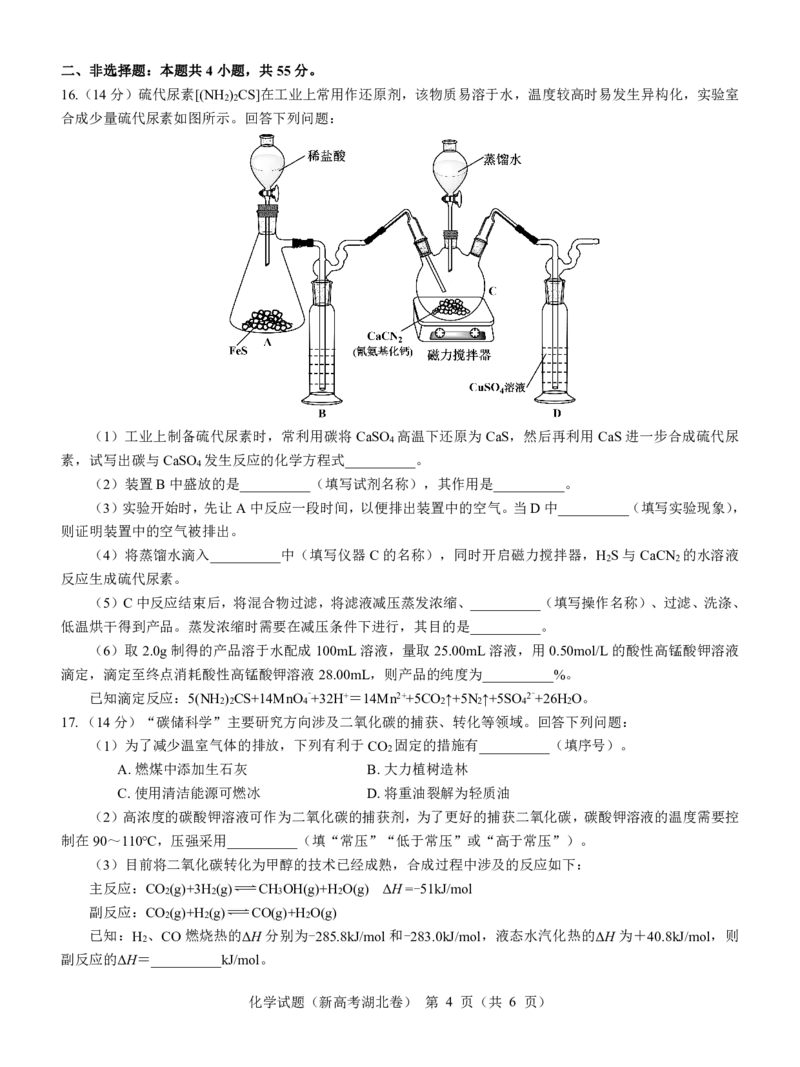
12.硅与镁能够形成二元半导体材料,其晶胞如图所示,已知晶胞参数为rnm。阿伏加德罗常数值为N 。下列
A
说法中不正确的是
A.镁原子位于硅原子所构成的正四面体空隙中
B.晶体中硅原子和镁原子的配位数之比为1:2
2
C.该晶体中两个硅原子间的最短距离为 rnm
2
304
D.晶体的密度为 g/cm3
N (r107)3
A
13.除去下列物质中的杂质(括号中的物质为杂质),所选除杂试剂和分离方法均正确的是
选项 被提纯的物质(杂质) 除杂试剂 分离方法
A 乙烷(乙烯) 酸性高锰酸钾溶液 洗气
B AlCl (小苏打) 蒸馏水 重结晶
3
C FeCl 溶液(FeCl ) 过量铜粉 过滤
2 3
D 乙酸异戊酯(乙酸) 饱和碳酸钠溶液 分液
14.重铬酸铵[(NH ) Cr O ]可用作有机合成催化剂,具有强氧化性。实验室将NH 通入重铬酸铵(H Cr O )溶
4 2 2 7 3 2 2 7
液制备(NH ) Cr O 的装置如图所示(夹持装置略去)。
4 2 2 7
已知:Cr O 2-+H O 2CrO 2-+2H+。
2 7 2 4
下列说法错误的是
A.仪器a的作用是防止倒吸
B.装置Y中的溶液pH不宜过大
C.装置X可以观察到通入氨气的快慢和装置Y中是否有堵塞
D.装置b中装入的试剂是碱石灰,目的是吸收过量的氨气
15.常温下,用0.10mol/L的NaOH溶液分别滴定浓度均为0.10mol/L的三种
一元酸HX、HY、HZ,滴定曲线如图所示。下列说法中正确的是
A.相同条件下,电离平衡常数越大的酸,滴定突变越不明显
B.常温下,0.0010mol/L的HZ溶液pH≈4
V(NaOH)
C. 1.0时,2c(OH-)+c(X-)>c(HX)+2c(H+)
V(HX)
D.滴定HY时,选用甲基橙作指示剂
化学试题(新高考湖北卷) 第 3 页(共 6 页)
{#{QQABbYSUggggAAJAAAhCUwFgCAIQkBECAIoGgAAAMAABARNABAA=}#}二、非选择题:本题共4小题,共55分。
16.(14分)硫代尿素[(NH ) CS]在工业上常用作还原剂,该物质易溶于水,温度较高时易发生异构化,实验室
2 2
合成少量硫代尿素如图所示。回答下列问题:
(1)工业上制备硫代尿素时,常利用碳将CaSO 高温下还原为CaS,然后再利用CaS进一步合成硫代尿
4
素,试写出碳与CaSO 发生反应的化学方程式__________。
4
(2)装置B中盛放的是__________(填写试剂名称),其作用是__________。
(3)实验开始时,先让A中反应一段时间,以便排出装置中的空气。当D中__________(填写实验现象),
则证明装置中的空气被排出。
(4)将蒸馏水滴入__________中(填写仪器C的名称),同时开启磁力搅拌器,H S与CaCN 的水溶液
2 2
反应生成硫代尿素。
(5)C中反应结束后,将混合物过滤,将滤液减压蒸发浓缩、__________(填写操作名称)、过滤、洗涤、
低温烘干得到产品。蒸发浓缩时需要在减压条件下进行,其目的是__________。
(6)取2.0g制得的产品溶于水配成100mL溶液,量取25.00mL溶液,用0.50mol/L的酸性高锰酸钾溶液
滴定,滴定至终点消耗酸性高锰酸钾溶液28.00mL,则产品的纯度为__________%。
已知滴定反应:5(NH ) CS+14MnO -+32H+=14Mn2++5CO ↑+5N ↑+5SO 2-+26H O。
2 2 4 2 2 4 2
17.(14分)“碳储科学”主要研究方向涉及二氧化碳的捕获、转化等领域。回答下列问题:
(1)为了减少温室气体的排放,下列有利于CO 固定的措施有__________(填序号)。
2
A.燃煤中添加生石灰 B.大力植树造林
C.使用清洁能源可燃冰 D.将重油裂解为轻质油
(2)高浓度的碳酸钾溶液可作为二氧化碳的捕获剂,为了更好的捕获二氧化碳,碳酸钾溶液的温度需要控
制在90~110℃,压强采用__________(填“常压”“低于常压”或“高于常压”)。
(3)目前将二氧化碳转化为甲醇的技术已经成熟,合成过程中涉及的反应如下:
主反应:CO (g)+3H (g) CH OH(g)+H O(g) ΔH=-51kJ/mol
2 2 3 2
副反应:CO (g)+H (g) CO(g)+H O(g)
2 2 2
已知:H 、CO燃烧热的ΔH分别为-285.8kJ/mol和-283.0kJ/mol,液态水汽化热的ΔH为+40.8kJ/mol,则
2
副反应的ΔH=__________kJ/mol。
化学试题(新高考湖北卷) 第 4 页(共 6 页)
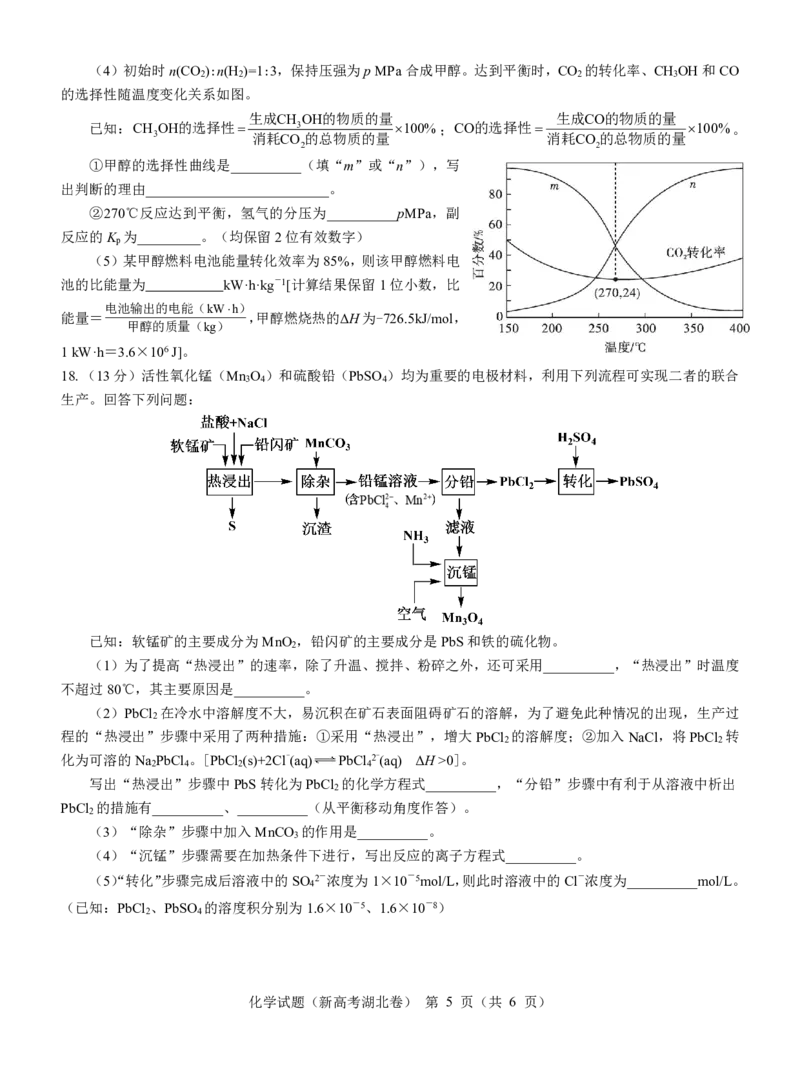
{#{QQABbYSUggggAAJAAAhCUwFgCAIQkBECAIoGgAAAMAABARNABAA=}#}(4)初始时n(CO ):n(H )=1:3,保持压强为pMPa合成甲醇。达到平衡时,CO 的转化率、CH OH和CO
2 2 2 3
的选择性随温度变化关系如图。
生成CH OH的物质的量 生成CO的物质的量
已知:CH OH的选择性 3 100%;CO的选择性 100%。
3 消耗CO 的总物质的量 消耗CO的总物质的量
2 2
①甲醇的选择性曲线是__________(填“m”或“n”),写
出判断的理由__________________________。
②270℃反应达到平衡,氢气的分压为__________pMPa,副
反应的K 为_________。(均保留2位有效数字)
p
(5)某甲醇燃料电池能量转化效率为85%,则该甲醇燃料电
池的比能量为 kW·h·kg-1[计算结果保留1位小数,比
电池输出的电能(kWh)
能量= ,甲醇燃烧热的ΔH为-726.5kJ/mol,
甲醇的质量(kg)
1kW·h=3.6×106J]。
18.(13分)活性氧化锰(Mn O )和硫酸铅(PbSO )均为重要的电极材料,利用下列流程可实现二者的联合
3 4 4
生产。回答下列问题:
已知:软锰矿的主要成分为MnO ,铅闪矿的主要成分是PbS和铁的硫化物。
2
(1)为了提高“热浸出”的速率,除了升温、搅拌、粉碎之外,还可采用__________,“热浸出”时温度
不超过80℃,其主要原因是__________。
(2)PbCl 在冷水中溶解度不大,易沉积在矿石表面阻碍矿石的溶解,为了避免此种情况的出现,生产过
2
程的“热浸出”步骤中采用了两种措施:①采用“热浸出”,增大PbCl 的溶解度;②加入NaCl,将PbCl 转
2 2
化为可溶的Na PbCl 。[PbCl (s)+2Cl-(aq) PbCl 2-(aq) ΔH>0]。
2 4 2 4
写出“热浸出”步骤中PbS转化为PbCl 的化学方程式__________,“分铅”步骤中有利于从溶液中析出
2
PbCl 的措施有__________、__________(从平衡移动角度作答)。
2
(3)“除杂”步骤中加入MnCO 的作用是__________。
3
(4)“沉锰”步骤需要在加热条件下进行,写出反应的离子方程式__________。
(5)“转化”步骤完成后溶液中的SO 2-浓度为1×10 -5mol/L,则此时溶液中的Cl-浓度为__________mol/L。
4
(已知:PbCl 、PbSO 的溶度积分别为1.6×10 -5、1.6×10 -8)
2 4
化学试题(新高考湖北卷) 第 5 页(共 6 页)
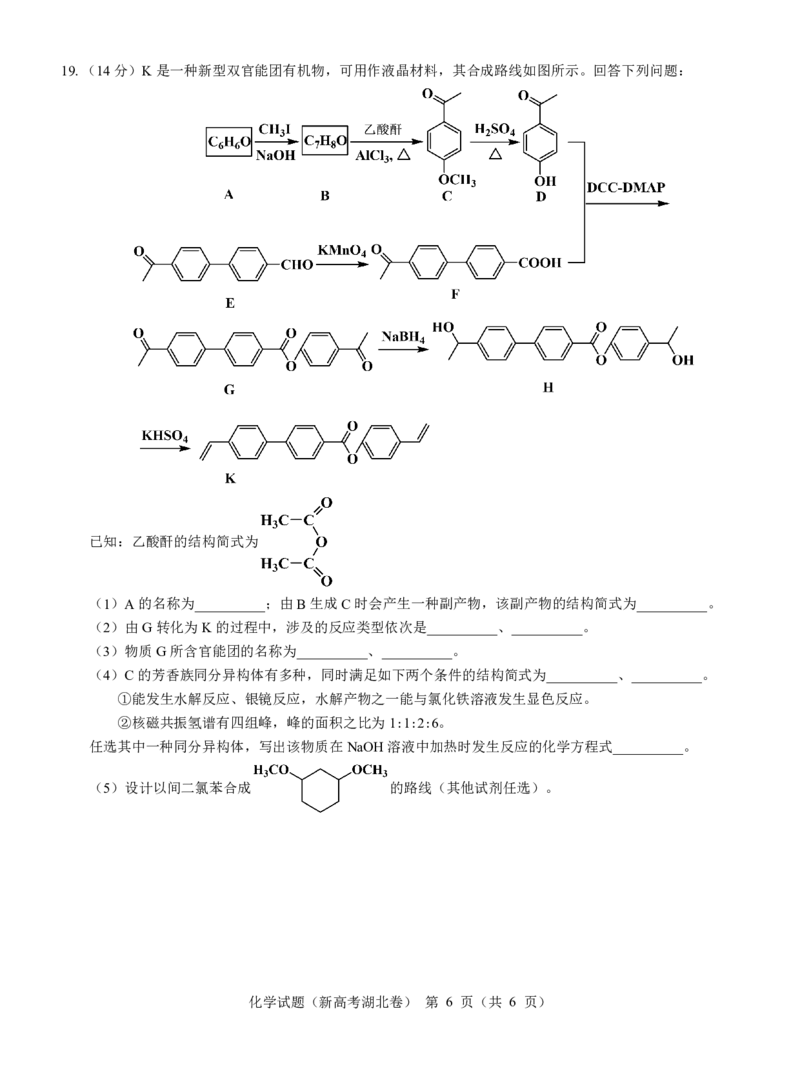
{#{QQABbYSUggggAAJAAAhCUwFgCAIQkBECAIoGgAAAMAABARNABAA=}#}19.(14分)K是一种新型双官能团有机物,可用作液晶材料,其合成路线如图所示。回答下列问题:
已知:乙酸酐的结构简式为
(1)A的名称为__________;由B生成C时会产生一种副产物,该副产物的结构简式为__________。
(2)由G转化为K的过程中,涉及的反应类型依次是__________、__________。
(3)物质G所含官能团的名称为__________、__________。
(4)C的芳香族同分异构体有多种,同时满足如下两个条件的结构简式为__________、__________。
①能发生水解反应、银镜反应,水解产物之一能与氯化铁溶液发生显色反应。
②核磁共振氢谱有四组峰,峰的面积之比为1:1:2:6。
任选其中一种同分异构体,写出该物质在NaOH溶液中加热时发生反应的化学方程式__________。
(5)设计以间二氯苯合成 的路线(其他试剂任选)。
化学试题(新高考湖北卷) 第 6 页(共 6 页)
{#{QQABbYSUggggAAJAAAhCUwFgCAIQkBECAIoGgAAAMAABARNABAA=}#}