文档内容
2025—2026 学年第一学期高二第三次月
卓 越 联 盟
化 学 试 题
考
本试卷满分100分,考试用时75分钟。
注意事项 :
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂
黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在
答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H1 C12 N14 O16 Na 23 Cu 64
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项
是符 合题目要求的。
1.化学与生产、生活密切相关,下列物质的主要成分属于金属的是
A.树桩 B.打印纸 C.瓷器 D.铜饰品
2.下列化学用语使用正确的是
A. 中子数为10的氧原子:8O
B.Mg²+ 的结构示意图:+1⑩38
C.HCIO 的结构式:H—O—Cl
D. 甲烷的空间填充模型:
3.将电能转化为化学能,在生活和生产中具有重要的意义。下列说法错误的是
A. 电镀时,通常把待镀的金属制品端作为阴极,镀层金属端作为阳极,用含有镀层金属离子
的溶液作电镀液
B. 粗铜电解精炼时,以待精炼的铜作阳极,以纯铜作阴极,用足量的硝酸银溶液作电解质溶液
C. 电解饱和食盐水(足量)时,两电极均为惰性电极,阳极的产物为Cl₂,阴极上发生还原反应
D. 用铂作电极电解某金属氯化物(MCl₂) 的溶液,当收集到1.12 L(标准状况)氯气时,阴
极 增重3 . 2g, 则 M 的相对原子质量为64
【高二化学第1页(共6页)】.4.次磷酸(H₃PO₂) 为一元弱酸,下列说法错误的是
A.NaH₂PO₂ 的水溶液显碱性
B.H₃PO₂ 在水溶液中的电离方程式为H₃PO₂+H₂O 一 H₂POz+H₃O+
C.H₃PO₂ 的水溶液中含磷微粒有H₃PO₂、H₂PO₂、HPO² - 和 PO³-
D. 将0 . 1mol ·L⁻¹ 的次磷酸加水稀释至0.01mol ·L⁻¹ 的过程中,n(H+) 一直增大
5. 装修后检测室内空气中甲醛(HCHO) 的含量越来越引起公众的重视。下列说法错误的是
A.C 位于元素周期表的第二周期第VIA族
B. 基态H 原子的能层中不包括p 能级
C. 基态 O 原子的简化电子排布式为[He]2s²2p⁴
D. 基 态O 原子中,其电子占据的最高能层的符号是L
6. 现代生活离不开方便实用的化学电源。 Zn-Cu 原电池结构如图所示,该装置工作时,下列
说 法正确的是
ZnSO₄ 溶液 CuSO₄ 溶液
已知:盐桥中装有含KCl 饱和溶液的琼脂,离子可在其中自由移
动。 A.CuSO₄ 溶液属于强电解质
B.Zn 电极上的电极反应式为Zn+2e-——Zn²+
C. 每生成6.4 g Cu,此时转移0.2 mol 电 子
D. 盐桥中的Cl 往 Cu 电极工作室方向迁移
7.设 NA 为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24 L SO₃中所含的原子总数为0.4NA
B. 常温下,0.1 mol·L- ¹ 稀硫酸中,所含H+ 的总数为0.2NA
C.2.8g 由 CO 和 N₂ 组成的混合气体中,所含的分子总数为
0.1NA D.7.8g Na₂O₂ 固体中,所含的离子总数为0.4NA
8.Na、Mg 元素的第一、二、三电离能如表所示。下列说法错误的是
元素 I₁/(kJ ·mol⁻¹) I₂/(kJ ·mol⁻¹) I₃/(kJ ·mol⁻¹)
Na 496 4562 6912
Mg 738 1451 7733
A. 基态Na 原子核外电子云有4种不同的伸展方向
B. 基态 Mg 原子中,2pr、2p, 、2p. 轨道能量不相同
C. 由表中数据可知,Na 容易形成Na+,Mg 容易形成Mg²+
D.Na 的焰色试验中,焰色是由Na 原子电子从激发态跃迁到基态时放出的光的颜
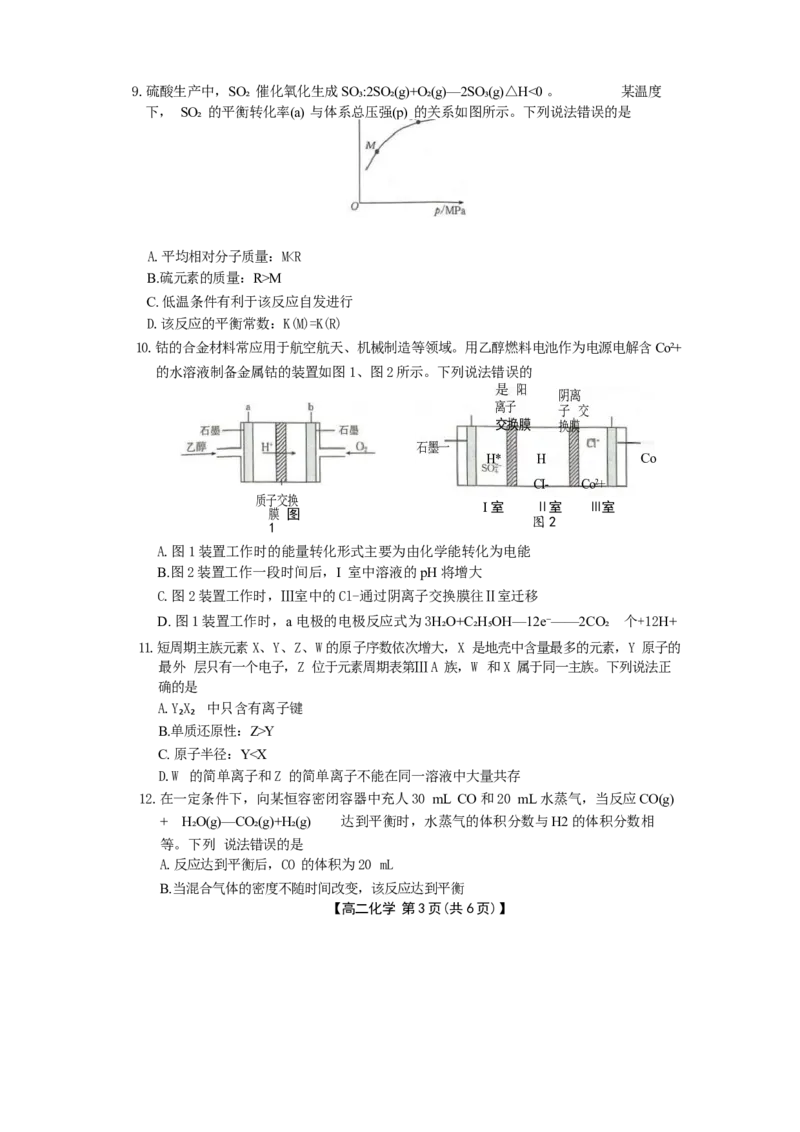
色 【高二化学 第2页(共6页)】9.硫酸生产中,SO₂ 催化氧化生成SO₃:2SO₂(g)+O₂(g)—2SO₃(g)△H<0 。 某温度
下, SO₂ 的平衡转化率(a) 与体系总压强(p) 的关系如图所示。下列说法错误的是
A.平均相对分子质量:MM
C. 低温条件有利于该反应自发进行
D.该反应的平衡常数:K(M)=K(R)
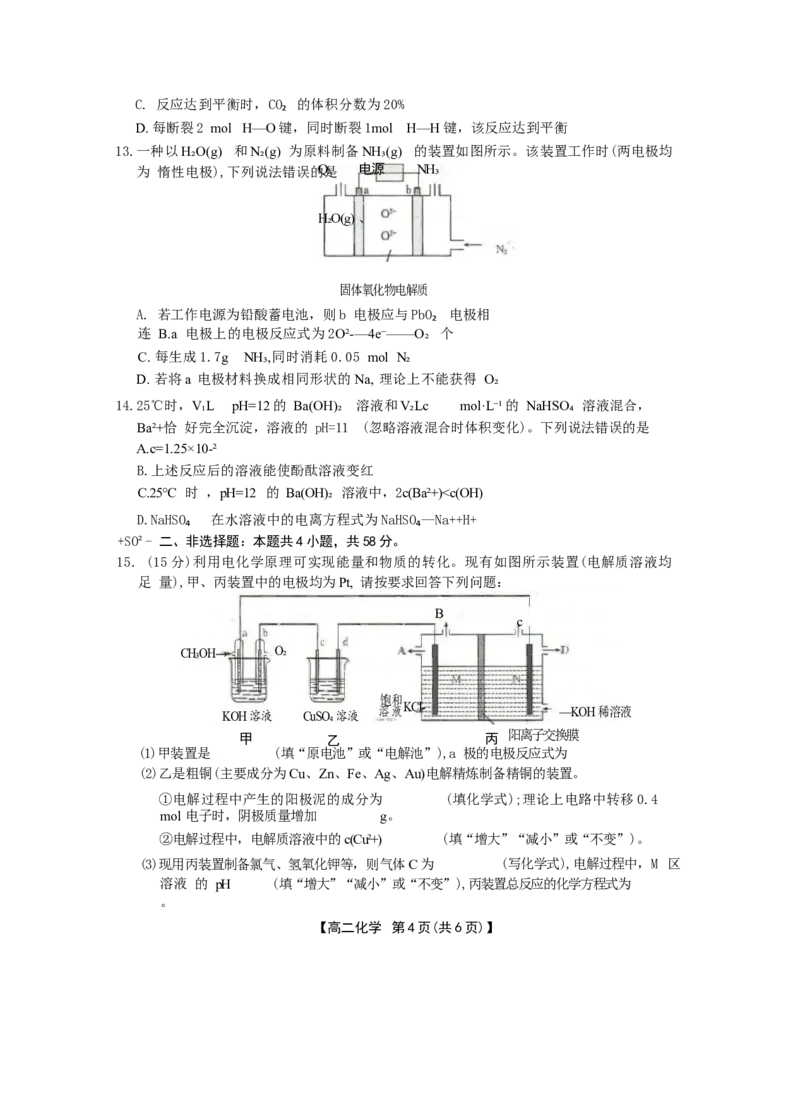
10.钴的合金材料常应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含Co²+
的水溶液制备金属钴的装置如图1、图2所示。下列说法错误的
是 阳
阴离
离子 子 交
交换膜 换膜
石墨一
H* H Co
CI- Co²+
质子交换
I室 Ⅱ室 Ⅲ室
膜 图
图2
1
A.图1装置工作时的能量转化形式主要为由化学能转化为电能
B.图2装置工作一段时间后,I 室中溶液的pH 将增大
C.图2装置工作时,Ⅲ室中的Cl-通过阴离子交换膜往Ⅱ室迁移
D. 图1装置工作时,a 电极的电极反应式为3H₂O+C₂H₅OH—12e⁻——2CO₂ 个+12H+
11.短周期主族元素X、Y、Z、W的原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的
最外 层只有一个电子,Z 位于元素周期表第ⅢA 族,W 和X 属于同一主族。下列说法正
确的是
A.Y₂X₂ 中只含有离子键
B.单质还原性:Z>Y
C. 原子半径:Y”或“<”)M²+。
(4)第一电离能:B (填“>”或“<”)C。
(5)少量的E 粉加入DCA 溶液中,发生反应的离子方程式为
(6)少量的M 粉加入ABC₃ 的浓溶液中,发生反应的化学方程式为
(7)仅由A 和 B 两种元素可组成一种酸,该酸的化学式为
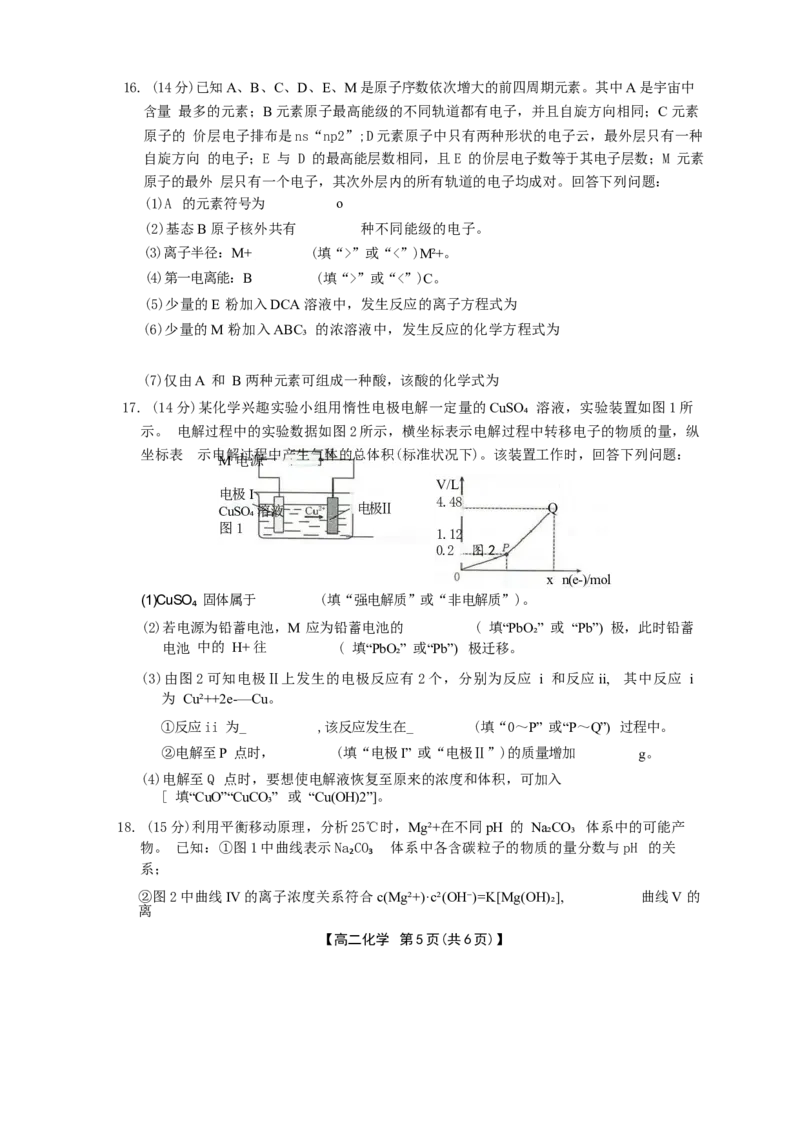
17. (14分)某化学兴趣实验小组用惰性电极电解一定量的CuSO₄ 溶液,实验装置如图1所
示。 电解过程中的实验数据如图2所示,横坐标表示电解过程中转移电子的物质的量,纵
坐标表 示电解过程中产生气体的总体积(标准状况下)。该装置工作时,回答下列问题:
M电源
V/L
电极I
4.48
CuSO₄溶液 电极Ⅱ Q
图1
1.12
0.2 图2
x n(e-)/mol
(1)CuSO₄ 固体属于 (填“强电解质”或“非电解质”)。
(2)若电源为铅蓄电池,M 应为铅蓄电池的 ( 填“PbO₂” 或 “Pb”) 极,此时铅蓄
电池 中的 H+ 往 ( 填“PbO₂” 或“Pb”) 极迁移。
(3)由图2可知电极Ⅱ上发生的电极反应有2个,分别为反应 i 和反应ii, 其中反应 i
为 Cu²++2e-—Cu。
①反应ii 为_ ,该反应发生在_ (填“0~P” 或“P~Q”) 过程中。
②电解至P 点时, (填“电极I” 或“电极Ⅱ”)的质量增加 g。
(4)电解至Q 点时,要想使电解液恢复至原来的浓度和体积,可加入
[ 填“CuO”“CuCO₃” 或 “Cu(OH)2”]。
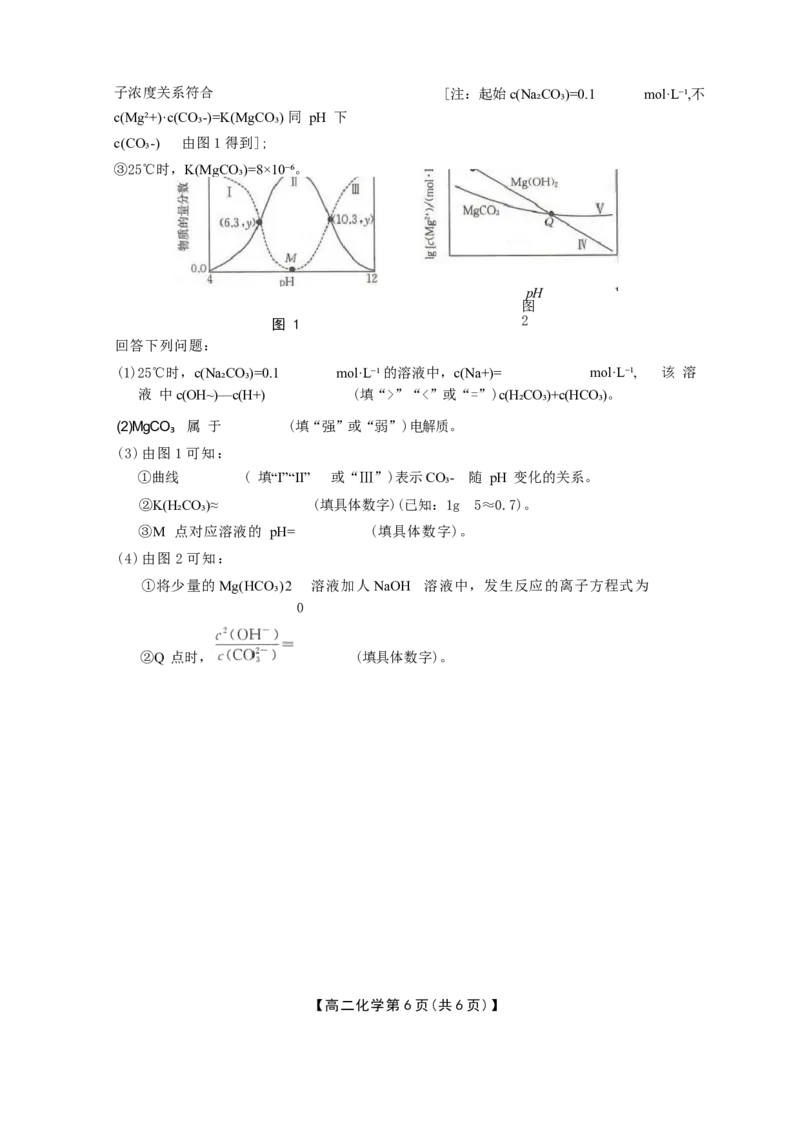
18. (15分)利用平衡移动原理,分析25℃时,Mg²+在不同pH 的 Na₂CO₃ 体系中的可能产
物。 已知:①图1中曲线表示Na₂CO₃ 体系中各含碳粒子的物质的量分数与pH 的关
系;
②图2中曲线IV的离子浓度关系符合c(Mg²+)·c²(OH⁻)=K[Mg(OH)₂], 曲线V 的
离
【高二化学 第5页(共6页)】子浓度关系符合 [注:起始c(Na₂CO₃)=0.1 mol·L⁻¹,不
c(Mg²+)·c(CO₃-)=K(MgCO₃) 同 pH 下
c(CO₃-) 由图1得到];
③25℃时,K(MgCO₃)=8×10⁻⁶。
pH 1
图
图 1 2
回答下列问题:
(1)25℃时,c(Na₂CO₃)=0.1 mol·L⁻¹的溶液中,c(Na+)= mol·L⁻¹, 该 溶
液 中c(OH~)—c(H+) (填“>”“<”或“=”)c(H₂CO₃)+c(HCO₃)。
(2)MgCO₃ 属 于 (填“强”或“弱”)电解质。
(3)由图 1 可知:
①曲线 ( 填“I”“Ⅱ” 或“Ⅲ”)表示CO₃- 随 pH 变化的关系。
②K(H₂CO₃)≈ (填具体数字)(已知:1g 5≈0.7)。
③M 点对应溶液的 pH= (填具体数字)。
(4)由图 2 可知:
①将少量的Mg(HCO₃)2 溶液加人NaOH 溶液中,发生反应的离子方程式为
0
②Q 点时, (填具体数字)。
【高二化学第6页(共6页)】2025—2026 学年第一学期高二第三次月
卓 越 联 盟
化学试题参考答案
考
1.D【 解析】树桩、打印纸的主要成分均属于有机物,A、B项均不符合题意;瓷器的主要成分
属 于硅酸盐,C 项不符合题意。
2.C【 解析】中子数为10的氧原子是8O,A 项错误;Mg²+ 的结构示意图 ,B 项错
误; 甲烷的分子结构模型为 ,D 项错误。
3.B【 解析】粗铜电解精炼时,以待精炼的铜作阳极,以纯铜作阴极,用足量的硫酸铜溶液作电
解质溶液,B 项错误。
4.C【 解析】H₃P O₂ 的水溶液中含磷微粒只有H₃PO₂ 、H₂PO₂,C 项错误。
5.A 【解析】C 位于元素周期表的第二周期第IVA 族 ,A 项错误。
6.C【 解析】CuSO₄ 溶液属于强电解质溶液,A 项错误;Zn 电极上的电极反应式为 Zn—
2e ——Zn²+,B 项错误;盐桥中的K+ 往 Cu 电极工作室方向迁移,D 项错误。
7.C 【 解析】标准状况下,SO₃ 非 气 态 ,A 项错误;未给出溶液的具体体积,B 项 错 误
;
7.8g Na₂O₂固体中,所含的离子总数为0.3NA,D 项错误。
8.B【 解析】基态 Mg 原子中,2p。、2p,、2p. 轨道能量相同,B 项错误。
9.B
10.B【 解析】图2装置工作一段时间后,I 室中溶液的pH 将减小,B 项错误。
11.D【 解析】根据已知信息可推出X、Y、Z、W依次为O、Na、A1、S。Na₂O₂ 中还含有共价
键, A 项错误;还原性Na>Al,B 项错误;原子半径Na>0,C 项错误。
12.B【 解析】该反应气体质量和容器容积不变,密度不变不能判断该反应达到平衡,B 项错误。
13.A【 解析】若工作电源为铅酸蓄电池,则b 电极应与Pb 电极相连,A 项错误。
14.A 【解析】c=1.25×10⁻³,A 项错误。
15. (1)原电池(1分);CH₃OH—6e+8OH-—CO-+6H₂O(2 分 )
(2)①Ag 、Au(2 分);12.8(2分)
②减小(2 分)
(3)H₂(2 分);不变(2分 分 )
【解析】(2)①利用电子得失可得: ,则阴极质量增加12.8g。
16.(1)H(2 分 )
(2)3(2 分)
(3)>(2 分)
【高二化学 ·参考答案 第1页(共2页)】(4)>(2 分)
(5)2Al+2OH⁻+6H₂O=2[Al(OH)₄]+3H₂ 个(2分)
(6)Cu+4HNO₃ (浓) —Cu(NO₃)₂+2NO₂ 个 + 2H₂O(2 分 )
(7)HN₃(2 分 )
【解析】依题意可知,A、B、C、D、E、M的元素符号分别为 H、N、O、Na、A1、Cu。
17. (1)强电解质(1分)
(2)PbO₂(1 分);PbO₂(1 分 )
(3)①2H₂O+2e—H₂ 个+2OH 或 2H++2e⁻—H₂↑(2 分) ;P~Q(1 分 )
②电极Ⅱ(2分);6.4(2分)
(4)0.1(2分);Cu(OH)₂(2 分 )
【解析】(4)P~Q 的过程中生成的气体为 O₂ 和 H₂ 。由 图 2 可 得 n(O₂)+n(H₂)=
mol, 又根据得失电子守恒可知n(O₂)×4=n(H₂)×2, 则 n(O₂)=
0.05 mol 、n(H₂)=0.1 mol, 转移电子的物质的量为0 . 2 mol, 故需补充0 . 1
mol Cu(OH)2。
18. (1)0.2(2分);>(2分)
(2)强(1分)
(3)①Ⅲ(2分)
②5×10⁻¹¹(答“10-10.3”给1分,2分)
③8.3(2分)
(4)①Mg²++2HCO₃+4OH-—Mg(OH)₂↓+2CO₃-+2H₂O(2 分 )
②1.25×10⁻⁷ (2分)
【高二化学 ·参考答案 第2页(共2页)】