文档内容
江苏省扬州中学高三化学月考试题
2024.10
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mn-55
I卷(选择题 共39分)
单项选择题:本题包括13题,每题3分,共39分。每题只有一个选项最符合题意。
1.某有机物含有C、H、O、N等元素,属于高分子化合物,则该有机物可能是
A.氨基酸 B.淀粉 C.蛋白质 D.脂肪
2. 光气(COCl )是一种重要的有机中间体。反应CHCl +H O=COCl ↑+HCl+H O可用于制
2 3 2 2 2 2
备光气。下列有关叙述正确的是
A.CHCl 为非极性分子 B.氯离子的结构示意图为
3
C.HO 的电子式为
2 2
D.COCl 中碳原子的轨道杂化类型为sp2杂化
2
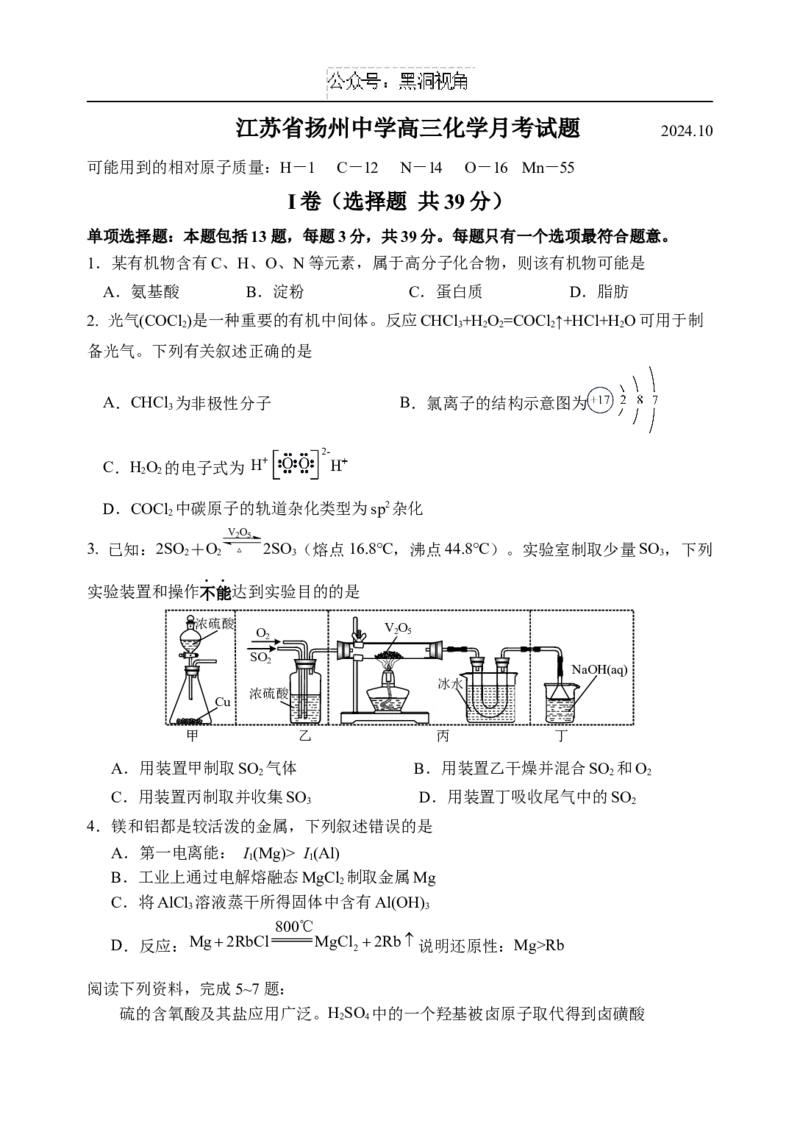
V2O5
3. 已知:2SO +O 2SO (熔点16.8℃,沸点44.8℃)。实验室制取少量SO ,下列
2 2 △ 3 3
实验装置和操作不能达到实验目的的是
浓硫酸
O O
22
VV 22OO
55
SSOO22
NaOH(aq)
冰水
浓硫酸 冰盐水
Cu
甲 乙 丙 丁
A.用装置甲制取SO 气体 B.用装置乙干燥并混合SO 和O
2 2 2
C.用装置丙制取并收集SO D.用装置丁吸收尾气中的SO
3 2
4.镁和铝都是较活泼的金属,下列叙述错误的是
A.第一电离能: I(Mg)> I(Al)
1 1
B.工业上通过电解熔融态MgCl 制取金属Mg
2
C.将AlCl 溶液蒸干所得固体中含有Al(OH)
3 3
800℃
D.反应:Mg2RbCl MgCl 2Rb说明还原性:Mg>Rb
2
阅读下列资料,完成5~7题:
硫的含氧酸及其盐应用广泛。HSO 中的一个羟基被卤原子取代得到卤磺酸
2 4(XSO H),加热时氟磺酸与硼酸(HBO)反应可制得BF 气体,氯磺酸与HO 反应可
3 3 3 3 2 2
制得过二硫酸(HSO),过二硫酸及其盐均为强氧化剂;硫代硫酸钠(NaSO)具有
2 2 8 2 2 3
还原性,常用作除氯剂,另外还可用作定影剂,将胶片上未感光的AgBr溶解生成
[Ag(S O)]3-。
2 3 2
5.下列说法正确的
A.酸性强弱:FSO H>ClSOH B.1 mol [Cu(HO) ]2+含8 mol σ键
3 3 2 4
C.HSO 中S元素的化合价为+7 D.[Ag(S O)]3-中Ag+提供孤电子对
2 2 8 2 3 2
6.下列化学反应表示不正确的是
A.电解精炼铜的阴极反应:Cu2++2e-=Cu
B.氟磺酸与HBO 反应制BF:3FSO H+HBO=BF↑+3HSO
3 3 3 3 3 3 3 2 4
C.水溶液中NaSO 氧化I-:SO+2I-=2SO+I
2 2 8 2 2
D.NaSO 除去水中Cl:SO+Cl+2HO=2SO+2Cl-+4H+
2 2 3 2 2 2 2
7.下列物质性质与用途有对应关系的是
A.CuSO 溶液呈蓝色,可用于泳池杀菌
4
B.HBO 溶液呈弱酸性,可用于处理溅在皮肤上的碱液
3 3
C.浓硫酸有脱水性,可用于气体的干燥
D.NaSO 有还原性,可用于胶片定影
2 2 3
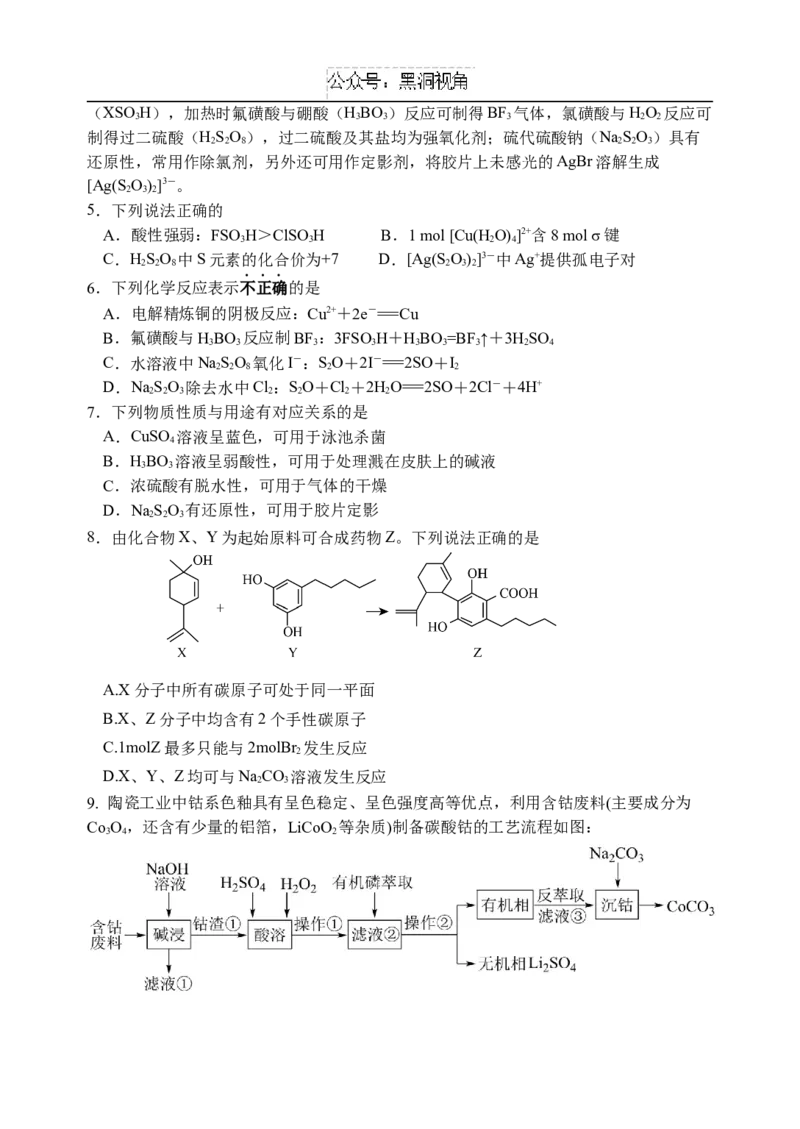
8.由化合物X、Y为起始原料可合成药物Z。下列说法正确的是
A.X分子中所有碳原子可处于同一平面
B.X、Z分子中均含有2个手性碳原子
C.1molZ最多只能与2molBr 发生反应
2
D.X、Y、Z均可与NaCO 溶液发生反应
2 3
9. 陶瓷工业中钴系色釉具有呈色稳定、呈色强度高等优点,利用含钴废料(主要成分为
Co O,还含有少量的铝箔,LiCoO 等杂质)制备碳酸钴的工艺流程如图:
3 4 2下列有关描述错误的是
A.“滤液①”主要成分是NaAlO
2
B.“操作①”、“操作②”的分离方法不同
C.“酸溶”反应中HO 可以换成O
2 2 2
D.“沉钴”时NaCO 的滴速过快或浓度太大将导致产品不纯,其原因是溶液碱性增
2 3
强会产生Co(OH) 杂质
2
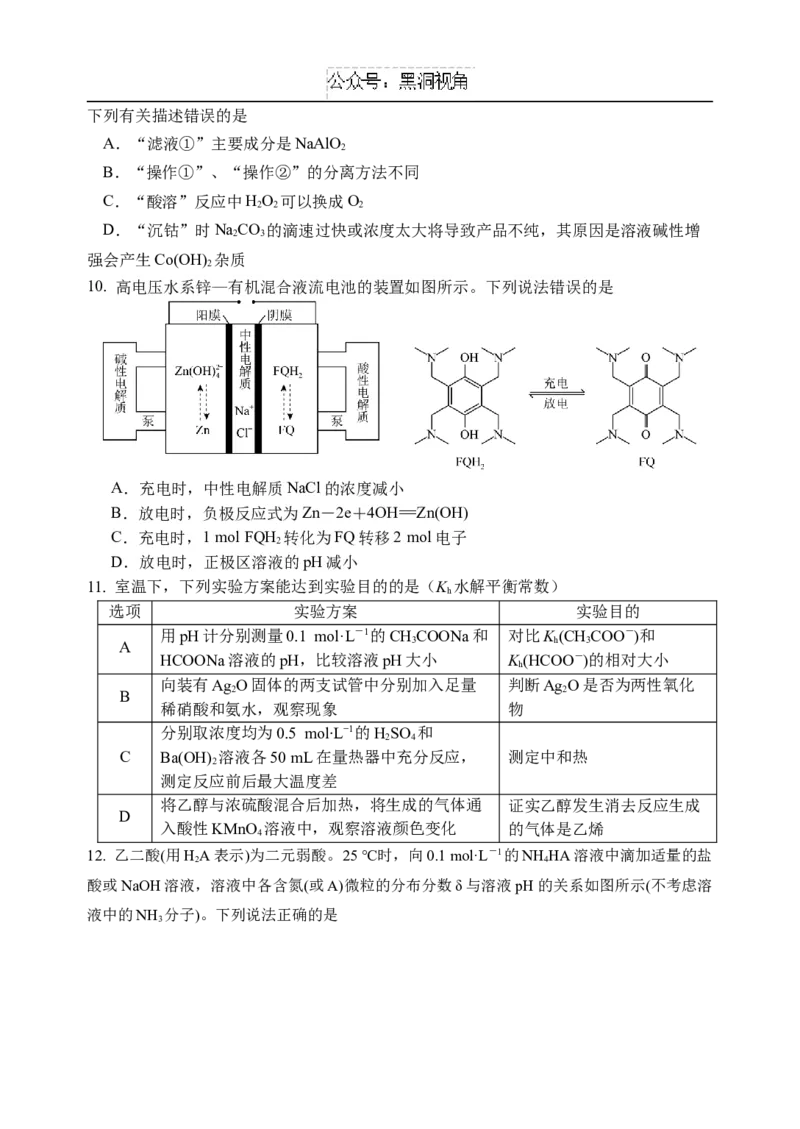
10. 高电压水系锌—有机混合液流电池的装置如图所示。下列说法错误的是
A.充电时,中性电解质NaCl的浓度减小
B.放电时,负极反应式为Zn-2e+4OH=Zn(OH)
C.充电时,1molFQH 转化为FQ转移2mol电子
2
D.放电时,正极区溶液的pH减小
11. 室温下,下列实验方案能达到实验目的的是(K 水解平衡常数)
h
选项 实验方案 实验目的
用pH计分别测量0.1 mol·L-1的CHCOONa和 对比K (CHCOO-)和
3 h 3
A
HCOONa溶液的pH,比较溶液pH大小 K (HCOO-)的相对大小
h
向装有Ag O固体的两支试管中分别加入足量 判断Ag O是否为两性氧化
B 2 2
稀硝酸和氨水,观察现象 物
分别取浓度均为0.5 mol∙L−1的HSO 和
2 4
C Ba(OH) 溶液各50 mL在量热器中充分反应, 测定中和热
2
测定反应前后最大温度差
将乙醇与浓硫酸混合后加热,将生成的气体通 证实乙醇发生消去反应生成
D
入酸性KMnO 溶液中,观察溶液颜色变化 的气体是乙烯
4
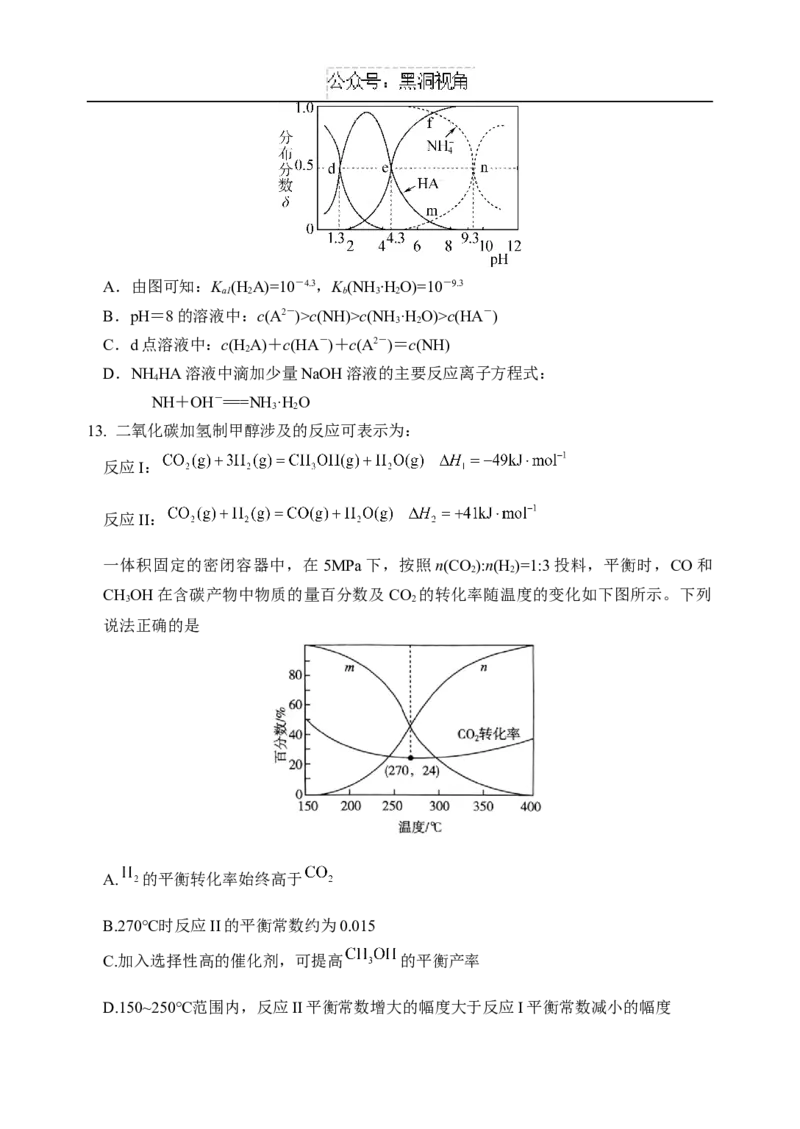
12. 乙二酸(用HA表示)为二元弱酸。25 ℃时,向0.1 mol·L-1的NHHA溶液中滴加适量的盐
2 4
酸或NaOH溶液,溶液中各含氮(或A)微粒的分布分数δ与溶液pH的关系如图所示(不考虑溶
液中的NH 分子)。下列说法正确的是
3A.由图可知:K (H A)=10-4.3,K (NH ∙HO)=10-9.3
a1 2 b 3 2
B.pH=8的溶液中:c(A2-)>c(NH)>c(NH ·H O)>c(HA-)
3 2
C.d点溶液中:c(H A)+c(HA-)+c(A2-)=c(NH)
2
D.NH HA溶液中滴加少量NaOH溶液的主要反应离子方程式:
4
NH+OH-===NH·H O
3 2
13. 二氧化碳加氢制甲醇涉及的反应可表示为:
反应I:
反应II:
一体积固定的密闭容器中,在 5MPa下,按照n(CO):n(H )=1:3投料,平衡时,CO和
2 2
CHOH在含碳产物中物质的量百分数及CO 的转化率随温度的变化如下图所示。下列
3 2
说法正确的是
A. 的平衡转化率始终高于
B.270℃时反应II的平衡常数约为0.015
C.加入选择性高的催化剂,可提高 的平衡产率
D.150~250℃范围内,反应II平衡常数增大的幅度大于反应I平衡常数减小的幅度Ⅱ卷(非选择题 共61分)
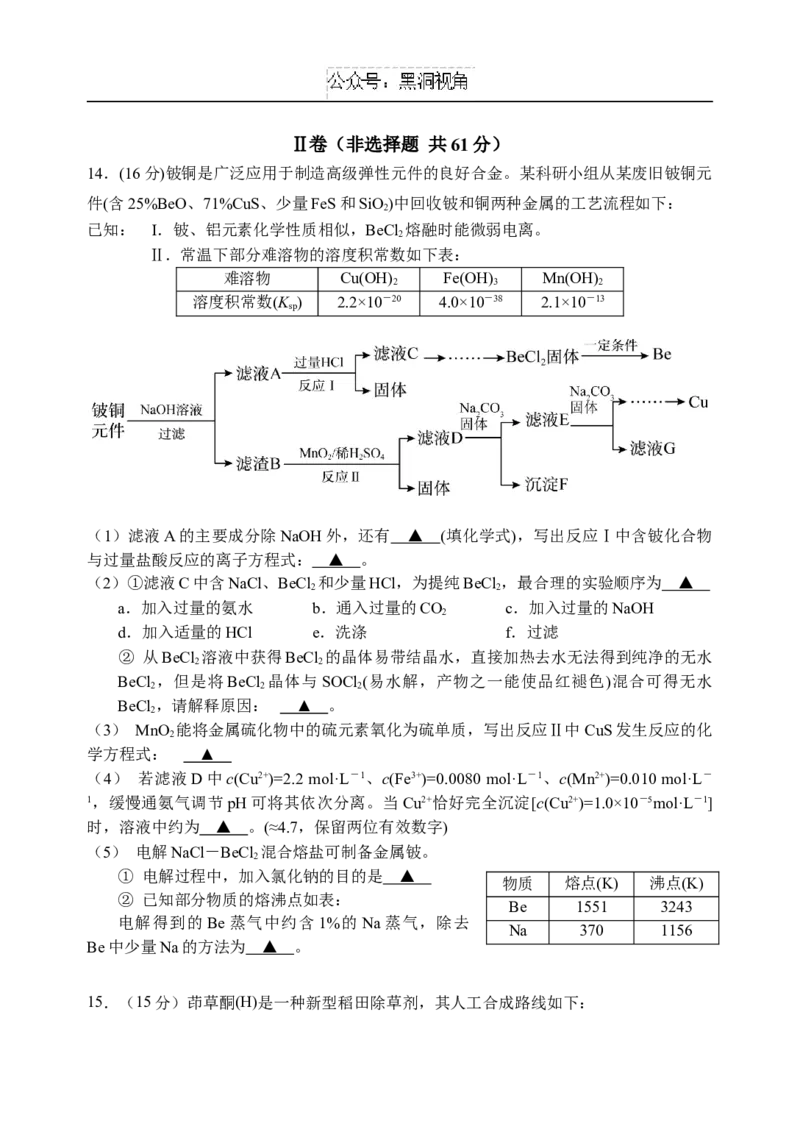
14.(16分)铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元
件(含25%BeO、71%CuS、少量FeS和SiO)中回收铍和铜两种金属的工艺流程如下:
2
已知: Ⅰ.铍、铝元素化学性质相似,BeCl 熔融时能微弱电离。
2
Ⅱ.常温下部分难溶物的溶度积常数如下表:
难溶物 Cu(OH) Fe(OH) Mn(OH)
2 3 2
溶度积常数(K ) 2.2×10-20 4.0×10-38 2.1×10-13
sp
(1)滤液A的主要成分除NaOH外,还有 ▲ (填化学式),写出反应Ⅰ中含铍化合物
与过量盐酸反应的离子方程式: ▲ 。
(2)①滤液C中含NaCl、BeCl 和少量HCl,为提纯BeCl ,最合理的实验顺序为 ▲
2 2
a.加入过量的氨水 b.通入过量的CO c.加入过量的NaOH
2
d.加入适量的HCl e.洗涤 f.过滤
② 从BeCl 溶液中获得BeCl 的晶体易带结晶水,直接加热去水无法得到纯净的无水
2 2
BeCl ,但是将BeCl 晶体与SOCl (易水解,产物之一能使品红褪色)混合可得无水
2 2 2
BeCl ,请解释原因: ▲ 。
2
(3) MnO 能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的化
2
学方程式: ▲
(4) 若滤液D中c(Cu2+)=2.2 mol·L-1、c(Fe3+)=0.0080 mol·L-1、c(Mn2+)=0.010 mol·L-
1,缓慢通氨气调节pH可将其依次分离。当Cu2+恰好完全沉淀[c(Cu2+)=1.0×10-5mol·L-1]
时,溶液中约为 ▲ 。(≈4.7,保留两位有效数字)
(5) 电解NaCl-BeCl 混合熔盐可制备金属铍。
2
① 电解过程中,加入氯化钠的目的是 ▲
物质 熔点(K) 沸点(K)
② 已知部分物质的熔沸点如表:
Be 1551 3243
电解得到的Be蒸气中约含1%的Na蒸气,除去
Na 370 1156
Be中少量Na的方法为 ▲ 。
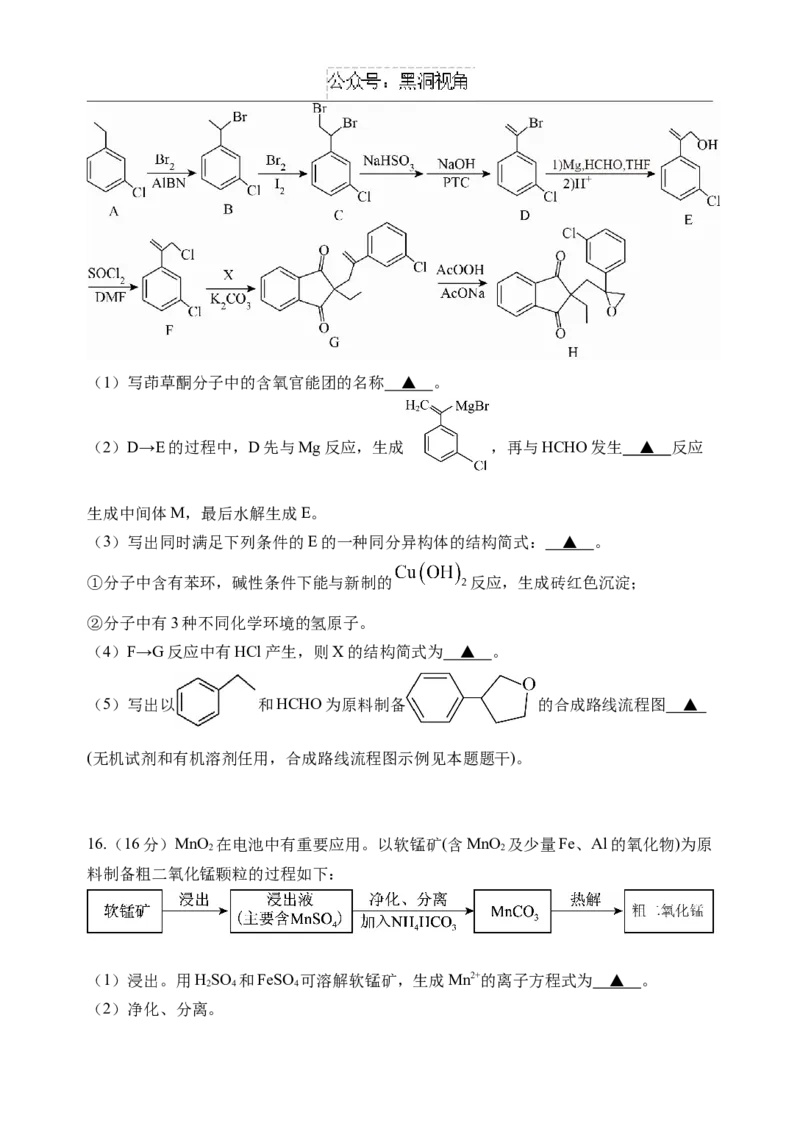
15.(15分)茚草酮(H)是一种新型稻田除草剂,其人工合成路线如下:(1)写茚草酮分子中的含氧官能团的名称 ▲ 。
(2)D→E的过程中,D先与Mg反应,生成 ,再与HCHO发生 ▲ 反应
生成中间体M,最后水解生成E。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式: ▲ 。
①分子中含有苯环,碱性条件下能与新制的 反应,生成砖红色沉淀;
②分子中有3种不同化学环境的氢原子。
(4)F→G反应中有HCl产生,则X的结构简式为 ▲ 。
(5)写出以 和HCHO为原料制备 的合成路线流程图 ▲
(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
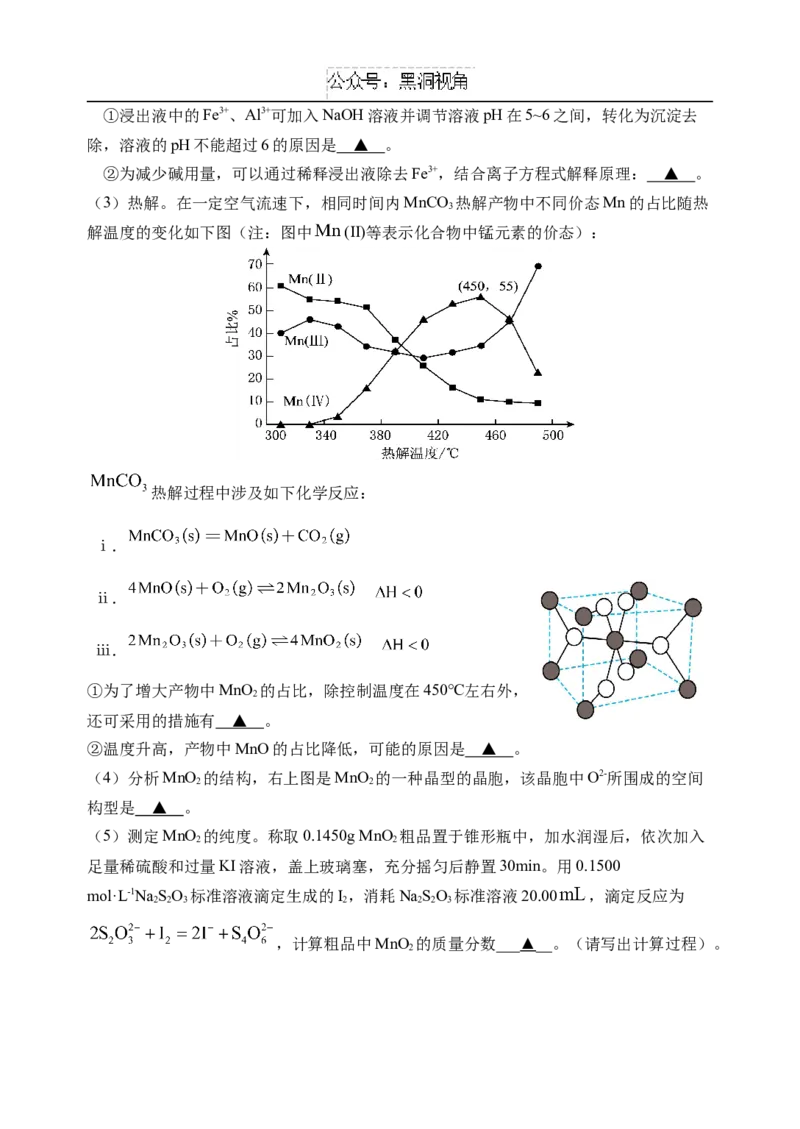
16.(16分)MnO 在电池中有重要应用。以软锰矿(含MnO 及少量Fe、Al的氧化物)为原
2 2
料制备粗二氧化锰颗粒的过程如下:
(1)浸出。用HSO 和FeSO 可溶解软锰矿,生成Mn2+的离子方程式为 ▲ 。
2 4 4
(2)净化、分离。①浸出液中的Fe3+、Al3+可加入NaOH溶液并调节溶液pH在5~6之间,转化为沉淀去
除,溶液的pH不能超过6的原因是 ▲ 。
②为减少碱用量,可以通过稀释浸出液除去Fe3+,结合离子方程式解释原理: ▲ 。
(3)热解。在一定空气流速下,相同时间内MnCO 热解产物中不同价态Mn的占比随热
3
解温度的变化如下图(注:图中 (Ⅱ)等表示化合物中锰元素的价态):
热解过程中涉及如下化学反应:
ⅰ.
ⅱ.
ⅲ.
①为了增大产物中MnO 的占比,除控制温度在450℃左右外,
2
还可采用的措施有 ▲ 。
②温度升高,产物中MnO的占比降低,可能的原因是 ▲ 。
(4)分析MnO 的结构,右上图是MnO 的一种晶型的晶胞,该晶胞中O2-所围成的空间
2 2
构型是 ▲ 。
(5)测定MnO 的纯度。称取0.1450g MnO 粗品置于锥形瓶中,加水润湿后,依次加入
2 2
足量稀硫酸和过量KI溶液,盖上玻璃塞,充分摇匀后静置30min。用0.1500
mol·L-1NaSO 标准溶液滴定生成的I,消耗NaSO 标准溶液20.00 ,滴定反应为
2 2 3 2 2 2 3
,计算粗品中MnO 的质量分数___▲__。(请写出计算过程)。
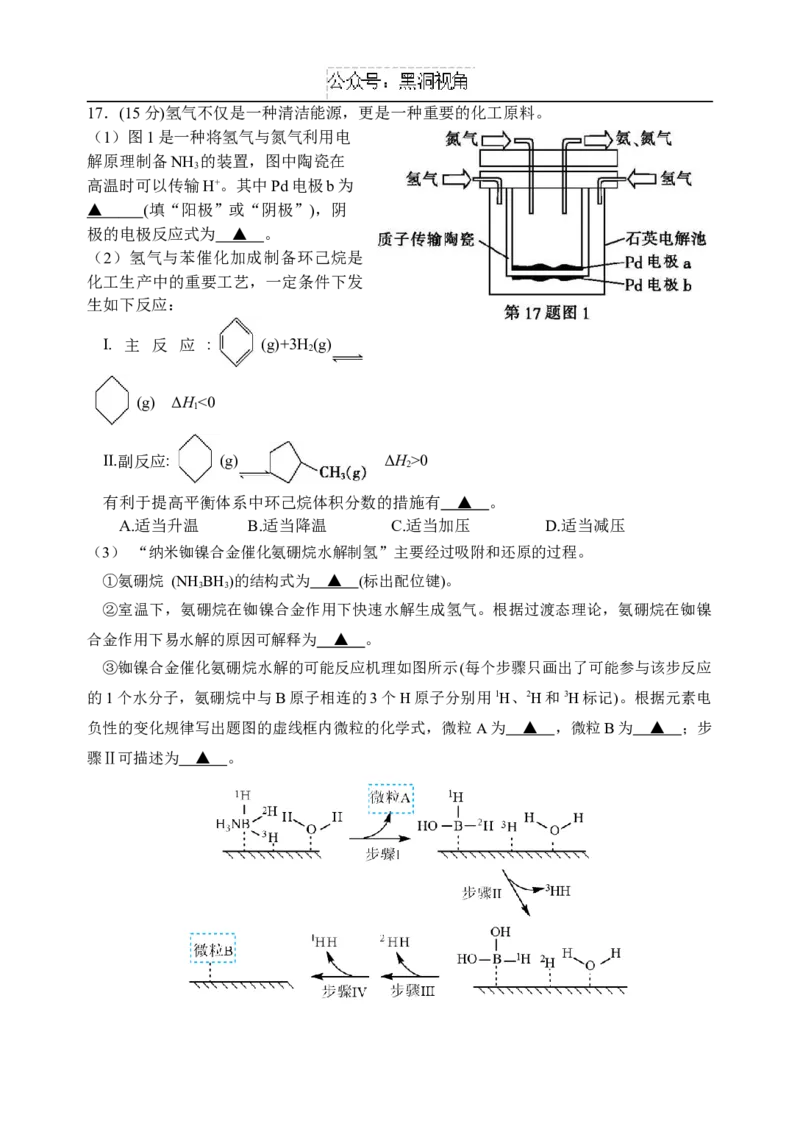
217.(15分)氢气不仅是一种清洁能源,更是一种重要的化工原料。
(1)图1是一种将氢气与氮气利用电
解原理制备NH 的装置,图中陶瓷在
3
高温时可以传输H+。其中Pd电极b为
▲ (填“阳极”或“阴极”),阴
极的电极反应式为 ▲ 。
(2)氢气与苯催化加成制备环己烷是
化工生产中的重要工艺,一定条件下发
生如下反应:
Ⅰ. 主 反 应 : (g)+3H(g)
2
(g) ΔH<0
1
Ⅱ.副反应: (g) ΔH>0
2
有利于提高平衡体系中环己烷体积分数的措施有 ▲ 。
A.适当升温 B.适当降温 C.适当加压 D.适当减压
(3) “纳米铷镍合金催化氨硼烷水解制氢”主要经过吸附和还原的过程。
①氨硼烷 (NHBH)的结构式为 ▲ (标出配位键)。
3 3
②室温下,氨硼烷在铷镍合金作用下快速水解生成氢气。根据过渡态理论,氨硼烷在铷镍
合金作用下易水解的原因可解释为 ▲ 。
③铷镍合金催化氨硼烷水解的可能反应机理如图所示(每个步骤只画出了可能参与该步反应
的1个水分子,氨硼烷中与B原子相连的3个H原子分别用1H、2H和3H标记)。根据元素电
负性的变化规律写出题图的虚线框内微粒的化学式,微粒 A为 ▲ ,微粒B为 ▲ ;步
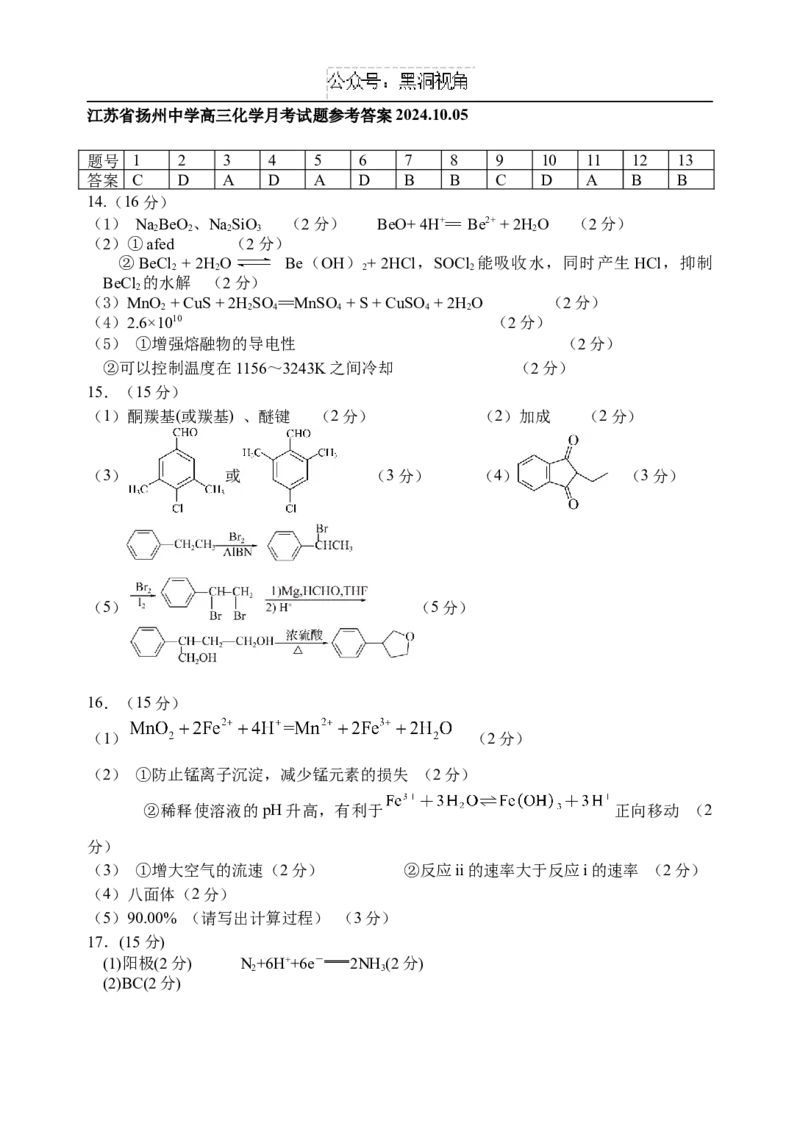
骤Ⅱ可描述为 ▲ 。江苏省扬州中学高三化学月考试题参考答案2024.10.05
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案 C D A D A D B B C D A B B
14.(16分)
(1) NaBeO、NaSiO (2分) BeO+ 4H+== Be2+ + 2H O (2分)
2 2 2 3 2
(2)①afed (2分)
②BeCl + 2H O Be(OH) + 2HCl,SOCl 能吸收水,同时产生HCl,抑制
2 2 2 2
BeCl 的水解 (2分)
2
(3)MnO + CuS + 2H SO ==MnSO + S + CuSO + 2H O (2分)
2 2 4 4 4 2
(4)2.6×1010 (2分)
(5) ①增强熔融物的导电性 (2分)
②可以控制温度在1156~3243K之间冷却 (2分)
15.(15分)
(1)酮羰基(或羰基) 、醚键 (2分) (2)加成 (2分)
(3) 或 (3分) (4) (3分)
(5) (5分)
16.(15分)
(1) (2分)
(2) ①防止锰离子沉淀,减少锰元素的损失 (2分)
②稀释使溶液的pH升高,有利于 正向移动 (2
分)
(3) ①增大空气的流速(2分) ②反应ii的速率大于反应i的速率 (2分)
(4)八面体(2分)
(5)90.00% (请写出计算过程) (3分)
17.(15分)
(1)阳极(2分) N+6H++6e- 2NH (2分)
2 3
(2)BC(2分)(3)① (2分)
② 铷镍合金催化剂改变了氨硼烷的反应历程,降低了反应的活化能(2分)
③ (1分) (1分)
带负电的3H与水分子中带正电的H结合生成3HH离开催化剂表面(1分),水分子
中带负电的-OH与带正电的B原子结合(1分),带负电的2H被吸附在催化剂表面。(1
分)(共3分)