文档内容
………………
○
………………
内
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
………………
○
………………
外
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
…
学
校
:
______________
姓
名
:
_____________
班
级
:
_______________
考
号
:
______________________
2023 年高考考前押题密卷(全国甲卷)
化 学
(考试时间:50分钟 试卷满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号等填写在答题卡和试卷指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用
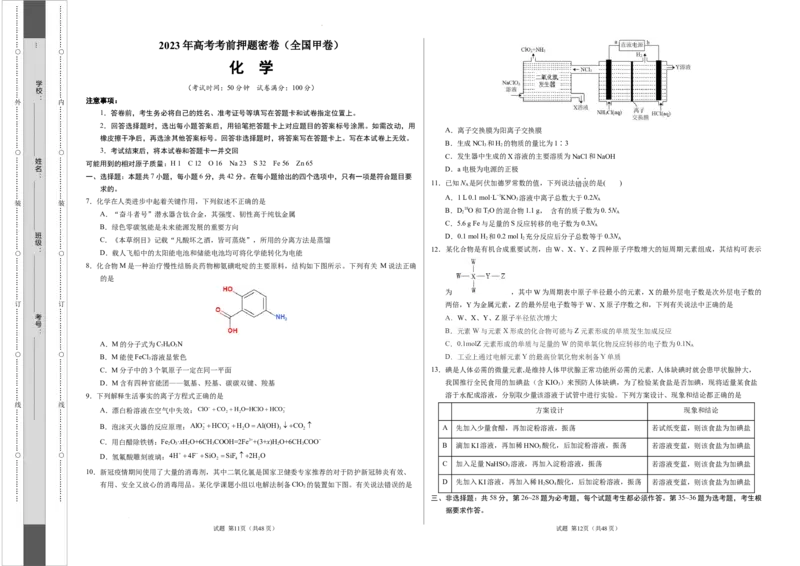
A.离子交换膜为阳离子交换膜
橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
B.生成NCl 和H 的物质的量比为1∶3
3 2
3.考试结束后,将本试卷和答题卡一并交回
C.发生器中生成的X溶液的主要溶质为NaCl和NaOH
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Fe 56 Zn 65
D.a电极为电源的正极
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要
11.已知N 是阿伏加德罗常数的值,下列说法错误的是( ) A
求的。
A.1 L 0.1 mol·L−1KNO 溶液中离子总数大于0.2N
7.化学在人类进步中起着关键作用,下列叙述不正确的是 3 A
B.D18O和TO的混合物1.1 g, 含有的质子数为0. 5N
A.“奋斗者号”潜水器含钛合金,其强度、韧性高于纯钛金属 2 2 A
C.5.6 g Fe与足量的S反应转移的电子数为0.3N
B.绿色零碳氢能是未来能源发展的重要方向 A
D.0.1 mol H 和0.2 mol I 充分反应后分子总数等于0.3N
C.《本草纲目》记载“凡酸坏之酒,皆可蒸烧”,所用的分离方法是蒸馏 2 2 A
12.某化合物是有机合成重要试剂,由W、X、Y、Z四种原子序数增大的短周期元素组成,其结构可表示
D.载人飞船中的太阳能电池和储能电池均可将化学能转化为电能
8.化合物M是一种治疗慢性结肠炎药物柳氨磺吡啶的主要原料,结构如下图所示。下列有关 M说法正确
的是
为 ,其中W为周期表中原子半径最小的元素,X的最外层电子数是次外层电子数的
两倍,Y为金属元素,Z的最外层电子数等于W、X原子序数之和,下列有关说法中正确的是
A.W、X、Y、Z原子半径依次增大
B.元素W与元素X形成的化合物可能与Z元素形成的单质发生加成反应
A.M的分子式为C HON C.0.1molZ元素形成的单质与足量的W的简单氧化物反应转移的电子数为0.1N
7 6 3 A
B.M能使FeCl 溶液显紫色 D.工业上通过电解元素Y的最高价氧化物来制备Y单质
3
C.M分子中的3个氧原子一定在同一平面 13.碘是人体必需的微量元素,是维持人体甲状腺正常功能所必需的元素, 人体缺碘时就会患甲状腺肿大,
D.M含有四种官能团——氨基、羟基、碳碳双键、羧基 我国推行全民食用的加碘盐(含KIO )来预防人体缺碘,为了检验某食盐是否加碘,现将适量某食盐
3
9.下列解释生活事实的离子方程式正确的是 溶于水配成溶液,分别取少量该溶液于试管中进行实验。下列方案设计、现象和结论都正确的是
A.漂白粉溶液在空气中失效:ClOCO H O=HClOHCO 方案设计 现象和结论
2 2 3
B.泡沫灭火器的反应原理:AlOHCOH OAl(OH) CO
A 先加入少量食醋,再加淀粉溶液,振荡 若试纸变蓝,则该食盐为加碘盐
2 3 2 3 2
C.用白醋除铁锈:Fe O·xHO+6CHCOOH=2Fe3++(3+x)H O+6CHCOO−
2 3 2 3 2 3 B 滴加KI溶液,再加稀HNO 酸化,后加淀粉溶液,振荡 若溶液变蓝,则该食盐为加碘盐
3
D.氢氟酸雕刻玻璃:4H 4FSiO SiF 2H O
2 4 2
C 加入足量NaHSO 溶液,再加入淀粉溶液,振荡 若溶液变蓝,则该食盐为加碘盐
3
10.新冠疫情期间使用了大量的消毒剂,其中二氧化氯是国家卫健委专家推荐的对于防护新冠肺炎有效、
D 先加入KI溶液,再加入稀HSO 酸化,后加淀粉溶液,振荡 若溶液变蓝,则该食盐为加碘盐
有用、安全又放心的消毒用品。某化学课题小组以电解法制备ClO 的装置如下图。有关说法错误的是 2 4
2
三、非选择题:共58分,第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根
据要求作答。
试题 第11页(共48页) 试题 第12页(共48页)
学科网(北京)股份有限公司………………
○
………………
外
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
………………
○
………………
内
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
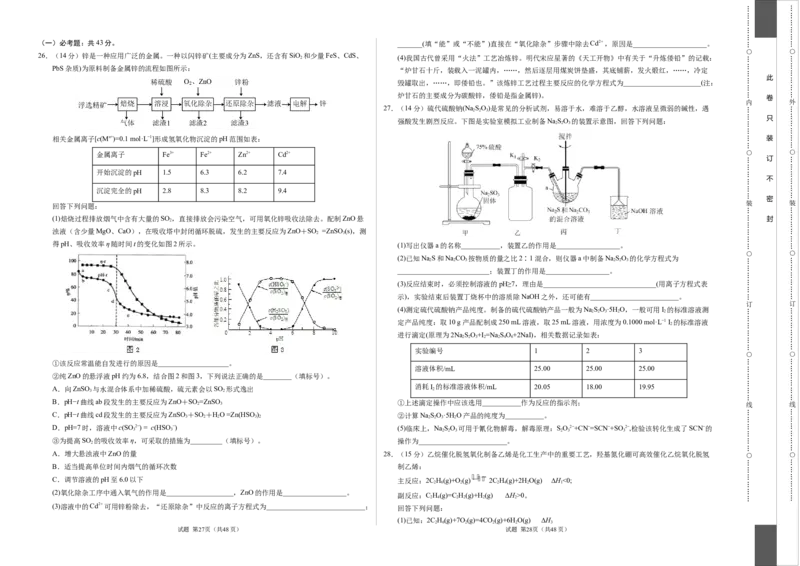
(一)必考题:共43分。 _______(填“能”或“不能”)直接在“氧化除杂”步骤中除去Cd2,原因是_____________________。
26.(14分)锌是一种应用广泛的金属。一种以闪锌矿(主要成分为ZnS,还含有SiO 和少量FeS、CdS、
2 (4)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:
PbS杂质)为原料制备金属锌的流程如图所示: “炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷定
此
毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为______________________(注:
炉甘石的主要成分为碳酸锌,倭铅是指金属锌)。
卷
27.(14分)硫代硫酸钠(Na SO)是常见的分析试剂,易溶于水,难溶于乙醇,水溶液呈微弱的碱性,遇 2 2 3
只
强酸发生剧烈反应。下图是实验室模拟工业制备NaSO 的装置示意图,回答下列问题:
2 2 3
相关金属离子[c(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如表: 装
金属离子 Fe3+ Fe2+ Zn2+ Cd2+
订
开始沉淀的pH 1.5 6.3 6.2 7.4
不
沉淀完全的pH 2.8 8.3 8.2 9.4
密
回答下列问题:
(1)焙烧过程排放烟气中含有大量的SO 2 ,直接排放会污染空气,可用氧化锌吸收法除去。配制ZnO悬 封
浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO+SO =ZnSO (s),测
2 3
得pH、吸收效率η随时间t的变化如图2所示。 (1)写出仪器a的名称___________,装置乙的作用是__________________。
(2)已知NaS和NaCO 按物质的量之比2∶1混合,则仪器a中制备NaSO 的化学方程式为
2 2 3 2 2 3
__________________________;装置丁的作用是__________________。
(3)反应结束时,必须控制溶液的pH≥7,理由是________________________________(用离子方程式表
示),实验结束后装置丁烧杯中的溶质除NaOH之外,还可能有_________________________。
(4)测定硫代硫酸钠产品纯度。制备的硫代硫酸钠产品一般为NaSO·5H O,一般可用I 的标准溶液测 2 2 3 2 2
定产品纯度:取10 g产品配制成250 mL溶液,取25 mL溶液,用浓度为0.1000 mol·L−1 I 的标准溶液
2
进行滴定(原理为2NaSO+I =Na SO+2NaI),相关数据记录如表:
2 2 3 2 2 4 6
实验编号 1 2 3
①该反应常温能自发进行的原因是____________________。
溶液体积/mL 25.00 25.00 25.00
②纯ZnO的悬浮液pH约为6.8,结合图2和图3,下列说法正确的是________(填标号)。
A.向ZnSO 3 与水混合体系中加稀硫酸,硫元素会以SO 2 形式逸出
消耗I
2
的标准溶液体积/mL 20.05 18.00 19.95
B.pH−t曲线ab段发生的主要反应为ZnO+SO =ZnSO ①上述滴定操作中应该选用___________作为反应的指示剂; 2 3
C.pH−t曲线cd段发生的主要反应为ZnSO+SO +HO =Zn(HSO ) ②计算NaSO·5H O产品的纯度为___________。
3 2 2 3 2 2 2 3 2
D.pH=7时,溶液中c(SO 2−) = c(HSO −) (5)临床上,NaSO 可用于氰化物解毒,解毒原理:SO2−+CN−=SCN−+SO2−,检验该转化生成了SCN−的
3 3 2 2 3 2 3 3
③为提高SO 的吸收效率η,可采取的措施为_________(填标号)。 操作为_________________________。
2
A.增大悬浊液中ZnO的量 28.(15分)乙烷催化脱氢氧化制备乙烯是化工生产中的重要工艺,羟基氮化硼可高效催化乙烷氧化脱氢
B.适当提高单位时间内烟气的循环次数 制乙烯:
C.调节溶液的pH至6.0以下 主反应:2C H(g)+O(g) 2C H(g)+2HO(g) ∆H<0;
2 6 2 2 4 2 1
(2)氧化除杂工序中通入氧气的作用是___________________,ZnO的作用是__________________。
副反应:C H(g)=C H(g)+H(g) ∆H>0。
2 4 2 2 2 2
(3)溶液中的Cd2可用锌粉除去,“还原除杂”中反应的离子方程式为____________________________;
回答下列问题:
(1)已知:2C H(g)+7O(g)=4CO (g)+6HO(g) ∆H
2 6 2 2 2 3
试题 第27页(共48页) 试题 第28页(共48页)………………
○
………………
内
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
………………
○
………………
外
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
…
学
校
:
______________
姓
名
:
_____________
班
级
:
_______________
考
号
:
______________________
C H(g)+3O(g)=2CO (g)+2HO(g) ∆H
2 4 2 2 2 4
则∆H=______________(用∆H、∆H 表示)。
1 3 4
(2)有利于提高平衡体系中乙烯体积分数的措施有_______(填标号)。
A.适当升温 B.适当降温 C.适当加压 D.适当减压
(3)主反应在管式反应器中进行,实际投料往往在n(C H)∶n(O )的基础上适当增大O 用量,其目的是
2 6 2 2
__________________________________________。
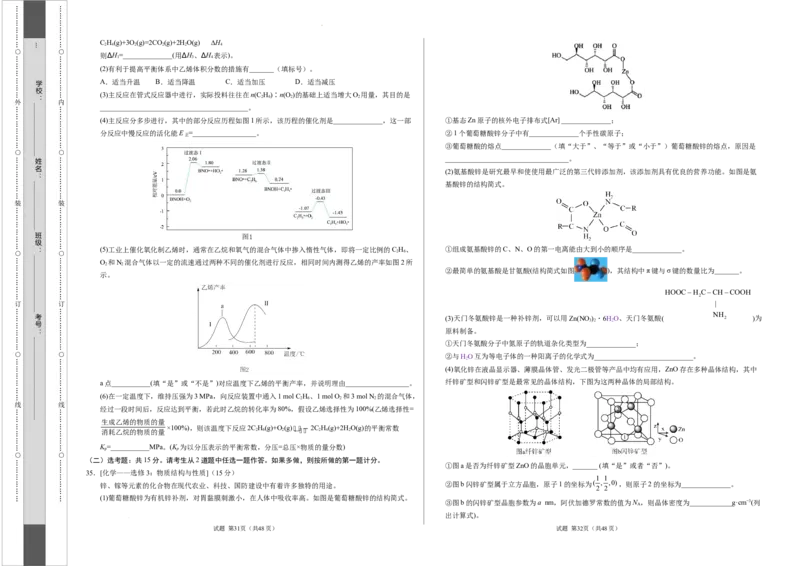
(4)主反应分多步进行,其中的部分反应历程如图1所示,该历程的催化剂是______________,这一部 ①基态Zn原子的核外电子排布式[Ar] ______________;
分反应中慢反应的活化能E =__________________。 ②1个葡萄糖酸锌分子中有______________个手性碳原子;
正
③葡萄糖酸的熔点______________(填“大于”、“等于”或“小于”)葡萄糖酸锌的熔点,原因是
___________________________________。
(2)氨基酸锌是研究最早和使使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图是氨
基酸锌的结构简式。
(5)工业上催化氧化制乙烯时,通常在乙烷和氧气的混合气体中掺入惰性气体,即将一定比例的C H、 ①组成氨基酸锌的C、N、O的第一电离能由大到小的顺序是______________。
2 6
O 和N 混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如图2所
2 2
②最简单的氨基酸是甘氨酸(结构简式如图 ),其结构中π键与σ键的数量比为_______。
示。
HOOCH CCHCOOH
2
|
NH
(3)天门冬氨酸锌是一种补锌剂,可以用Zn(NO ) ・6HO、天门冬氨酸( 2 )为
3 2 2
原料制备。
①天门冬氨酸分子中氮原子的轨道杂化类型为______________;
②与HO互为等电子体的一种阳离子的化学式为____________________________。
2
(4)氧化锌在液晶显示器、薄膜晶体管、发光二极管等产品中均有应用,ZnO存在多种晶体结构,其中
a点___________(填“是”或“不是”)对应温度下乙烯的平衡产率,并说明理由__________________。 纤锌矿型和闪锌矿型是最常见的晶体结构,下图为这两种晶体的局部结构。
(6)在一定温度下,维持压强为3 MPa,向反应装置中通入1 mol C H、1 mol O 和3 mol N 的混合气体,
2 6 2 2
经过一段时间后,反应达到平衡,若此时乙烷的转化率为80%,假设乙烯选择性为100%(乙烯选择性=
生成乙烯的物质的量
消耗乙烷的物质的量 ×100%),则该温度下反应2C 2 H 6 (g)+O 2 (g) 2C 2 H 4 (g)+2H 2 O(g)的平衡常数
K =___________MPa。(K 为以分压表示的平衡常数,分压=总压×物质的量分数)
p p
(二)选考题:共15分。请考生从2道题中任选一题作答。如果多做,则按所做的第一题计分。
①图a是否为纤锌矿型ZnO的晶胞单元,_______ (填“是”或者“否”)。
35.[化学——选修3:物质结构与性质](15分)
1 1
锌、镓等元素的化合物在现代农业、科技、国防建设中有着许多独特的用途。
②图b闪锌矿型属于立方晶胞,原子1的坐标为( , ,0),则原子2的坐标为______________。
2 2
(1)葡萄糖酸锌为有机锌补剂,对胃黏膜刺激小,在人体中吸收率高。如图是葡萄糖酸锌的结构简式。
③图b的闪锌矿型晶胞参数为a nm,阿伏加德罗常数的值为N ,则晶体密度为____________g·cm−3(列
A
出计算式)。
试题 第31页(共48页) 试题 第32页(共48页)
学科网(北京)股份有限公司………………
○
………………
外
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
………………
○
………………
内
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
36.[化学——选修5:有机化学基础](15分)
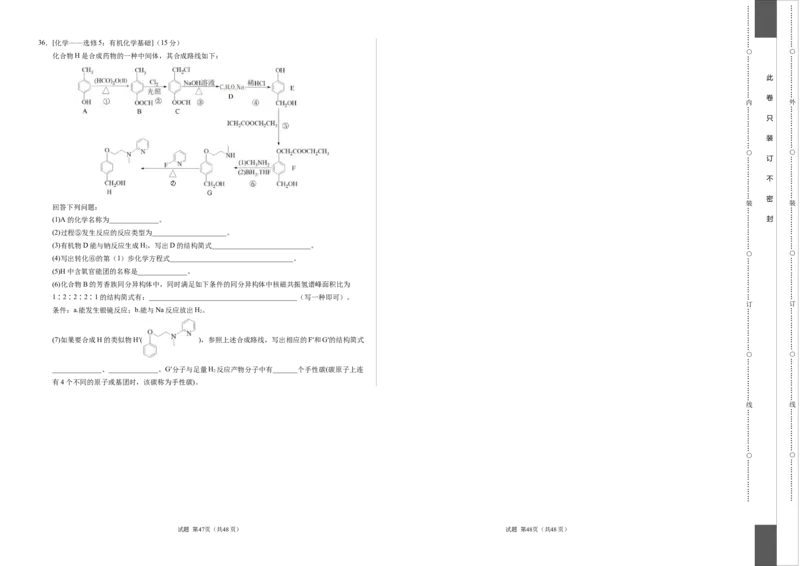
化合物H是合成药物的一种中间体,其合成路线如下:
此
卷
只
装
订
不
密
回答下列问题:
(1)A的化学名称为______________。 封
(2)过程⑤发生反应的反应类型为_____________________。
(3)有机物D能与钠反应生成H,写出D的结构简式____________________________。
2
(4)写出转化⑥的第(1)步化学方程式___________________________________。
(5)H中含氧官能团的名称是______________。
(6)化合物B的芳香族同分异构体中,同时满足如下条件的同分异构体中核磁共振氢谱峰面积比为
1∶2∶2∶2∶1的结构简式有:__________________________________________(写一种即可)。
条件:a.能发生银镜反应;b.能与Na反应放出H。 2
(7)如果要合成H的类似物H′( ),参照上述合成路线,写出相应的F′和G′的结构简式
______________、______________。G′分子与足量H 反应产物分子中有_______个手性碳(碳原子上连
2
有4个不同的原子或基团时,该碳称为手性碳)。
试题 第47页(共48页) 试题 第48页(共48页)………………
○
………………
内
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
…
………………
学
校
:
______________
姓
名
:
_____________
班
级
:
_______________
考
号
:
______________________
试题 第51页(共48页) 试题 第52页(共48页)
学科网(北京)股份有限公司