文档内容
绝密★使用前
东北育才学校科学高中部 2023-2024 学年度高考适应性测试(一)
高 三 化 学
考生注意:
1.本试卷共100分,考试时间75分钟。共三大题,20小题,共6页
2.请将各题答案填写在答题卡上。
3.本试卷主要考试内容:高考全部内容
一、选择题(本题共12小题,每小题3分,共36分.在每小题给出的四个选项中,只有一项是符合题目要
求的)
1.已知拆开1mol H–H键, 1mol N≡N键分别需要吸收的能量为436kJ 、946kJ;形成1mol N–H键,会放出能量
391kJ,在反应N + 3H 2NH 中,每生成2mol NH ,
2 2 3 3
A.放出92 kJ热量 B.吸收92 kJ热量
C.放出209kJ热量 D.吸收209kJ热量
2.下列关于ΔH的说法正确的是
A.反应过程中,消耗的反应物越多,ΔH越大
B.ΔH>0,吸热反应;ΔH<0,放热反应
C.ΔH越大,说明反应放出的热量越多
D.能量变化如图所示的化学反应为吸热反应,ΔH符号为“+”
3.欲配制100 mL 1.0 mol·L-1硫酸钠溶液,不正确的方法是
A.将14.2 g 硫酸钠溶于100 mL水中
B.将32.2 g Na SO ·10H O溶于少量水中,再加水稀释至100 mL
2 4 2
C.将20 mL 5.0 mol·L-1硫酸钠溶液用水稀释至100 mL
D.将14.2 g 硫酸钠溶于水中得到100 mL溶液
4.下列化学用语描述不正确的是
A.中子数为18 的Cl 原子: Cl B. 的结构示意图:
C. 的电子式: D.HO的结构式:
2
5.已知:H (g)+F (g) =2HF(g) △H=- 270 kJ /mol,下列说法正确的是
2 2
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B.1 mol 氢气与1 mol 氟气反应生成2mol 液态氟化氢放出的热量小于270kJ
C.在相同条件下,2 mol 氟化氢气体的总能量大于1 mol 氢气与1 mol 氟气的总能量
高三化学 第 1 页
学科网(北京)股份有限公司D.2 mol氟化氢气体分解成1mol的氢气积1mol的氟气吸收270kJ热量
6.下列离子不会对水体造成污染的是
A.Cl- B.Cr3+ C.Hg2+ D.Pb2+
7.BF 是非极性分子,下列有关说法错误的是
3
A.B-F键是极性键 B.空间结构为三角锥型
C.键角均为120° D.所有原子共平面
8.下列各组离子一定能大量共存的是
A.在酸性溶液中: 、 、 、
B.在含大量 的溶液中: 、 、 、
C.在 的溶液中: 、 、 、
D.与铝反应能产生大量氢气的溶液中: 、 、 、
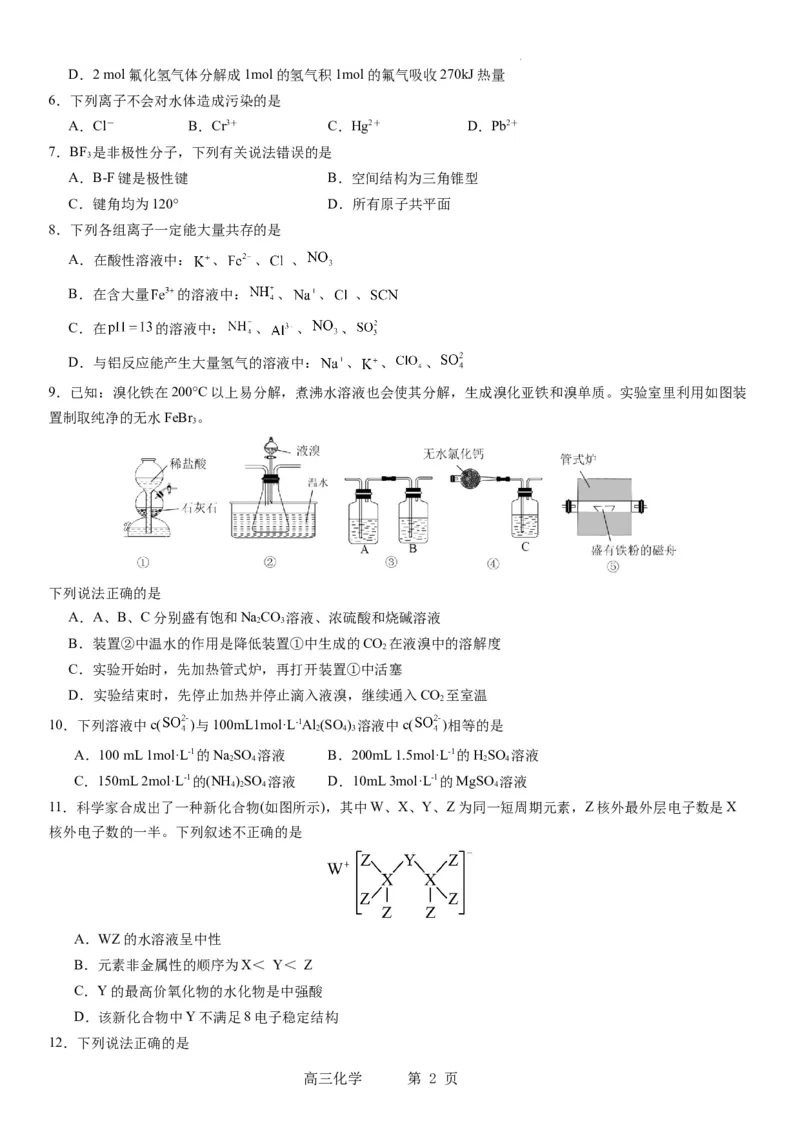
9.已知:溴化铁在200°C以上易分解,煮沸水溶液也会使其分解,生成溴化亚铁和溴单质。实验室里利用如图装
置制取纯净的无水FeBr 。
3
下列说法正确的是
A.A、B、C分别盛有饱和NaCO 溶液、浓硫酸和烧碱溶液
2 3
B.装置②中温水的作用是降低装置①中生成的CO 在液溴中的溶解度
2
C.实验开始时,先加热管式炉,再打开装置①中活塞
D.实验结束时,先停止加热并停止滴入液溴,继续通入CO 至室温
2
10.下列溶液中c( )与100mL1mol·L-1Al (SO ) 溶液中c( )相等的是
2 4 3
A.100 mL 1mol·L-1的NaSO 溶液 B.200mL 1.5mol·L-1的HSO 溶液
2 4 2 4
C.150mL 2mol·L-1的(NH )SO 溶液 D.10mL 3mol·L-1的MgSO 溶液
4 2 4 4
11.科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X
核外电子数的一半。下列叙述不正确的是
A.WZ的水溶液呈中性
B.元素非金属性的顺序为X< Y< Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
12.下列说法正确的是
高三化学 第 2 页
学科网(北京)股份有限公司A.明矾和漂白粉常用于水处理,两者的作用原理相同
B.利用潮汐发电是将化学能转化为电能
C.铝合金的大量使用是因为人们能用焦炭等还原剂从氧化铝中获取铝
D.2009年12月中旬在哥本哈根召开的国际气候会议受到全球政要的广泛关注,减少工业生产大量排放二氧
化碳等温室气体以抑制全球气候变暖成为该会议的主题
二、多选题(本题共3小题,每小题4分,共12分)
13.科学家开发了一种二氧化碳淡化海水技术,其循环如图所示。已知:常温下, 的电离常数的数量级为
; 的电离常数 , 。下列叙述错误的是
A.可采用过滤操作分离出
B.经上述多种循环获得的水的导电性增强
C.操作时先通入 ,再加入
D. 水溶液呈弱碱性
14.下列物质的性质与应用不对应的是
A. 具有氧化性,可用于漂白品红、织物等
B. 溶液能与Cu反应,可用于刻蚀印刷电路板
C. 的密度比空气的小,液氨可用作制冷剂
D. 能分别与 、 反应产生 ,可用作呼吸面具中的供氧剂
15.如下为氟利昂(如 )破坏臭氧层的反应过程示意图,下列说法正确的是
A.氟利昂 有两种同分异构体
B.过程Ⅱ可表示为
C.过程Ⅲ中 键断裂是放热过程, 形成是吸热过程
D.上述过程说明氟利昂中氯原子是破坏 的催化剂
高三化学 第 3 页
学科网(北京)股份有限公司三、填空题(共52分)
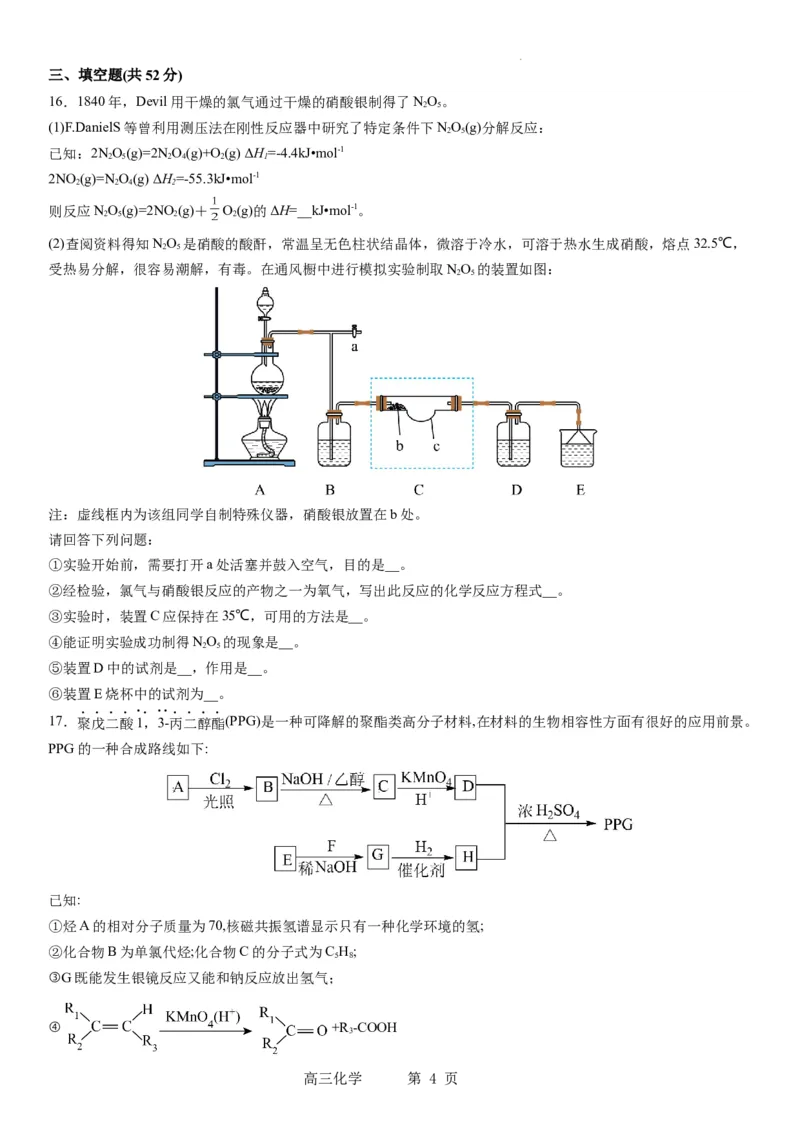
16.1840年,Devil用干燥的氯气通过干燥的硝酸银制得了NO。
2 5
(1)F.DanielS等曾利用测压法在刚性反应器中研究了特定条件下NO(g)分解反应:
2 5
已知:2NO(g)=2NO(g)+O(g) ΔH=-4.4kJ•mol-1
2 5 2 4 2 1
2NO (g)=NO(g) ΔH=-55.3kJ•mol-1
2 2 4 2
则反应NO(g)=2NO (g)+ O(g)的ΔH=__kJ•mol-1。
2 5 2 2
(2)查阅资料得知NO 是硝酸的酸酐,常温呈无色柱状结晶体,微溶于冷水,可溶于热水生成硝酸,熔点32.5℃,
2 5
受热易分解,很容易潮解,有毒。在通风橱中进行模拟实验制取NO 的装置如图:
2 5
注:虚线框内为该组同学自制特殊仪器,硝酸银放置在b处。
请回答下列问题:
①实验开始前,需要打开a处活塞并鼓入空气,目的是__。
②经检验,氯气与硝酸银反应的产物之一为氧气,写出此反应的化学反应方程式__。
③实验时,装置C应保持在35℃,可用的方法是__。
④能证明实验成功制得NO 的现象是__。
2 5
⑤装置D中的试剂是__,作用是__。
⑥装置E烧杯中的试剂为__。
17.聚戊二酸1,3-丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景。
PPG的一种合成路线如下:
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃;化合物C的分子式为C H;
5 8
③G既能发生银镜反应又能和钠反应放出氢气;
④ +R -COOH
3
高三化学 第 4 页
学科网(北京)股份有限公司回答下列问题:
(1)A的结构简式为_______________________。
(2)由B生成C的化学方程式为_______________________________。
(3)G的化学名称为________________________。
(4)由D和H生成PPG的化学方程式为___________________________。
(5)D的同分异构体中能同时满足下列条件的共有____种(不含立体异构);其中核磁共振氢谱显示为3组峰,且峰面积
比为6∶1∶1的是__(写结构简式)。
①能与饱和NaHCO 溶液反应产生气体
3
②既能发生银镜反应,又能发生水解反应
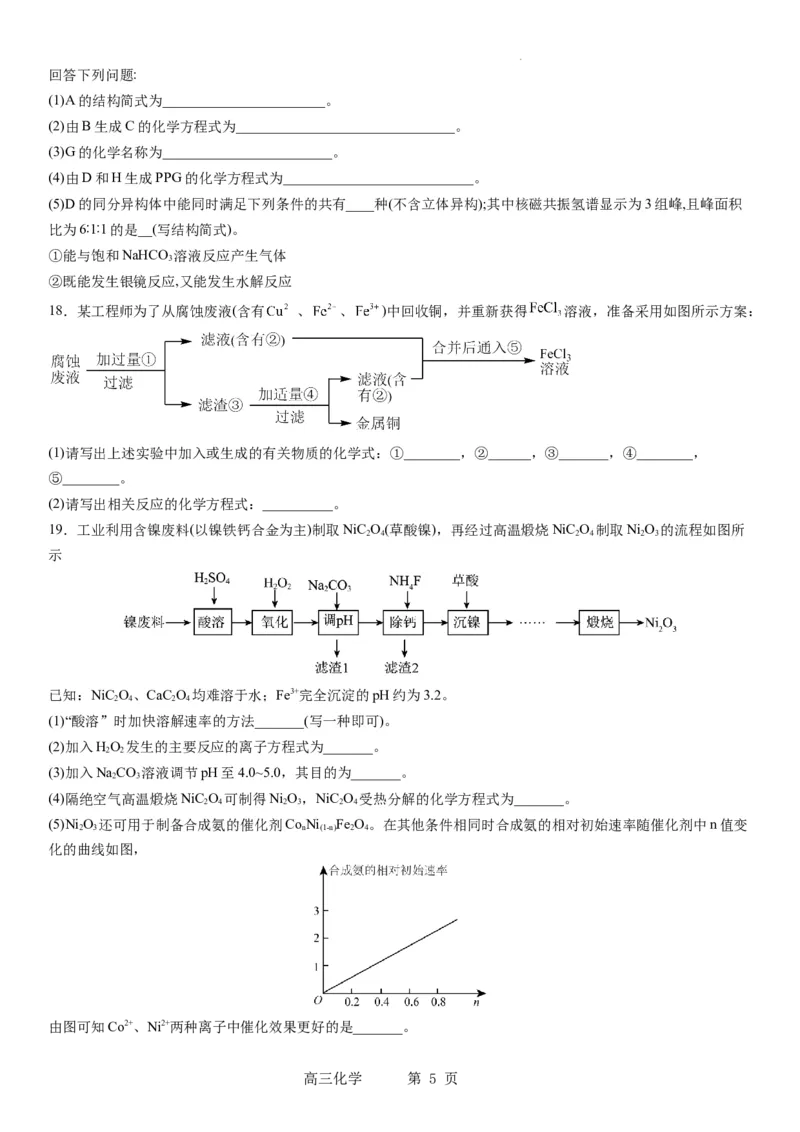
18.某工程师为了从腐蚀废液(含有 、 、 )中回收铜,并重新获得 溶液,准备采用如图所示方案:
(1)请写出上述实验中加入或生成的有关物质的化学式:①________,②______,③_______,④________,
⑤________。
(2)请写出相关反应的化学方程式:__________。
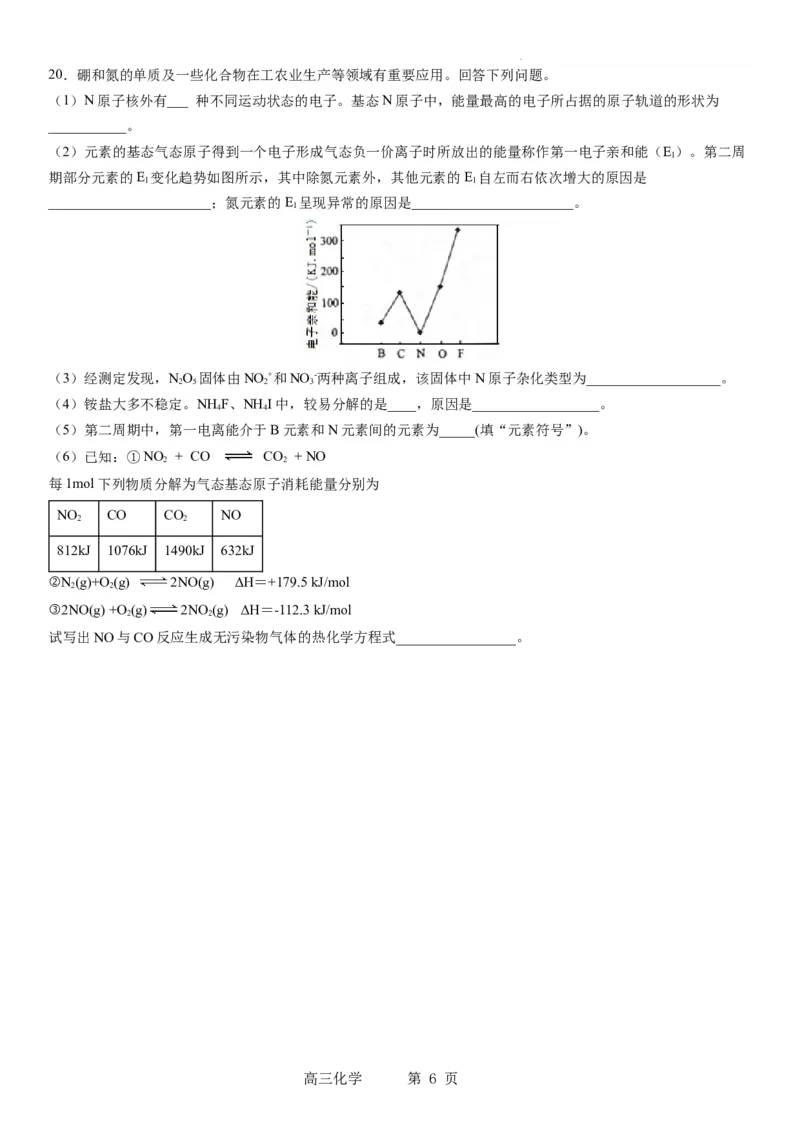
19.工业利用含镍废料(以镍铁钙合金为主)制取NiC O(草酸镍),再经过高温煅烧NiC O 制取Ni O 的流程如图所
2 4 2 4 2 3
示
已知:NiC O、CaC O 均难溶于水;Fe3+完全沉淀的pH约为3.2。
2 4 2 4
(1)“酸溶”时加快溶解速率的方法_______(写一种即可)。
(2)加入HO 发生的主要反应的离子方程式为_______。
2 2
(3)加入NaCO 溶液调节pH至4.0~5.0,其目的为_______。
2 3
(4)隔绝空气高温煅烧NiC O 可制得Ni O,NiC O 受热分解的化学方程式为_______。
2 4 2 3 2 4
(5)NiO 还可用于制备合成氨的催化剂Co Ni Fe O。在其他条件相同时合成氨的相对初始速率随催化剂中n值变
2 3 n (1-n) 2 4
化的曲线如图,
由图可知Co2+、Ni2+两种离子中催化效果更好的是_______。
高三化学 第 5 页
学科网(北京)股份有限公司20.硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题。
(1)N原子核外有___ 种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为
___________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E)。第二周
1
期部分元素的E 变化趋势如图所示,其中除氮元素外,其他元素的E 自左而右依次增大的原因是
1 1
_______________________;氮元素的E 呈现异常的原因是_______________________。
1
(3)经测定发现,NO 固体由NO +和NO -两种离子组成,该固体中N原子杂化类型为___________________。
2 5 2 3
(4)铵盐大多不稳定。NH F、NH I中,较易分解的是____,原因是__________________。
4 4
(5)第二周期中,第一电离能介于B元素和N元素间的元素为_____(填“元素符号”)。
(6)已知:①NO + CO CO + NO
2 2
每1mol下列物质分解为气态基态原子消耗能量分别为
NO CO CO NO
2 2
812kJ 1076kJ 1490kJ 632kJ
②N (g)+O(g) 2NO(g) ΔH=+179.5 kJ/mol
2 2
③2NO(g) +O (g) 2NO (g) ΔH=-112.3 kJ/mol
2 2
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。
高三化学 第 6 页
学科网(北京)股份有限公司