文档内容
2022 级高一年级教学质量监测卷(四)
化学参考答案
第Ⅰ卷(选择题,共42分)
一、选择题(本大题共 14小题,每小题3分,共42分。在每小题给出的四个选项中,只有
一项是符合题目要求的)
题号 1 2 3 4 5 6 7
答案 D B C B C B A
题号 8 9 10 11 12 13 14
答案 C B D A B A D
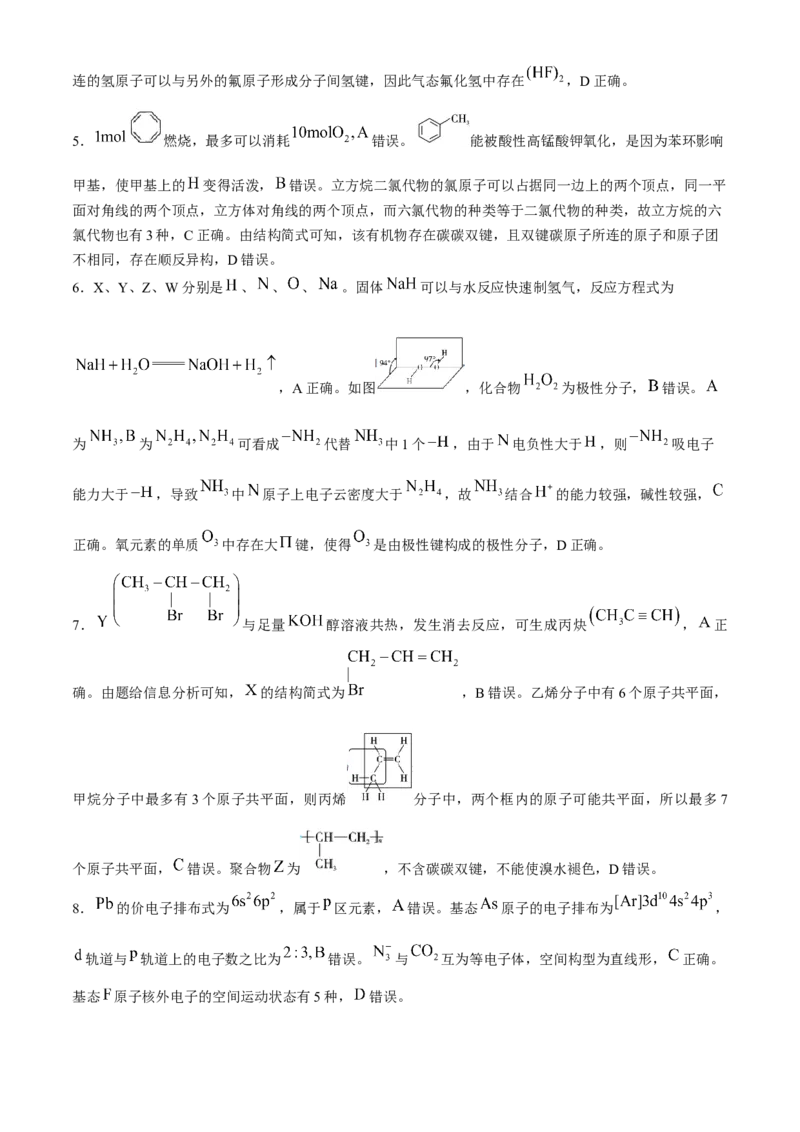
【解析】1.羟基(-OH)的电子式: ,A错误。乙酸乙酯的分子式为 ,实验式为 ,
错误。碳原子的半径应大于氢原子的半径,C错误。异戊二烯的键线式为 正确。
,
2.由于 和 是同一主族元素,故当 以四个单键与其他原子连接时形成四面体结构,故
和 为同一物质,A错误。乙醛与环氧乙烷( )的分子式均为 ,且二者官能团不同,
所以互为同分异构体,B正确。同系物是指结构相似组成上相差一个或若干个 原子团的物质,乙二醇
中有两个羟基,乙醇中有一个羟基,两者结构不同,不是同系物,C错误。同一元素形成的性质不同的单
质间才为同素异形体,故单晶硅为 和石英为 不互为同素异形体, 错误。
3.钠与铝不能形成离子键, 错误。铝与氯形成共价化合物 ,无离子键, 错误。钠与硫可以形
成离子化合物 正确。磷与氯形成共价化合物 或 错误。
4.正戊烷和新戊烷形成的晶体都是分子晶体,由于新戊烷支链多,对称性好,分子间作用力小,所以沸
点较低,A正确。碱金属元素的价电子数相等,都为1,锂离子的离子半径在碱金属中最小,形成的金属
键最强,所以碱金属中锂的熔点最高,B错误。由于电负性 , 键极性大于 键,使得羧
基上的羟基极性增强,氢原子更容易电离,酸性增强, 正确。氟的电负性大于氯的电负性,与氟原子相连的氢原子可以与另外的氟原子形成分子间氢键,因此气态氟化氢中存在 ,D正确。
5. 燃烧,最多可以消耗 错误。 能被酸性高锰酸钾氧化,是因为苯环影响
甲基,使甲基上的 变得活泼, 错误。立方烷二氯代物的氯原子可以占据同一边上的两个顶点,同一平
面对角线的两个顶点,立方体对角线的两个顶点,而六氯代物的种类等于二氯代物的种类,故立方烷的六
氯代物也有3种,C正确。由结构简式可知,该有机物存在碳碳双键,且双键碳原子所连的原子和原子团
不相同,存在顺反异构,D错误。
6.X、Y、Z、W分别是 、 、 、 。固体 可以与水反应快速制氢气,反应方程式为
,A正确。如图 ,化合物 为极性分子, 错误。
为 为 可看成 代替 中1个 ,由于 电负性大于 ,则 吸电子
能力大于 ,导致 中 原子上电子云密度大于 ,故 结合 的能力较强,碱性较强,
正确。氧元素的单质 中存在大 键,使得 是由极性键构成的极性分子,D正确。
7. 与足量 醇溶液共热,发生消去反应,可生成丙炔 , 正
确。由题给信息分析可知, 的结构简式为 ,B错误。乙烯分子中有6个原子共平面,
甲烷分子中最多有3个原子共平面,则丙烯 分子中,两个框内的原子可能共平面,所以最多7
个原子共平面, 错误。聚合物 为 ,不含碳碳双键,不能使溴水褪色,D错误。
8. 的价电子排布式为 ,属于 区元素, 错误。基态 原子的电子排布为 ,
轨道与 轨道上的电子数之比为 错误。 与 互为等电子体,空间构型为直线形, 正确。
基态 原子核外电子的空间运动状态有5种, 错误。9. 三氟甲苯中有 极性键, 错误。氢气为双原子分子,二氧化碳的分子组成为 ,含有2
个氧原子, 和 组成的混合物中不管比例如何,氢、氧原子总数都是 ,B正确。苯环上的
碳碳键是介于单键和双键之间一种特殊共价键,分子中不存在碳碳双键, 错误。由三氟乙酸的
可知,三氟乙酸为弱酸, 三氟乙酸溶液中, 的数目小于 错误。
10.化合物M可以发生氧化反应、加成反应、取代反应但不能发生消去反应,A错误。 ,
分子结构对称,核磁共振氢谱有4组峰,B错误。分子中含有两个碳碳三键和一个苯环, 该物质与氢
气反应,最多可消耗 ,C错误。化合物 存在碳碳三键,使酸性高锰酸钾溶液褪色发生氧化反应,
使溴水褪色发生加成反应,故褪色原理不同,D正确。
11.由AlN是高温绝缘陶瓷材料,知AlN为共价晶体,故AlN晶体中与 原子距离最近且相等的 有4
个, 正确。 元素和 元素形成的离子,离子半径较大的是 错误。上述元素中第一电离能最大
的是 错误。该轨道表示式违背洪特规则, 错误。
12.挥发的溴能和硝酸银溶液反应生成淡黄色沉淀,干扰 和硝酸银溶液的反应,A错误。溴水可以除
去甲烷中混有的乙烯,B正确。1-氯丁烷和硝酸银溶液不反应,检验1-氯丁烷中氯元素,应先加氢氧化
钠溶液水解,再加硝酸中和氢氧化钠至溶液呈酸性,最后加硝酸银溶液, 错误。电石与饱和食盐水反应
得到的乙炔气体中含硫化氢气体,硫化氢也能使酸性高锰酸钾溶液褪色,所以装置丁不能证明乙炔的还原
性,D错误。
13.酞菁分子中③ 原子 轨道提供一对电子, 正确。酞菁钴中心原子 的配位数为4, 错误。酞
菁钴中 显+2价, 错误。酞菁钴中没有手性碳原子,D错误。
14.冠醚与 之间并非离子键,而是通过配位键结合, 错误。甲展示了超分子的重要特征——分子识
别, 错误。乙物质阳离子基团较大,离子键较弱,较 熔沸点更低, 错误。将左边结构补齐会
形成两个环,被两个环共用的氧原子左边有7个,右边有7个共14个,独立成个体的氧原子有10个,同时每个环都有独立的硅原子,则 ,这样每个环所包含的O有17
个,硅有6个,再根据硅化合价为+4价,氧化合价为-2价,其结构通式为 ,D正确。
第Ⅱ卷(非选择题,共58分)
二、填空题(本大题共4小题,共58分)
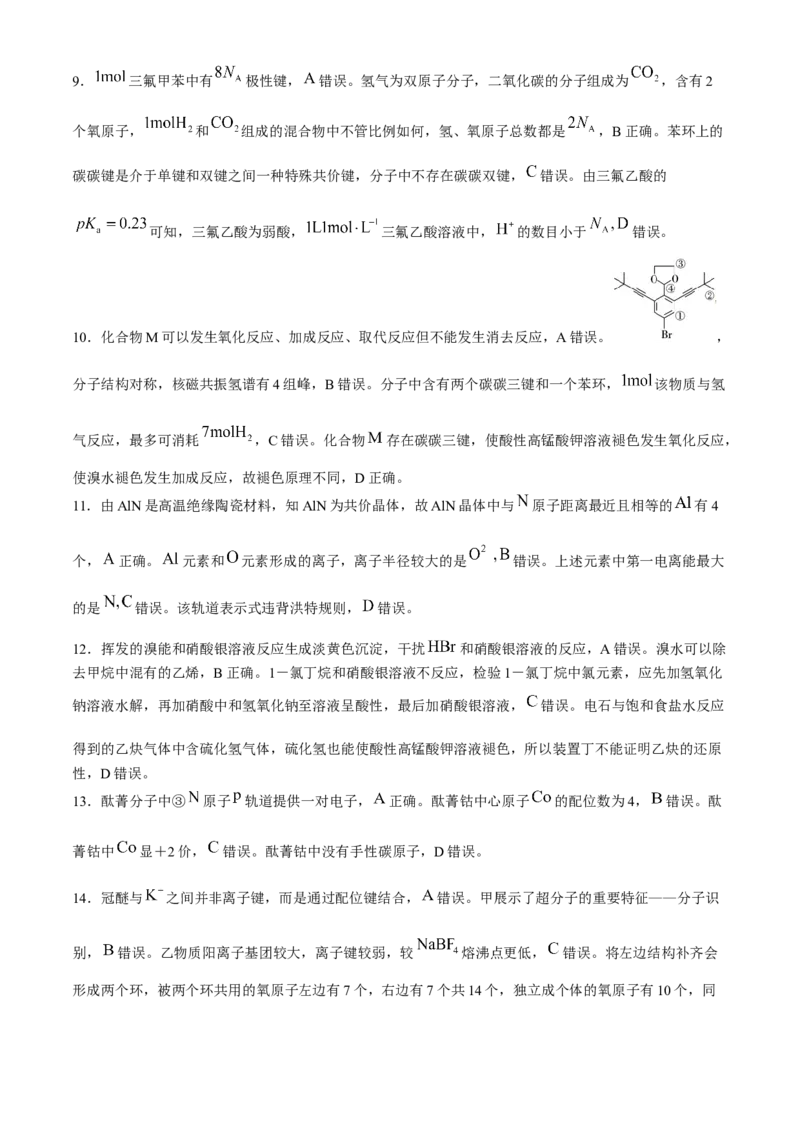
15.(每空2分,共14分)
(1)
(2)
(3)90 (4)羧基 (5) (6)
【解析】(2)分子式为 的芳香烃是苯乙烯 ,发生加聚反应生成聚苯乙烯 。
(3)质谱法确定有机物相对分子质量,相对分子质量=最大质荷比。
(4)红外光谱可确定有机物中包含的化学键和官能团,结合红外光谱图可知官能团有羟基和羧基。
( 5 ) 结 合 0.9g 有 机 物 完 全 燃 烧 , 测 得 生 成 物 为 和 进 行 计 算 ,
, 根 据 原 子 守 恒 可 知 , ,
,则 分子中 、 原子个数分别为 3 和 原子个数
,所以 分子式为 。
(6)结合红外光谱和核磁共振氢谱即可得出 结构简式为 。
16.(每空2分,共14分)
(1) (2)23 (3)①正四面体形 ②8(4)乙硫醇不能形成分子间氢键,而水和乙醇均能,且水比乙醇的氢键多
(5)
【解析】(1)原子序数在2130之间的元素基态价层电子排布中,未成对电子数最多的是 元素,有6个
未成对电子,其价电子排布图为 。
(2)任何原子中都不存在运动状态相同的电子,有几个电子就有几种运动状态, 有23个电子,有23
种运动状态。
(3)阴离子是 ,价层电子对是4对,无孤对电子,中心原子 是 杂化,空间结构是正四面体;
结构中,单键都是 键,双键一个 键一个 键,共有8个 键。
(4)乙硫醇不能形成分子间氢键,而水和乙醇均能,平均1个水分子有2个氢键,乙醇平均有1个氢键,
氢键越多分子间作用力越大,沸点越高。
(5)根据晶胞结构分析,氮原子在内部有1个, 原子位于立方晶胞的面心和顶角上,一个晶胞中有
个 原子,晶体的化学式为 ,铁与氨气发生置换反应生成 和氢气,可以写出
方程式为 ;在晶胞中两个铁原子之间最近距离是面对角线的一半,晶胞
的质量为 ,质量除以密度得到体积,体积开3次方就是边长,边长的 倍即得出距离为
,最后注意 转化为 。
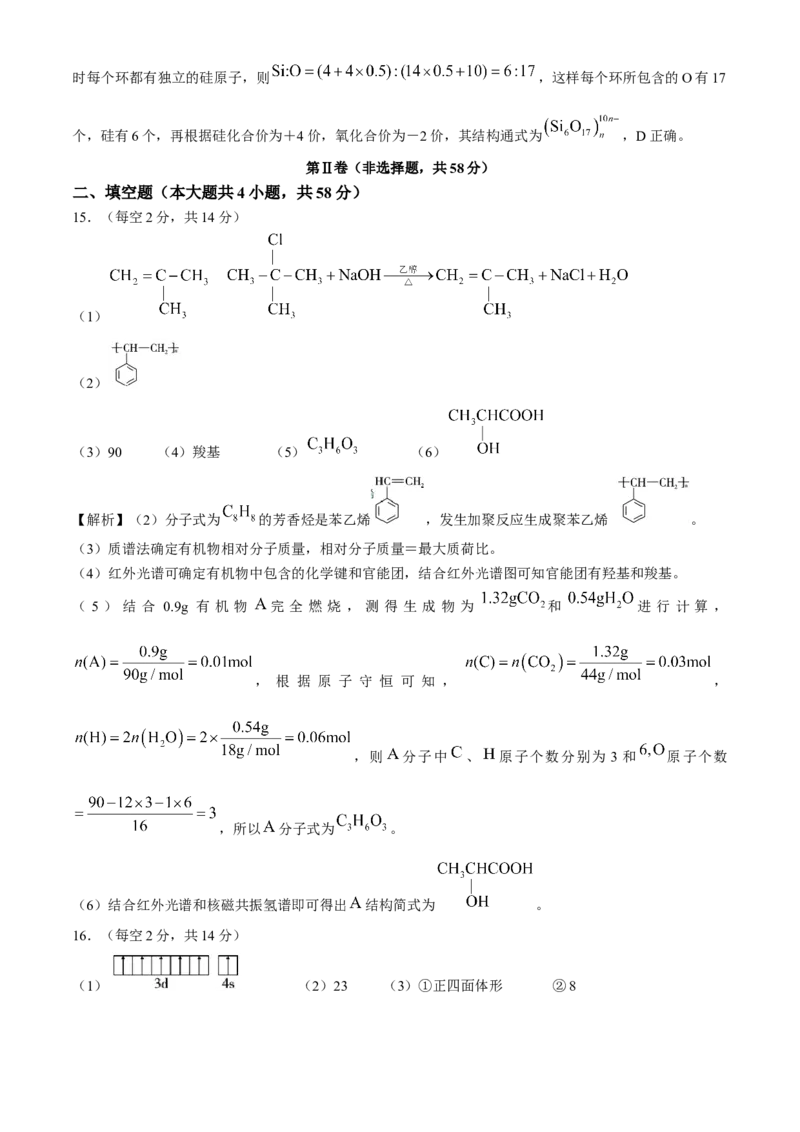
17.(每空2分,共16分)
(1) (2)羧基、酯基 (3)
(4)8 1,3,5-三甲苯(或均三甲苯) (5)AB
(6)①酸性高锰酸钾溶液 ②
【解析】(1)化合物 的分子式为 。(2)物质 为 ,官能团有羧基、酯基。
(3)化合物 与 发生取代反应生成化合物 、 和常见气体 ,该过程中 首先分解出
1个氯负离子,剩下的部分和醇形成氯化亚硫酸酯 ,这个氯负离子攻击碳原子,同时断
裂碳氧键和硫氯键,释放出 为 。
(4)比物质 多1个 原子的同系物,苯环侧链有3个 原子,可形成1个侧链 (正丙基、异丙
基)2种同分异构体;2个侧链分别为 和 有3种同分异构体;3个侧链即3个 有3种同
分异构体。其中苯环上一氯代物只有1种的是1,3,5-三甲苯(或均三甲苯)。
(5)反应⑥中Ac-转化为 ,C-O键断裂,O-H键形成;化合物H中存在 ,O原子形成2个
σ键和2个孤电子对,价层电子对数为4,采取 杂化;反应①和⑥羟基先被反应后又生成,目的是为了
保护羟基不被氧化;故选AB。
(6)以甲苯为含碳原料,利用反应③和④的原理,合成化合物K,甲苯先和酸性高锰酸钾溶液发生氧化反
应生成 , 和 发生取代反应生成 , 和甲苯发生④的原理得到
。
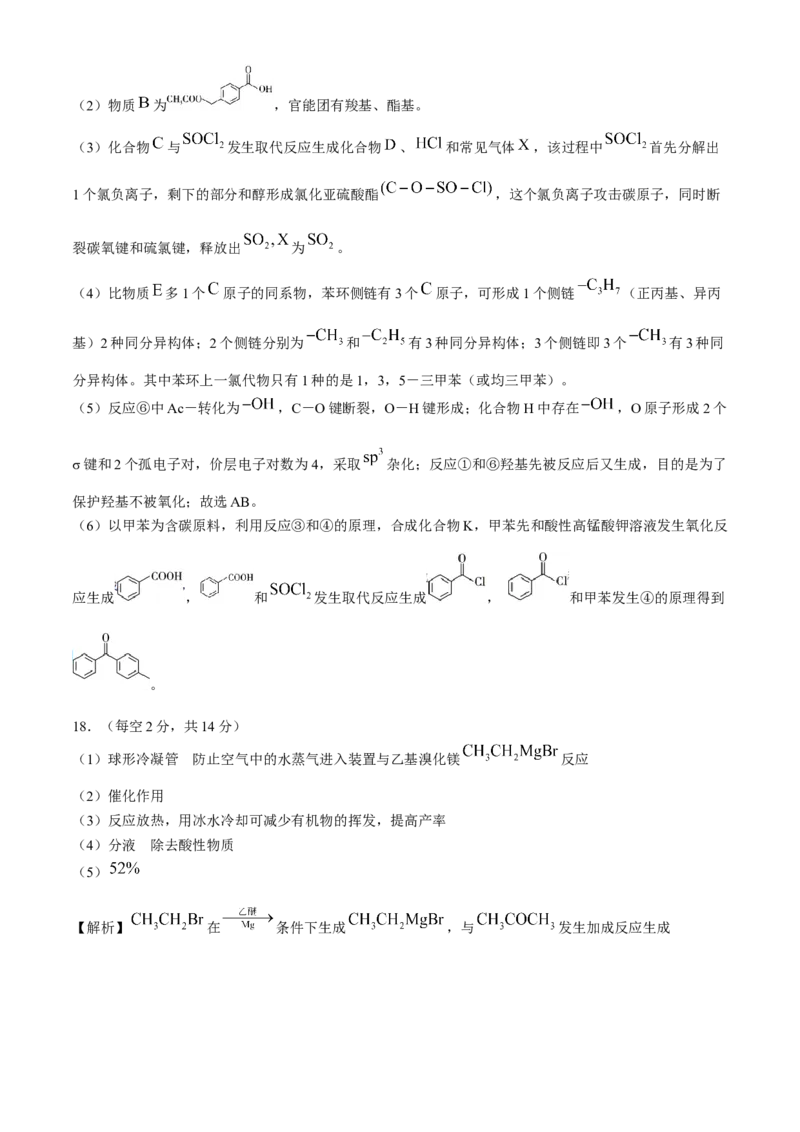
18.(每空2分,共14分)
(1)球形冷凝管 防止空气中的水蒸气进入装置与乙基溴化镁 反应
(2)催化作用
(3)反应放热,用冰水冷却可减少有机物的挥发,提高产率
(4)分液 除去酸性物质
(5)
【解析】 在 条件下生成 ,与 发生加成反应生成,又在酸性条件下生成 ,据此回答。
(1)由实验图知仪器 为球形冷凝管;由题中信息知 化学性质活泼,易与 发生反应
生成 ,故无水氯化钙的作用是防止空气中的水蒸气进入装置,与乙基溴化镁反应。
(2)由题已知“微热或加入小颗粒碘单质可引发 与镁屑的反应”,即碘的作用可能是催化作
用。
(3)反应放热,用冰水冷却可降低反应速率,同时减少有机物的挥发,提高产率。
(4)加入乙醚,产物易溶于乙醚,与水溶液分层,故采用分液法;用 碳酸钠溶液洗涤的目的是除去酸
性物质,如残余硫酸。
(5) 镁屑物质的量约为 溴乙烷物质的量为 ,由信息
知镁屑过量,即理论获取2-甲基-2-丁醇质量为 ,所以产率为
。