文档内容
可能用到的相对原子质量:s-32 Cu-64 I-127
7.下列关于物质的性质、用途等描述中不正确的是
A.SO 具有还原性并且可以杀菌、抗氧化,在葡萄酒中添加适量的SO 能杀灭微
2 2
生物并防止葡萄酒的氧化变质
B.高铁酸钾 在水处理过程中涉及的变化过程有:氧化还原反应、蛋白
质变性、盐类水解、胶体聚沉等
C.储氢合金是一类能大量吸收H 并与H 结合成金属氢化物的材料
2 2
D.液氨作为清洁能源的反应原理是
8.吲哚布芬是治疗心血管病变的有效药,其结构简式如图所示。下列关于吲哚
布芬的说法正确的是
A.分子式为C H NO
18 15 3
B.苯环上的一氯代物共有4种
C.能发生酯化反应、加成反应
D.分子中所有碳原子都能共平面
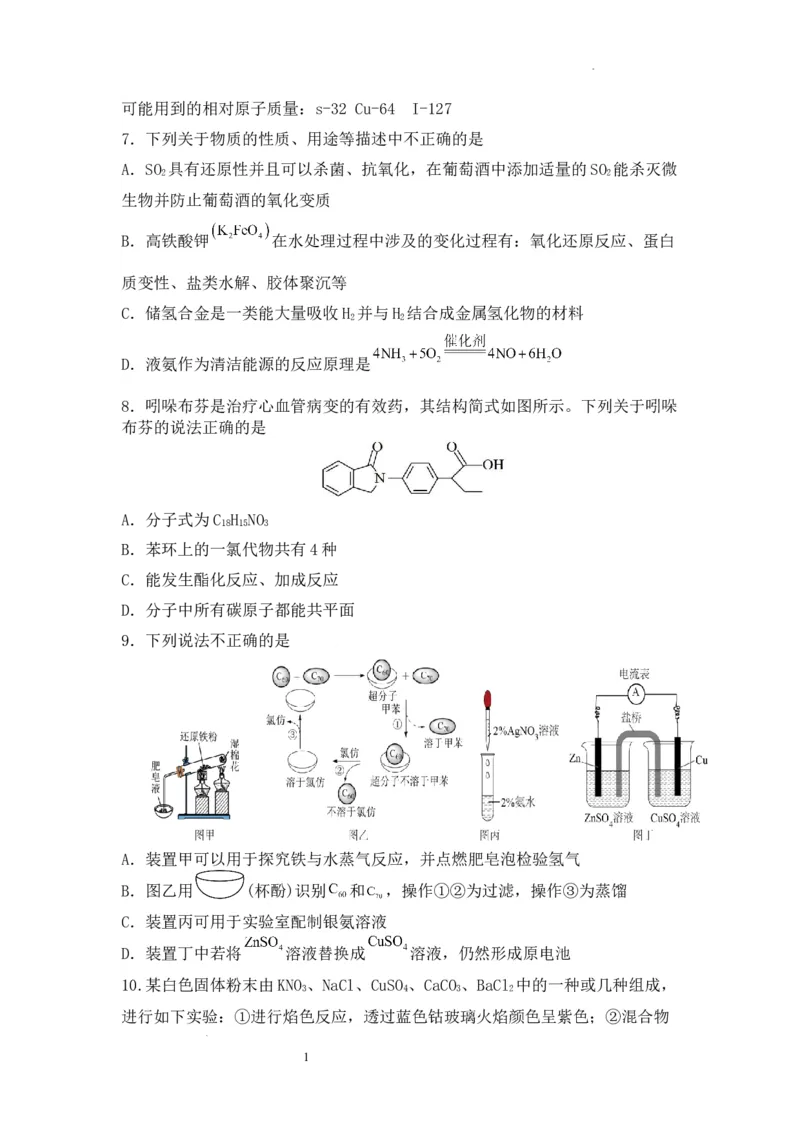
9.下列说法不正确的是
A.装置甲可以用于探究铁与水蒸气反应,并点燃肥皂泡检验氢气
B.图乙用 (杯酚)识别 和 ,操作①②为过滤,操作③为蒸馏
C.装置丙可用于实验室配制银氨溶液
D.装置丁中若将 溶液替换成 溶液,仍然形成原电池
10.某白色固体粉末由KNO 、NaCl、CuSO 、CaCO 、BaCl 中的一种或几种组成,
3 4 3 2
进行如下实验:①进行焰色反应,透过蓝色钴玻璃火焰颜色呈紫色;②混合物
1
学科网(北京)股份有限公司溶于水,得到澄清溶液;③向②所得的溶液中通入少量NH ,产生沉淀。该白色
3
粉末一定含有
A.KNO 、CuSO B.BaCl 、NaCl C.KNO 、CaCO D.CuSO 、NaCl
3 4 2 3 3 4
11. 分子在FC(氟化石墨烯)表面可能沿下列反应历程进行分解,即该反
应历程为酸根路径: ,其分解的各基
元反应能量曲线如下图所示(TS表示过渡态),下列说法不正确的是
A.该反应历程的第一步反应为吸热反应
B.该反应历程的决速步骤为
C. 比 稳定
D.随着 分子的不断分解,O原子在FG表面的覆盖度升高,对后续的分解
反应会产生影响
12.有一种天然硅酸盐的主要成分为MZ (ZW Y )(YX) 。已知X、 Y、 Z、 W、 M
2 3 10 2
为原子序数依次增大的前四周期主族元素,X为宇宙中最丰富的元素,Y原子的
最内层电子数是最外层电子数的1/3,M、Z为金属元素,Z单质制造的槽车能储
存、运输浓硫酸。下列说法错误的是
A.原子半径:Z>W>Y
B.最简单氢化物稳定性:Y>W
C.W、Z分别与Cl形成的最简单化合物中各原子均满足8电子稳定结构
D.Z 和M 的最高价氧化物对应的水化物可以相互反应
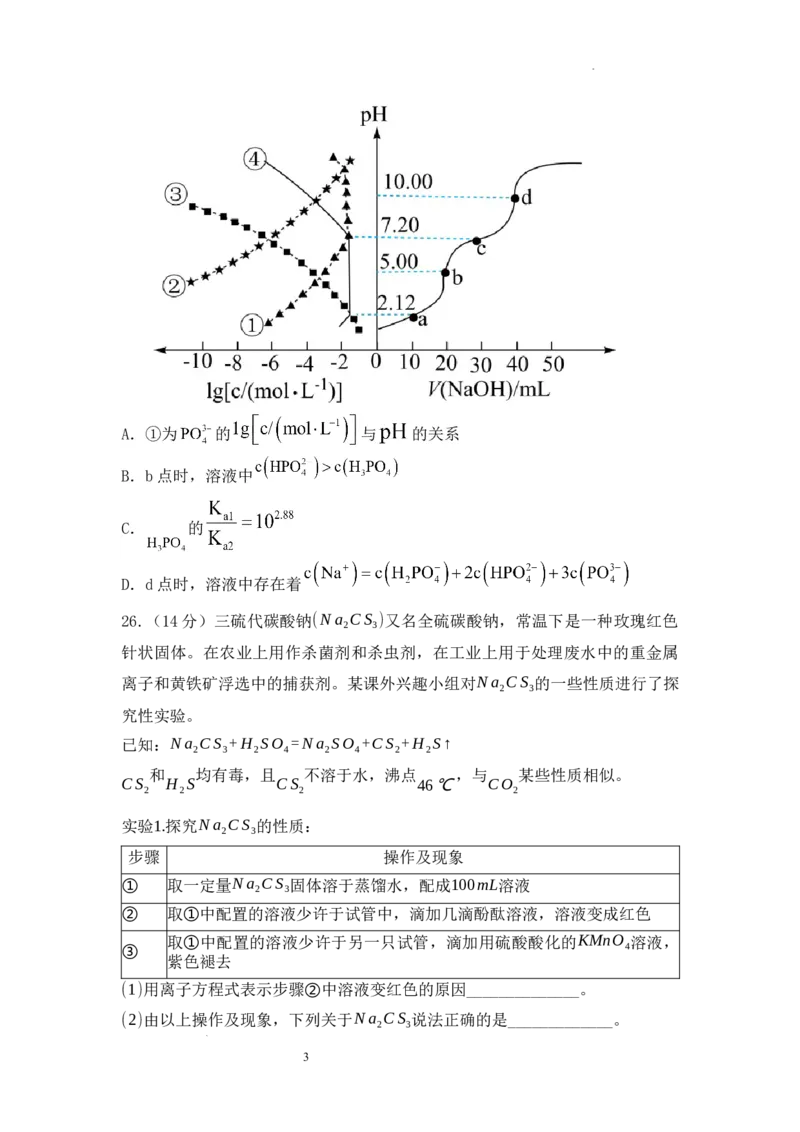
13.0.1000mol/L NaOH溶液滴定20.00ml 0.1000mol/L H PO 溶液时,
3 4
、各含磷元素微粒的 和 的关系如图。下列说法中正
确的是
2
学科网(北京)股份有限公司A.①为 的 与 的关系
B.b点时,溶液中
C. 的
D.d点时,溶液中存在着
26.(14分)三硫代碳酸钠(Na CS )又名全硫碳酸钠,常温下是一种玫瑰红色
2 3
针状固体。在农业上用作杀菌剂和杀虫剂,在工业上用于处理废水中的重金属
离子和黄铁矿浮选中的捕获剂。某课外兴趣小组对Na CS 的一些性质进行了探
2 3
究性实验。
已知:Na CS +H SO =Na SO +CS +H S↑
2 3 2 4 2 4 2 2
和 均有毒,且 不溶于水,沸点 ,与 某些性质相似。
CS H S CS 46℃ CO
2 2 2 2
实验1.探究Na CS 的性质:
2 3
步骤 操作及现象
① 取一定量Na CS 固体溶于蒸馏水,配成100mL溶液
2 3
② 取①中配置的溶液少许于试管中,滴加几滴酚酞溶液,溶液变成红色
取①中配置的溶液少许于另一只试管,滴加用硫酸酸化的KMnO 溶液,
③ 4
紫色褪去
(1)用离子方程式表示步骤②中溶液变红色的原因______________。
(2)由以上操作及现象,下列关于Na CS 说法正确的是_____________。
2 3
3
学科网(北京)股份有限公司A.易溶于水 B.溶液保存时用玻璃塞 C.应密封保存 D.有还原性
实验2.测定Na CS 溶液的浓度:
2 3
实验步骤如下:
Ⅰ.取实验1中配置的Na CS 溶液50.0mL置于仪器M中,打开K,通入一段时间
2 3
氮气;
Ⅱ.关闭K,打开分液漏斗活塞,滴入足量2.0mol·L−1稀硫酸,关闭活塞;
Ⅲ.反应结束后,再打开K,通入一段时间的热氮气;
Ⅳ.将B中沉淀进行过滤、洗涤、干燥、称量,得到4.8g固体。
(3)仪器M的名称是_________,滴入稀硫酸后,仪器M中的现象是_________。
(4)B中发生反应的离子方程式为_________,过滤后洗涤沉淀的操作是
_________。
(5)反应结束后通入一段时间的热氮气的作用是_________。
(6)根据实验数据计算,该Na CS 溶液的物质的量浓度为_________。
2 3
27.(15分)酸浸法回收废炉渣中(主要为铜、钴、镍、铁等金属元素的氧化
物)的铜、钴、镍的流程如下:
已知:25℃时, , .
(1)“磨细”过程的目的是____________.
(2)酸浸液中大量铁元素以 存在,加入 可减少铁屑的消耗从而降
4
学科网(北京)股份有限公司低成本, 与 反应过程中会产生气泡,其离子方程式为
_.
(3)“滤渣2”主要成分为___________(填化学式).
(4)“镍钴分离”过程 发生反应的离子方程式为____________.
(5)“酸溶1”过程用 替换 ,从绿色化学角度分析其可行性
_______ .
(6)“焙烧”过程发生反应的化学方程式为___________________.
(7)已知当 时,认为其沉淀完全.“沉镍”过程的目
的是为了将“ ”,此时应调节溶液的pH为___________.
(8)“操作X”为___________ _.
28.(14分)
利用 催化加氢制二甲醚,可以实现 的再利用,涉及以下主要反应:
相关物质及能量变化的示意图如图1所示。
图1
回答下列问题:
(1)反应Ⅱ的 ____________ ,该反应在___________(填“高
温”、“低温”或“任何温度”)下能自发进行。
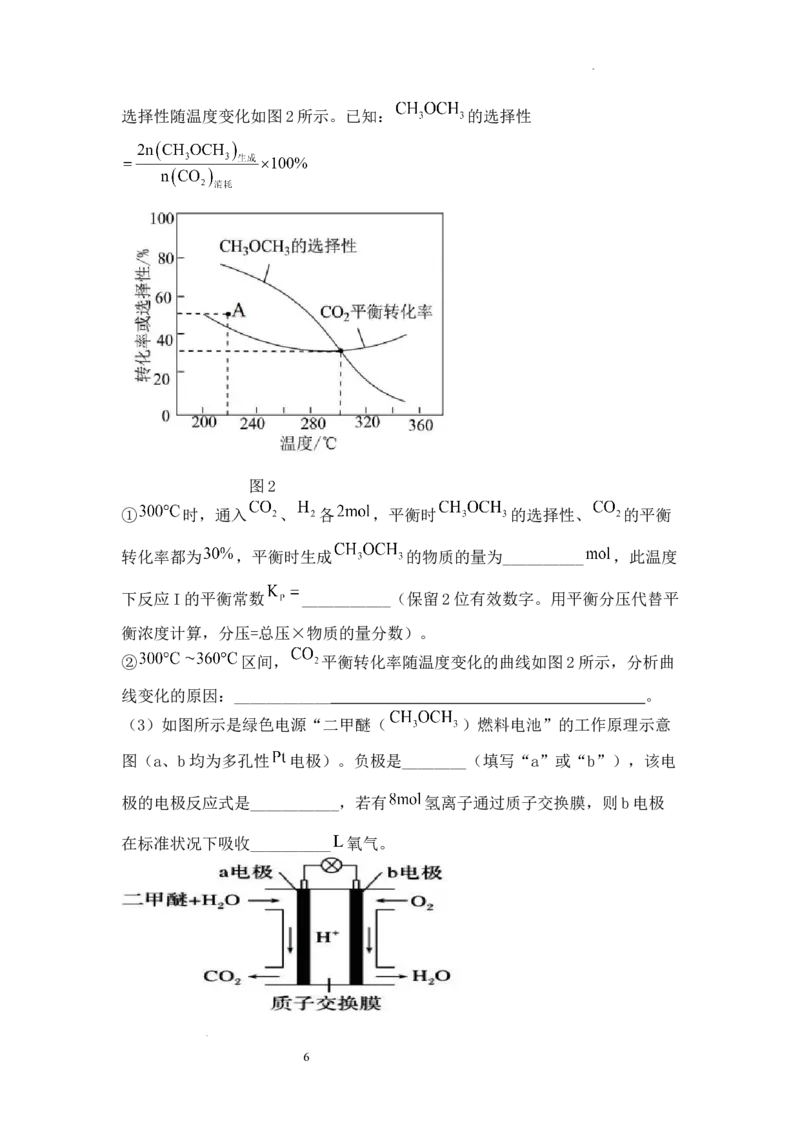
(2)恒压条件下, 、 起始量相等时, 的平衡转化率和 的
5
学科网(北京)股份有限公司选择性随温度变化如图2所示。已知: 的选择性
图2
① 时,通入 、 各 ,平衡时 的选择性、 的平衡
转化率都为 ,平衡时生成 的物质的量为__________ ,此温度
下反应I的平衡常数 ___________(保留2位有效数字。用平衡分压代替平
衡浓度计算,分压=总压×物质的量分数)。
② 区间, 平衡转化率随温度变化的曲线如图2所示,分析曲
线变化的原因:____________ 。
(3)如图所示是绿色电源“二甲醚( )燃料电池”的工作原理示意
图(a、b均为多孔性 电极)。负极是________(填写“a”或“b”),该电
极的电极反应式是___________,若有 氢离子通过质子交换膜,则b电极
在标准状况下吸收__________ 氧气。
6
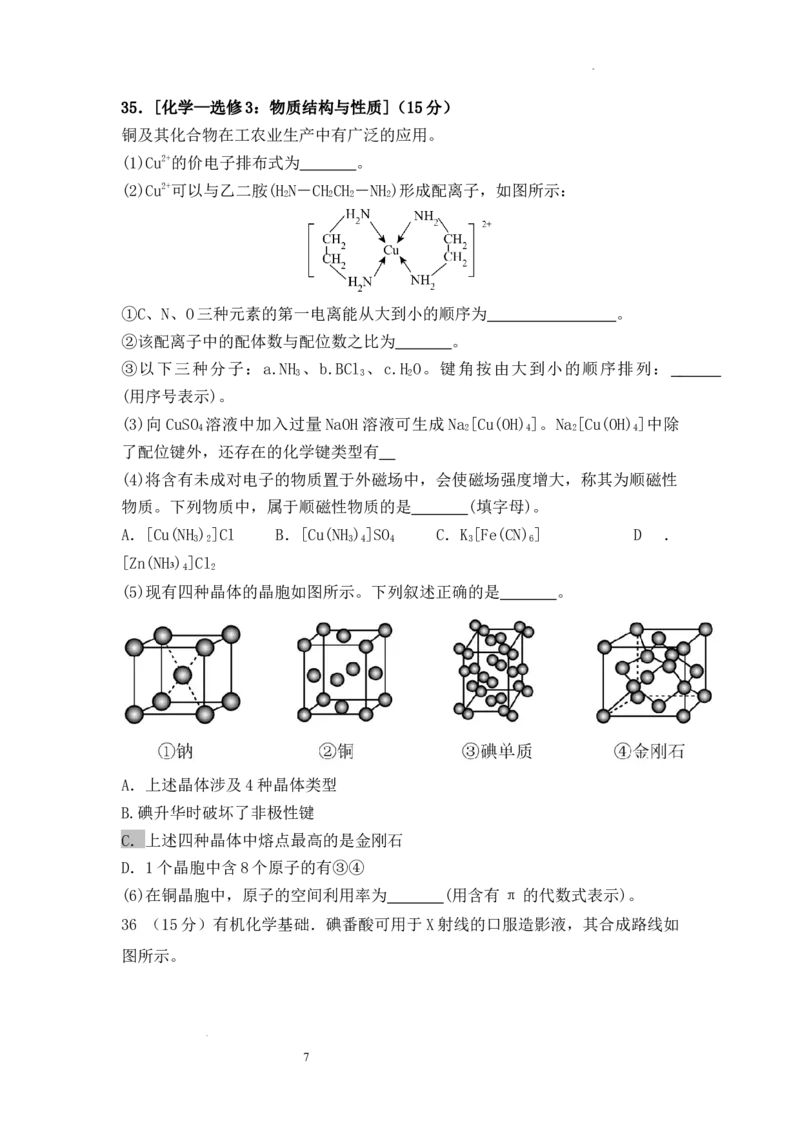
学科网(北京)股份有限公司35.[化学—选修3:物质结构与性质](15分)
铜及其化合物在工农业生产中有广泛的应用。
(1)Cu2+的价电子排布式为 。
(2)Cu2+可以与乙二胺(H N-CH CH -NH )形成配离子,如图所示:
2 2 2 2
①C、N、O三种元素的第一电离能从大到小的顺序为 。
②该配离子中的配体数与配位数之比为 。
③以下三种分子:a.NH 、b.BCl 、c.H O。键角按由大到小的顺序排列:
3 3 2
(用序号表示)。
(3)向CuSO 溶液中加入过量NaOH溶液可生成Na [Cu(OH) ]。Na [Cu(OH) ]中除
4 2 4 2 4
了配位键外,还存在的化学键类型有
(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性
物质。下列物质中,属于顺磁性物质的是 (填字母)。
A.[Cu(NH ) ]Cl B.[Cu(NH ) ]SO C.K [Fe(CN) ] D .
3 2 3 4 4 3 6
[Zn(NH₃) ]Cl
4 2
(5)现有四种晶体的晶胞如图所示。下列叙述正确的是 。
A.上述晶体涉及4种晶体类型
B.碘升华时破坏了非极性键
C.上述四种晶体中熔点最高的是金刚石
D.1个晶胞中含8个原子的有③④
(6)在铜晶胞中,原子的空间利用率为 (用含有π的代数式表示)。
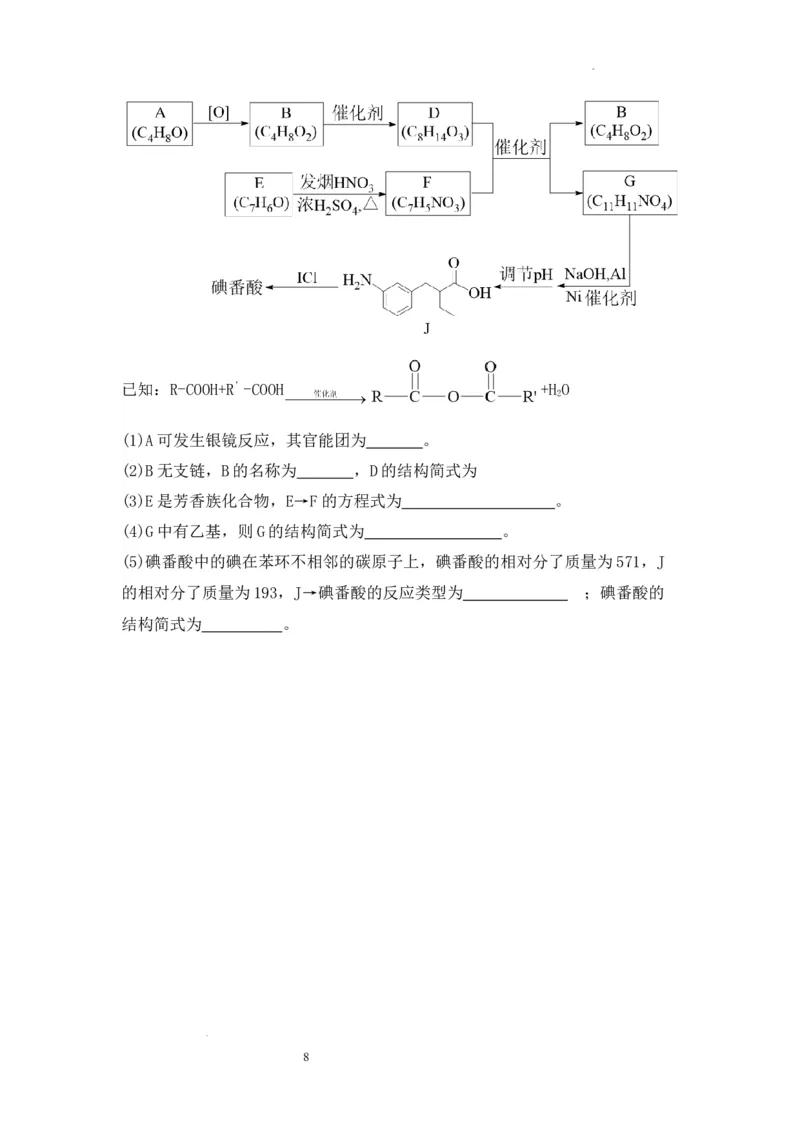
36 (15分)有机化学基础.碘番酸可用于X射线的口服造影液,其合成路线如
图所示。
7
学科网(北京)股份有限公司已知:R-COOH+R’-COOH +H O
2
(1)A可发生银镜反应,其官能团为 。
(2)B无支链,B的名称为 ,D的结构简式为
(3)E是芳香族化合物,E→F的方程式为 。
(4)G中有乙基,则G的结构简式为 。
(5)碘番酸中的碘在苯环不相邻的碳原子上,碘番酸的相对分了质量为571,J
的相对分了质量为193,J→碘番酸的反应类型为 ;碘番酸的
结构简式为 。
8
学科网(北京)股份有限公司2024届高三第一次模拟考试化学答案
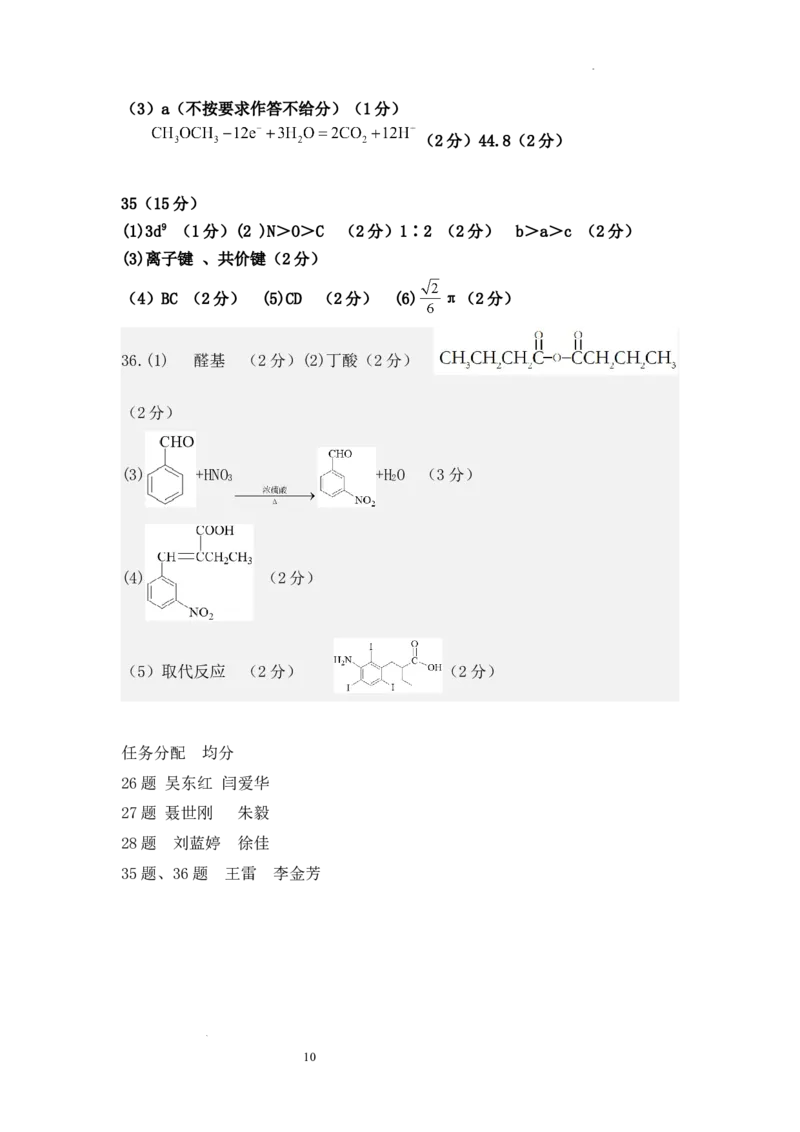
7D 8C 9C 10A 11B 12C 13B
26.(14分) (选2个或3个
(1)CS2−+H O⇌HCS−+OH−(2分)(2)ACD
3 2 3
均给2分)
(3)三颈烧瓶;(1分)
有油状液体生成(或者液体分层),有气泡产生(2分一个现象1分)
;
(4)Cu2++H S=CuS↓+2H+
2
沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,待水自然流尽,重复操作二至三次
(2分)
将反应产生的 气体全部赶入 溶液的吸收瓶吸收完全(1分)
(5) H S CuSO
2 4
(6)1mol/L (2分)
27.(15分)(1)增加反应物面积,加快酸浸速率(1分)
(2) (2分)
(3) (2分)
(4) (2分)
(5)使用 会产生有害气体 ,使用 可避免的同时也能起到酸溶的
作用(2分)
(6) (2分)
(7)9.0(2分)
(8)蒸发浓缩、冷却结晶、过滤洗涤(写不写干燥都不扣分)(2分)
28.(14分)
(1)-123.1(2分)低温(1分)
(2)①0.09(2分)0.20(2分)
②反应I为吸热反应,二氧化碳的平衡转化率随温度升高而增大,反应II
为放热反应,二氧化碳的平衡转化率随温度升高而减小(1分),300℃~360℃
区间,反应I的趋势大于反应II(1分)。(合计2分)
9
学科网(北京)股份有限公司(3)a(不按要求作答不给分)(1分)
(2分)44.8(2分)
35(15分)
(1)3d9 (1分)(2 )N>O>C (2分)1∶2 (2分) b>a>c (2分)
(3)离子键 、共价键(2分)
(4)BC (2分) (5)CD (2分) (6) π(2分)
36.(1) 醛基 (2分)(2)丁酸(2分)
(2分)
(3) +HNO +H O (3分)
3 2
(4) (2分)
(5)取代反应 (2分) (2分)
任务分配 均分
26题 吴东红 闫爱华
27题 聂世刚 朱毅
28题 刘蓝婷 徐佳
35题、36题 王雷 李金芳
10
学科网(北京)股份有限公司