文档内容
2024-2025 学年度高三上学期期中考试
化学试卷
考试范围:必修一,必修二,选必二
考试时间75分钟,满分100分
可能用到的相对原子质量:H-1 O-16 Mg-24 Fe-56 F-19 Cs-133
一.选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,
只有一项符合题目要求。
1.古医典富载化学知识,下述之物见其氧化性者为
A.金(Au):“虽被火亦未熟”
B.石灰(CaO):“以水沃之,即热蒸而解”
C.石硫黄(S):“能化……银、铜、铁,奇物”
D.石钟乳(CaCO):“色黄,以苦酒(醋)洗刷则白”
3
【答案】C【解析】A.金“虽被火亦未熟”是指金单质在空气中被火灼烧也不
反应,说明金的化学性质很稳定,与其氧化性无关,A不合题意;B.石灰
(CaO):“以水沃之,即热蒸而解”是指CaO+H O=Ca(OH) ,反应放热,产生
2 2
大量的水汽,而CaO由块状变为粉末状,未发生氧化还原反应,与其氧化性无
关,B不合题意;C.石硫黄即S:“能化……银、铜、铁,奇物”是指2Ag+S
Ag S、Fe+S FeS、2Cu+S Cu S,反应中S作氧化剂,与其氧化性有关,
2 2
C符合题意;D.石钟乳(CaCO):“色黄,以苦酒(醋)洗刷则白”是指
3
CaCO +2CH COOH (CHCOO) Ca+H O+CO↑,未发生氧化还原反应,与其
3 3 3 2 2 2
氧化性无关,D不合题意;选C。
2.幸福不会从天而降,美好生活靠劳动创造。下列劳动项目与所述的化学知识没有
关联的是
选项 劳动项目 化学知识
A 医院消毒:喷洒次氯酸钠溶液 次氯酸钠溶液显碱性
B 生产活动:海水晒盐 蒸发原理
C 家务劳动:用食醋洗水壶 醋酸可与水垢中的Mg(OH)、CaCO 反应
2 3
D 环境保护:用硫酸铁处理污水 Fe(OH) 胶体具有吸附性
3
A.A B.B C.C D.D
1
学科网(北京)股份有限公司【答案】A【解析】A.次氯酸钠溶液具有强氧化性,能杀菌消毒,与显碱性无
关联,劳动项目与所述的化学知识没有关联,A符合题意;B.海水晒盐通过蒸
发原理得到,劳动项目与所述的化学知识有关联,B不符合题意;C.醋酸显酸
性,且酸性比碳酸强,可与水垢中的Mg(OH) 、CaCO 反应而使其溶解除去,
2 3
劳动项目与所述的化学知识有关联,C不符合题意;D.铁离子水解生成的氢氧
化铁胶体具有吸附性,能处理污水,劳动项目与所述的化学知识有关联,D不
符合题意;选A。
3.化学实验是化学探究的一种重要途径。下列有关实验的描述正确的是
A.容量瓶、滴定管、分液漏斗使用前均需要检验是否漏水
B.可用氢氟酸清洗做过硅酸分解实验的瓷坩埚
C.进行焰色试验时,可用玻璃棒替代铂丝
D.制备金属镁的电解装置失火时,可以使用二氧化碳灭火器灭火
【答案】A【解析】A.容量瓶颈上有玻璃塞,酸式滴定管下端有玻璃活塞,碱
式滴定管下端有玻璃珠,酸式滴定管下端有玻璃活塞,分液漏斗有玻璃活塞,
它们是否密封不能直接观察出来,故使用前均需要检验是否漏水,A正确;B.
瓷坩埚的主要成分中含有二氧化硅,能够与氢氟酸反应,不能用氢氟酸清洗做
过硅酸分解实验的瓷坩埚,B错误;C.玻璃中含有钠等金属元素,进行焰色试
验时,不可用玻璃棒替代铂丝,C错误;D.由于镁可以在CO 中继续激烈燃烧,
2
反应原理为:2Mg+CO 2MgO+C,故金属镁着火时,不可用二氧化碳灭火
2
器灭火,D错误;选A。
4.下列叙述正确的是
A.金属与盐溶液的反应都是置换反应
B.La-Ni储氢合金在加热条件下可与氢气反应生成稳定的金属氢化物
C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物
D.硝酸见光、受热易分解,一般保存在棕色试剂瓶中,并放置在阴凉处
【答案】D【解析】A.铜与氯化铁溶液反应不是置换反应,A错误;B.形成
金属氢化物不需要加热,加热会使氢化物分解,B错误;C.与强酸、强碱都反
应的物质可以是两性氧化物、两性氢氧化物或部分金属,例如金属铝,还有弱
酸的酸式盐、弱酸的铵盐、氨基酸等,C错误;D.硝酸见光受热会分解生成
NO 、O 和HO,实验室中硝酸保存在棕色试剂瓶并放置在阴凉处,D正确;选
2 2 2
D。
5.下列化学用语表述错误的是
2
学科网(北京)股份有限公司A.HClO的电子式:
B.中子数为10的氧原子:O
C.PH 分子的VSEPR模型:
3
D.基态As原子的价层电子排布式:4s24p3
【答案】C【解析】A.HClO是共价化合物,Cl原子和H原子分别与O原子形
成共价键,HClO的电子式是 ,A正确;B.氧原子的质子数为8,中
子数为10,则质量数=8+10=18,可表示为:O,B正确;C.PH 中的P原子有
3
1对孤电子对,还与3个H原子成键,故PH 的价层电子对数为4,根据VSEPR
3
模型,可知,PH 的VSEPR模型为四面体型: ,C错误;D.As是第四
3
周期第ⅤA主族元素,基态As原子的价层电子排布式:4s24p3,D正确;选
C。
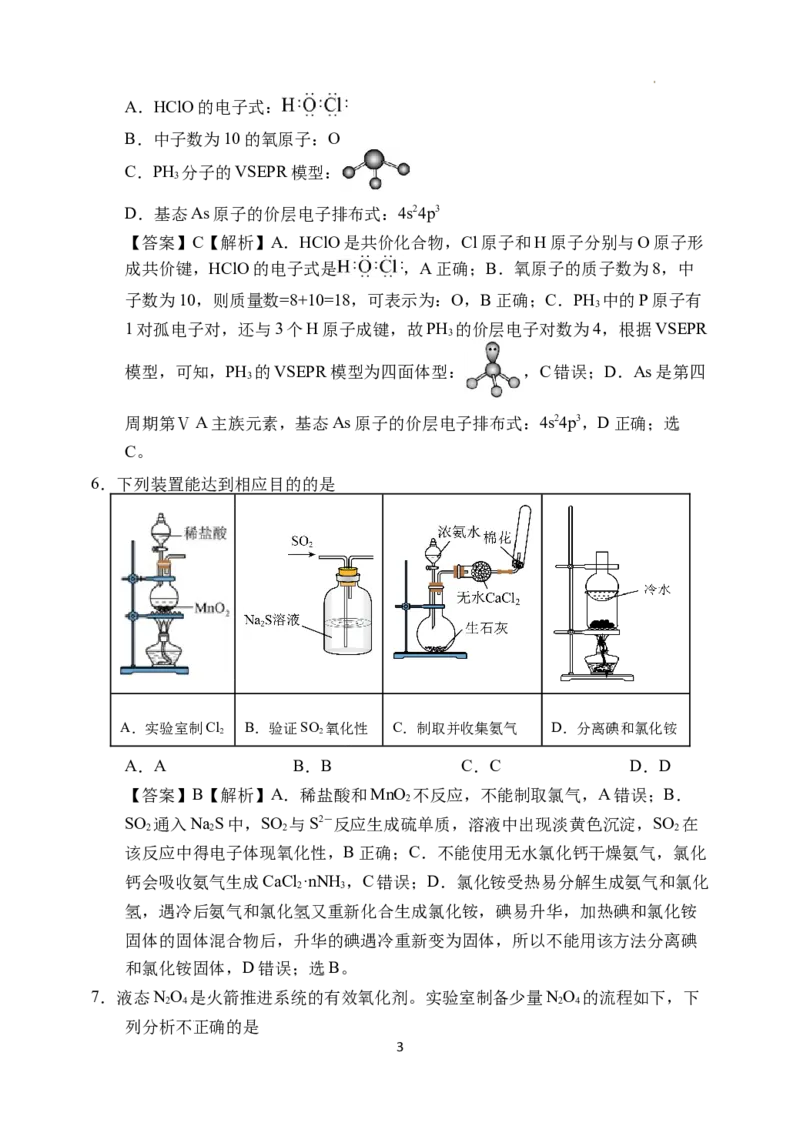
6.下列装置能达到相应目的的是
A.实验室制Cl B.验证SO 氧化性 C.制取并收集氨气 D.分离碘和氯化铵
2 2
A.A B.B C.C D.D
【答案】B【解析】A.稀盐酸和MnO 不反应,不能制取氯气,A错误;B.
2
SO 通入NaS中,SO 与S2-反应生成硫单质,溶液中出现淡黄色沉淀,SO 在
2 2 2 2
该反应中得电子体现氧化性,B正确;C.不能使用无水氯化钙干燥氨气,氯化
钙会吸收氨气生成CaCl ·nNH ,C错误;D.氯化铵受热易分解生成氨气和氯化
2 3
氢,遇冷后氨气和氯化氢又重新化合生成氯化铵,碘易升华,加热碘和氯化铵
固体的固体混合物后,升华的碘遇冷重新变为固体,所以不能用该方法分离碘
和氯化铵固体,D错误;选B。
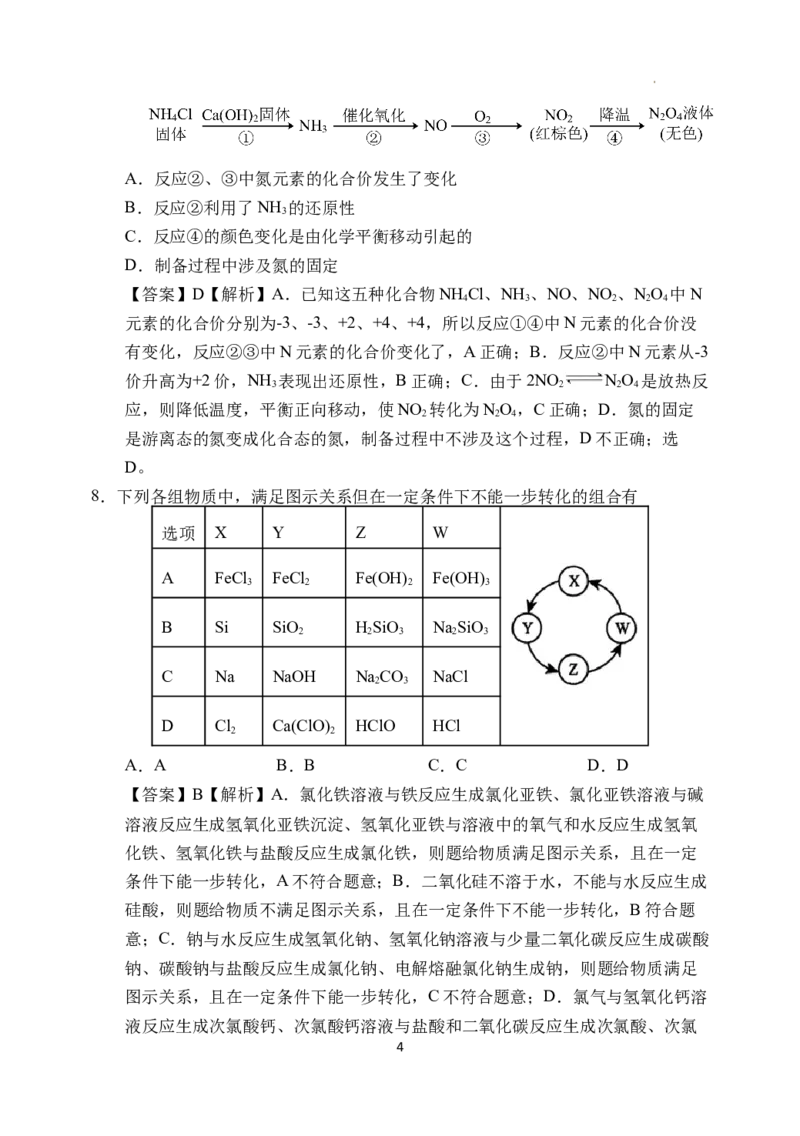
7.液态NO 是火箭推进系统的有效氧化剂。实验室制备少量NO 的流程如下,下
2 4 2 4
列分析不正确的是
3
学科网(北京)股份有限公司A.反应②、③中氮元素的化合价发生了变化
B.反应②利用了NH 的还原性
3
C.反应④的颜色变化是由化学平衡移动引起的
D.制备过程中涉及氮的固定
【答案】D【解析】A.已知这五种化合物NH Cl、NH 、NO、NO 、NO 中N
4 3 2 2 4
元素的化合价分别为-3、-3、+2、+4、+4,所以反应①④中N元素的化合价没
有变化,反应②③中N元素的化合价变化了,A正确;B.反应②中N元素从-3
价升高为+2价,NH 表现出还原性,B正确;C.由于2NO NO 是放热反
3 2 2 4
应,则降低温度,平衡正向移动,使NO 转化为NO,C正确;D.氮的固定
2 2 4
是游离态的氮变成化合态的氮,制备过程中不涉及这个过程,D不正确;选
D。
8.下列各组物质中,满足图示关系但在一定条件下不能一步转化的组合有
选项 X Y Z W
A FeCl FeCl Fe(OH) Fe(OH)
3 2 2 3
B Si SiO HSiO NaSiO
2 2 3 2 3
C Na NaOH NaCO NaCl
2 3
D Cl Ca(ClO) HClO HCl
2 2
A.A B.B C.C D.D
【答案】B【解析】A.氯化铁溶液与铁反应生成氯化亚铁、氯化亚铁溶液与碱
溶液反应生成氢氧化亚铁沉淀、氢氧化亚铁与溶液中的氧气和水反应生成氢氧
化铁、氢氧化铁与盐酸反应生成氯化铁,则题给物质满足图示关系,且在一定
条件下能一步转化,A不符合题意;B.二氧化硅不溶于水,不能与水反应生成
硅酸,则题给物质不满足图示关系,且在一定条件下不能一步转化,B符合题
意;C.钠与水反应生成氢氧化钠、氢氧化钠溶液与少量二氧化碳反应生成碳酸
钠、碳酸钠与盐酸反应生成氯化钠、电解熔融氯化钠生成钠,则题给物质满足
图示关系,且在一定条件下能一步转化,C不符合题意;D.氯气与氢氧化钙溶
液反应生成次氯酸钙、次氯酸钙溶液与盐酸和二氧化碳反应生成次氯酸、次氯
4
学科网(北京)股份有限公司酸光照分解生成盐酸、盐酸与二氧化锰共热反应生成氯气,则题给物质满足图
示关系,且在一定条件下能一步转化,D不符合题意;选B。
9.宏观辨识与微观探析是化学学科核心素养之一,下列解释实验事实的化学用语正
确的是
A.用过量NaOH溶液除去乙烯中的SO :SO +2OH- SO+H O
2 2 2
B.用食醋和淀粉–KI溶液检验食盐中的KIO :IO+5I-+6H+ 3I+3H O
3 2 2
C.Ba(OH) 溶液与稀硫酸混合后溶液几乎不导电:
2
Ba2++SO+H++OH- BaSO↓+H O
4 2
D.用三氯化铁溶液刻制覆铜电路板:2Fe3++3Cu 2Fe+3Cu2+
【答案】A【解析】A.用过量NaOH溶液除去乙烯中的SO ,氢氧化钠过量生
2
成亚硫酸根,离子方程式正确,A正确;B.食醋是弱电解质,不能拆成离子的
形式,正确的离子方程式为IO+5I-+6CH COOH 3I+3H O+6CHCOO-,B
3 2 2 3
错误;C.Ba(OH) 溶液与稀硫酸混合后溶液几乎不导电,说明刚好完全反应,
2
正确的离子方程式为Ba2++SO+2H++2OH- BaSO↓+2H O,C错误;D.
4 2
Fe3+可以将Cu氧化成Cu2+,三氯化铁刻蚀铜电路板时反应的离子方程式为2Fe3+
+Cu=2Fe2++Cu2+,D错误;选A。
10.配位化合物是一类重要的化合物,下列有关说法正确的是
A.[Cu(NH )]SO ·H O中配体是NH 和HO,配位数是4
3 4 4 2 3 2
B.NH 中H-N-H键角大于[Cu(NH )]2+中H-N-H键角
3 3 4
C.由于O的电负性比N大,[Cu(H O) ]2+比[Cu(NH )]2+的配位键更稳定
2 4 3 4
D.向[Ag(NH)]Cl溶液中加入稀硝酸会产生白色沉淀
3 2
【答案】D【解析】A.[Cu(NH )]SO ·H O中配体是NH ,配位数是4,A错误;
3 4 4 2 3
B.NH 中N有1对孤对电子,H-N-H的键角小于[Cu(NH )]2+中H-N-H的键角,
3 3 4
B错误;C.因为N和O都有孤对电子,但O电负性更大,吸引孤电子对能力
强,NH 提供孤电子对能力更强,配位键更稳定,C错误;D.加入稀硝酸会与
3
NH 结合成NH破坏原来的配位键,产生AgCl白色沉淀,D正确;选D。
3
11.反应KSO(过硫酸钾)+MnSO +HO—KMnO +H SO +K SO (未配平),下
2 2 8 4 2 4 2 4 2 4
列说法不正确的是
A.KSO 中S的价态为
2 2 8
B.KMnO 是氧化产物
4
C.氧化剂和还原剂的物质的量之比是5∶2
D.若消耗3.6 g HO时,则反应转移的电子数为0.25 N (N 表示阿伏加德罗
2 A A
5
学科网(北京)股份有限公司常数的值)
【答案】A【解析】在反应中,Mn由+2价升高到+7价,KSO 中部分O由-1
2 2 8
价降低到-2价,则KSO 是氧化剂,MnSO 是还原剂,结合电子守恒反应为
2 2 8 4
5KSO+2MnSO +8H O 2KMnO +8H SO +4K SO 。A.KSO 中含有过氧根,
2 2 8 4 2 4 2 4 2 4 2 2 8
过氧根中氧为-1,故S的价态不是+7,而为+6,A错误;B.Mn由+2价升高到
+7价,发生氧化反应得到氧化产物高锰酸钾,B正确;C.由分析,氧化剂和
还原剂的物质的量之比是5∶2,C正确;D.由反应方程式,可建立如下关系
式:8HO~10e−,若消耗3.6 g HO(为0.2 mol)时,则反应转移的电子0.2
2 2
mol×10/8=0.25 mol,数目为0.25 N ,D正确;选A。
A
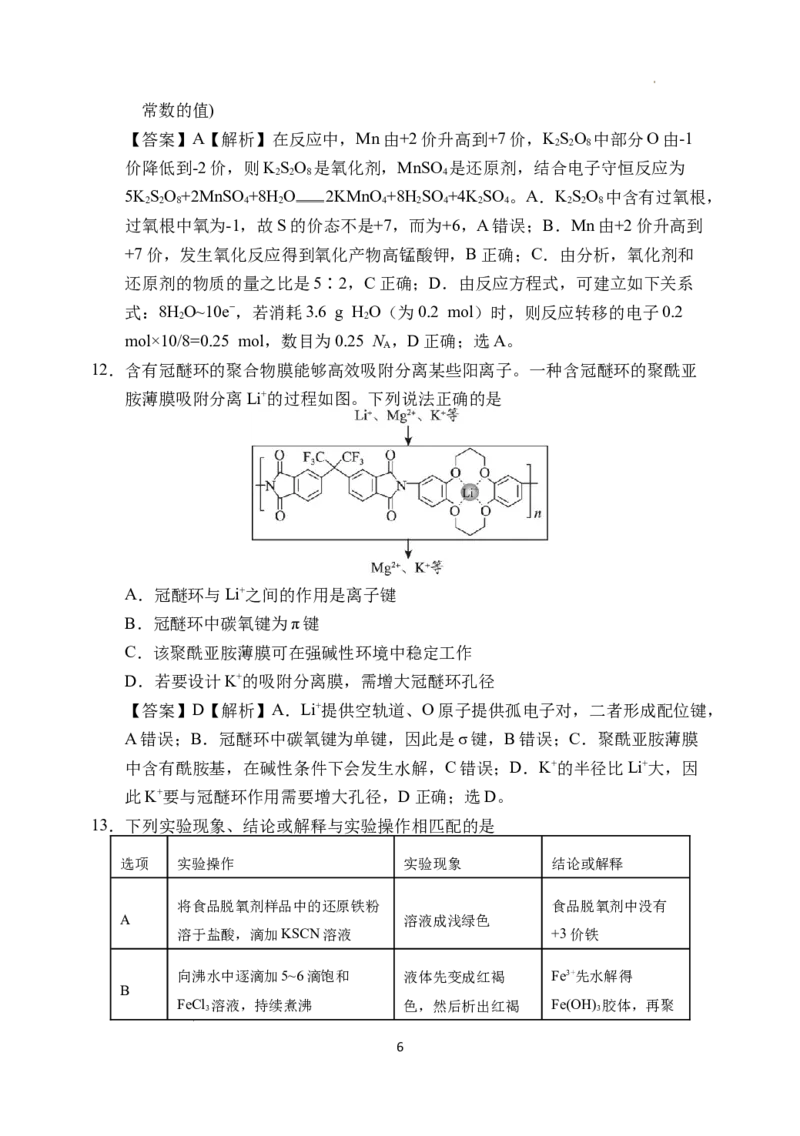
12.含有冠醚环的聚合物膜能够高效吸附分离某些阳离子。一种含冠醚环的聚酰亚
胺薄膜吸附分离Li+的过程如图。下列说法正确的是
A.冠醚环与Li+之间的作用是离子键
B.冠醚环中碳氧键为π键
C.该聚酰亚胺薄膜可在强碱性环境中稳定工作
D.若要设计K+的吸附分离膜,需增大冠醚环孔径
【答案】D【解析】A.Li+提供空轨道、O原子提供孤电子对,二者形成配位键,
A错误;B.冠醚环中碳氧键为单键,因此是σ键,B错误;C.聚酰亚胺薄膜
中含有酰胺基,在碱性条件下会发生水解,C错误;D.K+的半径比Li+大,因
此K+要与冠醚环作用需要增大孔径,D正确;选D。
13.下列实验现象、结论或解释与实验操作相匹配的是
选项 实验操作 实验现象 结论或解释
将食品脱氧剂样品中的还原铁粉 食品脱氧剂中没有
A 溶液成浅绿色
溶于盐酸,滴加KSCN溶液 +3价铁
向沸水中逐滴加5~6滴饱和 液体先变成红褐 Fe3+先水解得
B
FeCl 溶液,持续煮沸 色,然后析出红褐 Fe(OH) 胶体,再聚
3 3
6
学科网(北京)股份有限公司色沉淀 集成Fe(OH) 沉淀
3
向2 mL KI溶液中滴加几滴溴 I 的氧化性比Br 的
2 2
C 溶液呈蓝色
水,振荡,再滴加2滴淀粉溶液 强
D 向某溶液中滴加CaCl 溶液 产生白色沉淀 溶液中一定含有CO
2
A.A B.B C.C D.D
【答案】B【解析】A.将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加KSCN
溶液,溶液呈浅绿色,Fe3+可能被Fe还原为Fe2+,该现象不能说明食品脱氧剂
样品中没有Fe3+,A不符合题意;B.向沸水中逐滴加5~6滴饱和FeCl 溶液,
3
持续煮沸,液体先变成红褐色,形成胶体,然后析出红褐色沉淀,胶体发生聚
沉,B符合题意;C.向2 mL KI溶液中滴加几滴溴水,振荡,再滴加2滴淀粉
溶液,溶液呈蓝色,说明Br 将I-氧化为I,说明Br 的氧化性比I 的强,C不
2 2 2 2
符合题意;D.向某溶液中滴加CaCl 溶液,产生白色沉淀,该白色沉淀可能是
2
CaCO 或AgCl等,溶液中不一定含有CO,D不符合题意;选B。
3
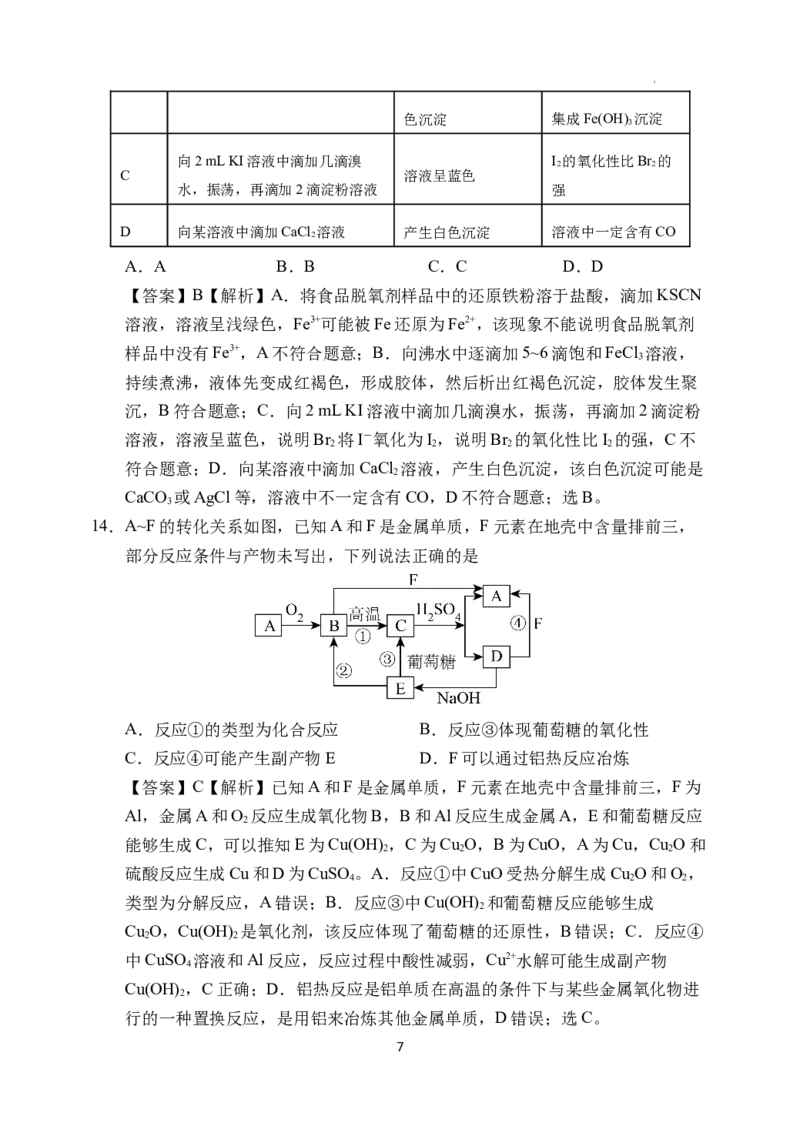
14.A~F的转化关系如图,已知A和F是金属单质,F元素在地壳中含量排前三,
部分反应条件与产物未写出,下列说法正确的是
A.反应①的类型为化合反应 B.反应③体现葡萄糖的氧化性
C.反应④可能产生副产物E D.F可以通过铝热反应冶炼
【答案】C【解析】已知A和F是金属单质,F元素在地壳中含量排前三,F为
Al,金属A和O 反应生成氧化物B,B和Al反应生成金属A,E和葡萄糖反应
2
能够生成C,可以推知E为Cu(OH) ,C为Cu O,B为CuO,A为Cu,Cu O和
2 2 2
硫酸反应生成Cu和D为CuSO 。A.反应①中CuO受热分解生成Cu O和O,
4 2 2
类型为分解反应,A错误;B.反应③中Cu(OH) 和葡萄糖反应能够生成
2
Cu O,Cu(OH) 是氧化剂,该反应体现了葡萄糖的还原性,B错误;C.反应④
2 2
中CuSO 溶液和Al反应,反应过程中酸性减弱,Cu2+水解可能生成副产物
4
Cu(OH) ,C正确;D.铝热反应是铝单质在高温的条件下与某些金属氧化物进
2
行的一种置换反应,是用铝来冶炼其他金属单质,D错误;选C。
7
学科网(北京)股份有限公司15.主族元素W、X、Y、Z原子序数依次增大,分别位于前四周期,X、Y的价电
子数相等,4种元素形成的化合物如图。下列说法正确的是
A.第一电离能:WK,A错误;B.同主族元素,
离子半径OH,
C正确;D.K的氧化物溶于水且与水反应生成强碱,S的最高价氧化物溶于水
且与水反应生成硫酸,因此,水溶液pH的大小关系为KOH>H SO ,D错误;
2 4
选C。
二.非选择题:本题共4小题,共55分。
16.(13分)铁元素在人体健康和新材料研发中有重要的应用。
I.在血液中,以Fe2+为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,
可用于输送O。如图1为载氧后的血红蛋白分子示意图。
2
(1)基态Fe2+的价电子轨道表示式为___________。
(2)载氧时,血红蛋白分子中Fe2+脱去配位的HO并与O 配位;若人体吸入
2 2
CO,则CO占据配位点,血红蛋白失去携氧功能。此条件下,与Fe2+配位能力
由强到弱的配体顺序是___________。
(3)该Fe2+配位化合物存在平衡Fe2++O Fe3++O,比较半径:Fe2+___ Fe3+
2
(填“>”或“<”)。
(4)一种最简单的卟啉环结构如图2所示。
8
学科网(北京)股份有限公司图1 图2 图3
① 比较C和N的电负性大小,并从原子结构角度说明理由:
___________。
②该卟啉分子中,1号位和2号位N的杂化方式分别是_____和______杂化。
③该卟啉分子在酸性环境中配位能力会减弱,原因是___________。
II.Fe2+可用于制备优良铁磁体材料。图3是一种铁磁体化合物的立方晶胞,其
边长为a nm。
(5)该晶体的密度是___________ 。
(6)距离Fe最近的F的个数为___________。
【答案】(1) (1分) (2)CO>O>H O(1分)
2 2
(3)>(1分) (4)①C的电负性小于N;C和N电子层数相同,核电荷
数C<N,原子半径C>N,原子核对最外层电子的吸引作用C<N,所以C的
电负性小于N的电负性(2分,结论1分,理由1分) ②sp2(1分);sp3
(1分) ③酸性环境中,卟啉分子中的N原子与H+形成配位键,导致提供
孤对电子的能力降低(2分) (5)246×1021/a3N (2分) (6)6(2分)
A
【解析】(1)铁元素的原子序数为26,基态Fe2+的价电子排布式为3d6,轨道
表示式: ;(2)载氧时,血红蛋白分子中亚铁离子脱去配位
的水并与氧气配位,说明氧分子与亚铁离子的配位能力强于水分子;若人体吸
入一氧化碳,则一氧化碳占据配位点,血红蛋白失去携氧功能说明一氧化碳与
亚铁离子的配位能力强于氧分子,所以与亚铁离子的配位能力由强到弱的配体
顺序是CO>O>HO;(3)Fe2+和Fe3+电子层数相同,核电荷数相同,Fe2+核
2 2
外电子数更多,半径更大;(4)①C和N电子层数相同,核电荷数C<N,原
子半径C>N,原子核对最外层电子的吸引作用C<N,所以C的电负性小于N
的电负性;②1号N原子形成2个σ键,含1对孤电子对,杂化轨道数为3,为
sp2杂化,2号位N原子形成3个 键,含1对孤电子对,杂化轨道数为4,为
9
学科网(北京)股份有限公司sp3杂化;分子中存在大 键,则1号氮原子有1个电子参与形成大 键,2号氮
原子孤电子对参与形成大 键,故1号氮原子更容易给出孤电子对形成配位键;
③酸性环境中,卟啉分子中的氮原子与氢离子形成配位键,导致提供孤对电子
的能力降低,所以卟啉分子在酸性环境中配位能力会减弱;(5)由晶胞结构可
知,晶胞中位于顶点的铁原子个数:8×1/8=1,位于体心的铯原子个数1,位于
棱上的氟原子个数:12×1/4=3,则晶胞的化学式为CsFeF ,晶胞密度:
3
ρ=m/V=M/(N V)=(1×133+1×56+3×19)/[N ×(a×10−7)3]=246×1021/a3N g·cm−3;
A A A
(6)距离Fe最近的F位于棱心,每个晶胞中距离Fe最近的F有3个,顶点的
Fe被8个晶胞所共用,则距离Fe最近的F的个数为6。
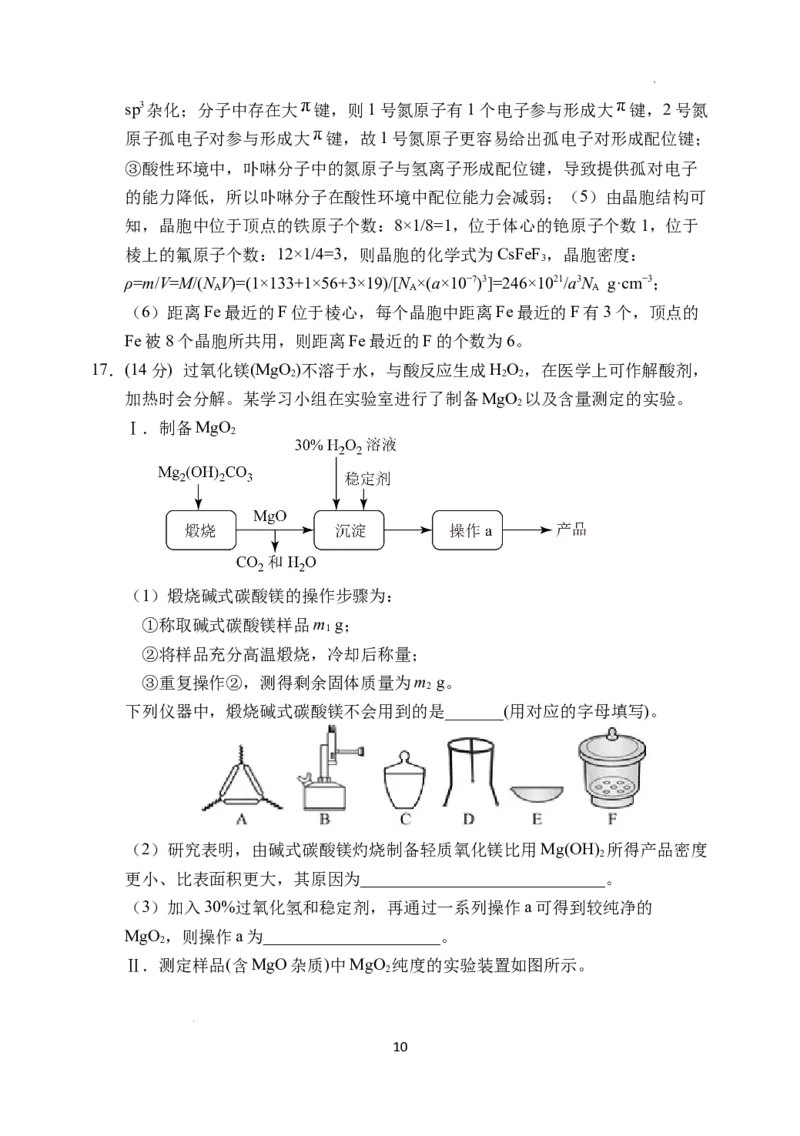
17.(14分) 过氧化镁(MgO )不溶于水,与酸反应生成HO,在医学上可作解酸剂,
2 2 2
加热时会分解。某学习小组在实验室进行了制备MgO 以及含量测定的实验。
2
Ⅰ.制备MgO
2
(1)煅烧碱式碳酸镁的操作步骤为:
①称取碱式碳酸镁样品m g;
1
②将样品充分高温煅烧,冷却后称量;
③重复操作②,测得剩余固体质量为m g。
2
下列仪器中,煅烧碱式碳酸镁不会用到的是_______(用对应的字母填写)。
(2)研究表明,由碱式碳酸镁灼烧制备轻质氧化镁比用Mg(OH) 所得产品密度
2
更小、比表面积更大,其原因为_____________________________。
(3)加入30%过氧化氢和稳定剂,再通过一系列操作a可得到较纯净的
MgO ,则操作a为_____________________。
2
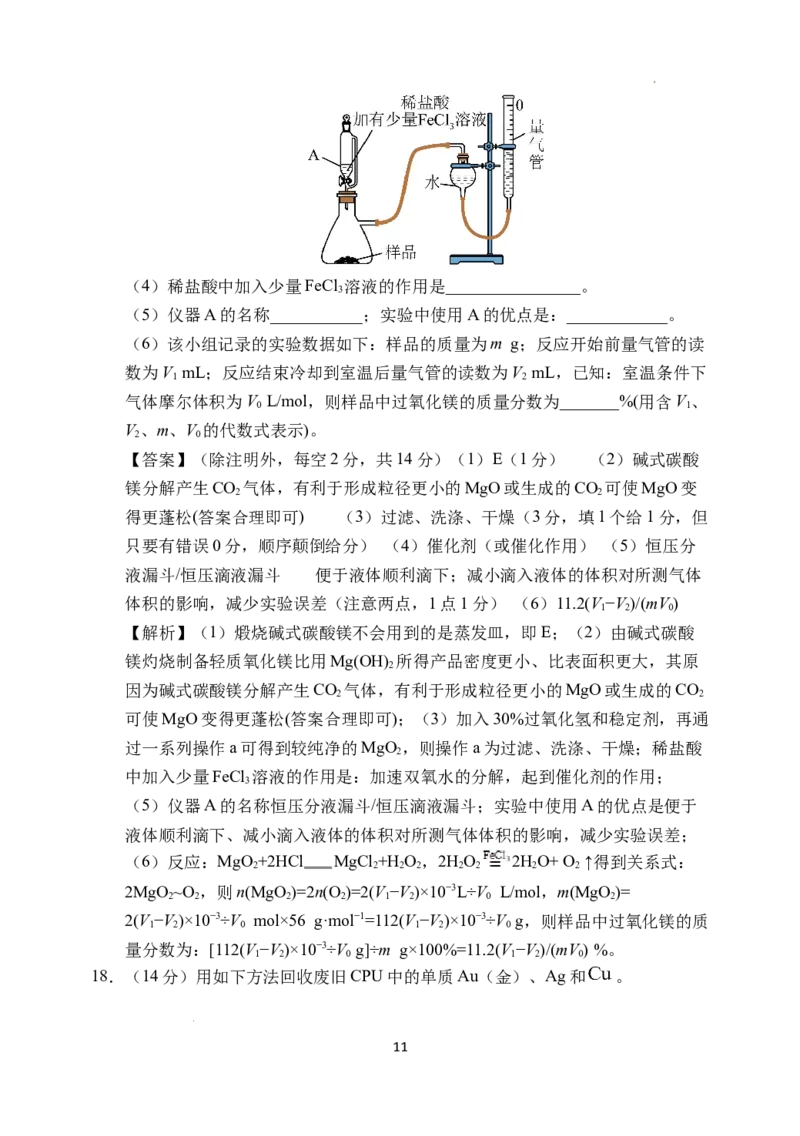
Ⅱ.测定样品(含MgO杂质)中MgO 纯度的实验装置如图所示。
2
10
学科网(北京)股份有限公司(4)稀盐酸中加入少量FeCl 溶液的作用是________________。
3
(5)仪器A的名称___________;实验中使用A的优点是:____________。
(6)该小组记录的实验数据如下:样品的质量为m g;反应开始前量气管的读
数为V mL;反应结束冷却到室温后量气管的读数为V mL,已知:室温条件下
1 2
气体摩尔体积为V L/mol,则样品中过氧化镁的质量分数为_______%(用含V、
0 1
V、m、V 的代数式表示)。
2 0
【答案】(除注明外,每空2分,共14分)(1)E(1分) (2)碱式碳酸
镁分解产生CO 气体,有利于形成粒径更小的MgO或生成的CO 可使MgO变
2 2
得更蓬松(答案合理即可) (3)过滤、洗涤、干燥(3分,填1个给1分,但
只要有错误0分,顺序颠倒给分) (4)催化剂(或催化作用) (5)恒压分
液漏斗/恒压滴液漏斗 便于液体顺利滴下;减小滴入液体的体积对所测气体
体积的影响,减少实验误差(注意两点,1点1分) (6)11.2(V−V)/(mV)
1 2 0
【解析】(1)煅烧碱式碳酸镁不会用到的是蒸发皿,即E;(2)由碱式碳酸
镁灼烧制备轻质氧化镁比用Mg(OH) 所得产品密度更小、比表面积更大,其原
2
因为碱式碳酸镁分解产生CO 气体,有利于形成粒径更小的MgO或生成的CO
2 2
可使MgO变得更蓬松(答案合理即可);(3)加入30%过氧化氢和稳定剂,再通
过一系列操作a可得到较纯净的MgO ,则操作a为过滤、洗涤、干燥;稀盐酸
2
中加入少量FeCl 溶液的作用是:加速双氧水的分解,起到催化剂的作用;
3
(5)仪器A的名称恒压分液漏斗/恒压滴液漏斗;实验中使用A的优点是便于
液体顺利滴下、减小滴入液体的体积对所测气体体积的影响,减少实验误差;
(6)反应:MgO
2
+2HCl MgCl
2
+H
2
O
2
,2H
2
O
2
2H
2
O+ O
2
↑得到关系式:
2MgO ~O ,则n(MgO )=2n(O )=2(V−V)×10−3L÷V L/mol,m(MgO )=
2 2 2 2 1 2 0 2
2(V−V)×10−3÷V mol×56 g·mol−1=112(V−V)×10−3÷V g,则样品中过氧化镁的质
1 2 0 1 2 0
量分数为:[112(V−V)×10−3÷V g]÷m g×100%=11.2(V−V)/(mV)%。
1 2 0 1 2 0
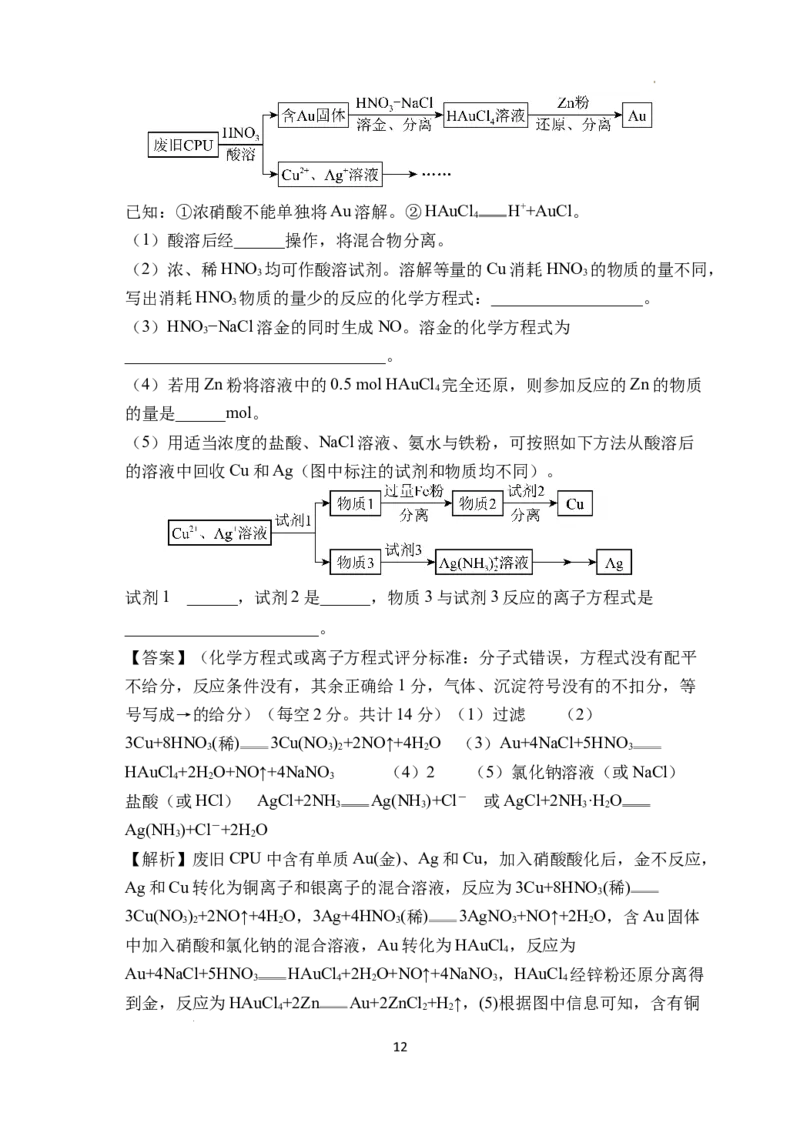
18.(14分)用如下方法回收废旧CPU中的单质Au(金)、Ag和 。
11
学科网(北京)股份有限公司已知:①浓硝酸不能单独将Au溶解。②HAuCl H++AuCl。
4
(1)酸溶后经______操作,将混合物分离。
(2)浓、稀HNO 均可作酸溶试剂。溶解等量的Cu消耗HNO 的物质的量不同,
3 3
写出消耗HNO 物质的量少的反应的化学方程式:__________________。
3
(3)HNO−NaCl溶金的同时生成NO。溶金的化学方程式为
3
_______________________________。
(4)若用Zn粉将溶液中的0.5 mol HAuCl 完全还原,则参加反应的Zn的物质
4
的量是______mol。
(5)用适当浓度的盐酸、NaCl溶液、氨水与铁粉,可按照如下方法从酸溶后
的溶液中回收Cu和Ag(图中标注的试剂和物质均不同)。
试剂1 是______,试剂2是______,物质3与试剂3反应的离子方程式是
_______________________。
【答案】(化学方程式或离子方程式评分标准:分子式错误,方程式没有配平
不给分,反应条件没有,其余正确给1分,气体、沉淀符号没有的不扣分,等
号写成→的给分)(每空2分。共计14分)(1)过滤 (2)
3Cu+8HNO (稀) 3Cu(NO )+2NO↑+4HO (3)Au+4NaCl+5HNO
3 3 2 2 3
HAuCl +2H O+NO↑+4NaNO (4)2 (5)氯化钠溶液(或NaCl)
4 2 3
盐酸(或HCl) AgCl+2NH Ag(NH)+Cl- 或AgCl+2NH·H O
3 3 3 2
Ag(NH)+Cl-+2H O
3 2
【解析】废旧CPU中含有单质Au(金)、Ag和Cu,加入硝酸酸化后,金不反应,
Ag和Cu转化为铜离子和银离子的混合溶液,反应为3Cu+8HNO (稀)
3
3Cu(NO )+2NO↑+4HO,3Ag+4HNO (稀) 3AgNO+NO↑+2HO,含Au固体
3 2 2 3 3 2
中加入硝酸和氯化钠的混合溶液,Au转化为HAuCl ,反应为
4
Au+4NaCl+5HNO HAuCl +2H O+NO↑+4NaNO ,HAuCl 经锌粉还原分离得
3 4 2 3 4
到金,反应为HAuCl +2Zn Au+2ZnCl +H ↑,(5)根据图中信息可知,含有铜
4 2 2
12
学科网(北京)股份有限公司离子和银离子的溶液加入试剂1后得到的是物质1和物质3,物质3加入试剂3
后得到的是二氨合银离子,试剂3是氨水,物质3是氯化银,试剂1是NaCl溶
液,物质1是氯化铜,氯化铜加入过量铁粉得到铜和亚铁离子,经过试剂2,过
滤后得到铜单质,试剂2是盐酸,除去过量的铁粉,物质3是AgCl,与试剂3
氨水反应生成Ag(NH),Ag(NH)经过还原可以得到银单质,实现了铜和银的分
3 3
离,据此分析解答。(1)Au(金)、Ag和Cu经酸溶后得到含Au固体、铜离子
和银离子的混合溶液,将固体和液体分开的操作是过滤;(2)铜与稀硝酸的反
应为3Cu+8HNO(稀) 3Cu(NO )+2NO↑+4HO,溶解1 mol Cu消耗8/3 mol
3 3 2 2
HNO,铜与浓硝酸的反应为Cu+4HNO (浓) Cu(NO )+2NO↑+2H O,溶解1
3 3 3 2 2 2
mol Cu消耗4 mol HNO,则消耗HNO 物质的量少的反应的化学方程式为
3 3
3Cu+8HNO (稀) 3Cu(NO )+2NO↑+4HO;(3)含Au固体中加入硝酸和氯化钠
3 3 2 2
的混合溶液,Au转化为HAuCl ,反应为Au+4NaCl+5HNO
4 3
HAuCl +2H O+NO↑+4NaNO ;(4)由于HAuCl =H++AuCl,若用Zn粉将溶液中
4 2 3 4
的 1mol HAuCl 完全还原,HAuCl 中金的化合价为+3价,被锌还原为0价,锌
4 4
的化合价从0价升高到+2价,参加反应的Zn的物质的量x,锌的化合价从0价
升高到+2价,根据得失电子守恒可知:2x=3,x=1.5 mol,则参加反应的Zn的
物质的量是1.5 mol,另外1 mol HAuCl 中H+可消耗0.5 mol Zn,共2 mol;
4
(5)根据图中信息可知,含有铜离子和银离子的溶液加入试剂1(NaCl)后得
到的是物质1是CuCl 、NaNO 和物质3是AgCl,AgCl加入试剂3氨水后反应
2 3
的离子方程式是AgCl+2NH Ag(NH)+Cl-或AgCl+2NH·H O
3 3 3 2
Ag(NH)+Cl-+2H O,试剂3是氨水,物质3是氯化银,试剂1是NaCl溶液,物
3 2
质1是氯化铜和硝酸钠的混合物,氯化铜加入过量铁粉得到铜和亚铁离子,经
过试剂2,过滤后得到铜单质,试剂2是盐酸,除去过量的铁粉,二氨合银离子
经过还原可以得到银单质,实现了铜和银的分离,试剂1是NaCl溶液,试剂2
是盐酸。
19.(14分)元素周期律的发现和元素周期表的诞生,开创了化学科学的新纪元。
从此,人们对丰富多彩的物质世界的认识更加系统。回答下列问题:
(1)Cu在周期表中的位置是_______。
(2)下列有关性质的比较,能用元素周期律解释的是_______。
a.酸性:HSO >H CO b.金属性:Ca>Al
2 3 2 3
c.热稳定性:NaCO>NaHCO d.碱性:NaOH>Mg(OH)
2 3 3 2
(3)比较Br和I的非金属性,从原子结构角度解释原因______________。
13
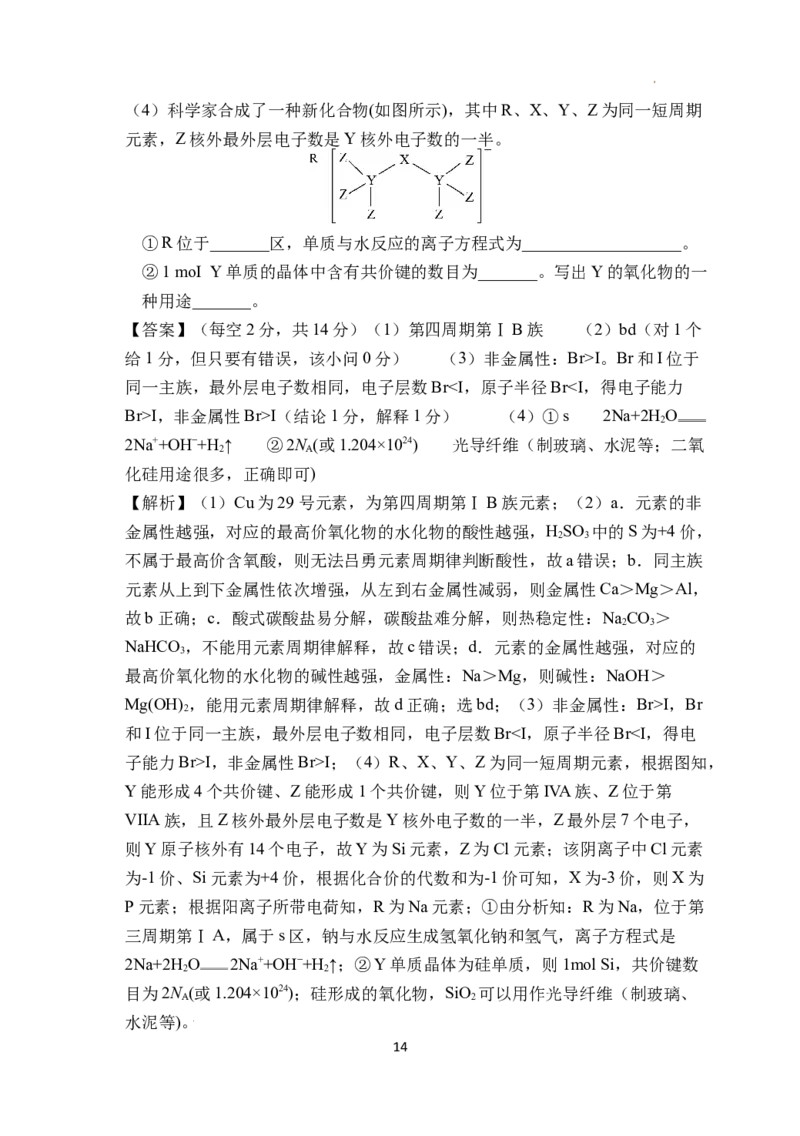
学科网(北京)股份有限公司(4)科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期
元素,Z核外最外层电子数是Y核外电子数的一半。
①R位于_______区,单质与水反应的离子方程式为___________________。
②1 moI Y单质的晶体中含有共价键的数目为_______。写出Y的氧化物的一
种用途_______。
【答案】(每空2分,共14分)(1)第四周期第ⅠB族 (2)bd(对1个
给1分,但只要有错误,该小问0分) (3)非金属性:Br>I。Br和I位于
同一主族,最外层电子数相同,电子层数BrI,非金属性Br>I(结论1分,解释1分) (4)①s 2Na+2HO
2
2Na++OH−+H ↑ ②2N (或1.204×1024) 光导纤维(制玻璃、水泥等;二氧
2 A
化硅用途很多,正确即可)
【解析】(1)Cu为29号元素,为第四周期第ⅠB族元素;(2)a.元素的非
金属性越强,对应的最高价氧化物的水化物的酸性越强,HSO 中的S为+4价,
2 3
不属于最高价含氧酸,则无法吕勇元素周期律判断酸性,故a错误;b.同主族
元素从上到下金属性依次增强,从左到右金属性减弱,则金属性Ca>Mg>Al,
故b正确;c.酸式碳酸盐易分解,碳酸盐难分解,则热稳定性:NaCO>
2 3
NaHCO ,不能用元素周期律解释,故c错误;d.元素的金属性越强,对应的
3
最高价氧化物的水化物的碱性越强,金属性:Na>Mg,则碱性:NaOH>
Mg(OH) ,能用元素周期律解释,故d正确;选bd;(3)非金属性:Br>I,Br
2
和I位于同一主族,最外层电子数相同,电子层数BrI,非金属性Br>I;(4)R、X、Y、Z为同一短周期元素,根据图知,
Y能形成4个共价键、Z能形成1个共价键,则Y位于第IVA族、Z位于第
VIIA族,且Z核外最外层电子数是Y核外电子数的一半,Z最外层7个电子,
则Y原子核外有14个电子,故Y为Si元素,Z为Cl元素;该阴离子中Cl元素
为-1价、Si元素为+4价,根据化合价的代数和为-1价可知,X为-3价,则X为
P元素;根据阳离子所带电荷知,R为Na元素;①由分析知:R为Na,位于第
三周期第ⅠA,属于s区,钠与水反应生成氢氧化钠和氢气,离子方程式是
2Na+2HO 2Na++OH−+H ↑;②Y单质晶体为硅单质,则1mol Si,共价键数
2 2
目为2N (或1.204×1024);硅形成的氧化物,SiO 可以用作光导纤维(制玻璃、
A 2
水泥等)。
14
学科网(北京)股份有限公司