文档内容
赤峰二中 2024 级高一上学期第一次月考
化学试题
本试卷共19道题,满分100分。考试时间75分钟
(答案填写在答题卡上) 2024年10月19日
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32
Cl-35.5 Mn-55 Fe-56 Cu-64 Ag-108 Ba-137
第Ⅰ卷(共45分)
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个正确选项)
1. 中国历史悠久,文化灿烂。下列有关说法或解释不合理的是
A.我国古代用明矾净水,是因为明矾溶于水生成一种能凝聚水中悬浮物的胶状物
质
B.《抱朴子内篇·黄白》记载“曾青(硫酸铜)涂铁,铁赤色如铜”,该过程涉及置
换反应
C.《江楼夜话》中有诗句“江雾秋楼白,灯花夜雨青”,描写的雾是一种液溶胶
D.《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即指牡蛎壳之类的贝壳),
并把这种灰称为“蜃”,“蜃”的主要成分可以作干燥剂
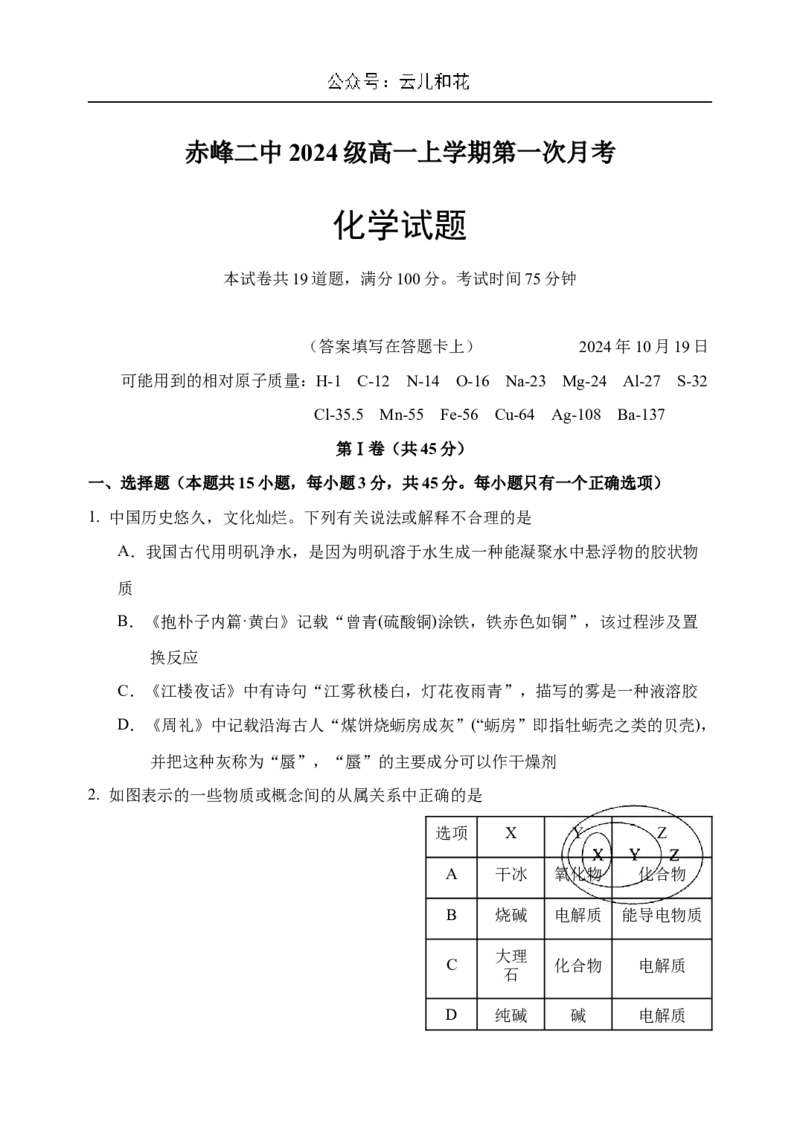
2. 如图表示的一些物质或概念间的从属关系中正确的是
选项 X Y Z
A 干冰 氧化物 化合物
B 烧碱 电解质 能导电物质
大理
C 化合物 电解质
石
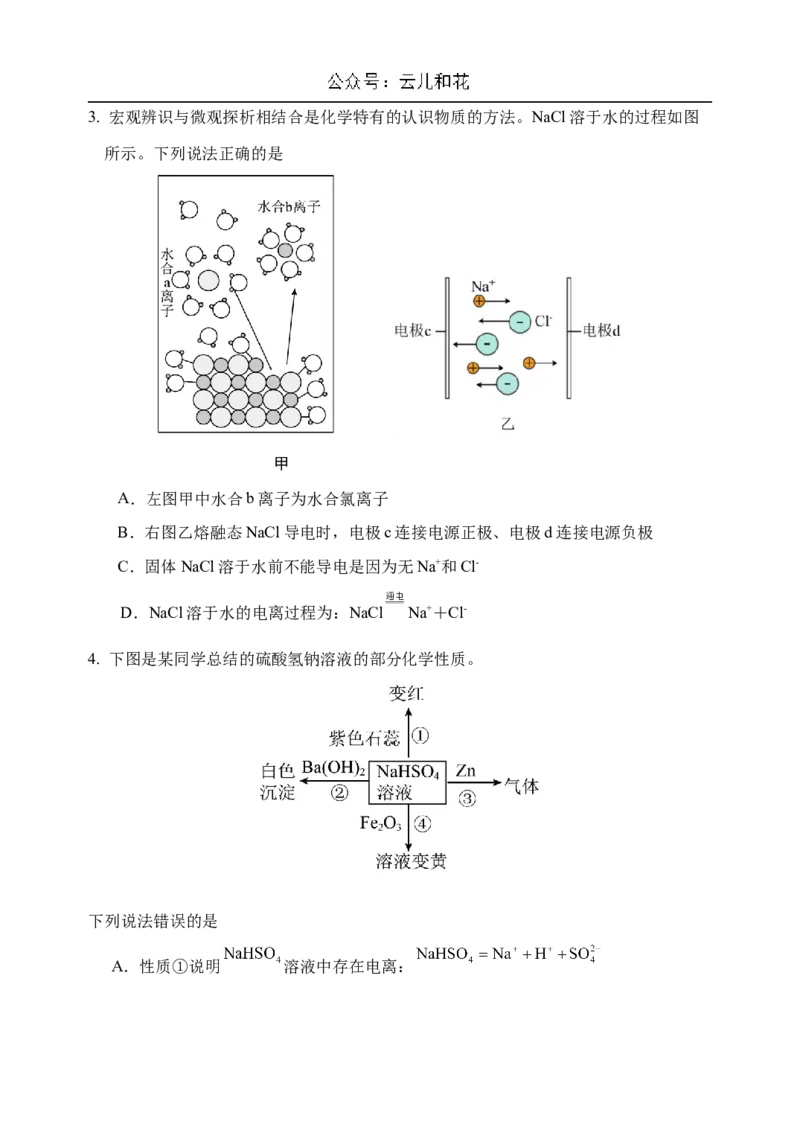
D 纯碱 碱 电解质3. 宏观辨识与微观探析相结合是化学特有的认识物质的方法。NaCl溶于水的过程如图
所示。下列说法正确的是
甲
A.左图甲中水合b离子为水合氯离子
B.右图乙熔融态NaCl导电时,电极c连接电源正极、电极d连接电源负极
C.固体NaCl溶于水前不能导电是因为无Na+和Cl-
D.NaCl溶于水的电离过程为:NaCl Na++Cl-
4. 下图是某同学总结的硫酸氢钠溶液的部分化学性质。
下列说法错误的是
A.性质①说明 溶液中存在电离:B.性质②中发生反应的离子方程式为
C.性质③中反应生成的气体是 ,该反应本质上属于置换反应
D.以上性质说明 溶液具有酸的通性,在某些反应中可以代替稀
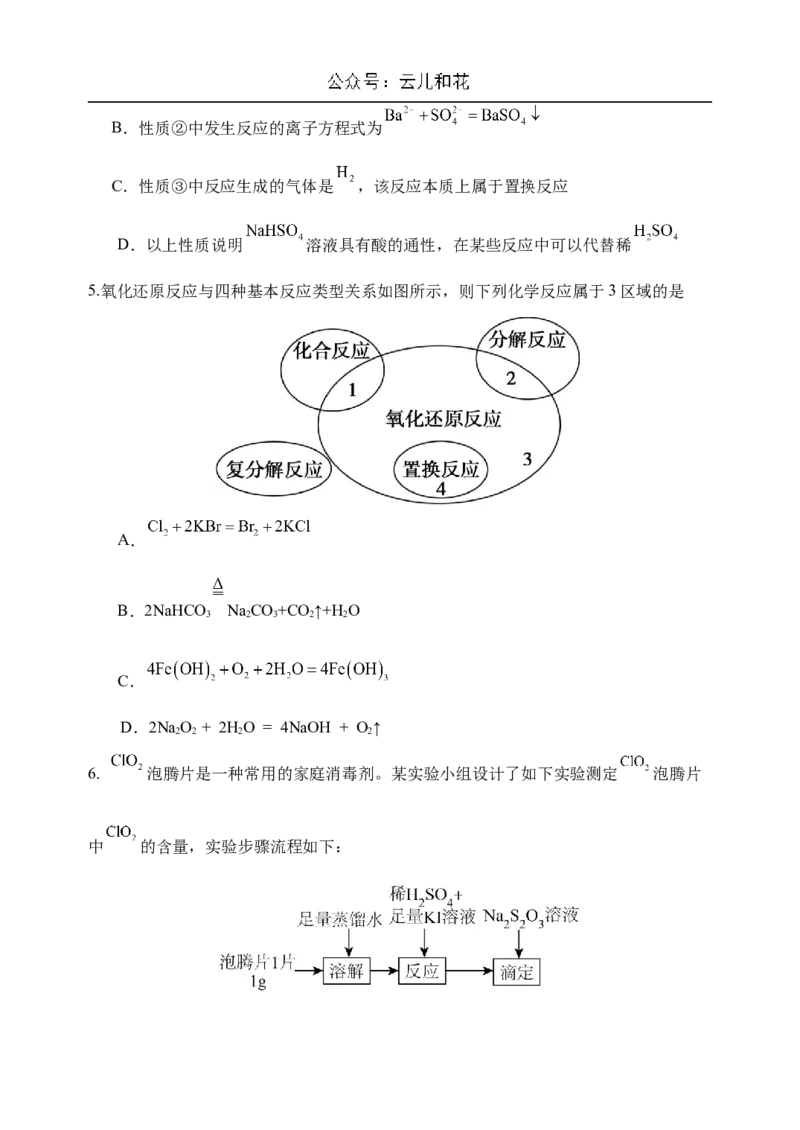
5.氧化还原反应与四种基本反应类型关系如图所示,则下列化学反应属于3区域的是
A.
B.2NaHCO NaCO+CO ↑+H O
3 2 3 2 2
C.
D.2NaO + 2HO = 4NaOH + O↑
2 2 2 2
6. 泡腾片是一种常用的家庭消毒剂。某实验小组设计了如下实验测定 泡腾片
中 的含量,实验步骤流程如下:已知:①反应原理: ,
滴定原理: ;
② 泡腾片说明书中所示的 的含量为 片。
下列有关说法不正确的是
A.氧化性:
B.上述涉及的反应中仅有2种元素化合价发生变化
C.“溶解”步骤中需要使用的玻璃仪器有玻璃棒、烧杯
D.实际测得 的含量为 /片,可能原因是在“反应”步骤中, 参与了反
应
7. 正确掌握化学用语是学好化学的基础。能正确解释下列反应原理,且离子方程式书写
正确的的是
A. 用FeCl 溶液腐蚀铜线路板:Cu + Fe3+ = Cu2+ + Fe2+
3
B. 用食醋检验牙膏中的碳酸钙:
C. 亚硫酸氢钠溶液和氢氧化钠反应:
D. CO 通入CaCl 溶液中: Ca2+ + CO + H O = CaCO ↓+ 2H+
2 2 2 2 3
8. 在下列条件下,一定能大量共存的离子组是
A.强碱性溶液中: 、 、 、
B.使酚酞溶液呈红色的溶液中: 、 、 、
C.澄清透明的溶液中: 、 、 、D.含有大量 的水溶液中: 、 、 、
9. 中国科学技术大学的钱逸泰教授等以 和金属钠为原料制造出纳
米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科
学家们高度评价为“稻草变黄金”,其化学方程式为
(金刚石) 。下列关于该反应的说法不正确的是
A.金刚石是由 原子构成的单质,它与碳纳米管、石墨烯互为同素异形体
B.该纳米级金刚石粉末溶于水形成的分散系能产生丁达尔效应
C.该反应利用了 的强还原性
D.该反应得到的 固体常温下可以导电
10. 为探究钠的部分性质,设计实验操作如下:①向如图所示的试管中加入苯(苯的密度
为0.86 g·cm-3,不溶于水);②拔出大头 针,使Na(密度为0.97 g·cm-3)落入苯中(钠与苯
不反应);③从长颈漏斗中加入MgCl 溶液(密度约为1.2 g·cm-3)。下列说法中正确的是
2
A.把MgCl 溶液加入苯中,MgCl 溶液在上层
2 2
B.钠一直停留在苯层不发生反应
C.Na在MgCl 溶液底部四处游动,MgCl 溶液中有白色沉淀产生
2 2
D.Na在MgCl 溶液与苯的界面处反应,并上下跳动直至消失,下
2
层有白色沉淀产生
11. 下列各组物质的分类正确的有几项
①氯水、氨水、碱石灰、福尔马林均属于混合物
②含有氧元素的化合物叫氧化物
③根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
④非金属氧化物为酸性氧化物,金属氧化物为碱性氧化物
⑤强电解质溶液的导电能力一定比弱电解质强⑥有单质参加的反应或有单质生成的反应是氧化还原反应
⑦氨水属于混合物,而液氯、冰醋酸均属于纯净物
⑧能电离出H+的纯净物属于酸
A.只有1项 B.2项 C.3项 D.4项
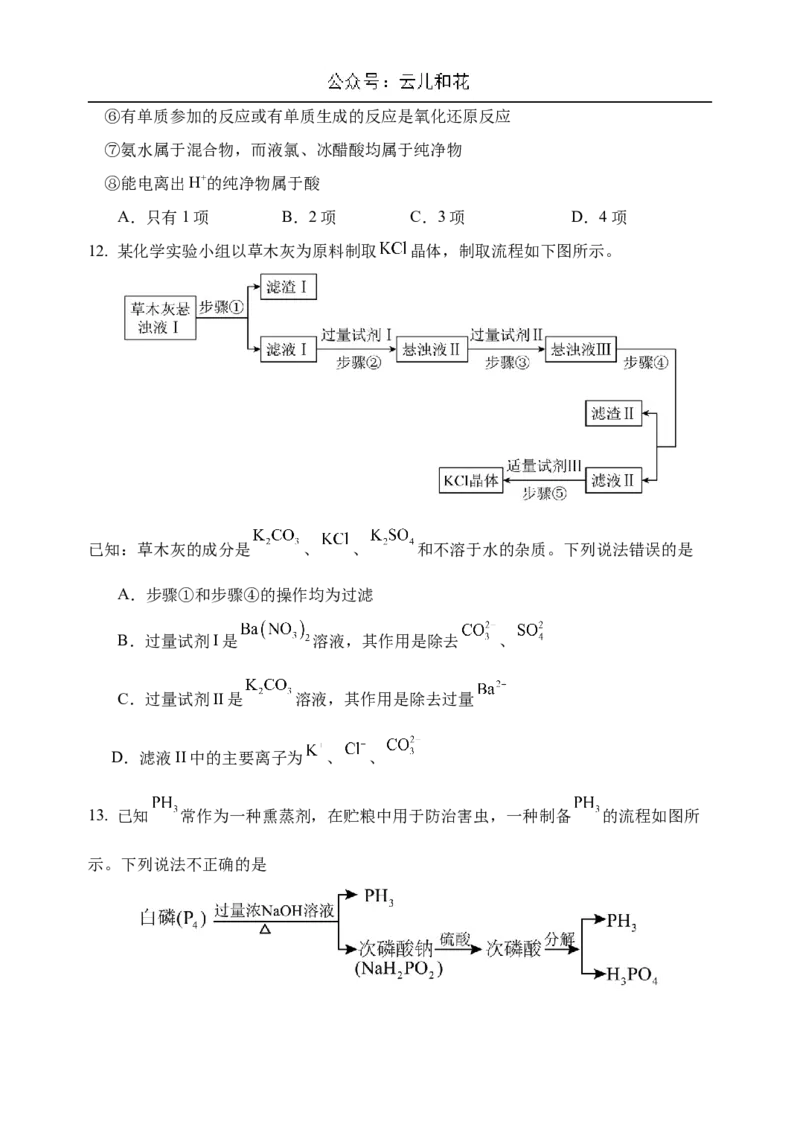
12. 某化学实验小组以草木灰为原料制取 晶体,制取流程如下图所示。
已知:草木灰的成分是 、 、 和不溶于水的杂质。下列说法错误的是
A.步骤①和步骤④的操作均为过滤
B.过量试剂I是 溶液,其作用是除去 、
C.过量试剂II是 溶液,其作用是除去过量
D.滤液II中的主要离子为 、 、
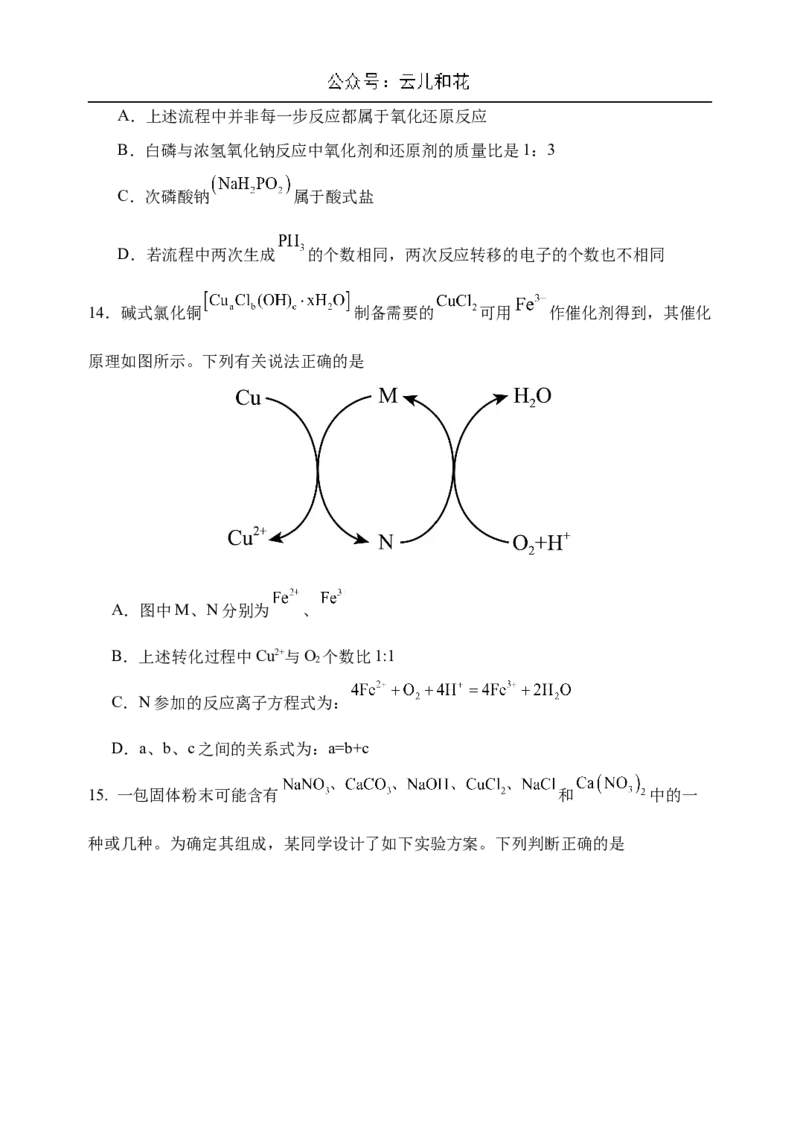
13. 已知 常作为一种熏蒸剂,在贮粮中用于防治害虫,一种制备 的流程如图所
示。下列说法不正确的是A.上述流程中并非每一步反应都属于氧化还原反应
B.白磷与浓氢氧化钠反应中氧化剂和还原剂的质量比是1:3
C.次磷酸钠 属于酸式盐
D.若流程中两次生成 的个数相同,两次反应转移的电子的个数也不相同
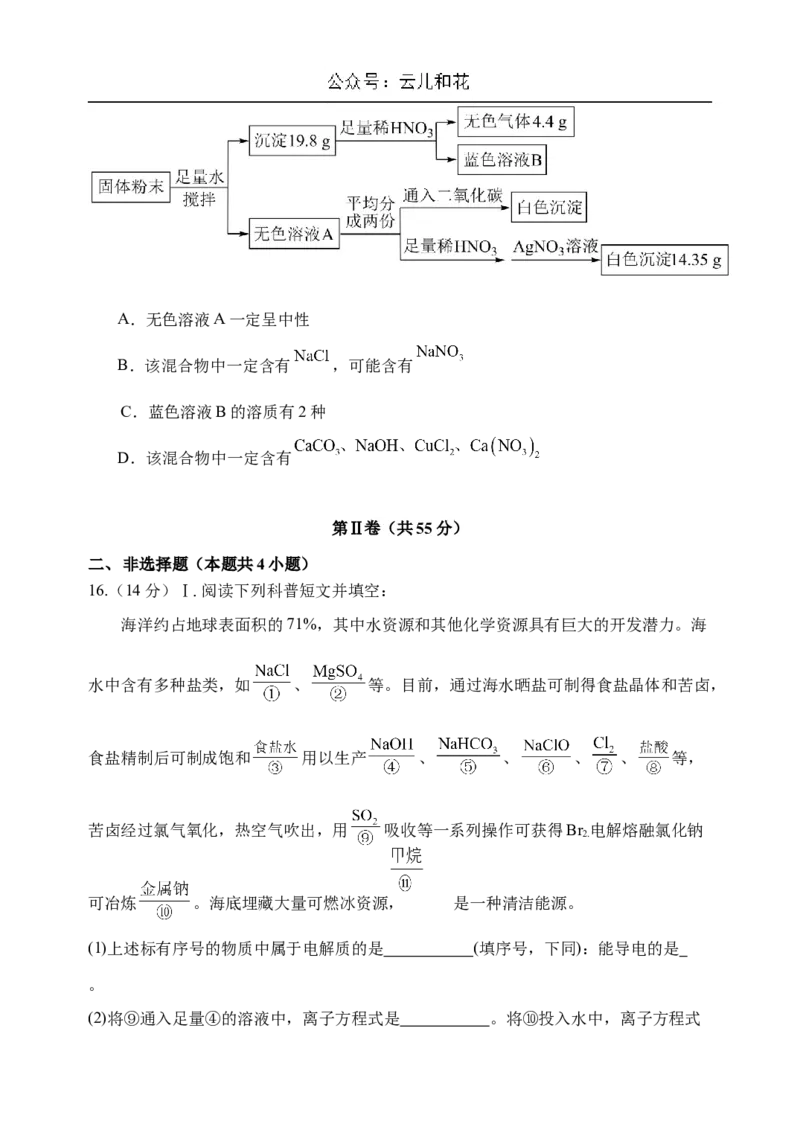
14.碱式氯化铜 制备需要的 可用 作催化剂得到,其催化
原理如图所示。下列有关说法正确的是
A.图中M、N分别为 、
B.上述转化过程中Cu2+与O 个数比1:1
2
C.N参加的反应离子方程式为:
D.a、b、c之间的关系式为:a=b+c
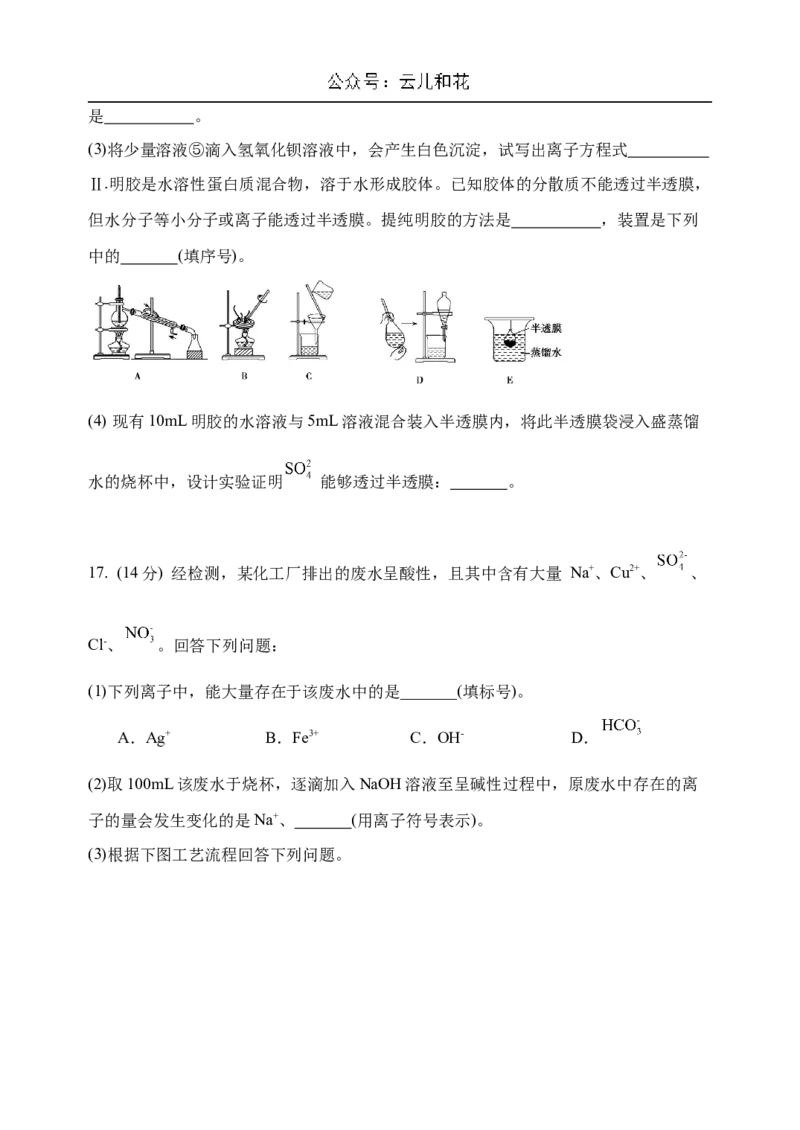
15. 一包固体粉末可能含有 和 中的一
种或几种。为确定其组成,某同学设计了如下实验方案。下列判断正确的是A.无色溶液A一定呈中性
B.该混合物中一定含有 ,可能含有
C.蓝色溶液B的溶质有2种
D.该混合物中一定含有
第Ⅱ卷(共55分)
二、非选择题(本题共4小题)
16.(14分)Ⅰ.阅读下列科普短文并填空:
海洋约占地球表面积的71%,其中水资源和其他化学资源具有巨大的开发潜力。海
水中含有多种盐类,如 、 等。目前,通过海水晒盐可制得食盐晶体和苦卤,
食盐精制后可制成饱和 用以生产 、 、 、 、 等,
苦卤经过氯气氧化,热空气吹出,用 吸收等一系列操作可获得Br 电解熔融氯化钠
2.
可冶炼 。海底埋藏大量可燃冰资源, 是一种清洁能源。
(1)上述标有序号的物质中属于电解质的是 (填序号,下同):能导电的是
。
(2)将⑨通入足量④的溶液中,离子方程式是 。将⑩投入水中,离子方程式是 。
(3)将少量溶液⑤滴入氢氧化钡溶液中,会产生白色沉淀,试写出离子方程式 。
Ⅱ.明胶是水溶性蛋白质混合物,溶于水形成胶体。已知胶体的分散质不能透过半透膜,
但水分子等小分子或离子能透过半透膜。提纯明胶的方法是 ,装置是下列
中的 (填序号)。
(4) 现有10mL明胶的水溶液与5mL溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏
水的烧杯中,设计实验证明 能够透过半透膜: 。
17. (14分) 经检测,某化工厂排出的废水呈酸性,且其中含有大量 Na+、Cu2+、 、
Cl-、 。回答下列问题:
(1)下列离子中,能大量存在于该废水中的是_______(填标号)。
A.Ag+ B.Fe3+ C.OH- D.
(2)取100mL该废水于烧杯,逐滴加入NaOH溶液至呈碱性过程中,原废水中存在的离
子的量会发生变化的是Na+、 (用离子符号表示)。
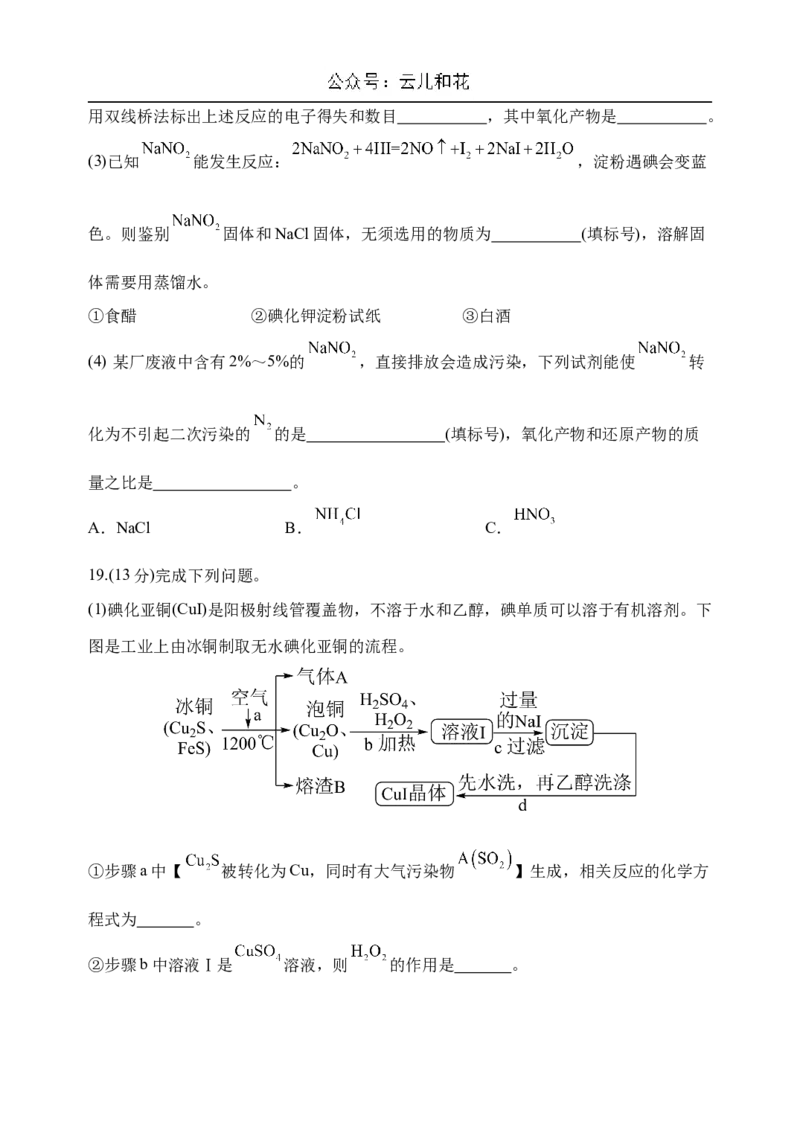
(3)根据下图工艺流程回答下列问题。①“分离操作”的名称是 ,需用到的玻璃仪器主要有 。
②向“白色沉淀2”中加入足量盐酸,发生反应的离子方程式为 。
(5) 配平下列反应方程式,并用单线桥表示电子的转移。
__
18.(14分)完成下列问题。
(1)HNO 是一种弱酸,且不稳定,易分解生成NO和NO ;它是一种还原剂,能被常见
2 2
的强氧化剂氧化,但在酸性溶液中它也是一种氧化剂,如能把 氧化成 。人体正
常的血红蛋白含有 。若误食亚硝酸盐如(NaNO ),则导致血红蛋白中的 转化为
2
而中毒,可以服用维生素 可解毒。下列叙述不正确的是 (填序号)。
A.亚硝酸盐被氧化 B.维生素 是还原剂
C.维生素 将 还原为 D.亚硝酸盐是还原剂
(2) 是食品防腐剂,常用于肉类食品保鲜。但亚硝酸钠具有一定的毒性,还会与
食物作用生成致癌物,因此食品中用量和残留量均有严格规定。某实验小组欲用酸性
测定 样品的纯度。
5NO - + 2MnO - + 6H+ = 5NO - + 2Mn2+ + 3HO
2 4 3 2用双线桥法标出上述反应的电子得失和数目 ,其中氧化产物是 。
(3)已知 能发生反应: ,淀粉遇碘会变蓝
色。则鉴别 固体和NaCl固体,无须选用的物质为 (填标号),溶解固
体需要用蒸馏水。
①食醋 ②碘化钾淀粉试纸 ③白酒
(4) 某厂废液中含有2%~5%的 ,直接排放会造成污染,下列试剂能使 转
化为不引起二次污染的 的是 (填标号),氧化产物和还原产物的质
量之比是 。
A.NaCl B. C.
19.(13分)完成下列问题。
(1)碘化亚铜(CuI)是阳极射线管覆盖物,不溶于水和乙醇,碘单质可以溶于有机溶剂。下
图是工业上由冰铜制取无水碘化亚铜的流程。
①步骤a中【 被转化为Cu,同时有大气污染物 】生成,相关反应的化学方
程式为 。
②步骤b中溶液Ⅰ是 溶液,则 的作用是 。③步骤c中有 生成,则发生反应的离子方程式为 。
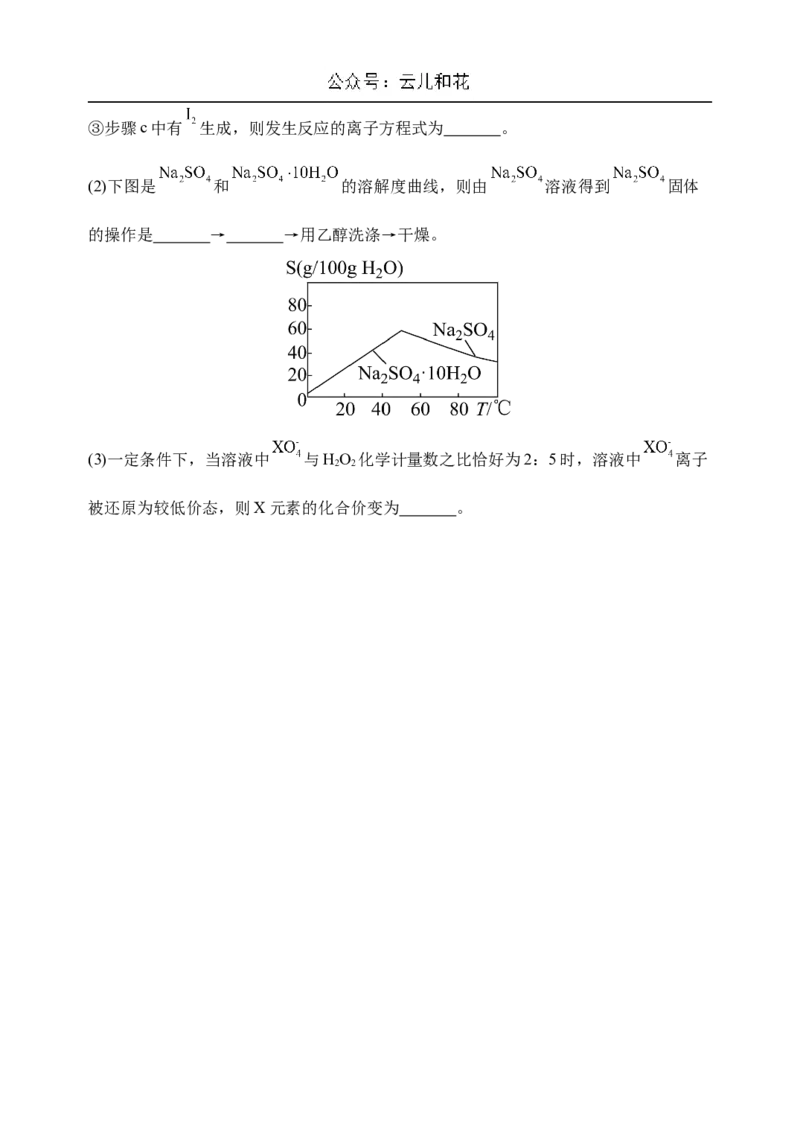
(2)下图是 和 的溶解度曲线,则由 溶液得到 固体
的操作是 → →用乙醇洗涤→干燥。
(3)一定条件下,当溶液中 与HO 化学计量数之比恰好为2:5时,溶液中 离子
2 2
被还原为较低价态,则X元素的化合价变为 。20241019 高一化学第一次月考参考答案
选择每题3分,共45分。 CABBD BCCDD BBCCD
16(14分)
Ⅰ.(1) ①②④⑤⑥ ③⑧⑩
(2)
(3) HCO - + OH- + Ba2+ = BaCO↓ + H O
3 3 2
Ⅱ.渗析(1分) E(1分)
(4)取烧杯中少量液体于试管中,向其中加入HCl,无明显现象,再滴加BaCl 溶液,产生
2
白色沉淀,则证明有
17(14分)
(1)B
(2) 、Cu2+
(3) 过滤 漏斗、玻璃棒、烧杯
(4) (4分)配平2分单线桥2分(略)配平
错直接扣4分
18(14分)
(1) AD (3分) 只选A或只选D给2分,有错就0分
(2) (3分) (1分)
(3)③
(4)B (3分) 1:1
19(13分)
(1) Cu S+O 2Cu+SO 作氧化剂、将氧化亚铜、铜氧化生成硫酸铜 2Cu2+
2 2 2
+4I-=2CuI↓+I (3分)
2
(2) 蒸发结晶 趁热过滤
(3) +2