文档内容
2025-2026 学年上学期期末考试
高一年级 化学
本试卷共10页。考试结束后,将答题卡交回。
注意事项:1.答卷前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在考生信息条
形码粘贴区。
2.答题时请按要求用笔。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;
在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Fe 56
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项符合题目
要求。
1.化学与生活、社会发展息息相关,下列有关说法不正确的是
A.节日庆典中烟花点燃后焰火的五彩斑斓与金属元素的焰色有关
B.漂白粉敞口露置保存,可提高漂白效率
C.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入铁粉包
D.新型储氢合金材料的研究和开发为氢气能源的实际应用起到重要的推动作用
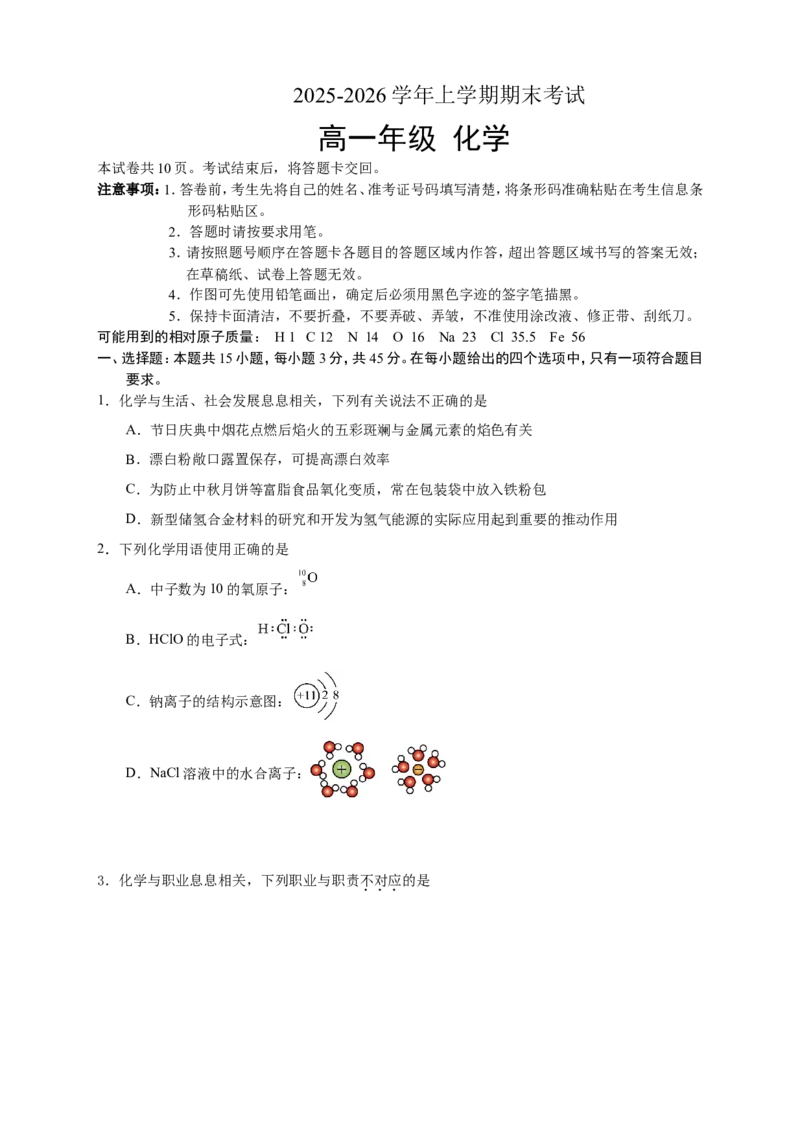
2.下列化学用语使用正确的是
A.中子数为10的氧原子:
B.HClO的电子式:
C.钠离子的结构示意图:
D.NaCl溶液中的水合离子:
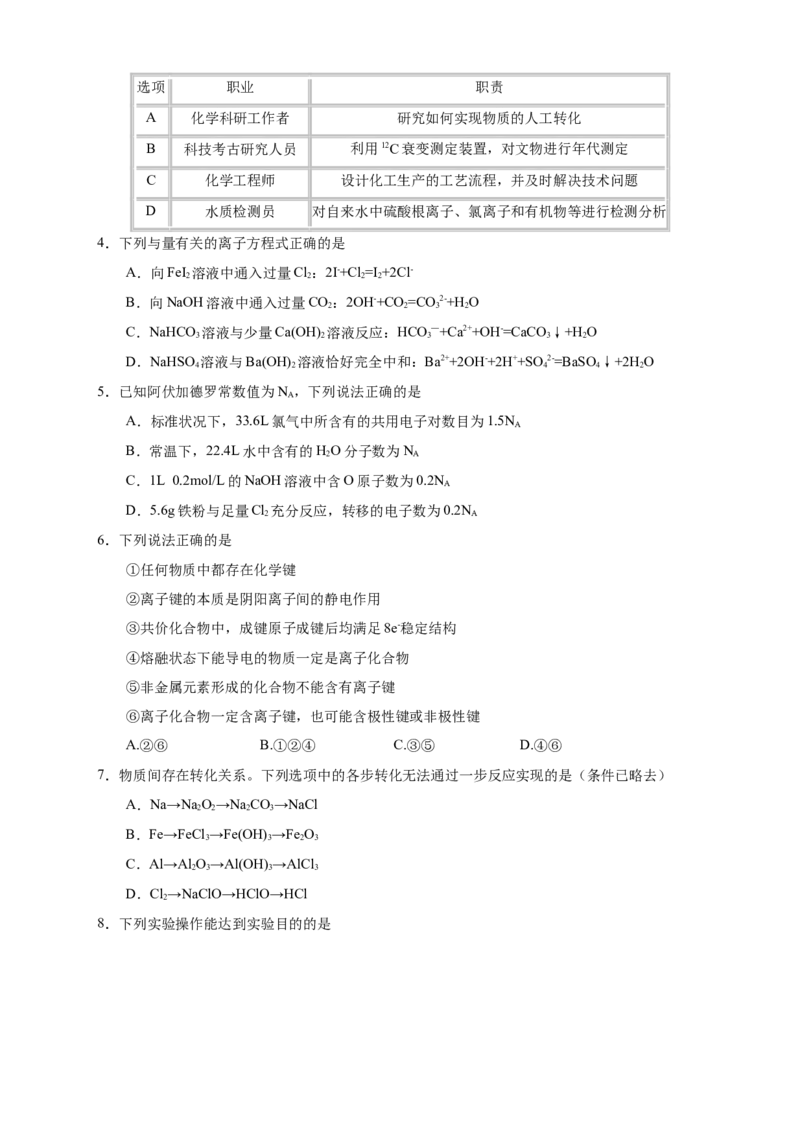
3.化学与职业息息相关,下列职业与职责不对应的是选项 职业 职责
A 化学科研工作者 研究如何实现物质的人工转化
B 科技考古研究人员 利用12C衰变测定装置,对文物进行年代测定
C 化学工程师 设计化工生产的工艺流程,并及时解决技术问题
D 水质检测员 对自来水中硫酸根离子、氯离子和有机物等进行检测分析
4.下列与量有关的离子方程式正确的是
A.向FeI 溶液中通入过量Cl:2I-+Cl=I +2Cl-
2 2 2 2
B.向NaOH溶液中通入过量CO:2OH-+CO =CO 2-+H O
2 2 3 2
C.NaHCO 溶液与少量Ca(OH) 溶液反应:HCO —+Ca2++OH-=CaCO ↓+HO
3 2 3 3 2
D.NaHSO 溶液与Ba(OH) 溶液恰好完全中和:Ba2++2OH-+2H++SO2-=BaSO ↓+2H O
4 2 4 4 2
5.已知阿伏加德罗常数值为N ,下列说法正确的是
A
A.标准状况下,33.6L氯气中所含有的共用电子对数目为1.5N
A
B.常温下,22.4L水中含有的HO分子数为N
2 A
C.1L 0.2mol/L的NaOH溶液中含O原子数为0.2N
A
D.5.6g铁粉与足量Cl 充分反应,转移的电子数为0.2N
2 A
6.下列说法正确的是
①任何物质中都存在化学键
②离子键的本质是阴阳离子间的静电作用
③共价化合物中,成键原子成键后均满足8e-稳定结构
④熔融状态下能导电的物质一定是离子化合物
⑤非金属元素形成的化合物不能含有离子键
⑥离子化合物一定含离子键,也可能含极性键或非极性键
A.②⑥ B.①②④ C.③⑤ D.④⑥
7.物质间存在转化关系。下列选项中的各步转化无法通过一步反应实现的是(条件已略去)
A.Na→Na O→NaCO→NaCl
2 2 2 3
B.Fe→FeCl →Fe(OH) →Fe O
3 3 2 3
C.Al→Al O→Al(OH) →AlCl
2 3 3 3
D.Cl→NaClO→HClO→HCl
2
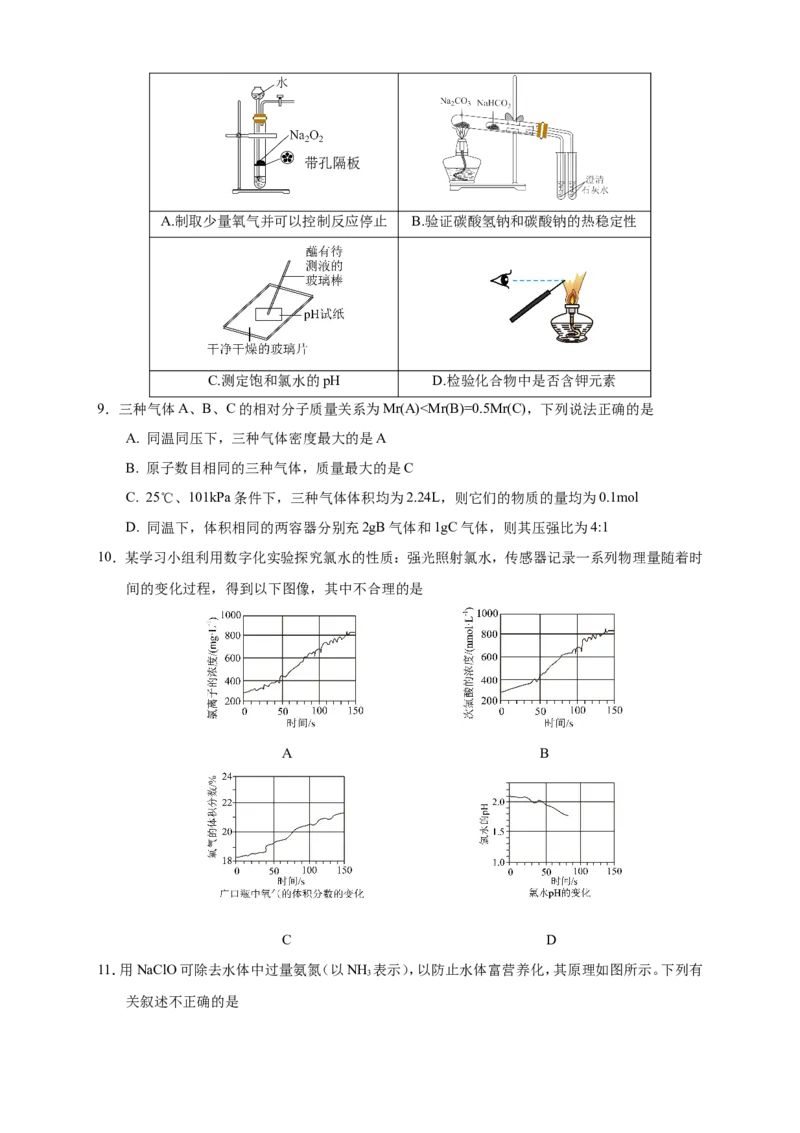
8.下列实验操作能达到实验目的的是带孔隔板
A.制取少量氧气并可以控制反应停止 B.验证碳酸氢钠和碳酸钠的热稳定性
C.测定饱和氯水的pH D.检验化合物中是否含钾元素
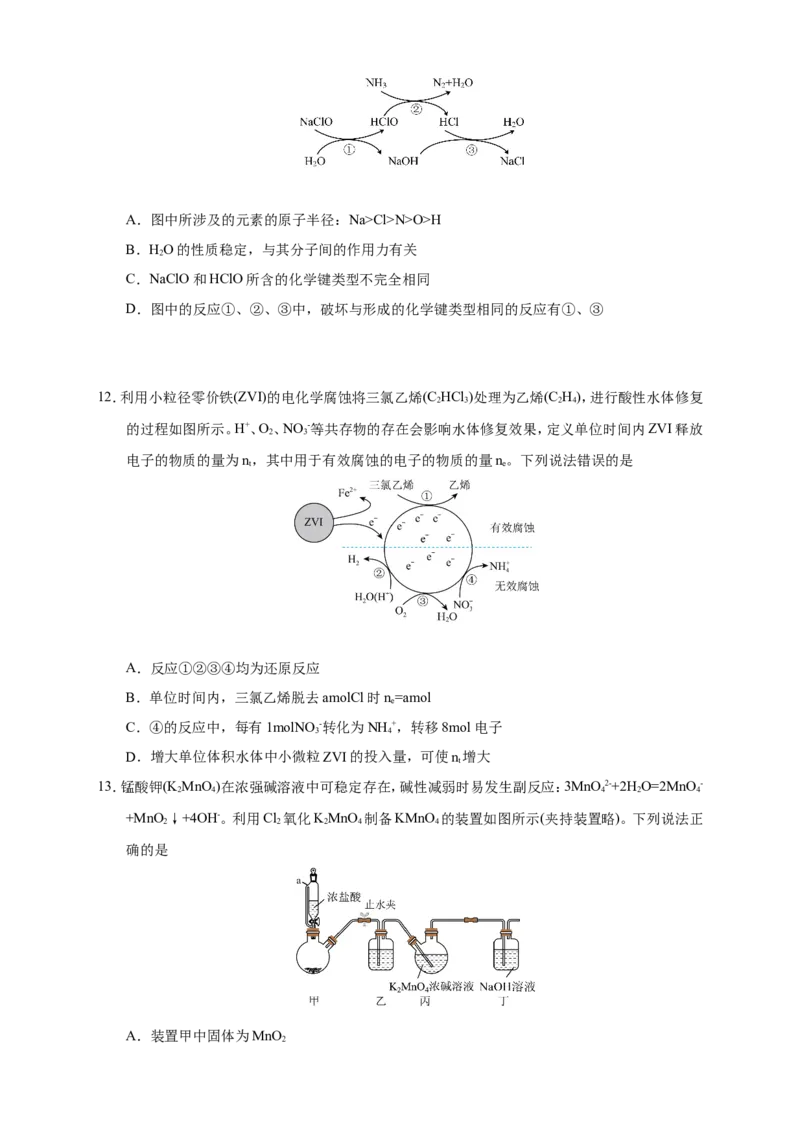
9.三种气体A、B、C的相对分子质量关系为Mr(A)Cl>N>O>H
B.HO的性质稳定,与其分子间的作用力有关
2
C.NaClO和HClO所含的化学键类型不完全相同
D.图中的反应①、②、③中,破坏与形成的化学键类型相同的反应有①、③
12.利用小粒径零价铁(ZVI)的电化学腐蚀将三氯乙烯(C HCl )处理为乙烯(C H),进行酸性水体修复
2 3 2 4
的过程如图所示。H+、O、NO -等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放
2 3
电子的物质的量为n,其中用于有效腐蚀的电子的物质的量n。下列说法错误的是
t e
A.反应①②③④均为还原反应
B.单位时间内,三氯乙烯脱去amolCl时n=amol
e
C.④的反应中,每有1molNO -转化为NH +,转移8mol电子
3 4
D.增大单位体积水体中小微粒ZVI的投入量,可使n增大
t
13.锰酸钾(K MnO )在浓强碱溶液中可稳定存在,碱性减弱时易发生副反应:3MnO 2-+2H O=2MnO -
2 4 4 2 4
+MnO↓+4OH-。利用Cl 氧化KMnO 制备KMnO 的装置如图所示(夹持装置略)。下列说法正
2 2 2 4 4
确的是
A.装置甲中固体为MnO
2B.若去掉装置乙,会导致KMnO 产率降低
4
C.装置乙中盛放饱和NaHCO 溶液,可以提高KMnO 的产率
3 4
D.装置丙可以用NaOH作碱性介质
14.日光灯中用到的某种荧光粉的主要成分为3D(CA)·DB 。已知:A、B、C和D为原子序数依次增
3 4 2 2
大的前20号主族元素,D为金属元素。A与B同周期,A的最外层电子数是其次外层电子数的3
倍,B的最外层电子数等于C与D的最外层电子数之和。下列说法正确的是
A.化合物DB 为共价化合物 B.简单离子半径:D>A>B
2
C.非金属性:B>C>A D.C元素最高价氧化物对应的水化物为强酸
15.一定质量的铁的氧化物与90mL 4mol/L的盐酸恰好完全反应,所得溶液中的Fe2+恰好能被标准
状况下672mLCl 氧化,则该固体中铁原子和氧原子的个数之比为
2
A.7:9 B.5:6 C.3:4 D. 2:3
二、非选择题:本题共4小题,共55分。
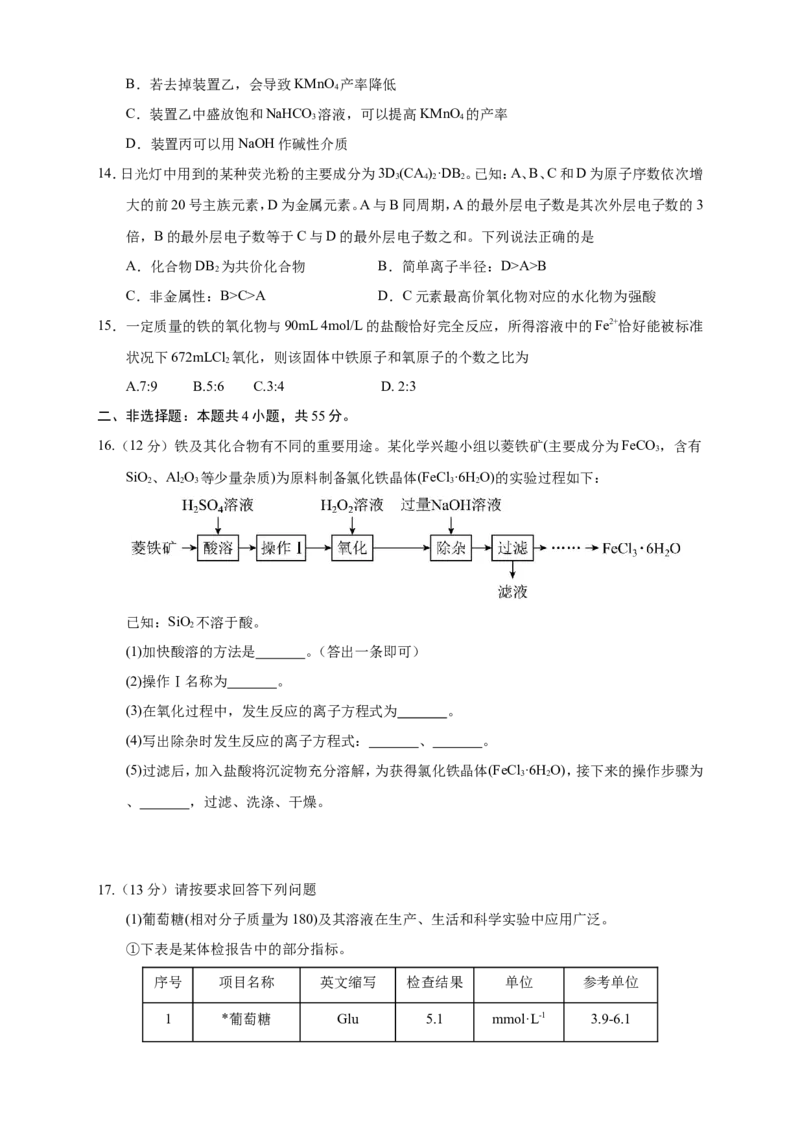
16.(12分)铁及其化合物有不同的重要用途。某化学兴趣小组以菱铁矿(主要成分为FeCO,含有
3
SiO、Al O 等少量杂质)为原料制备氯化铁晶体(FeCl ·6H O)的实验过程如下:
2 2 3 3 2
已知:SiO 不溶于酸。
2
(1)加快酸溶的方法是 。(答出一条即可)
(2)操作Ⅰ名称为 。
(3)在氧化过程中,发生反应的离子方程式为 。
(4)写出除杂时发生反应的离子方程式: 、 。
(5)过滤后,加入盐酸将沉淀物充分溶解,为获得氯化铁晶体(FeCl ·6H O),接下来的操作步骤为
3 2
、 ,过滤、洗涤、干燥。
17.(13分)请按要求回答下列问题
(1)葡萄糖(相对分子质量为180)及其溶液在生产、生活和科学实验中应用广泛。
①下表是某体检报告中的部分指标。
序号 项目名称 英文缩写 检查结果 单位 参考单位
1 *葡萄糖 Glu 5.1 mmol·L-1 3.9-6.12 *总胆固醇 TC 4.65 mmol·L-1 2.85-5.70
3 *甘油三酯 TG 1.50 mmol·L-1 0.45-1.70
体检报告表中,表示葡萄糖指标的物理量是 (填字母)。
a.摩尔质量 b.物质的量浓度 c.质量分数 d.溶解度
②血液中的葡萄糖(简称血糖)含量,参考指标常以两种计量单位表示,即“mmol·L-1”和
“mg·dL-1”(1 L=10 dL)。某人血糖检测结果为:54 mg·dL-1,参照上表相关标准,他的
血糖 (填“偏高”、“正常”或“偏低”)。
(2)实验室分别用KMnO 和HO 制相同物质的量的氧气,转移电子的数目之比为 。
4 2 2
(3)某无土栽培用的营养液中c(NH +):c(SO 2-):c(K+):c(Cl-)=8:4:9:9。若用NH Cl、KCl、KSO 来配
4 4 4 2 4
制该营养液,则这三种盐的物质的量之比c(NH Cl):c(KCl):c(K SO )= 。
4 2 4
(4)自来水消毒剂ClO 能与NaOH溶液反应生成NaClO 及等物质的量的另一种含氯物质,反应
2 3
的化学方程式为 。
(5)汽车发生强烈碰撞时,安全气囊内的NaN (叠氮化钠)发生化学反应生成NaN
3 3
和N,所产生的N 快速充满气囊,可以达到保护车内人员的目的,若97.5克NaN 完全
2 2 3
分解,在标准状况下,气囊膨胀的体积约为 L。
(6)若将HO 消毒液与84消毒液混合使用,会产生一种无色无味的气体单质,同时混合溶液的
2 2
消毒能力严重降低,该反应现象说明氧化性NaClO HO(填“大于”或“小于”)。
2 2
18(. 14分)Ⅰ.下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
(1)元素②的简单氢化物的电子式为 。
(2)元素⑤和③的单质加热生成产物中含有的化学键类型为 。(填序号:①离子键②极性
共价键③非极性共价键)
(3)元素⑨在周期表中的位置是 。
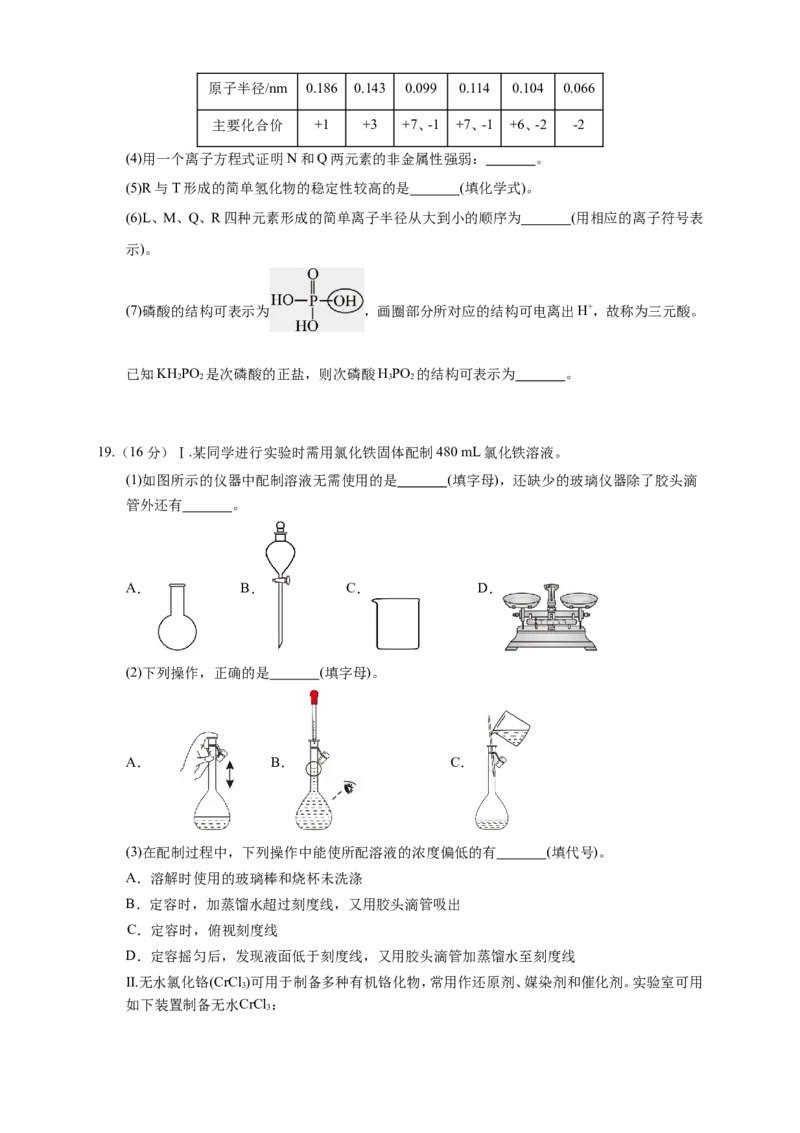
Ⅱ. L、M、N、Q、R、T分别代表上述十种元素之一,其原子半径及主要化合价关系如表:
元素代号 L M N Q R T原子半径/nm 0.186 0.143 0.099 0.114 0.104 0.066
主要化合价 +1 +3 +7、-1 +7、-1 +6、-2 -2
(4)用一个离子方程式证明N和Q两元素的非金属性强弱: 。
(5)R与T形成的简单氢化物的稳定性较高的是 (填化学式)。
(6)L、M、Q、R四种元素形成的简单离子半径从大到小的顺序为 (用相应的离子符号表
示)。
(7)磷酸的结构可表示为 ,画圈部分所对应的结构可电离出H+,故称为三元酸。
已知KH PO 是次磷酸的正盐,则次磷酸HPO 的结构可表示为 。
2 2 3 2
19.(16分)Ⅰ.某同学进行实验时需用氯化铁固体配制480 mL氯化铁溶液。
(1)如图所示的仪器中配制溶液无需使用的是 (填字母),还缺少的玻璃仪器除了胶头滴
管外还有 。
A. B. C. D.
(2)下列操作,正确的是 (填字母)。
A. B. C.
(3)在配制过程中,下列操作中能使所配溶液的浓度偏低的有 (填代号)。
A.溶解时使用的玻璃棒和烧杯未洗涤
B.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
C.定容时,俯视刻度线
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
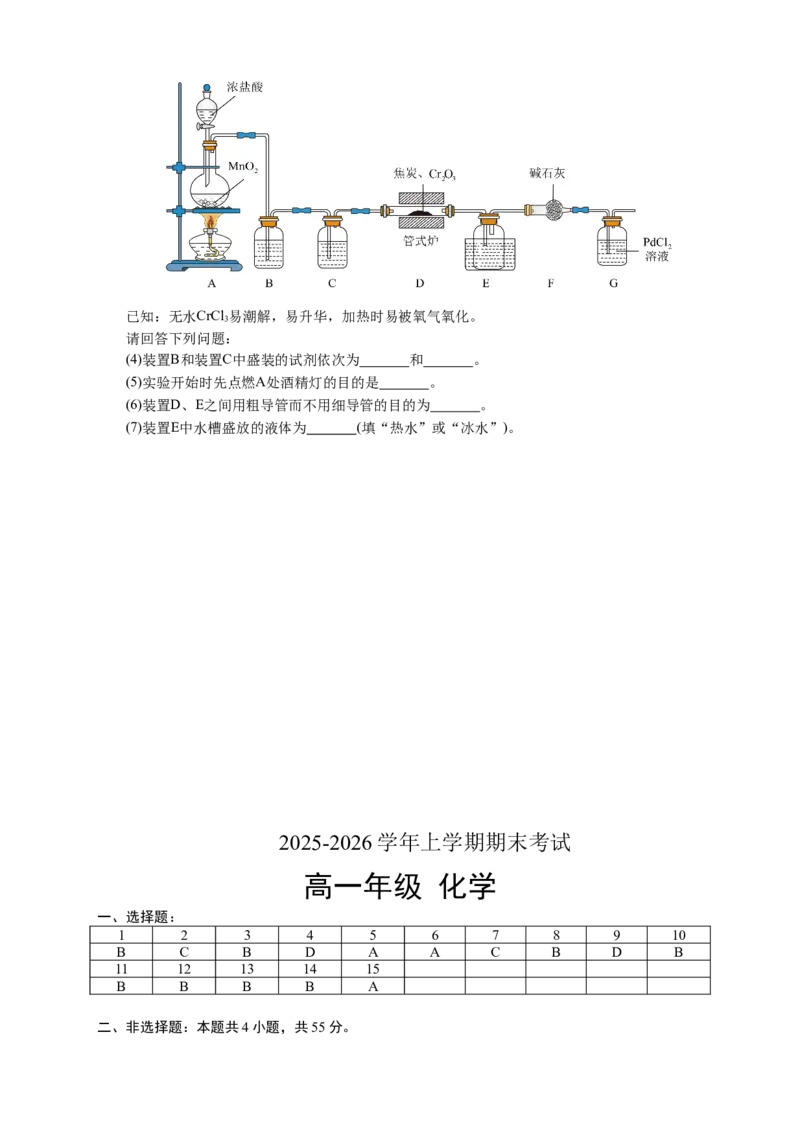
Ⅱ.无水氯化铬(CrCl )可用于制备多种有机铬化物,常用作还原剂、媒染剂和催化剂。实验室可用
3
如下装置制备无水CrCl :
3已知:无水CrCl 易潮解,易升华,加热时易被氧气氧化。
3
请回答下列问题:
(4)装置B和装置C中盛装的试剂依次为 和 。
(5)实验开始时先点燃A处酒精灯的目的是 。
(6)装置D、E之间用粗导管而不用细导管的目的为 。
(7)装置E中水槽盛放的液体为 (填“热水”或“冰水”)。
2025-2026 学年上学期期末考试
高一年级 化学
一、选择题:
1 2 3 4 5 6 7 8 9 10
B C B D A A C B D B
11 12 13 14 15
B B B B A
二、非选择题:本题共4小题,共55分。16.(12分)
(1)将菱铁矿石粉碎;适当增大硫酸浓度;适当提高温度;加快搅拌速度(2分)(合理即给分)
(2)过滤(2分)
(3) 2Fe2+ + HO + 2H+ = 2Fe3+ + 2HO(2分)(方程式未配平,但物质化学式均正确,得1分;物质
2 2 2
化学式错误,本题不得分;写成化学方程式不得分)
(4)Fe3+ + 3OH- = Fe(OH) ↓ Al3+ + 4OH- = [Al(OH) ](- 沉淀符号不做评分要求;写成AlO-形式
3 4 2
不得分)
(5)蒸发浓缩,冷却结晶(2分)(每空1分;降温结晶也得分)
17.(13分)
(1) ①b (1分)(填大写B不得分)
②偏低(2分)(其余答法均不得分)
(2)2:1(2分)
(3)8:1:4(2分)
(4)2ClO + 2NaOH = NaClO + NaClO + HO(2分)(方程式未配平,但物质化学式均正确,
2 3 2 2
得1分;物质化学式错误,本题不得分;写成离子方程式不得分)
(5)44.8(2分)
(6)大于(2分)
18.(14分)
(1) (2分)
(2)①③(2分)(有错不给分,答对1个得1分)
(3)第四周期第VIII族(2分)
(4)Cl + 2Br- = 2Cl- + Br(2分)(方程式未配平,但物质化学式均正确,得1分;物质化学式错误,
2 2
本题不得分;写成化学方程式不得分)
(5)H O(2分)
2
(6)Br- > S2- > Na+ > Al3+(2分)(书写原子符号不得分;没有“>”号,但顺序对,得分;按由小到
大顺序书写的不得分)
(7) (2分)
19.(16分)
(1)AB(2分)(写对一个得1分;有错不得分)500ml容量瓶 玻璃棒(2分)(写对一个得1分;有错不得分)
(2)C(2分)
(3)ABD(2分)(有错不得分,对但不全得1分)
(4)饱和NaCl溶液 浓硫酸(2分)(没按顺序答不得分;写化学式或名称均可)
(5)排除装置内空气或氧气,防止 被氧化、潮解(2分)(合理即可)
(6)防止因温度降低,凝华的 固体堵塞导管(2分)(合理即可)
(7)冰水(2分)