文档内容
第六章 化学反应与能量
第一节 化学反应与能量变化
第 2 课时 化学反应与电能
1.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因
是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.防止电池中渗漏的电解液腐蚀其他物品
D.回收其中的石墨电极
【答案】 B
【解析】 回收电池的主要目的是防止对环境的污染。
2.下面是有关各种形式能量的相互转化途径的叙述,其中错误的是( )
A.家庭液化气灶将化学能转变为热能
B.灯泡将电能全部转变为光能
C.光合作用将光能转变为化学能
D.太阳能电池将光能转变为电能
【答案】 B
【解析】 灯泡除了将电能转变为光能之外,还转变为热能等其他形式的能。
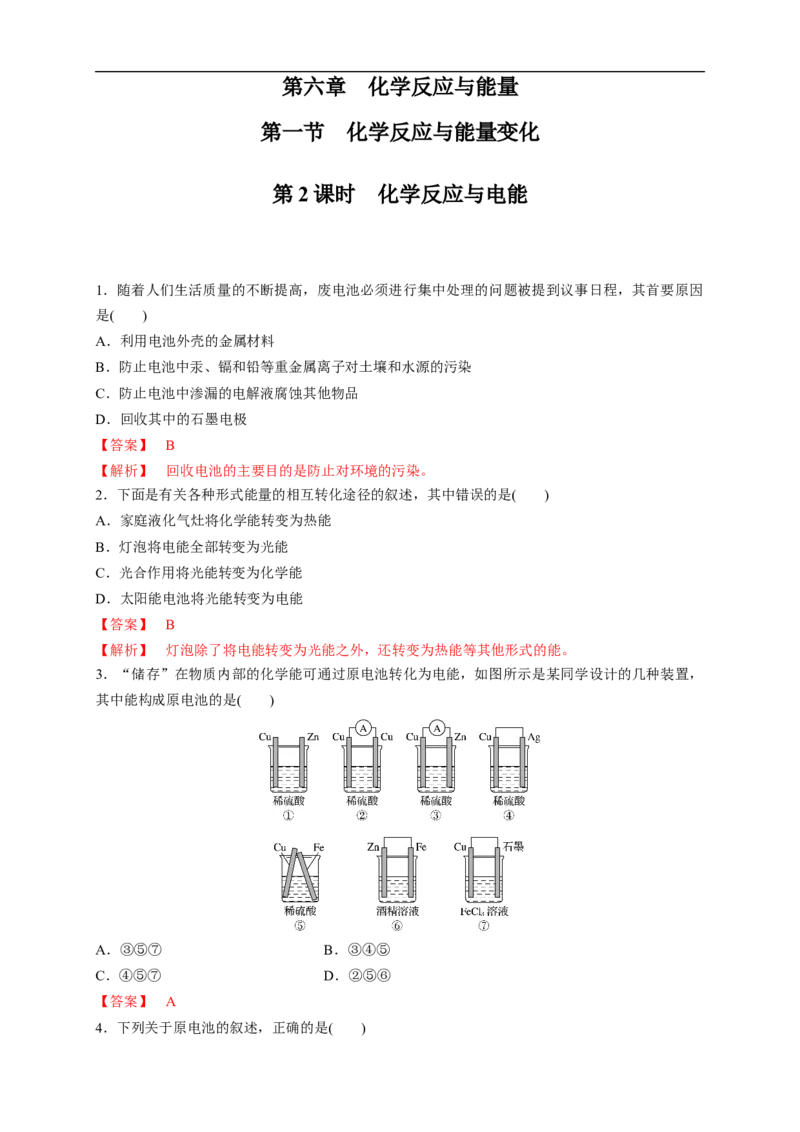
3.“储存”在物质内部的化学能可通过原电池转化为电能,如图所示是某同学设计的几种装置,
其中能构成原电池的是( )
A.③⑤⑦ B.③④⑤
C.④⑤⑦ D.②⑤⑥
【答案】 A
4.下列关于原电池的叙述,正确的是( )A.构成原电池的正极和负极材料必须是两种活动性不同的金属
B.原电池是将化学能转变为电能的装置
C.在原电池中,电子流出的一极是负极,该电极被还原
D.原电池放电时,电流的方向是从负极到正极
【答案】 B
【解析】 构成原电池的正极和负极可以是两种活动性不同的金属,也可以是导电的非金属(如石
墨棒)和金属,A错误;原电池是将化学能转变为电能的装置,B正确;在原电池中,负极上发生失
去电子的氧化反应,正极上发生得到电子的还原反应,所以电子从负极沿导线流向正极,C错误;
原电池放电时,电子从负极沿导线流向正极,则电流的方向是从正极到负极,D错误。
5.某实验兴趣小组按下图装置实验后,所记录内容合理的是( )
①Cu为正极,Zn为负极;
②Zn质量减少,Cu质量增加;
③SO向Cu极移动;
实验记录
④电子流向:由Zn经导线流入Cu片;
⑤Zn电极发生还原反应;
⑥正极反应式:Cu2++2e-===Cu。
A.②③④ B.①②④⑥ C.①②④⑤ D.②③⑤⑥
【答案】 B
【解析】 ①Zn比Cu活泼,Zn为负极,Cu为正极,故正确;②铜为正极,发生反应:Cu2++2e
-===Cu,铜极质量增大,故正确;③原电池工作时,阴离子向负极移动,故错误;④电子由负极
经导线流向正极,即电子由Zn电极经导线流向Cu电极,故正确;⑤Zn电极发生氧化反应,故错
误;⑥正极发生还原反应,电极反应方程式为Cu2++2e-===Cu,故正确。综上所述,B正确。
6.人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式:Zn+2OH--2e-
===ZnO+HO,Ag O+HO+2e-===2Ag+2OH-。据此判断氧化银是( )
2 2 2
A.负极,被氧化 B.正极,被还原
C.负极,被还原 D.正极,被氧化
【答案】 B
【解析】 电池的电极反应式:Zn+2OH--2e-===ZnO+HO,AgO+HO+2e-===2Ag+2OH
2 2 2
-,从中可以看出锌的化合价升高,所以锌为负极,被氧化,而氧化银中的银化合价降低,故氧化
银为正极,被还原。
7.如图是铅蓄电池构造示意图,下列说法不正确的是( )A.铅蓄电池是二次电池,充电时电能转化为化学能
B.电池工作时,电子由Pb板通过导线流向PbO 板
2
C.电池工作时,负极反应为Pb-2e-===Pb2+
D.电池工作时,H+移向PbO 板
2
【答案】 C
【解析】 二次电池是可充电电池,典型的是铅蓄电池,充电时是把电能转化成化学能的装置,故
A说法正确;依据原电池的工作原理,电子从负极经外电路流向正极,Pb作负极,PbO 作正极,
2
电子从 Pb 板通过导线流向 PbO 板,故 B 说法正确;电池的总反应式:Pb+PbO +
2 2
2HSO ===2PbSO+2HO,负极上的电极反应式:Pb+SO-2e-===PbSO,故C说法错误;依据原
2 4 4 2 4
电池的工作原理,阳离子向正极移动,故D说法正确。
8.如图将锌片和铜片用导线连接后放入稀硫酸中,发生原电池反应,下列叙述错误的是( )
A.溶液的pH增大
B.溶液中的Zn2+浓度增大
C.溶液中的SO浓度增大
D.溶液的密度增大
【答案】 C
【解析】 A项,氢离子浓度降低,溶液的pH增大,正确;B项,锌不断溶解,溶液中的Zn2+浓
度增大,正确;C项,由于在反应过程中溶液中SO没有参加反应,所以溶液中c(SO)不变,错误;
D项,原电池放电时,溶液由硫酸溶液逐渐变成硫酸锌溶液,所以溶液的密度增大,正确。
9.如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,
则A、B、C应是下列各组中的( )
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀AgNO 溶液
3
D.A是Ag,B是Fe,C为稀AgNO 溶液
3【答案】 D
【解析】 A极逐渐变粗,说明A极为原电池的正极,溶液中的金属阳离子得到电子后在A极上析
出;B极逐渐变细,说明B极为原电池的负极,失去电子后变成离子进入溶液中。A和B两项中的
反应为Zn+HSO ===ZnSO +H↑,则A项A极变细,B项A极不变;C和D两项中的反应为Fe+
2 4 4 2
2AgNO===2Ag+Fe(NO ),其中C项A极变细,D项A极变粗。
3 3 2
10.X、Y、Z、W四种金属片浸在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示:
则四种金属的活动性由强到弱的顺序为( )
A.Z>Y>X>W B.Z>X>Y>W
C.Z>Y>W>X D.Y>Z>X>W
【答案】 A
11.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )
A.2Al+2NaOH+2HO===2NaAlO+3H↑
2 2 2
B.2H+O=====2HO
2 2 2
C.MgN+6HO===3Mg(OH) +2NH ↑
3 2 2 2 3
D.CH+2O=====CO+2HO
4 2 2 2
【答案】 C
【解析】 只有属于氧化还原反应,才能用于设计原电池;A、B、D属于氧化还原反应,均可以
设计为原电池。C不属于氧化还原反应,不能设计成原电池。
12.为将反应2Al+6H+===2Al3++3H↑的化学能转化为电能,下列装置能达到目的的是(铝条均已
2
除去了氧化膜)( )
【答案】 B
【解析】 A项为原电池,铝为负极,但总反应为2Al+2OH-+2HO===2AlO+3H↑,不符合;C
2 2
项为原电池,但硝酸是氧化性酸,则总反应为Al+4H++NO===Al3++NO↑+2HO,不符合;D项
2
装置中有外接电源,不属于原电池,不符合。
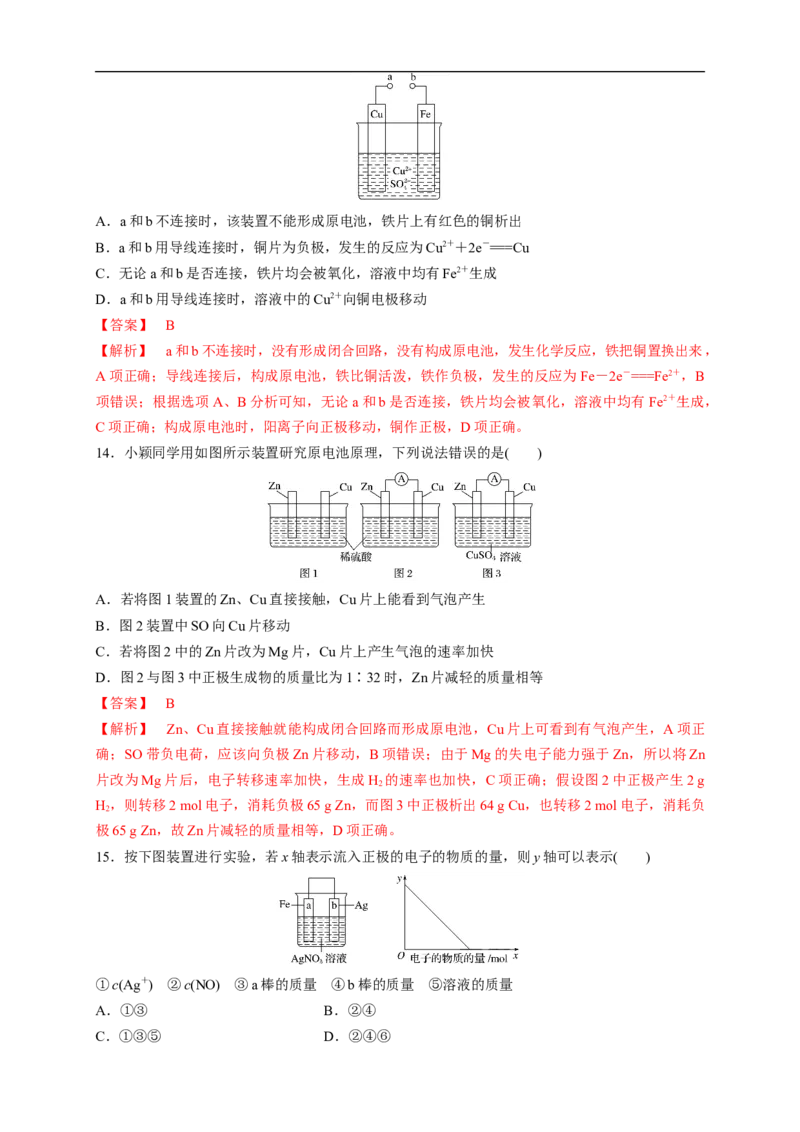
13.某科学探究小组为探究电化学原理,设计了如图所示的装置进行探究实验。下列对实验中观察
到的现象或相关结论的叙述错误的是( )A.a和b不连接时,该装置不能形成原电池,铁片上有红色的铜析出
B.a和b用导线连接时,铜片为负极,发生的反应为Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会被氧化,溶液中均有Fe2+生成
D.a和b用导线连接时,溶液中的Cu2+向铜电极移动
【答案】 B
【解析】 a和b不连接时,没有形成闭合回路,没有构成原电池,发生化学反应,铁把铜置换出来,
A项正确;导线连接后,构成原电池,铁比铜活泼,铁作负极,发生的反应为 Fe-2e-===Fe2+,B
项错误;根据选项A、B分析可知,无论a和b是否连接,铁片均会被氧化,溶液中均有 Fe2+生成,
C项正确;构成原电池时,阳离子向正极移动,铜作正极,D项正确。
14.小颖同学用如图所示装置研究原电池原理,下列说法错误的是( )
A.若将图1装置的Zn、Cu直接接触,Cu片上能看到气泡产生
B.图2装置中SO向Cu片移动
C.若将图2中的Zn片改为Mg片,Cu片上产生气泡的速率加快
D.图2与图3中正极生成物的质量比为1∶32时,Zn片减轻的质量相等
【答案】 B
【解析】 Zn、Cu直接接触就能构成闭合回路而形成原电池,Cu片上可看到有气泡产生,A项正
确;SO带负电荷,应该向负极Zn片移动,B项错误;由于Mg的失电子能力强于Zn,所以将Zn
片改为Mg片后,电子转移速率加快,生成H 的速率也加快,C项正确;假设图2中正极产生2 g
2
H ,则转移2 mol电子,消耗负极65 g Zn,而图3中正极析出64 g Cu,也转移2 mol电子,消耗负
2
极65 g Zn,故Zn片减轻的质量相等,D项正确。
15.按下图装置进行实验,若x轴表示流入正极的电子的物质的量,则y轴可以表示( )
①c(Ag+) ②c(NO) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
A.①③ B.②④
C.①③⑤ D.②④⑥【答案】 A
【解析】 根据图中装置可判断,Fe、Ag、AgNO 构成的原电池中,活泼金属Fe为负极,Ag为正
3
极,Fe和硝酸银之间发生氧化还原反应,所以银离子浓度减小,硝酸根浓度不变,①正确、②错
误;在负极上金属铁本身失电子,即a棒质量减轻,③正确;正极b棒上析出金属银,即b棒质量
增加,④错误;负极上金属铁本身失电子,正极Ag上析出金属银,所以溶液的质量是增加了 Fe,
但是析出了Ag,在转移电子数相等情况下,析出的金属质量多,所以溶液质量减轻,但不能为零,
⑤错误。
16.某同学为了探究原电池产生电流的过程,设计了如图所示实验。
(1)打开K,观察到的现象为________________________________。
(2)关闭K,观察到的现象是____________________________________。
此电池的负极的电极反应式为___________________________________。
总反应式为____________________________________。
(3)关闭 K,溶液中阳离子向________(填“Zn”或“C”)极移动,外电路中,电子流动方向是
___________________________________________________________。
【答案】 (1)锌棒上附着有红色固体
(2)碳棒上附着有红色固体
Zn-2e-===Zn2+
Zn+Cu2+===Zn2++Cu
(3)C Zn→C(或负极→正极)
【解析】 (1)打开K,锌与硫酸铜接触,置换出铜,所以可以看到锌棒上附着有红色固体。(2)关
闭K,形成原电池,锌作负极,碳作正极,溶液中的铜离子在碳棒上得到电子生成铜,看到碳棒上
附着有红色固体;其正极反应为Cu2++2e-===Cu;负极反应为Zn-2e-===Zn2+;总反应为Zn+
Cu2+===Zn2++Cu。(3)关闭K,溶液中的阳离子向正极移动,即向碳棒移动,电子从锌出来经过导
线流向碳。
16.在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡(如图所示)。小心地
往烧杯中央滴入CuSO 溶液。
4
(1)片刻后可观察到的现象是(指悬吊的金属圈)____(填字母)。
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(2)产生上述现象的原因是________________________________________________。
(3)写出反应的化学方程式:________________________________________________。【答案】 (1)D (2)加入CuSO 溶液后,构成Fe-Ag原电池,铁溶解,质量减轻,Cu2+在银圈上
4
得电子,生成的Cu沉积在银圈上,质量增加 (3)Fe+CuSO ===FeSO+Cu
4 4
【解析】 加入CuSO 溶液后,构成Fe-Ag原电池,Fe失电子作负极,质量减轻,Cu2+在正极银
4
圈上得电子,生成的金属铜沉积在上面使其质量增加。
17.将Fe片和石墨用导线相连,一组插入稀HSO 中,一组插入FeCl 溶液中,分别形成了原电池。
2 4 3
(1)这两个原电池中,正极分别是________(填字母)。
A.石墨、石墨 B.石墨、Fe片
C.Fe片、Fe片 D.Fe片、石墨
(2)写出插入稀HSO 中形成原电池的正极反应式:____________________________________
2 4
__________________________(用离子方程式表示,下同)。
(3)写出插入FeCl 溶液中形成原电池的总反应式:____________________________________。
3
【答案】 (1)A (2)2H++2e-===H ↑ (3)2Fe3++Fe===3Fe2+
2
【解析】 当电解质溶液为稀HSO 时,总反应为Fe+HSO ===FeSO +H↑,则负极为Fe,正极
2 4 2 4 4 2
为石墨,正极反应式为 2H++2e-===H ↑;当电解质溶液为 FeCl 时,总反应为 Fe+
2 3
2FeCl ===3FeCl ,离子方程式为Fe+2Fe3+===3Fe2+,负极为Fe,正极为石墨。
3 2
18.铁及铁的化合物应用广泛,如FeCl 可用于催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
3
(1)写出FeCl 溶液腐蚀印刷电路铜板的离子方程式:_________________________________。
3
(2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图,标出正、负极,并写出电极
反应式。
正极反应:______________________________________________;
负极反应:_______________________________________________。
【答案】 (1)2Fe3++Cu===2Fe2++Cu2+
(2)
2Fe3++2e-===2Fe2+
Cu-2e-===Cu2+
【解析】 (1)Fe3+有强氧化性,能把铜氧化成铜离子,自身被还原成Fe2+,反应的离子方程式为:
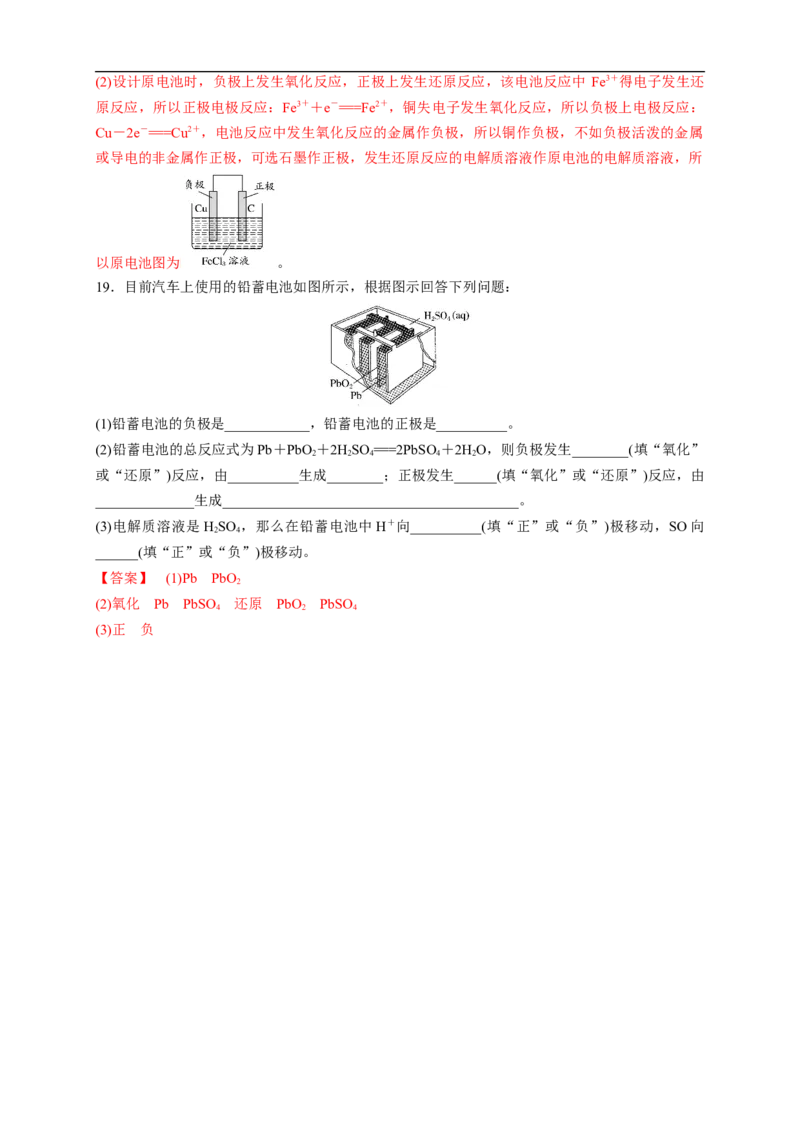
2Fe3++Cu===Cu2++2Fe2+。(2)设计原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中 Fe3+得电子发生还
原反应,所以正极电极反应:Fe3++e-===Fe2+,铜失电子发生氧化反应,所以负极上电极反应:
Cu-2e-===Cu2+,电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属
或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所
以原电池图为 。
19.目前汽车上使用的铅蓄电池如图所示,根据图示回答下列问题:
(1)铅蓄电池的负极是____________,铅蓄电池的正极是__________。
(2)铅蓄电池的总反应式为Pb+PbO +2HSO ===2PbSO +2HO,则负极发生________(填“氧化”
2 2 4 4 2
或“还原”)反应,由__________生成________;正极发生______(填“氧化”或“还原”)反应,由
______________生成__________________________________________。
(3)电解质溶液是HSO ,那么在铅蓄电池中H+向__________(填“正”或“负”)极移动,SO向
2 4
______(填“正”或“负”)极移动。
【答案】 (1)Pb PbO
2
(2)氧化 Pb PbSO 还原 PbO PbSO
4 2 4
(3)正 负