文档内容
第六章 化学反应与能量
第二节 化学反应速率与限度
第 2 课时 化学反应的限度和化学反应条件的控制
1.反应CO(g)+HO(g) CO(g)+H(g),达到平衡后,再向反应容器中充入含 18O的一氧化
2 2 2
碳,经过一段时间后,18O存在于( )
A.CO B.H O C.CO CO D.CO HO CO
2 2 2 2
【答案】 D
【解析】 含18O的一氧化碳正向和HO生成含18O的二氧化碳,同时含18O的二氧化碳又逆向和
2
H 反应生成了一氧化碳和水,故最终CO、HO和CO 中都含有了18O。
2 2 2
2.下列关于化学平衡的说法中,不正确的是( )
A.当可逆反应达到平衡时,正、逆反应速率都为零
B.当可逆反应达到化学平衡时,正、逆反应速率一定相等
C.当可逆反应达到化学平衡后,改变某些条件可以使平衡破坏
D.当可逆反应达到平衡时,尽管正、逆反应都还在进行,但各物质的浓度保持不变
【答案】 A
【解析】 可逆反应达到平衡时,v =v ≠0,化学平衡应为动态平衡。
正 逆
3.在一定温度下的恒容容器中,发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反
应已达到平衡状态的是( )
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2∶1∶1
⑤单位时间内生成n mol C,同时生成n mol D
⑥单位时间内生成n mol D,同时生成2n mol A
A.①②⑤ B.②③⑤ C.②③⑥ D.①③⑥
【答案】 C
【解析】 此反应为反应前后气体体积相等的反应,恒容条件下在达到平衡状态前后体系的压强始
终不变,①不能作为平衡状态的判断标志;容积固定,因为此反应有固体参与,气体密度不变说明
气体总质量不变,说明此反应达到平衡状态,②可作为平衡状态的判断标志;C(g)的浓度不变说明
生成C(g)和消耗C(g)的量相等,说明反应达到平衡状态,③能作为平衡状态的判断标志;非平衡状
态下,三种气体的浓度之比也可为2∶1∶1,④不能作为平衡状态的判断标志;单位时间内生成n
mol C和n mol D均表示正反应速率,⑤不能作为平衡状态的判断标志;单位时间内生成n mol
D,即消耗2n mol A,同时生成2n mol A,表明此时v (A)=v (A),⑥能作为平衡状态的判断标
正 逆志。
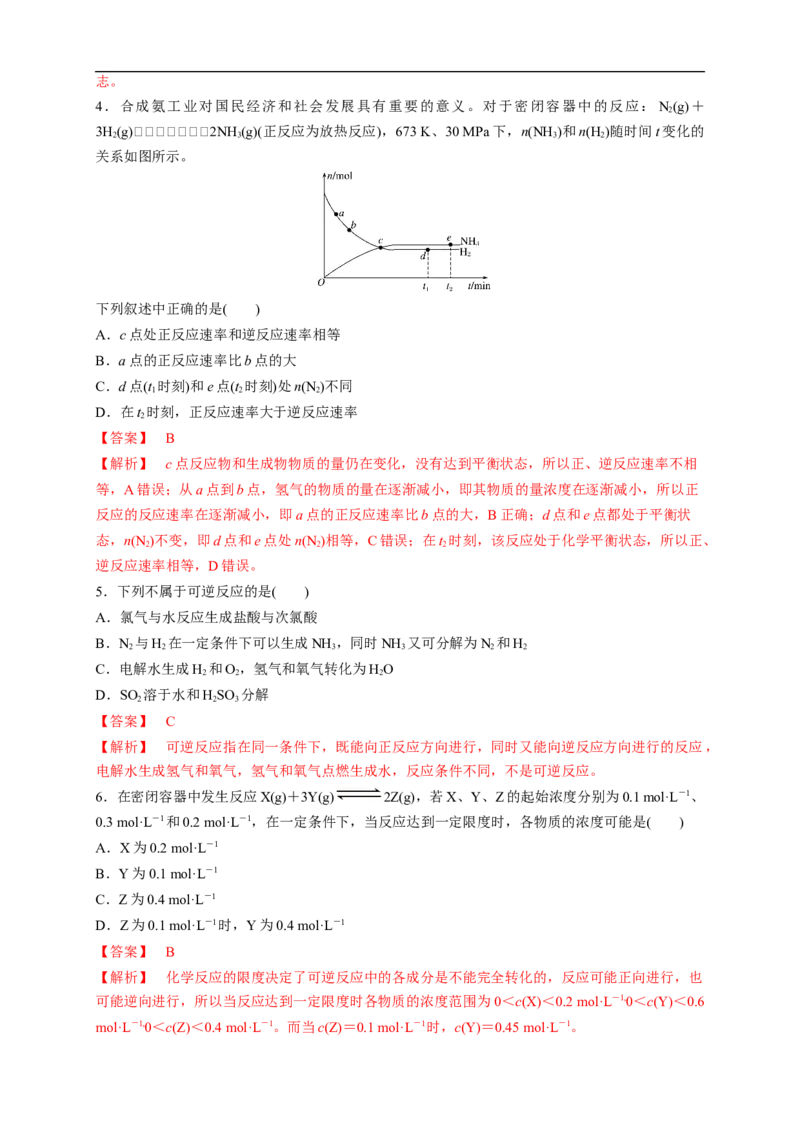
4.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N(g)+
2
3H(g)2NH (g)(正反应为放热反应),673 K、30 MPa下,n(NH )和n(H )随时间t变化的
2 3 3 2
关系如图所示。
下列叙述中正确的是( )
A.c点处正反应速率和逆反应速率相等
B.a点的正反应速率比b点的大
C.d点(t 时刻)和e点(t 时刻)处n(N )不同
1 2 2
D.在t 时刻,正反应速率大于逆反应速率
2
【答案】 B
【解析】 c点反应物和生成物物质的量仍在变化,没有达到平衡状态,所以正、逆反应速率不相
等,A错误;从a点到b点,氢气的物质的量在逐渐减小,即其物质的量浓度在逐渐减小,所以正
反应的反应速率在逐渐减小,即a点的正反应速率比b点的大,B正确;d点和e点都处于平衡状
态,n(N )不变,即d点和e点处n(N )相等,C错误;在t 时刻,该反应处于化学平衡状态,所以正、
2 2 2
逆反应速率相等,D错误。
5.下列不属于可逆反应的是( )
A.氯气与水反应生成盐酸与次氯酸
B.N 与H 在一定条件下可以生成NH ,同时NH 又可分解为N 和H
2 2 3 3 2 2
C.电解水生成H 和O,氢气和氧气转化为HO
2 2 2
D.SO 溶于水和HSO 分解
2 2 3
【答案】 C
【解析】 可逆反应指在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,
电解水生成氢气和氧气,氢气和氧气点燃生成水,反应条件不同,不是可逆反应。
6.在密闭容器中发生反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为0.1 mol·L-1、
0.3 mol·L-1和0.2 mol·L-1,在一定条件下,当反应达到一定限度时,各物质的浓度可能是( )
A.X为0.2 mol·L-1
B.Y为0.1 mol·L-1
C.Z为0.4 mol·L-1
D.Z为0.1 mol·L-1时,Y为0.4 mol·L-1
【答案】 B
【解析】 化学反应的限度决定了可逆反应中的各成分是不能完全转化的,反应可能正向进行,也
可能逆向进行,所以当反应达到一定限度时各物质的浓度范围为0<c(X)<0.2 mol·L-1,0<c(Y)<0.6
mol·L-1,0<c(Z)<0.4 mol·L-1。而当c(Z)=0.1 mol·L-1时,c(Y)=0.45 mol·L-1。7.向一密闭容器中放入1 mol X,进行可逆反应2X(g) 3Y(g),反应过程中的反应速率(v)与
时间(t)的关系曲线如图所示,下列叙述正确的是( )
A.t 时,只有正反应
1
B.t~t 时,反应不再发生
2 3
C.t 时,容器内有1.5 mol Y
2
D.t~t 时,X、Y的物质的量均没有发生变化
2 3
【答案】 D
【解析】 t 时,v >v >0,正、逆反应都在发生,A项错误;t ~t 时,v =v >0,反应并未
1 正 逆 2 3 正 逆
停止,B项错误;该反应为可逆反应,1 mol X不能完全反应,所以当反应达到平衡时,容器内 Y
的物质的量小于1.5 mol,C项错误;t ~t 时为化学平衡状态,X、Y的物质的量均不发生变化,D
2 3
项正确。
8.在一定温度下,向密闭容器中充入一定量的 NO 和SO ,发生反应:NO (g)+SO (g)
2 2 2 2
NO(g)+SO (g),当化学反应达到平衡时,下列叙述正确的是( )
3
A.SO 和SO 的物质的量一定相等
2 3
B.NO 和SO 的物质的量一定相等
2 3
C.反应后混合物的总物质的量一定等于反应开始时NO 和SO 的总物质的量
2 2
D.SO 、NO 、NO、SO 的物质的量一定相等
2 2 3
【答案】 C
【解析】 题中没有给出各物质的投料情况,NO 、SO 、NO和SO 的量之间没有必然的关系,可
2 2 3
能相等,也可能不等,A、B、D项错;该反应反应前后气体分子数不变,故反应后混合物的总物
质的量一定等于反应开始时NO 和SO 的总物质的量,C项正确。
2 2
9.在一定条件下,使一定量的A和B气体混合发生反应2A(g)+3B(g) 4C(g)。下列描述中,
说明反应已达到平衡状态的是( )
A.各物质的浓度之比c(A)∶c(B)∶c(C)=2∶3∶4
B.混合气体中各物质的浓度相等
C.单位时间内,消耗a mol A物质的同时消耗2a mol C物质
D.混合气体的体积是反应开始前的
【答案】 C
【解析】 化学平衡状态时,各组分浓度保持不变,不是浓度相等;用不同物质的反应速率表示达
到平衡,要求反应方向是一正一逆,且反应速率之比为化学计量数之比。
10.可逆反应2NO (g) 2NO(g)+O(g)在体积固定的密闭容器中进行,达到平衡状态的标志
2 2
是( )
①单位时间内生成n mol O 的同时生成2n mol NO
2 2
②单位时间内生成n mol O 的同时生成2n mol NO
2③用NO 、NO、O 表示的反应速率的比为2∶2∶1的状态
2 2
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦
C.①③④⑤ D.全部
【答案】 A
【解析】 ①中单位时间内生成n mol O 的同时生成2n mol NO ,知v =v ,所以能说明达到平
2 2 正 逆
衡状态;②所描述的都是指正反应方向的速率,无法判断;③无论达到平衡与否,物质的反应速率
之比都等于化学方程式中物质的化学计量数之比;④有色气体的颜色不变能够说明达到了化学平衡;
因容器体积固定,密度是一个常数,所以⑤不能说明达到平衡;该反应是一个反应前后气体体积不
等的反应,容器的体积又固定,所以⑥⑦均能说明达到平衡。
11.下列可以证明2HI(g) H(g)+I(g)已达平衡状态的是( )
2 2
①单位时间内生成n mol H 的同时生成n mol HI
2
②一个H—H键断裂的同时有两个H—I键断裂
③温度和体积一定时,混合气体密度不再变化
④v(H )=v(I)=0.5v(HI)
2 2
⑤c(HI)∶c(H )∶c(I)=2∶1∶1
2 2
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和压强一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
A.②③④⑤⑥ B.②⑥⑦⑧⑨
C.①②⑥⑧ D.②⑥⑨
【答案】 D
【解析】 ③该反应是反应前后气体分子数不变的反应,所以温度和体积一定时混合气体密度始终
不变;④未指明正、逆反应;⑤三种物质的浓度比等于相应的化学计量数比时不一定是平衡状态;
③④⑤不能作为达到平衡状态的标志,A项错误。⑦温度和体积一定时,容器内压强始终不变;⑧
温度和压强一定时,混合气体的平均相对分子质量始终不变;⑦⑧不能作为达到平衡状态的标志,
B项错误。①单位时间内生成n mol H 的同时生成n mol HI,不符合对应的化学计量数比,C项错
2
误。②一个H—H键断裂的同时有两个H—I键断裂,表明正、逆反应速率相等;⑥温度和体积一
定时,某一生成物浓度不再变化,符合化学平衡的定义;⑨温度和体积一定时,混合气体的颜色不
再变化,说明碘的浓度不再变化,可以作为达到平衡状态的标志,D项正确。
12.一定温度下,在某恒容的密闭容器中,建立化学平衡:C(s)+HO(g) CO(g)+H(g)。下
2 2
列叙述中不能说明该反应已达到化学平衡状态的是( )
A.体系的压强不再发生变化
B.v (CO)=v (H O)
正 逆 2
C.生成n mol CO的同时生成n mol H
2D.1 mol H—H键断裂的同时断裂2 mol H—O键
【答案】 C
【解析】 A项,由于该反应前后气体体积改变,当体系的压强不再发生变化时,说明反应已达到
化学平衡状态;B项,CO的正反应速率等于其逆反应速率,说明反应已达到化学平衡状态;C项,
生成CO、H 均表示反应向正反应方向进行,没有表示出正、逆反应速率的关系,不能说明反应已
2
达化学平衡状态;D项,H—H键断裂和H—O键断裂是两个相反的反应方向,1 mol H—H键断裂
的同时断裂2 mol H—O键,即消耗1 mol H 的同时消耗了1 mol H O,可知H 的消耗量等于其生成
2 2 2
量,说明反应已达到化学平衡状态。
13.化学反应条件的控制具有重要的现实意义。如下反应条件的控制中,不恰当的是( )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO 的分解速率而加入MnO
3 2
D.降温加快HO 的分解速率
2 2
【答案】 D
【解析】 A项,防止铁生锈,可在其表面涂一层防锈油漆,阻止铁与潮湿的空气接触;B项,面
粉厂、加油站周围的空气中飘浮着可燃性的气体或粉尘,遇明火可能会发生爆炸,所以面粉厂、加
油站均要严禁烟火;C项,加入MnO ,对KClO 的分解起催化作用,可以加快化学反应速率;D
2 3
项,降温会使化学反应速率减小,减慢HO 的分解速率。
2 2
14.某可逆反应在体积为5 L的密闭容器中进行,0~3 min 内各物质的物质的量的变化情况如图所
示(A、B、C均为气体)。
(1)该反应的化学方程式为__________________________________________。
(2)反应开始至2 min时,B的平均反应速率为________________。
(3)能说明该反应已达到平衡状态的是________(填字母)。
a.v(A)=2v(B)
b.容器内压强保持不变
c.2v (A)=v (B)
逆 正
d.容器内混合气体的密度保持不变
(4)在密闭容器里,通入a mol A(g)、b mol B(g)、c mol C(g),发生上述反应,当改变下列条件时,
反应速率会减小的是________(填序号)。
①降低温度 ②加入催化剂 ③增大容器体积
【答案】 (1)2A+B2C (2)0.1 mol·L-1·min-1 (3)b (4)①③
【解析】 (1)从图像分析,在相同时间内,A减少了2 mol,B减少了1 mol,C增加了2 mol,所
以该反应的化学方程式为2A+B2C。
(2)2 min内B减少了1 mol,所以v(B)==0.1 mol·L-1·min-1。(3)a.没有说明正、逆反应方向,不能说明反应已达平衡;b.压强不变说明反应达到平衡状态;c.反
应达到平衡状态时,A的逆反应速率应该是B的正反应速率的2倍,表示为v (A)=2v (B),所以错
逆 正
误;d.容器内的密度始终不变。
(4)①降温,反应速率减小;②加入催化剂,反应速率增大;③增大容器的体积,物质的浓度减小,
反应速率减小,所以选①③。
15.在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间
变化的曲线如图。回答下列问题:
(1)该反应的化学方程式为__________________________________________________。
(2)0~t s内A的反应速率为________。
1
(3)反应后与反应前的压强之比为________。
(4)(t +10)s时,A气体的体积分数为________,此时v (A)________(填“>”“<”或“=”)v
1 正 逆
(B)。
(5)下列关于该反应的说法正确的是________(填字母)。
a.到达t s时反应已停止
1
b.在t s之前B气体的消耗速率大于它的生成速率
1
c.在t s时C气体的正反应速率等于逆反应速率
1
【答案】 (1)3A+B2C
(2) mol·L-1·s-1
(3)9∶13
(4)22.2% >
(5)bc
【解析】 (1)从0到t s时,Δc(A)=0.8 mol·L-1-0.2 mol·L-1=0.6 mol·L-1,Δc(B)=0.5 mol·L-1
1
-0.3 mol·L-1=0.2 mol·L-1,Δc(C)=0.4 mol·L-1,三者之比为Δc(A)∶Δc(B)∶Δc(C)=
0.6 mol·L-1∶0.2 mol·L-1∶0.4 mol·L-1=3∶1∶2,所以化学方程式为3A+B2C。
(2)0~t s内A的反应速率为= mol·L-1·s-1。
1
(3)压强之比等于物质的量之比,为9∶13。
(4)A气体的体积分数为=≈22.2%;在t ~(t +10)s反应处于平衡状态,v (A)=3v (B),故v (A)
1 1 正 逆 正
>v (B)。
逆
(5)a项,可逆反应不可能停止,错误;b项,在t s之前,反应未达平衡,仍然向正反应方向进行,
1
故B气体的消耗速率大于它的生成速率,正确;c项,在t s时,反应达到平衡,故C气体的正反
1
应速率等于逆反应速率,正确。
16.一定温度下,在2 L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:(1)反应的化学方程式为__________________________________。
(2)反应达到最大限度的时间是________min,该时间内的平均反应速率v(N)=________。
(3)反应达到平衡状态时,放出 6Q kJ 的热量,则当容器中充入 1 mol N 时,反应放出的热量
______(填序号,下同)。
①等于Q kJ ②小于Q kJ ③大于Q kJ ④等于2Q kJ
(4)判断该反应达到平衡状态的依据是________。
①该条件下,正、逆反应速率都为零
②该条件下,混合气体的密度不再发生变化
③该条件下,混合气体的压强不再发生变化
④该条件下,单位时间内消耗2 mol N的同时,生成1 mol M
(5)能加快反应速率的措施是________。
①升高温度
②容器体积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar
④使用催化剂
【答案】 (1)2NM
(2)6 0.5 mol·L-1·min-1
(3)② (4)③ (5)①④
【解析】 (1)如题图在相同时间内,Δn(N)=2Δn(M)
则方程式为2NM。
(2)根据图像可知反应进行到6 min时物质的量不再发生变化,因此反应达到最大限度的时间是 6
min,该时间内的平均反应速率v(N)==0.5 mol·L-1·min-1。
(3)反应达到平衡状态时,放出6Q kJ的热量,即消耗6 mol N放出6Q kJ的热量,由于是可逆反应,
则1 mol N不能完全消耗,所以反应放出的热量为小于Q kJ,答案选②。
(4)①达到平衡状态时正、逆反应速率相等,但不能为零,错误;②密度是混合气体的质量和容器容
积的比值,在反应过程中混合气体的质量和容器容积始终是不变的,因此该条件下,混合气体的密
度不再发生变化不能说明反应达到平衡状态,错误;③正反应体积减小,则该条件下,混合气体的
压强不再发生变化能说明反应达到平衡状态,正确;④该条件下,单位时间内消耗2 mol N的同时,
生成1 mol M均表示正反应速率,不能说明反应达到平衡状态,错误;答案选③。
(5)①升高温度反应速率加快;②容器体积不变,充入惰性气体Ar,反应物浓度不变,反应速率不
变;③容器压强不变,充入惰性气体Ar,容器容积增大,反应物浓度减小,反应速率减小;④使
用催化剂反应速率加快;答案选①④。
17.在2 L密闭容器中,800 ℃时,反应2NO(g)+O(g) 2NO (g)体系中,n(NO)随时间的变
2 2
化如下表所示。时间/s 0 1 2 3 4 5
n(NO)
0.020 0.010 0.008 0.007 0.007 0.007
/mol
(1)上图中,A点处v ________v (填“大于”“小于”或“等于”)。
正 逆
(2)图中表示 NO 变化的曲线是________。用 O 表示从 0~2 s 内该反应的平均速率 v=
2 2
________________。
(3)下列能说明该反应已经达到平衡状态的是________(填字母,下同)。
a.v(NO )=2v(O )
2 2
b.容器内压强保持不变
c.v (NO)=2v (O )
逆 正 2
d.容器内的密度保持不变
(4)下列能使该反应的反应速率增大的是________。
a.及时分离出NO 气体
2
b.适当升高温度
c.增大O 的浓度
2
d.选择高效的催化剂
【答案】 (1)大于 (2)b 1.5×10-3 mol·L-1·s-1 (3)bc (4)bcd
【解析】 (1)图中表明A点的反应时间小于1 s,表中表明在0~1 s内n(NO)呈减小状态,则反应
2NO(g)+O(g)2NO(g)在向右进行,v >v 。
2 2 (正) (逆)
(2)上述反应向右进行,则c(NO)由逐渐减小到保持不变。表中表明,上述反应从开始到平衡,
n(NO)减小0.020 mol-0.007 mol=0.013 mol,则n(NO )增加0.013 mol。上述反应容器的容积为2
2
L,则平衡时c(NO )为0.006 5 mol·L-1,则表示NO 变化的曲线是b。表中表明,在0~2 s内n(NO)
2 2
减小0.020 mol-0.008 mol=0.012 mol,则n(O )减小0.006 mol,容器容积为2 L,则c(O )减小0.003
2 2
mol·L-1,反应时间为2 s,根据v=计算得v(O )=1.5×10-3 mol·L-1·s-1。
2
(3)化学平衡状态中正、逆反应速率相等,v (NO )=2v (O )体现了上述反应中正、逆反应速率相等,
正 2 逆 2
v(NO )=2v(O )则不可以。上述反应,在达到平衡之前气体总物质的量不守恒,则在恒温、恒容下
2 2
气体总压强不守恒;在达到平衡之后气体总物质的量守恒,则在恒温、恒容下气体总压强守恒。总
之,上述反应的容器内压强保持不变,说明反应已经到达平衡。上述反应,在达到平衡前后气体质
量守恒,由于容器容积不变,则容器内的密度不变不能说明反应达到平衡。
(4)其他条件一定,升高温度或增大反应物的浓度或使用催化剂,都能使化学反应速率增大;反之,
可使化学反应速率减小。
18.甲、乙两个研究小组决定用实验探究的方法证明化学反应具有一定的限度,在一定条件下会达
到“平衡状态”。
(Ⅰ)甲组:取5 mL 0.1 mol·L-1的KI溶液于试管中,滴加0.1 mol·L-1的FeCl 溶液2 mL,发生如下
3反应:2I-+2Fe3+===2Fe2++I 。为了证明该反应具有一定的限度,他们设计了如下实验:①取少
2
量反应液,滴加AgNO 溶液,发现有少量的黄色沉淀(AgI)生成,证明反应物没有反应完全;②再
3
取少量反应液,加入少量CCl ,振荡,发现CCl 层显浅紫色,证明萃取到了I,即有I 生成。结合
4 4 2 2
①②的结论,他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度。
(1)指导老师指出上述实验中①不合理,你认为原因是________________________________,改进的
方法是____________________________________。
(2)有人认为步骤②适合检验生成I 较多的情况,还有一种简单的方法可以灵敏地检验是否生成了
2
I,这种方法是_____________________________________。
2
(Ⅱ)乙组:取4 mL 1 mol·L-1的CaCl 溶液于试管中,发现滴入1 mol·L-1的NaSO 溶液6 mL后已
2 2 4
经观察不到有白色沉淀产生了,发生的反应是NaSO +CaCl ===CaSO ↓+2NaCl。请设计一个简单
2 4 2 4
的实验,确认上述反应具有可逆性和反应限度,简要列出实验步骤和结论:
________________________________________________________________________。
【答案】 Ⅰ.(1)该反应中 KI相对过量,故不能直接检验是否存在 I- 取少量反应液,滴加
KSCN,若出现红色,则证明还有Fe3+未完全反应
(2)取少量反应液,滴加淀粉溶液,若溶液变蓝色,说明生成了I
2
Ⅱ.取上层清液少许置于试管中,滴加1 mol·L-1的NaCO 溶液,若产生白色沉淀,则说明反应有一
2 3
定的可逆性和反应限度
【解析】 甲组实验①不合理,因为所加的I-是过量的,不能检验I-存在证明反应的可逆性,只
能证明少量反应物Fe3+是否剩余及是否生成了I 来证明,因此,用KSCN溶液、淀粉溶液(或CCl
2 4
萃取)等合理方法。乙组从反应物的量的角度考虑,NaSO 溶液相对过量,若反应无可逆性,则Ca2
2 4
+沉淀完全,若反应有一定可逆性和反应限度,则Ca2+没有完全沉淀,故可用NaCO 来证明Ca2+
2 3
即可。