文档内容
期中模拟卷1
(时间:90分钟 满分:100分)
可能用到的相对原子质量:H 1 C 12 Si 28 P 31 Cl 35.5
一、选择题(本题包括15个小题,每小题只有一个选项符合题意。每小题2分,共
30分)
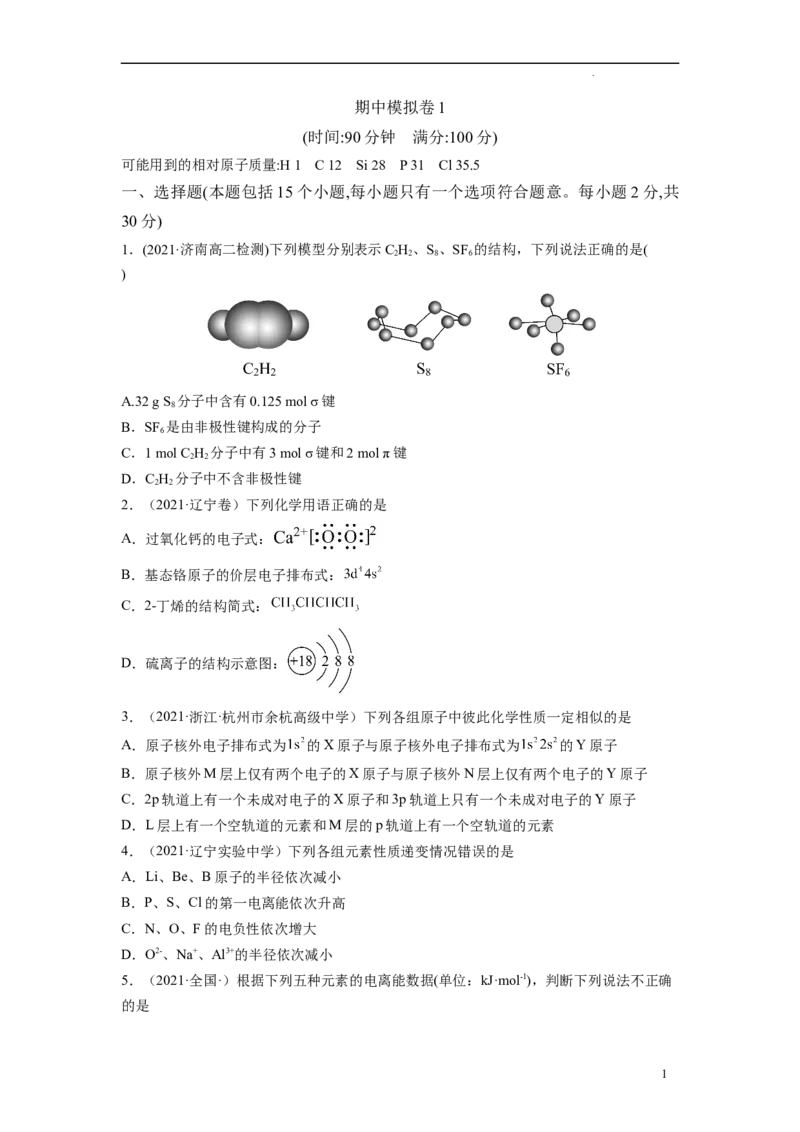
1.(2021·济南高二检测)下列模型分别表示C H、S、SF 的结构,下列说法正确的是(
2 2 8 6
)
A.32 g S 分子中含有0.125 mol σ键
8
B.SF 是由非极性键构成的分子
6
C.1 mol C H 分子中有3 mol σ键和2 mol π键
2 2
D.C H 分子中不含非极性键
2 2
2.(2021·辽宁卷)下列化学用语正确的是
A.过氧化钙的电子式:
B.基态铬原子的价层电子排布式:
C.2-丁烯的结构简式:
D.硫离子的结构示意图:
3.(2021·浙江·杭州市余杭高级中学)下列各组原子中彼此化学性质一定相似的是
A.原子核外电子排布式为 的X原子与原子核外电子排布式为 的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上有一个未成对电子的X原子和3p轨道上只有一个未成对电子的Y原子
D.L层上有一个空轨道的元素和M层的p轨道上有一个空轨道的元素
4.(2021·辽宁实验中学)下列各组元素性质递变情况错误的是
A.Li、Be、B原子的半径依次减小
B.P、S、Cl的第一电离能依次升高
C.N、O、F的电负性依次增大
D.O2-、Na+、Al3+的半径依次减小
5.(2021·全国·)根据下列五种元素的电离能数据(单位:kJ·mol-1),判断下列说法不正确
的是
1
学科网(北京)股份有限公司元素代号 I I I I
1 2 3 4
Q 2 080 4 000 6 100 9 400
R 500 4 600 6 900 9 500
S 740 1 500 7 700 10 500
T 580 1 800 2 700 11 600
U 420 3 100 4 400 5 900
A.元素的电负性最大的可能是Q元素
B.R和S均可能与U在同一主族
C.U元素可能在元素周期表的s区
D.原子的价电子排布为ns2np1的可能是T元素
6.(2021·四川省绵阳第一中学)下列关于原子结构与元素周期表的说法正确的是
A.电负性最大的元素位于周期表的左下角
B.某基态原子的价电子排布式为4s24p1,该元素位于周期表第四周期IIIA族
C.2s 轨道在空间呈哑铃形
D.原子核外可能有两个电子的运动状态是相同的
7.(2021·辽宁·沈阳市第一二〇中学)著名的观赏石-崂山璐石主要成分可表示为
,其中W、Y、Z表示三种原子序数依次增大的第三周期元
素,W没有未成对电子,Z的最高正价与最低负价的代数和为0.下列说法错误的是
A.Y的离子半径在同周期元素中最小
B.Z在它的简单氢化物中显负价
C.W、Y、Z的最高价氧化物的水化物都属于弱电解质
D.三种元素的电负性由大到小的顺序为Z>Y>W
8.(2021·江苏镇江·)X、Y、Z、W为原子序数依次增大的前四周期元素,X的一种单质
是天然存在的最坚硬矿物质,Z原子最外层电子数为次外层电子数的三倍,W基态原子的
价电子排布为3d64s2。下列说法正确的是
A.原子半径:Z>Y>X
B.元素的第一电离能:Z>Y>X
C.X、Y最简单气态氢化物分子的键角:X>Y
D.W2+价电子轨道表示式:
9.(2021·北京·101中学)已知各共价键的键能如表所示,下列说法正确的是
共价键 H—H F—F H—F H—Cl H—I
2
学科网(北京)股份有限公司键能E(kJ/mol) 436 157 568 432 298
A.键的极性大小顺序:H—I>H—Cl>H—F
B.表中最稳定的共价键是F—F键
C.432kJ/mol>E(H—Br)>298kJ/mol
D.上述键能可以说明热稳定性的顺序是:HF<HCl<HI
10.(2021·北京高二检测)CH、—CH、CH都是重要的有机反应中间体,有关它们的说法
3
正确的是( )
A.—CH 与—NH 连接形成的化合物中,碳原子采取sp3杂化
3 2
B.CH与NH 、HO+的立体构型均为正四面体形
3 3
C.CH中的碳原子采取sp3杂化,所有原子不都共面
D.CH与OH-形成的化合物中含有离子键
11.(2021·天津高二检测)用短线“—”表示共用电子对,用“ ”表示未成键孤电子对的
式子叫路易斯结构式。R分子的路易斯结构式可以表示为 。则以下叙述错误的是(
)
A.R为三角锥形 B.R可以是BF
3
C.R是极性分子 D.键角小于109°28′
12.(2021·全国·)下列“类比”结果不正确的是
A.浓硫酸与NaCl微热制备HCl,则浓硫酸与 微热可制备
B. 的分子构型为V形,则 的分子构型为V形
C.纯水的电离 ,则液氨的电离
D. 通入 溶液中无沉淀生成,则 通入 溶液中也没有沉淀生成
13.(2021·陕西·武功县普集高级中学)氯化亚硫( )是一种很重要的化学试剂,可以
作为氯化剂和脱水剂。下列关于氯化亚硫分子的空间结构和中心原子( )采取何种杂化方式
的说法正确的是
A.三角锥形、 B.平面三角形、
C.平面三角形、 D.三角锥形、
14.下列说法中正确的是( )
A.PCl 分子是三角锥形,这是因为磷原子是sp2杂化的结果
3
B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的4个sp3杂化轨道
C.凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体形
D.AB 型的分子空间结构必为平面三角形
3
3
学科网(北京)股份有限公司15.根据杂化轨道理论和价层电子对互斥模型判断,下列分子或者离子的空间结构的相关描
述正确的是 ( )
中心原子 价层电子 分子或离子
选项 分子式
杂化方式 对互斥模型 的空间结构
A SO sp 直线形 直线形
2
B HCHO sp2 平面三角形 三角锥形
C NF sp2 四面体形 平面三角形
3
D N sp3 正四面体形 正四面体形
二、选择题(本题包括5个小题,每小题有1~2个选项符合题意。每小题 3分,共
15分)
16.已知M元素原子的价层电子排布式为3s23p1,短周期元素L的原子最外层p轨道为半充
满状态,下列叙述错误的是( )
A.M为金属元素,L为非金属元素 B.M与L为同周期元素
C.L的电负性大于M D.M的第一电离能大于L
17.图中三条曲线表示C、Si、P元素四级电离能的变化趋势。下列说法正确的是( )
A.电负性:c>b>a B.最简单氢化物的稳定性:c>a>b
C.第五电离能:a>c>b D.最简单氢化物的沸点:a>b>c
18.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述正确
的是( )
A.W、R元素单质分子内都存在非极性键 B.X、Z元素都能形成双原子分子
C.最简单氢化物的熔、沸点:WH (填元素符号);X和Z形成的化合
物XZ 为一种液体溶剂,其分子中的σ键和π键数目之比为 ,该化合物 溶于
2
水(填“易”或“难”)。
(3)Y的最简单氢化物分子中含有 共价键(填“极性”或“非极性”,下同),是
分子,该氢化物易液化,其原因是 。
(4)M的气态氢化物和氟化氢相比(填写化学式,并从微粒间作用力的角度分析原因),稳定性强
6
学科网(北京)股份有限公司的是 ,其原因是 ;沸点高的是 ,
其原因是 。
24.(11分)卤族元素形成的单质和化合物有很多,我们可以利用所学物质结构与性质的相关
知识去认识和理解它们。
(1)卤族元素位于元素周期表的 区;溴的价层电子排布式为 。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF) 形式存在的,使氢氟酸分子缔合的作用
2
力是 。
(3)请根据下表提供的第一电离能数据判断,还原性最强的卤素原子是 (写出名称)。
元 素 氟 氯 溴 碘
第一电离能/(kJ·mol-1) 1 681 1 251 1 140 1 008
(4)已知下列5种羧酸:
①CF COOH ②CHCOOH ③CHFCOOH
3 3 2
④CH ClCOOH ⑤CHCHCOOH
2 3 2
其酸性由强到弱的顺序为 (填序号)。
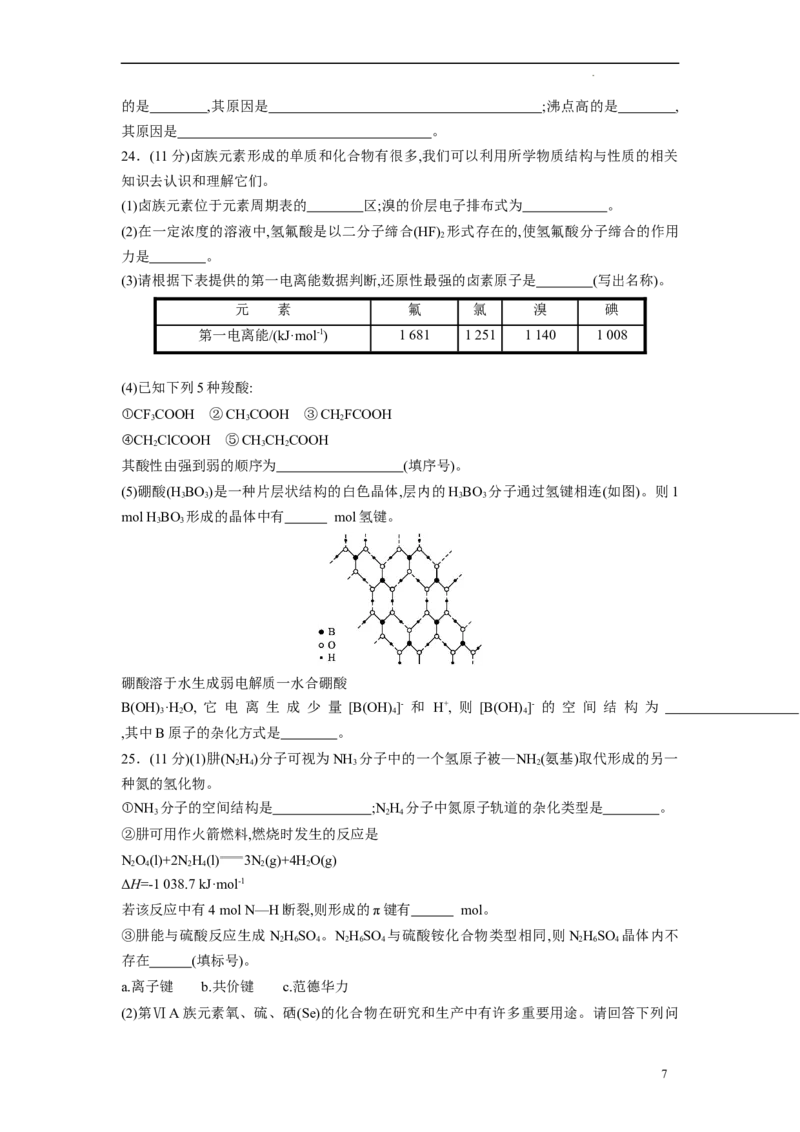
(5)硼酸(H BO)是一种片层状结构的白色晶体,层内的HBO 分子通过氢键相连(如图)。则1
3 3 3 3
mol HBO 形成的晶体中有 mol氢键。
3 3
硼酸溶于水生成弱电解质一水合硼酸
B(OH) ·H O, 它 电 离 生 成 少 量 [B(OH) ]- 和 H+, 则 [B(OH) ]- 的 空 间 结 构 为
3 2 4 4
,其中B原子的杂化方式是 。
25.(11分)(1)肼(N H)分子可视为NH 分子中的一个氢原子被—NH (氨基)取代形成的另一
2 4 3 2
种氮的氢化物。
①NH 分子的空间结构是 ;N H 分子中氮原子轨道的杂化类型是 。
3 2 4
②肼可用作火箭燃料,燃烧时发生的反应是
NO(l)+2N H(l) 3N(g)+4HO(g)
2 4 2 4 2 2
ΔH=-1 038.7 kJ·mol-1
若该反应中有4 mol N—H断裂,则形成的π键有 mol。
③肼能与硫酸反应生成NHSO 。NHSO 与硫酸铵化合物类型相同,则NHSO 晶体内不
2 6 4 2 6 4 2 6 4
存在 (填标号)。
a.离子键 b.共价键 c.范德华力
(2)第ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问
7
学科网(北京)股份有限公司题:
①HSe 的酸性比 HS (填“强”或“弱”)。气态 SeO 分子的空间结构为
2 2 3
,SO2-的空间结构为 。
3
②H SeO 的分别为2.7×10-3和2.5×10-7,H SeO 第一步几乎完全电离,为1.2×10-2,请根据结构与
2 3 2 4
性质的关系解释:H SeO 比HSeO 酸性强的原因 。
2 4 2 3
8
学科网(北京)股份有限公司9
学科网(北京)股份有限公司