文档内容
驻马店市 2023~2024 学年度第二学期期终质量监测
高一化学试题
本试题卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,共6页,19题,满分100分,考
试用时75分钟。考生作答时,将答案答在答题卡上,在本试题卷上答题无效。考试结束后,
监考老师只收答题卡。
注意事项:
1.答题前,考生务必将自己的姓名、准考证号填写(涂)在答题卡上。考生要认真核对答题
卡上粘贴的条形码的“准考证号、姓名”与考生本人准考证号、姓名是否一致。
2.第I卷每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,
用橡皮擦干净后,再选涂其他答案标号。第Ⅱ卷用黑色墨水签字笔在答题卡上书写作答,在
试题上作答,答案无效。
3.考试结束,监考教师将答题卡收回。
可能用到的相对原子质量:
第I卷(选择题 共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1. 沼气在我国部分农村地区有广泛的应用。在一定的温度、湿度和酸碱度的条件下,秸秆、杂草、人畜粪
便等在沼气池经隔绝空气发酵可产生沼气(如图所示)。下列说法错误的是
A. 沼气不属于可再生能源
B. 厨余垃圾也可作为沼气生产原料
C. 动、植物废物中含有纤维素、蛋白质和脂肪
D. 在新农村建设中,大力推广兴建沼气池,能改善农村卫生条件,改变能源结构,减少环境污染
2. 化学实验实践中一些反应器内壁污垢,可选用针对性的试剂溶解除去.下表中污垢处理试剂的选用,符
合安全、环保理念的是
第1页/共13页
学科网(北京)股份有限公司实验 ① ② ③ ④
污垢 银镜反应的银垢 石化设备内的硫垢 锅炉内的石膏垢 制氧的 垢
饱和 溶
溶液;
溶
试剂 液; 浓盐酸
液 溶液
柠檬酸溶液
A. ①④ B. ②③ C. ③④ D. ①②
3. 设N 为阿伏加德罗常数的值。下列说法正确的是
A
A. 100 g质量分数为46%的乙醇溶液中含有氧原子数为4N
A
B. 浓硫酸与足量铜加热反应,生成SO 分子的数目为0.46N
2 A
C. 将5.6 g铁块投入一定量的稀硝酸中,恰好完全反应,一定转移0.3N 个电子
A
D. 17 g羟基与17 g氢氧根离子所含电子数均为10N
A
4. 几位同学以相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
水果种
实验编号 电极间距离 电流
类
1 番茄 1 98.7
2 番茄 2 92.5
.
3 苹果 3 272
下列有关分析正确的是
A. 该实验的目的只探究水果种类对水果电池电流大小的影响
B. 该实验所用的装置中,负极材料是锌片,电势较高
C. 实验1和实验3表明水果种类对电流大小有影响
D. 水果的酸碱度也能影响水果电池电流大小
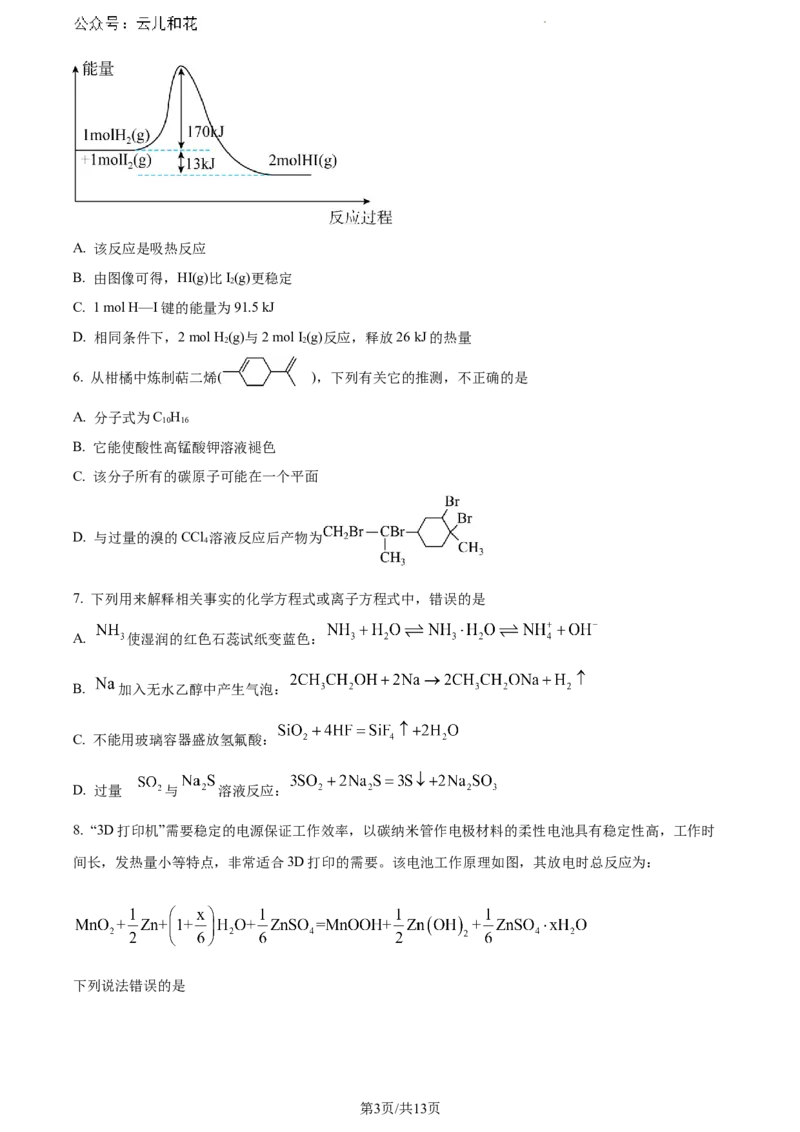
5. 一定条件下发生反应 ,当反应了1 mol H (g)和1 mol I (g)生成2 mol HI(g)时,
2 2
其断键、成键过程的能量变化如图所示。下列说法正确的是
第2页/共13页
学科网(北京)股份有限公司A. 该反应是吸热反应
B. 由图像可得,HI(g)比I(g)更稳定
2
C. 1 mol H—I键的能量为91.5 kJ
D. 相同条件下,2 mol H (g)与2 mol I (g)反应,释放26 kJ的热量
2 2
6. 从柑橘中炼制萜二烯( ),下列有关它的推测,不正确的是
A. 分子式为C H
10 16
B. 它能使酸性高锰酸钾溶液褪色
C. 该分子所有的碳原子可能在一个平面
D. 与过量的溴的CCl 溶液反应后产物为
4
7. 下列用来解释相关事实的化学方程式或离子方程式中,错误的是
A. 使湿润的红色石蕊试纸变蓝色:
B. 加入无水乙醇中产生气泡:
C. 不能用玻璃容器盛放氢氟酸:
的
D. 过量 与 溶液反应:
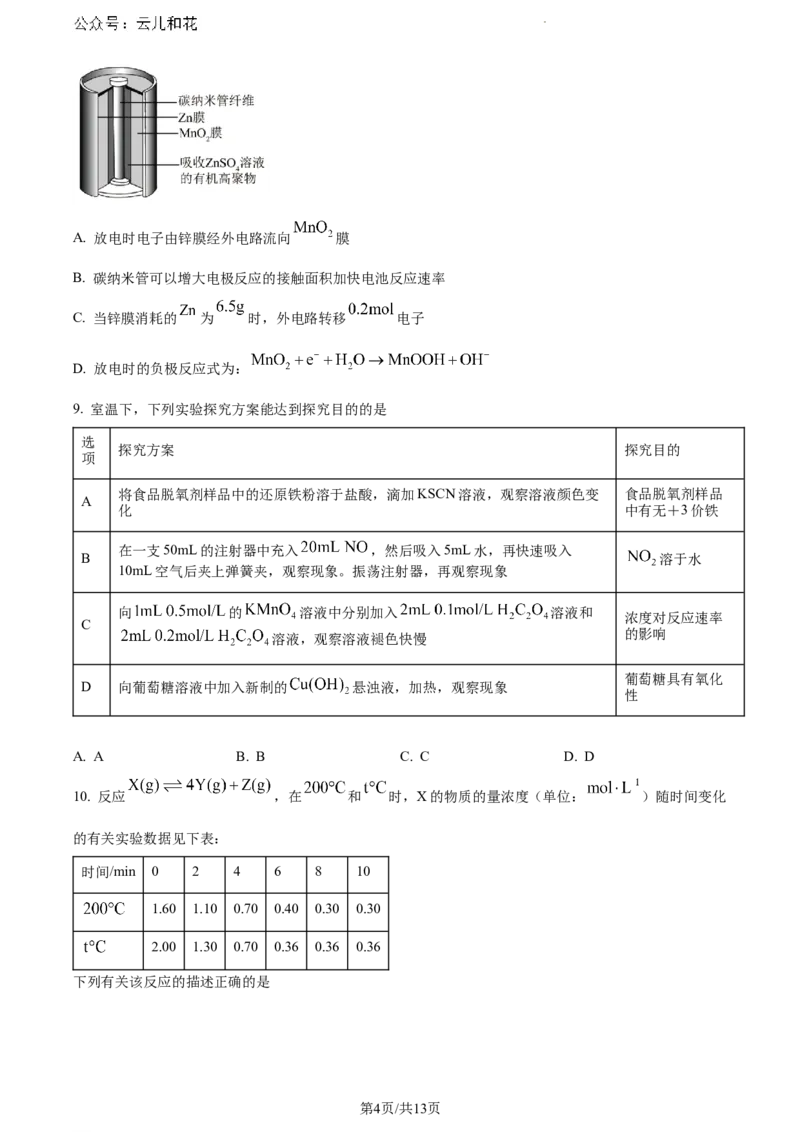
8. “3D打印机”需要稳定的电源保证工作效率,以碳纳米管作电极材料的柔性电池具有稳定性高,工作时
间长,发热量小等特点,非常适合3D打印的需要。该电池工作原理如图,其放电时总反应为:
下列说法错误的是
第3页/共13页
学科网(北京)股份有限公司A. 放电时电子由锌膜经外电路流向 膜
B. 碳纳米管可以增大电极反应的接触面积加快电池反应速率
C. 当锌膜消耗的 为 时,外电路转移 电子
D. 放电时的负极反应式为:
9. 室温下,下列实验探究方案能达到探究目的的是
选
探究方案 探究目的
项
将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加KSCN溶液,观察溶液颜色变 食品脱氧剂样品
A
化 中有无+3价铁
在一支50mL的注射器中充入 ,然后吸入5mL水,再快速吸入
B 溶于水
10mL空气后夹上弹簧夹,观察现象。振荡注射器,再观察现象
向 的 溶液中分别加入 溶液和
浓度对反应速率
C
的影响
溶液,观察溶液褪色快慢
葡萄糖具有氧化
D 向葡萄糖溶液中加入新制的 悬浊液,加热,观察现象
性
A. A B. B C. C D. D
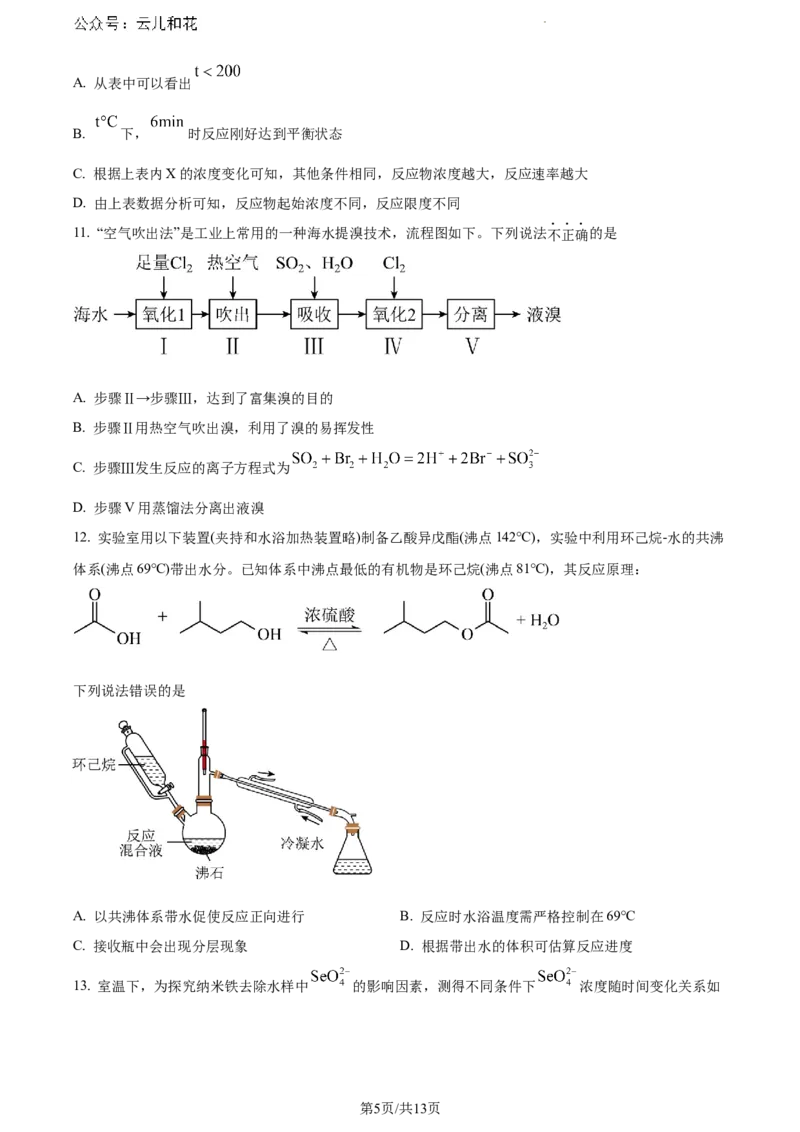
10. 反应 ,在 和 时,X的物质的量浓度(单位: )随时间变化
的有关实验数据见下表:
时间/min 0 2 4 6 8 10
1.60 1.10 0.70 0.40 0.30 0.30
2.00 1.30 0.70 0.36 0.36 0.36
下列有关该反应的描述正确的是
第4页/共13页
学科网(北京)股份有限公司A. 从表中可以看出
B. 下, 时反应刚好达到平衡状态
C. 根据上表内X的浓度变化可知,其他条件相同,反应物浓度越大,反应速率越大
D. 由上表数据分析可知,反应物起始浓度不同,反应限度不同
11. “空气吹出法”是工业上常用的一种海水提溴技术,流程图如下。下列说法不正确的是
A. 步骤Ⅱ→步骤Ⅲ,达到了富集溴的目的
B. 步骤Ⅱ用热空气吹出溴,利用了溴的易挥发性
C. 步骤Ⅲ发生反应的离子方程式为
D. 步骤V用蒸馏法分离出液溴
12. 实验室用以下装置(夹持和水浴加热装置略)制备乙酸异戊酯(沸点142℃),实验中利用环己烷-水的共沸
体系(沸点69℃)带出水分。已知体系中沸点最低的有机物是环己烷(沸点81℃),其反应原理:
下列说法错误的是
A. 以共沸体系带水促使反应正向进行 B. 反应时水浴温度需严格控制在69℃
C. 接收瓶中会出现分层现象 D. 根据带出水的体积可估算反应进度
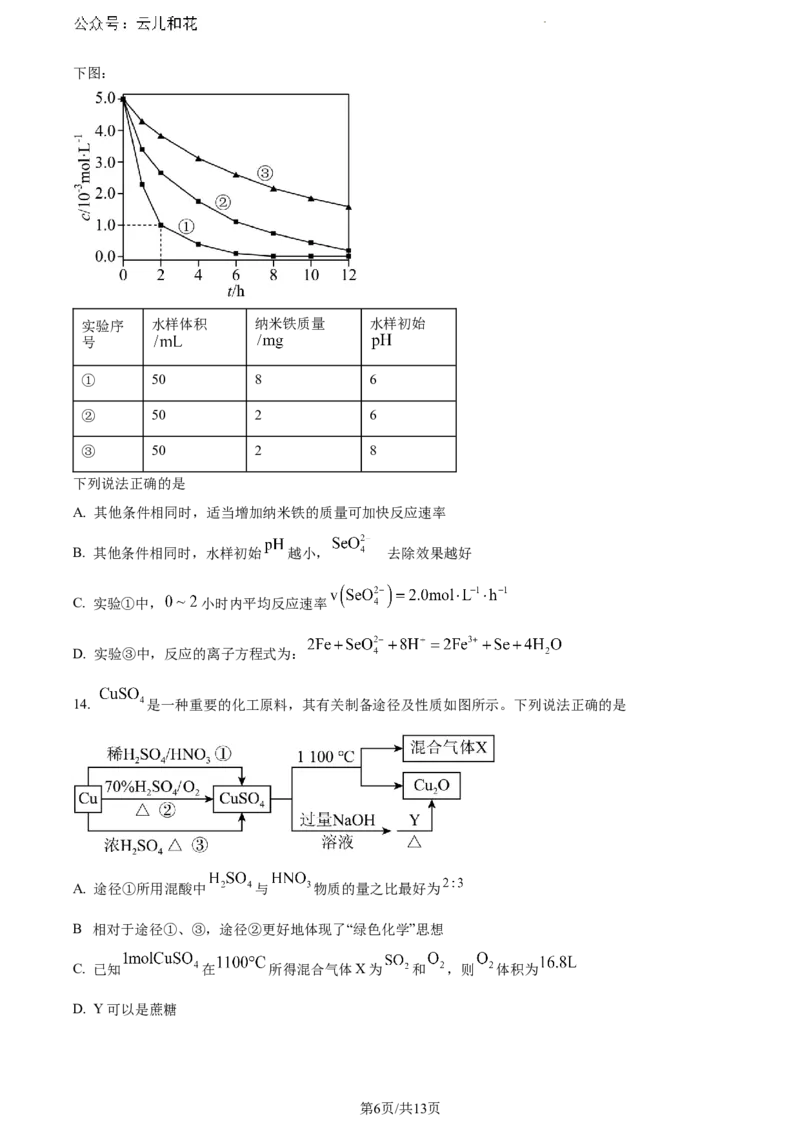
13. 室温下,为探究纳米铁去除水样中 的影响因素,测得不同条件下 浓度随时间变化关系如
第5页/共13页
学科网(北京)股份有限公司下图:
实验序 水样体积 纳米铁质量 水样初始
号
① 50 8 6
② 50 2 6
③ 50 2 8
下列说法正确的是
A. 其他条件相同时,适当增加纳米铁的质量可加快反应速率
的
B. 其他条件相同时,水样初始 越小, 去除效果越好
C. 实验①中, 小时内平均反应速率
D. 实验③中,反应的离子方程式为:
14. 是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法正确的是
A. 途径①所用混酸中 与 物质的量之比最好为
.
B 相对于途径①、③,途径②更好地体现了“绿色化学”思想
C. 已知 在 所得混合气体X为 和 ,则 体积为
D. Y可以是蔗糖
第6页/共13页
学科网(北京)股份有限公司第Ⅱ卷(非选择题,共58分)
二、非选择题(本大题共4小题,共58分)
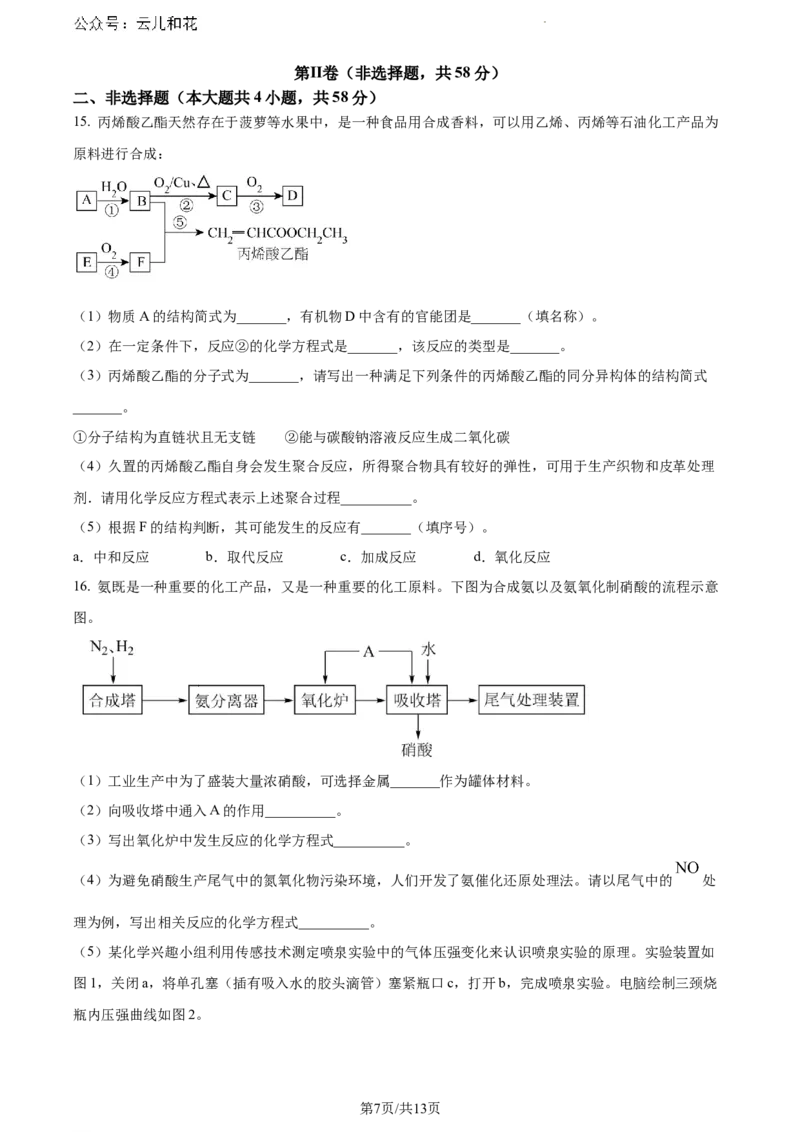
15. 丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料,可以用乙烯、丙烯等石油化工产品为
原料进行合成:
(1)物质A的结构简式为_______,有机物D中含有的官能团是_______(填名称)。
(2)在一定条件下,反应②的化学方程式是_______,该反应的类型是_______。
(3)丙烯酸乙酯的分子式为_______,请写出一种满足下列条件的丙烯酸乙酯的同分异构体的结构简式
_______。
①分子结构为直链状且无支链 ②能与碳酸钠溶液反应生成二氧化碳
(4)久置的丙烯酸乙酯自身会发生聚合反应,所得聚合物具有较好的弹性,可用于生产织物和皮革处理
剂.请用化学反应方程式表示上述聚合过程__________。
(5)根据F的结构判断,其可能发生的反应有_______(填序号)。
a.中和反应 b.取代反应 c.加成反应 d.氧化反应
16. 氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意
图。
(1)工业生产中为了盛装大量浓硝酸,可选择金属_______作为罐体材料。
(2)向吸收塔中通入A的作用__________。
(3)写出氧化炉中发生反应的化学方程式__________。
(4)为避免硝酸生产尾气中的氮氧化物污染环境,人们开发了氨催化还原处理法。请以尾气中的 处
理为例,写出相关反应的化学方程式__________。
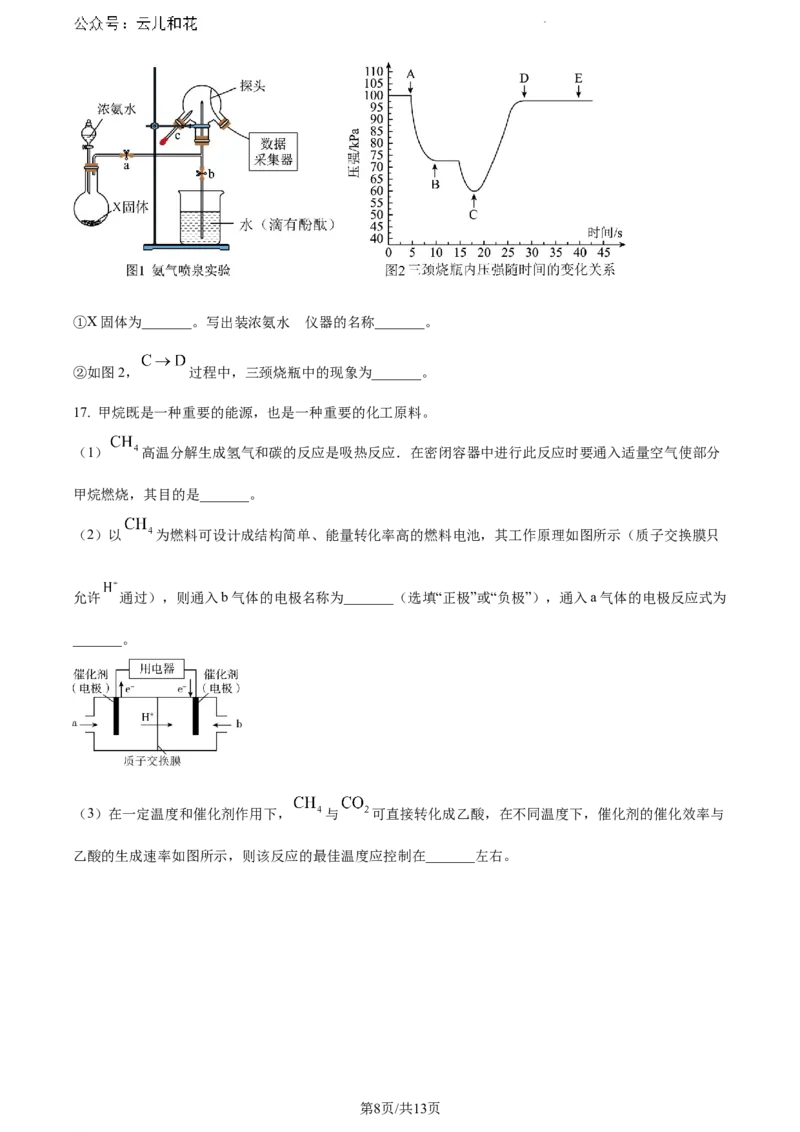
(5)某化学兴趣小组利用传感技术测定喷泉实验中的气体压强变化来认识喷泉实验的原理。实验装置如
图1,关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧瓶口c,打开b,完成喷泉实验。电脑绘制三颈烧
瓶内压强曲线如图2。
第7页/共13页
学科网(北京)股份有限公司的
①X固体为_______。写出装浓氨水 仪器的名称_______。
②如图2, 过程中,三颈烧瓶中的现象为_______。
17. 甲烷既是一种重要的能源,也是一种重要的化工原料。
(1) 高温分解生成氢气和碳的反应是吸热反应.在密闭容器中进行此反应时要通入适量空气使部分
甲烷燃烧,其目的是_______。
(2)以 为燃料可设计成结构简单、能量转化率高的燃料电池,其工作原理如图所示(质子交换膜只
允许 通过),则通入b气体的电极名称为_______(选填“正极”或“负极”),通入a气体的电极反应式为
_______。
(3)在一定温度和催化剂作用下, 与 可直接转化成乙酸,在不同温度下,催化剂的催化效率与
乙酸的生成速率如图所示,则该反应的最佳温度应控制在_______左右。
第8页/共13页
学科网(北京)股份有限公司(4)一定条件下, 和 发生催化重整反应 。恒温恒容下,
往 密闭容器中加入 进行该反应, 后测得生成了 。则 内平
均反应速率 _______ 的转化率为_______。
(5)工业上利用 和 制备 燃料,实现资源的循环利用。恒温恒容时,充入 和 发生如
下反应: 。
①下列情况表明该反应已达到平衡状态的是_______(填序号)。
a.混合气体的密度不随时间变化 b.混合气体的总压强不随时间变化
c.混合气体的平均摩尔质量不随时间变化 d. 和 的浓度之比不随时间变化
②其他条件相同时,只改变一个条件,能增大 的生成速率的是_______(填序号)。
a.降低温度 b.充入 c.再充入 d.及时移走部分
18. 我国在新能源汽车领域世界领先,新能源汽车动力电池的制备和回收利用技术至关重要。回收含
的废旧电池(还有 、石墨粉和铝箔)制备 的流程如图所示:
已知:① 在水中的溶解度很小,溶解度随温度的升高而降低;② 不溶于冷水,
第9页/共13页
学科网(北京)股份有限公司能溶于硫酸;③ 沉淀完全的 约3.7。
(1)“碱溶”前一般先将含 的废料进行粉碎,原因是__________。
(2)“碱溶”时铝箔发生反应的离子方程式为___________。
(3)“操作1”和“操作2”需要使用的玻璃仪器有烧杯、_______;滤渣2和滤渣3的主要成分分别为
_______、_______。
(4)“酸浸”过程中温度不宜高于 ,原因是___________。
(5)“沉锂”时发生反应的离子方程式为___________。
(6) 粗品可以用_______(填序号)洗涤;检验 是否洗涤干净的操作及现象为_______。
a.热水 b.冷水 c.稀硫酸 d.氯化锂溶液
第10页/共13页
学科网(北京)股份有限公司驻马店市 2023~2024 学年度第二学期期终质量监测
高一化学试题
本试题卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,共6页,19题,满分100分,考
试用时75分钟。考生作答时,将答案答在答题卡上,在本试题卷上答题无效。考试结束后,
监考老师只收答题卡。
注意事项:
1.答题前,考生务必将自己的姓名、准考证号填写(涂)在答题卡上。考生要认真核对答题
卡上粘贴的条形码的“准考证号、姓名”与考生本人准考证号、姓名是否一致。
2.第I卷每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,
用橡皮擦干净后,再选涂其他答案标号。第Ⅱ卷用黑色墨水签字笔在答题卡上书写作答,在
试题上作答,答案无效。
3.考试结束,监考教师将答题卡收回。
可能用到的相对原子质量:
第I卷(选择题 共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
【1题答案】
【答案】A
【2题答案】
【答案】B
【3题答案】
【答案】A
【4题答案】
【答案】D
【5题答案】
【答案】C
【6题答案】
【答案】C
【7题答案】
【答案】D
【8题答案】
【答案】D
【9题答案】
第11页/共13页
学科网(北京)股份有限公司【答案】B
【10题答案】
【答案】C
【11题答案】
【答案】C
【12题答案】
【答案】B
【13题答案】
【答案】A
【14题答案】
【答案】B
第Ⅱ卷(非选择题,共58分)
二、非选择题(本大题共4小题,共58分)
【15题答案】
【答案】(1) ①. ②. 羧基
(2) ①. ②. 氧化反应
( 3 ) ① . ②. 或 或
(4)nCH=CHCOOCH CH ;
2 2 3
(5)
【16题答案】
【答案】(1)铁 (2)充分氧化 ,使 被充分吸收
(3)
第12页/共13页
学科网(北京)股份有限公司(4)
(5) ①. 或 固体 ②. 分液漏斗 ③. 产生红色喷泉
【17题答案】
【答案】(1)提供 分解所需的能量
(2) ①. 正极 ②.
(3)
(4) ①. 0.2 ②.
(5) ①. ②. c
【18题答案】
【答案】(1)增大接触面积,加快反应速率
(2)
(3) ①. 漏斗、玻璃棒 ②. 石墨粉 ③.
(4)防止 分解
(5)
(6) ①. a ②. 取最后一次洗涤液,加入盐酸酸化的 溶液,若无明显现象,则证明已经洗涤
干净,反之则没有
第13页/共13页
学科网(北京)股份有限公司