文档内容
第一章 原子结构与性质
第一节 原子结构
一、能层与能级
1、能层
(1)含义:根据核外电子的 能量 不同,将核外电子分为不同的能层(电子层)。
(2)序号及符号:能层序号一、二、三、四、五、六、七……分别用 K、L、M、N、O、
P、Q……表示,其中每层所容纳的电子数最多为 2 n 2 个。
(3)能量关系:能层越高,电子的能量越高,能量的高低顺序为 E (K ) <E(L)< E (M) <
E(N)<E(O)<E(P) < E (Q ) 。
2、能级
(1)含义:根据多电子原子的同一能层的电子的 能量 也可能不同,将它们分为不同 能
级 。
(2)表示方法:分别用相应能层的 序数 和字母s、p、d、f等表示,如n能层的能级按能
量由 低 到高 的排列顺序为ns、 n p 、 n d 、nf等。
3、能层、能级与最多容纳的电子数
能层(n) 一 二 三 四 五 六 七 ……
符号 K L M N O P Q ……
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s …… …… …… ……
最多电 2 2 6 2 6 10 2 6 10 14 2 …… …… …… ……
子数 2 8 18 32 …… …… …… 2n2
由上表可知:
(1)能层序数 等于 该能层所包含的能级数,如第三能层有 3 个能级。
(2)s、p、d、f 各能级可容纳的最多电子数分别为 1 、 3 、 5 、 7 的2倍。
(3)原子核外电子的每一能层最多可容纳的电子数是 2 n 2 (n为能层的序数)。
二、基态与激发态 原子光谱
1、基态原子与激发态原子
(1)基态原子:处于 最低能量 状态的原子。
(2)激发态原子:基态原子 吸收 能量,它的电子会跃迁到 较高 能级,变成 激发
态原子。
2、光谱
(1)光谱的成因及分类
(2)光谱分析:在现代化学中,常利用原子光谱上的 特征谱线 来鉴定元素,称为光谱分
学科网(北京)股份有限公司析。
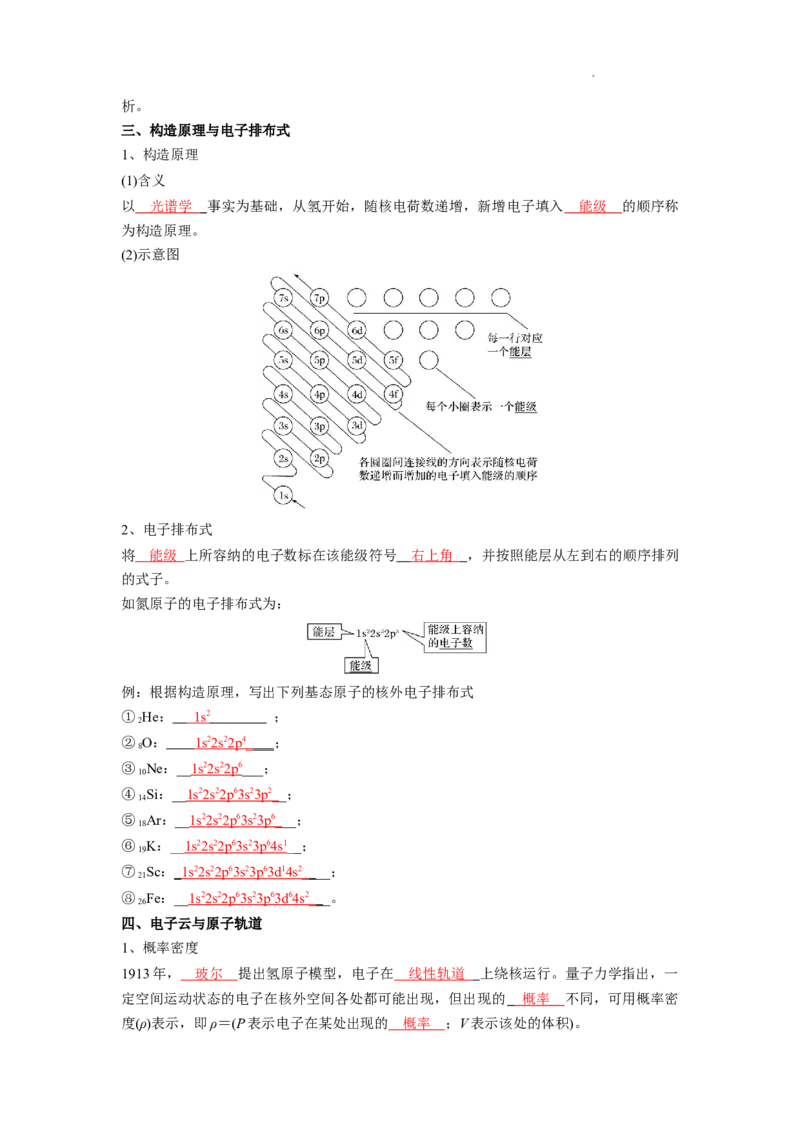
三、构造原理与电子排布式
1、构造原理
(1)含义
以 光谱学 事实为基础,从氢开始,随核电荷数递增,新增电子填入 能级 的顺序称
为构造原理。
(2)示意图
2、电子排布式
将 能级 上所容纳的电子数标在该能级符号 右上角 ,并按照能层从左到右的顺序排列
的式子。
如氮原子的电子排布式为:
例:根据构造原理,写出下列基态原子的核外电子排布式
① He: 1 s 2 ;
2
② O: 1 s 2 2 s 2 2 p 4 _ __ _;
8
③ Ne:__ 1s 2 2s 2 2p 6 ___;
10
④ Si:__ 1s 2 2s 2 2p 6 3s 2 3p 2 _ _;
14
⑤ Ar:__ 1s 2 2s 2 2p 6 3s 2 3p 6 _ __;
18
⑥ K:__ 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 __;
19
⑦ Sc: _ 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 _ _ __;
21
⑧ Fe:__ 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 _ _ _。
26
四、电子云与原子轨道
1、概率密度
1913年, 玻尔 提出氢原子模型,电子在 线性轨道 上绕核运行。量子力学指出,一
定空间运动状态的电子在核外空间各处都可能出现,但出现的 概率 不同,可用概率密
度(ρ)表示,即ρ=(P表示电子在某处出现的 概率 ;V表示该处的体积)。
学科网(北京)股份有限公司2、电子云
(1)定义:处于一定空间 运动状态 的电子在原子核外空间的概率密度分布的形象化描述。
(2)含义:用单位体积内小黑点的疏密程度表示电子在原子核外出现概率大小,小黑点越
密 ,表示概率密度越 大 。
(3)形状
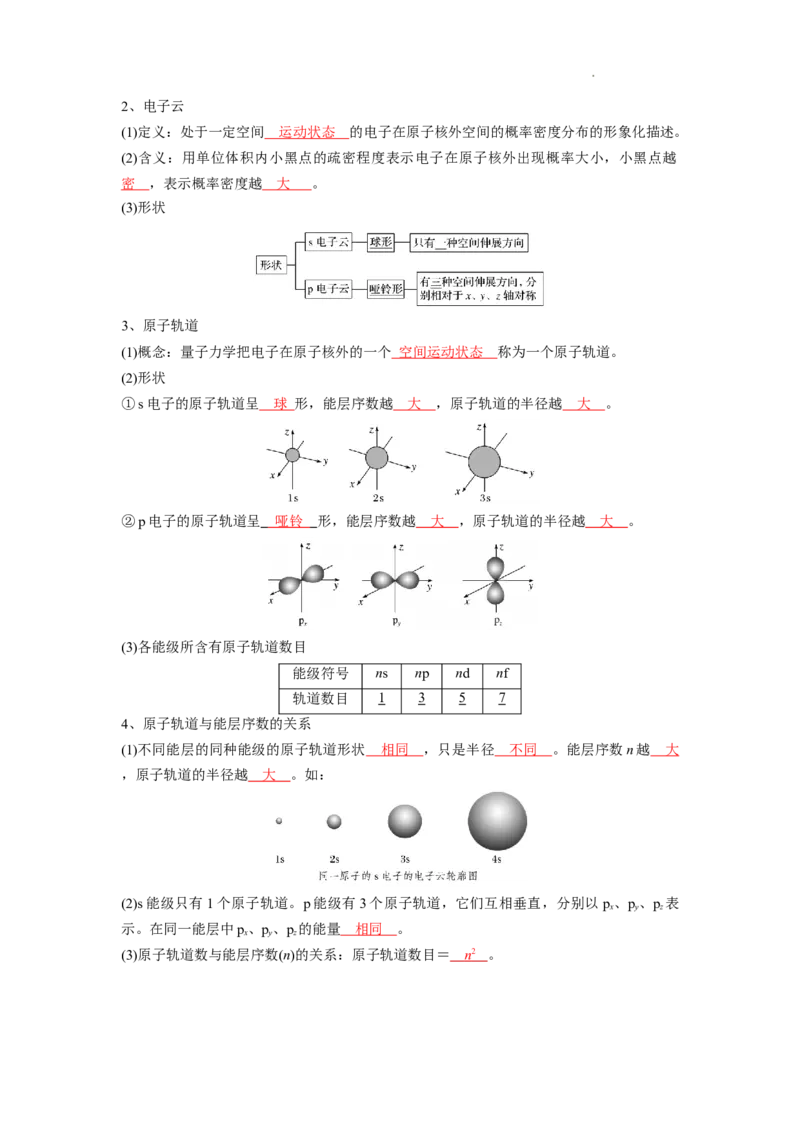
3、原子轨道
(1)概念:量子力学把电子在原子核外的一个 空间运动状态 称为一个原子轨道。
(2)形状
①s电子的原子轨道呈 球 形,能层序数越 大 ,原子轨道的半径越 大 。
②p电子的原子轨道呈 哑铃 形,能层序数越 大 ,原子轨道的半径越 大 。
(3)各能级所含有原子轨道数目
能级符号 ns np nd nf
轨道数目 1 3 5 7
4、原子轨道与能层序数的关系
(1)不同能层的同种能级的原子轨道形状 相同 ,只是半径 不同 。能层序数n越 大
,原子轨道的半径越 大 。如:
(2)s能级只有1个原子轨道。p能级有3个原子轨道,它们互相垂直,分别以p、p、p 表
x y z
示。在同一能层中p、p、p 的能量 相同 。
x y z
(3)原子轨道数与能层序数(n)的关系:原子轨道数目= n 2 。
学科网(北京)股份有限公司五、泡利原理、洪特规则、能量最低原理
(一)原子核外电子的排布规则
1、泡利原理:在一个原子轨道里,最多只能容纳 2 个电子,它们的自旋 相反 ,常用
上下箭头(↑和↓)表示自旋相反的 电子 。
2、电子排布的轨道表示式(电子排布图)
O的轨道表示式如下:
8
例:根据上面回答下列问题:
(1)简并轨道: 能量 相同的原子轨道。
(2)电子对:同一个原子轨道中,自旋方向 相反 的一对电子。
(3)单电子: 一个原子 轨道中若只有一个电子,则该电子称为单电子。
(4)自旋平行: 箭头同向 的单电子称为自旋平行。
(5)在氧原子中,有 3 对电子对,有 2 个单电子。
(6)在氧原子中,有 5 种空间运动状态,有 8 种运动状态不同的电子。
3、洪特规则
(1)内容:基态原子中,填入 简并轨道 的电子总是先单独分占,且自旋平行。
(2)特例:在简并轨道上的电子排布处于全充满、半充满和全空状态时,具有 较低 的能
量和 较大 的稳定性。
相对稳定的状态
如: Cr 的电子排布式为 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 5 4 s 1 ,为半充满状态,易错写为
24
1s22s22p63s23p63d44s2。
4、能量最低原理
(1)内容:在构建基态原子时,电子将尽可能地占据 能量最低 的原子轨道,使整个原子
的能量最 低 。
(2)因素:整个原子的能量由 核电荷数 、 电子数 和 电子状态 三个因素共同决定。
注意:书写轨道表示式时,常出现的错误及正确书写
(二)核外电子的表示方法
电子排布式与轨道表示式的比较
含义 用数字在能级符号右上角标明该能级上排布的 电子数 ,这就是电子排布式
电子排布式 意义 能直观反映出核外的电子层、能级及各能级上的电子数
实例 K: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1
学科网(北京)股份有限公司为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体原子结构的部分
含义
简化电子排 以相应稀有气体元素符号外加 方括号 表示
布式 意义 避免书写电子排布式过于繁琐
实例 K: [Ar]4 s 1
含义 每个方框代表一个原子轨道,每个箭头代表一个 电子
意义 能直观反映出电子的排布情况及电子的 自旋 状态
轨道表示式
实例
Al:
熟记第四周期未成对电子数规律
未成对电子数及其占据的原子轨道 元素符号及价电子排布
4s K:4s1,Cu: 3 d 1 0 4 s 1
1 3d Sc:3d14s2
4p Ga:4s24p1,Br: 4 s 2 4 p 5
3d Ti:3d24s2,Ni: 3 d 8 4 s 2
2
4p Ge:4s24p2,Se:4s24p4
3d V:3d34s2,Co: 3 d 7 4 s 2
3
4p As:4s24p3
4 3d Fe: 3 d 6 4 s 2
5 3d Mn:3d54s2
6 3d和4s Cr:3d54s1
第二节 原子结构与元素的性质
一、原子结构与元素周期表
(一)元素周期律、元素周期系和元素周期表
1、元素周期律:元素的性质随元素原子的 核电荷数 递增发生 周期性 递变。
2、元素周期系:元素按其原子 核电荷数 递增排列的序列。
3、元素周期表: 呈现周期系 的表格,元素周期系只有一个,元素周期表多种多样。
4、三张有重要历史意义的周期表
(1)门捷列夫周期表:门捷列夫周期表又称 短式 周期表,重要特征是从第 四 周期开
始每个周期截成两 截,第 1 ~ 7 族分 主副 族,第 八 族称为过渡元素。
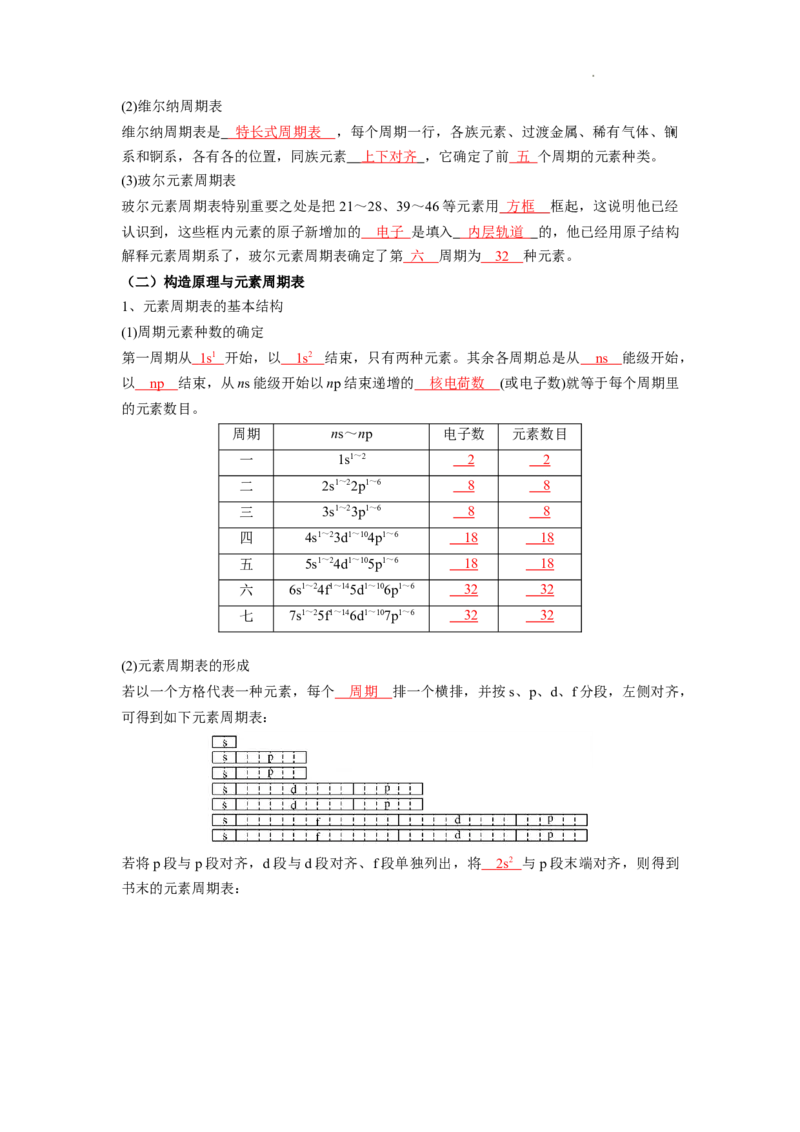
学科网(北京)股份有限公司(2)维尔纳周期表
维尔纳周期表是 特长式周期表 ,每个周期一行,各族元素、过渡金属、稀有气体、镧
系和锕系,各有各的位置,同族元素 上下对齐 ,它确定了前 五 个周期的元素种类。
(3)玻尔元素周期表
玻尔元素周期表特别重要之处是把21~28、39~46等元素用 方框 框起,这说明他已经
认识到,这些框内元素的原子新增加的 电子 是填入 内层轨道 的,他已经用原子结构
解释元素周期系了,玻尔元素周期表确定了第 六 周期为 32 种元素。
(二)构造原理与元素周期表
1、元素周期表的基本结构
(1)周期元素种数的确定
第一周期从 1 s 1 开始,以 1 s 2 结束,只有两种元素。其余各周期总是从 n s 能级开始,
以 np 结束,从ns能级开始以np结束递增的 核电荷数 (或电子数)就等于每个周期里
的元素数目。
周期 ns~np 电子数 元素数目
一 1s1~2 2 2
二 2s1~22p1~6 8 8
三 3s1~23p1~6 8 8
四 4s1~23d1~104p1~6 18 18
五 5s1~24d1~105p1~6 18 18
六 6s1~24f1~145d1~106p1~6 32 32
七 7s1~25f1~146d1~107p1~6 32 32
(2)元素周期表的形成
若以一个方格代表一种元素,每个 周期 排一个横排,并按s、p、d、f分段,左侧对齐,
可得到如下元素周期表:
若将p段与p段对齐,d段与d段对齐、f段单独列出,将 2 s 2 与p段末端对齐,则得到
书末的元素周期表:
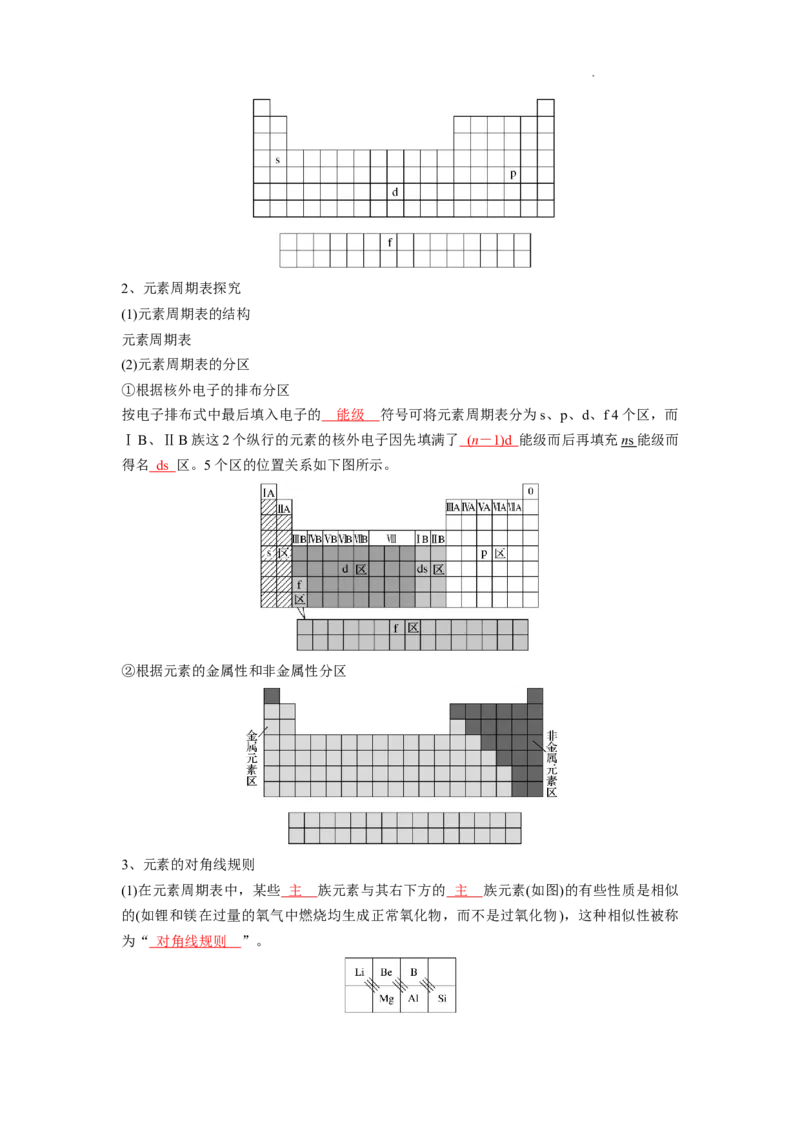
学科网(北京)股份有限公司2、元素周期表探究
(1)元素周期表的结构
元素周期表
(2)元素周期表的分区
①根据核外电子的排布分区
按电子排布式中最后填入电子的 能级 符号可将元素周期表分为s、p、d、f 4个区,而
ⅠB、ⅡB族这2个纵行的元素的核外电子因先填满了 ( n - 1)d 能级而后再填充 n s 能级而
得名 ds 区。5个区的位置关系如下图所示。
②根据元素的金属性和非金属性分区
3、元素的对角线规则
(1)在元素周期表中,某些 主 族元素与其右下方的 主 族元素(如图)的有些性质是相似
的(如锂和镁在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物),这种相似性被称
为“ 对角线规则 ”。
学科网(北京)股份有限公司(2)处于“对角线”位置的元素,它们的 性质 具有相似性。
实例分析:
①锂和镁的相似性
A、锂与镁的沸点较为接近:
元素 Li Na Be Mg
沸点/℃ 1 341 881.4 2 467 1 100
B、锂和镁在氧气中 燃烧 时只生成对应的氧化物,并且LiO和MgO与水反应都十分缓
2
慢。
4Li+O=====2LiO、2Mg+O=====2MgO。
2 2 2
C、锂和镁与水的反应都十分缓慢,并且生成的氢氧化物 难 溶于水,附着于金属表面
阻碍反应的进行。
D、锂和镁都能直接与氮气反应生成相应的氮化物LiN和MgN。
3 3 2
E、锂和镁的氢氧化物在加热时,可分解为LiO、HO和MgO、HO。
2 2 2
F、在碱金属的氟化物、碳酸盐和磷酸盐中,只有锂盐是 难 溶于水的,相应的镁盐也
难 溶于水。
②铍和铝的相似性
A、铍与铝都可与酸、碱反应放出 氢气 ,并且铍在浓硝酸中也发生 钝 化。
B、二者的氧化物和氢氧化物都既能溶于强酸又能溶于强碱溶液:
Al(OH) +3HCl=== AlCl + 3H O ,Al(OH) +NaOH=== NaAlO + 2H O ;
3 3 2 3 2 2
Be(OH) +2HCl=== BeCl + 2H O ,Be(OH) +2NaOH=== Na BeO + 2H O 。
2 2 2 2 2 2 2
C、二者的氧化物Al O 和BeO的熔点和硬度都很高。
2 3
D、BeCl 和AlCl 都是共价化合物,易 升华 。
2 3
③硼和硅的相似性
A、自然界中B与Si均以化合物的形式存在。
B、B与Si的单质都易与强碱反应,且不与稀酸反应:
2B+2KOH+2HO=== 2KBO + 3H ↑ ,Si+2KOH+HO=== K SiO + 2H ↑ 。
2 2 2 2 2 3 2
C、硼烷和硅烷的稳定性都比较差,且都易 水解 。
D、硼和硅的卤化物的熔、沸点比较低,易挥发,易水解。
解题技巧:根据原子结构特征判断元素在元素周期表中的位置
电子排布式――→价电子排布式――→
学科网(北京)股份有限公司二、元素周期律
(一)原子半径
1、影响原子半径大小的因素
(1)电子的能层数:电子的能层越多,电子之间的 排斥 作用使原子半径 增大 。
(2)核电荷数:核电荷数越 大 ,核对电子的吸引作用就越 大 ,使原子半径 减小 。
2、原子半径的递变规律
(1)同周期:从左至右,核电荷数越 大 ,半径越 小 。
(2)同主族:从上到下,核电荷数越 大 ,半径越 大 。
3、原子或离子半径的比较方法
(1)同种元素的离子半径:阴离子 大 于原子,原子 大 于阳离子,低价阳离子 大
于高价阳离子。例如:r(Cl-)>r(Cl),r(Fe)>r(Fe2+)>r(Fe3+)。
(2)能层结构相同的离子:核电荷数越大 ,半径越 小 。例如:r(O2-)>r(F-)>r(Na+)>
r(Mg2+)>r(Al3+)。
(3)带相同电荷的离子:能层数越 多 ,半径越 大 。例如:r(Li+)<r(Na+)<r(K+) <
r(Rb+)<r(Cs+),
r(O2-)<r(S2-) < (Se2-)<r(Te2-)。
(4)核电荷数、能层数均不同的离子:可选一种离子参照比较。例如:比较r(K+)与r(Mg2
+),可选r(Na+)为参照,r(K+) > r(Na+) > r(Mg2+)。
解题技巧:粒子半径比较的一般思路
(1)“一层”:先看能层数,能层数越 多 ,一般微粒半径越 大 。
(2)“二核”:若能层数相同,则看核电荷数,核电荷数越 大 ,微粒半径越 小 。
(3)“三电子”:若能层数、核电荷数均相同,则看核外电子数,电子数 多 的半径 大
。
(二)元素的电离能
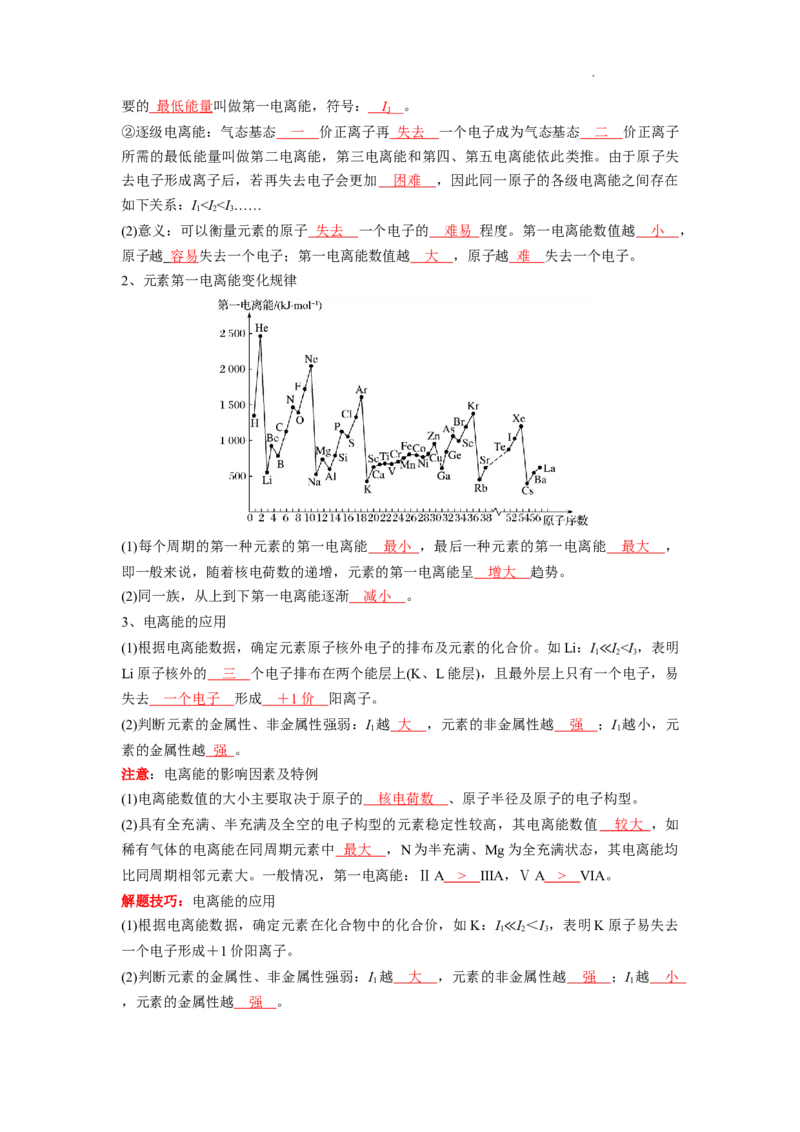
1、元素第一电离能的概念与意义
(1)概念
①第一电离能: 气态 电中性 基态 原子失去一个电子转化为 气态基态 正离子所需
学科网(北京)股份有限公司要的 最低能量叫做第一电离能,符号: I 。
1
②逐级电离能:气态基态 一 价正离子再 失去 一个电子成为气态基态 二 价正离子
所需的最低能量叫做第二电离能,第三电离能和第四、第五电离能依此类推。由于原子失
去电子形成离子后,若再失去电子会更加 困难 ,因此同一原子的各级电离能之间存在
如下关系:I ⅢA,ⅤA > ⅥA。
解题技巧:电离能的应用
(1)根据电离能数据,确定元素在化合物中的化合价,如K:I I <I ,表明K原子易失去
1 2 3
一个电子形成+1价阳离子。
≪
(2)判断元素的金属性、非金属性强弱:I 越 大 ,元素的非金属性越 强 ;I 越 小
1 1
,元素的金属性越 强 。
学科网(北京)股份有限公司(三)电负性
1、有关概念与意义
(1)键合电子:元素相互化合时,原子中用于形成 化学键 的电子称为 键合电子 。
(2)电负性:用来描述不同元素的原子对键合电子 吸引力 的大小。电负性越 大 的原
子,对键合电子的吸引力越 大 。
(3)电负性大小的标准:以氟的电负性为4.0 和锂的电负性为1.0 作为相对标准。
2、递变规律
(1)同周期,自左到右,元素的电负性逐渐 增大 ,元素的非金属性逐渐 增强 、金属
性逐渐 减弱 。
(2)同主族,自上到下,元素的电负性逐渐 减小 ,元素的金属性逐渐 增强 、非金属性
逐渐 减弱 。
3、应用
(1)判断元素的金属性和非金属性强弱
①金属的电负性一般 小于 1.8,非金属的电负性一般 大于 1.8,而位于非金属三角区边
界的“类金属”(如锗、锑等)的电负性则在 1. 8 左右,它们既有金属性,又有非金属性。
②金属元素的电负性 越小 ,金属元素越活泼;非金属元素的电负性 越大 ,非金属元
素越活泼。
(2)判断元素的化合价
①电负性数值小的元素在化合物中吸引电子的能力 弱 ,元素的化合价为 正值 。
②电负性数值大的元素在化合物中吸引电子的能力 强 ,元素的化合价为 负值 。
(3)判断化合物的类型
如H的电负性为2.1,Cl的电负性为3.0,Cl的电负性与H的电负性之差为3.0-2.1=
0.9<1.7,故HCl为共价化合物;如Al的电负性为1.5,Cl的电负性与Al的电负性之差为
3.0-1.5=1.5<1.7,因此AlCl 为共价化合物;同理,BeCl 也是共价化合物。
3 2
注意:电负性之差大于1.7的元素不一定都形成离子化合物,如F的电负性与H的电负性
之差为1.9,但HF为共价化合物。
(四)元素周期律的综合应用
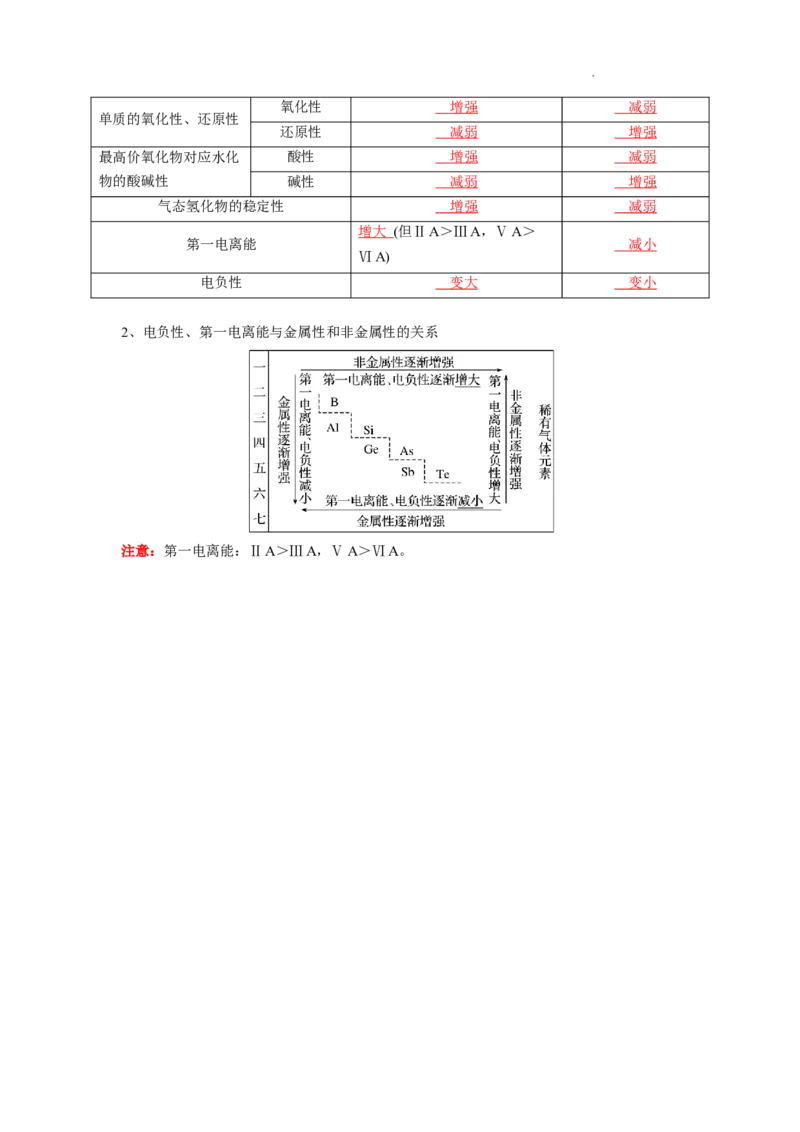
1、同周期、同主族元素性质的递变规律
性质 同一周期(从左到右) 同一主族(从上到下)
能层数 相同 增加
核外电子的排布
最外层电子数 1→2或8 相同
金属性 减弱 增强
非金属性 增强 减弱
学科网(北京)股份有限公司氧化性 增强 减弱
单质的氧化性、还原性
还原性 减弱 增强
最高价氧化物对应水化 酸性 增强 减弱
物的酸碱性 碱性 减弱 增强
气态氢化物的稳定性 增强 减弱
增大 (但ⅡA>ⅢA,ⅤA>
第一电离能 减小
ⅥA)
电负性 变大 变小
2、电负性、第一电离能与金属性和非金属性的关系
注意:第一电离能:ⅡA>ⅢA,ⅤA>ⅥA。
学科网(北京)股份有限公司