文档内容
班级 姓名 学号 分数
第一章 原子结构与性质
核心知识1 能层与能级 原子光谱
1. 基态K原子中,核外电子占据最高能层的符号是______。
2. 指出下列符号的意义:
(1)2s:____;
(2)2p3:____;
(3)3p :____。
3. 下列现象与电子的跃迁没有直接关联的是
A.氢原子发光 B.霓虹灯发光 C.燃放烟花 D.钠与水剧烈反应
A.A B.B C.C D.D
4. 对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是
A.氖原子获得电子后转变成发出红光的物质
B.在电流的作用下,氖原子与构成灯管的物质发生反应
C.电子由激发态向基态跃迁时以光的形式释放能量
D.电子由基态向激发态跃迁时吸收除红光以外的光线
5. 回答下列问题:
(1)1861年德国人基尔霍夫(r. Kirchhoff)和本生(R.w. Bunsen)研究锂云母的某谱时,发现在深红区有一新线,
从而发现了铷元素,他们研究的是_______
(2)含有钾元素的盐的焰色试验为_______色。许多金属盐都可以发生焰色试验,其原因是_______
6. 基态与激发态
(1)基态原子:处于___________状态的原子,
(2)基态原子___________,电子跃迁到___________,变为激发态原子;(3)电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将___________;
(4)___________是电子跃迁释放能量的重要形式之一。
核心知识2 构造原理与电子排布式
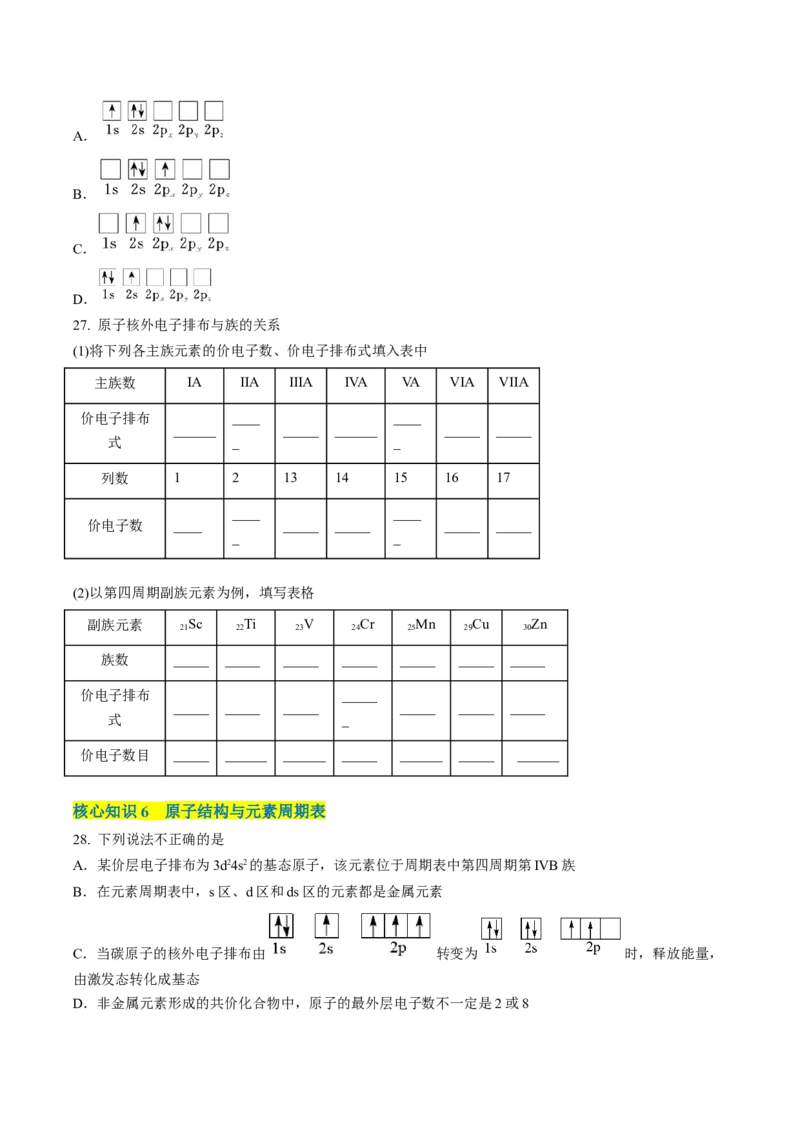
7. 下列各组指定的元素,能形成 型化合物的是
A. 和 B. 和
C. 和 D. 和
8. 下列各原子或离子的电子排布式或电子排布图表示正确的是
A.Ca2+:1s22s22p63s23p6
B.F-:1s22s23p6
C.P:最外层电子排布图为
D.Cr:1s22s22p63s23p63d44s2
9. 镍元素基态原子的电子排布式为______, 能级上的未成对电子数为______。
10. 根据 Mn原子核外电子排布情况,回答下列问题。
25
(1)价层电子排布图:_______。
(2)在锰原子的核外电子中,有_______种运动状态不同的电子;共有_______对成对电子;有_______个未
成对电子;最高化合价为_______价。
11. 按要求填空:
(1)Fe成为阳离子时首先失去_______轨道电子,Sm的价层电子排布式为 , 价层电子排布式为
_______。
(2)Cu2+基态核外电子排布式为_______。
核心知识3 电子云与原子轨道
12. 下列关于氢原子电子云的说法正确的是
A.通常用小点来表示电子的多少,小点密度大,电子数目多
B.小点密度大,单位体积内电子出现的机会大
C.通常用小点来表示电子绕核做高速圆周运动
D.其轮廓图为圆形
13. 下列叙述正确的是
A.核外电子排布遵循了能量最低原理的原子就是基态原子
B.原子轨道和电子云都可以用来描述电子的空间运动状态
C.各能层的s电子云轮廓图都是圆形,但圆的半径大小不同
D.电子云图中的每个小黑点表示一个电子
14. 下列有关原子轨道的描述,正确的是A.从空间结构看, 轨道比 轨道大,其空间包含了 轨道
B.p能级的能量一定比s能级的能量高
C. 、 、 能级的轨道数依次增多
D. 、 、 轨道相互垂直,且能量不相等
15. LiCoO 、LiFePO 常用作锂离子电池的正极材料。基态Co原子核外电子排布式为___,基态磷原子中,
2 4
电子占据的最高能层符号为___;该能层能量最高的电子云在空间有___个伸展方向,原子轨道呈___形。
16. 回答下列问题:
(1)在基态多电子原子中,关于核外电子能量的叙述错误的是_______。
a.最易失去的电子能量最高
b.同一个电子层上的不同能级上的原子轨道,能量大小不同
c.p轨道电子能量一定高于s轨道电子能量
d.在离核最近区域内运动的电子能量最低
(2)比较下列多电子原子的原子轨道的能量高低。
①1s,3d:_______;②3s,3p,3d:_______;③2p,3p,4p:_______;④ :_______。
(3)基态铝原子核外电子云有_______种不同的伸展方向,共有_______种不同能级的电子,有_______种不
同运动状态的电子。
核心知识4 电子排布与元素推断
17. M-的最外层电子排布式为3s23p6,下列说法中正确的是
A.M可能为稀有气体元素
B.M原子的核外电子排布式为1s22s22p63s23p64s1
C.M原子的价层电子排布式为3p5
D.M的最外电子层上有7个电子
18. 某基态原子的所有含电子的能层中,其最高能层所含电子最少,且基态原子核外有15种不同空间运动
状态的电子,则该原子的元素符号可能是
A.K B.Sc C.Cu D.Ga
19. 为原子序数依次增大的短周期主族元素。X、Z原子中分别有1个、7个运动状态完
全不同的电子,Y原子中各亚层的电子数相等,W原子最外层电子数是内层的3倍,R的原子半径是该周
期主族元素中最大的。下列说法正确的是
A.最高价含氧酸的酸性: B.简单离子半径:
C.得电子能力: D. 形成的化合物一定不含离子键
20. X、Y、Z三种元素的原子,其价电子排布式分别为ns1、3s23p4和2s22p4,由这三种元素组成的化合物
的化学式不可能是
A.XYZ B.XYZ C.XYZ D.XYZ
2 2 7 2 4 2 3 3
21. 下列用原子最外层电子排布式表示的各对元素中,能形成离子化合物的是A. 和 B. 和
C. 和 D. 和
22. 已知A原子中只含1个电子;B原子的3p轨道上得到1个电子后形成半满结构;C原子的2p轨道上有
1个电子的自旋方向与其他电子的自旋方向相反;D原子3d能级全空,第四电子层上只有1个电子;E原
子的核电荷数为B、D核电荷数之和。
(1)按要求书写下列图式。
① B原子的核外电子排布简式:_______;
② C原子的外围电子排布图:_______;
③ D原子的核外电子排布式:_______;
(2)写出E的元素符号:_______,它所在周期表中的位置_______。
核心知识5 核外电子排布原理
23. 下列说法错误的是
A. 电子的能量不一定高于 p电子的能量
B. 的电子排布式 违反了洪特规则
C.电子排布式 违反了构造原理
D.电子排布式 违反了泡利原理
24. 下列状态的Li原子中,能量最低的是
A. B.
C. D.
25. 下列有关核外电子排布的表示不正确的是
A.29Cu的电子排布式:1s22s22p63s23p63d104s1
B.K的简化电子排布式:[Ar]4s1
C.N原子的电子排布图为
D.S原子的电子排布图为
26. (1)Fe成为阳离子时首先失去___轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为___。
(2)Cu2+基态核外电子排布式为___。
(3)Mn位于元素周期表中第四周期___族,基态Mn原子核外未成对电子有___个。
(4)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为___、__(填标号)。A.
B.
C.
D.
27. 原子核外电子排布与族的关系
(1)将下列各主族元素的价电子数、价电子排布式填入表中
主族数 IA IIA IIIA IVA VA VIA VIIA
价电子排布 ____ ____
______ _____ ______ _____ _____
式 _ _
列数 1 2 13 14 15 16 17
____ ____
价电子数 ____ _____ _____ _____ _____
_ _
(2)以第四周期副族元素为例,填写表格
副族元素 Sc Ti V Cr Mn Cu Zn
21 22 23 24 25 29 30
族数 _____ _____ _____ _____ _____ _____ _____
价电子排布 _____
_____ _____ _____ _____ _____ _____
式 _
价电子数目 _____ ______ ______ _____ ______ _____ ______
核心知识6 原子结构与元素周期表
28. 下列说法不正确的是
A.某价层电子排布为3d24s2的基态原子,该元素位于周期表中第四周期第IVB族
B.在元素周期表中,s区、d区和ds区的元素都是金属元素
C.当碳原子的核外电子排布由 转变为 时,释放能量,
由激发态转化成基态
D.非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或829. 元素R的+2价离子的电子排布式为1s22s22p63s23p63d6,下列说法正确的是
A.R2+比R3+稳定性强
B.R位于周期表的第三周期第ⅤB族,属于ds区
C.R位于周期表的第四周期第Ⅷ族,属于d区
D.R元素名称为铬
30. 有四种元素原子的基态或激发态原子的电子排布式如下:
① ② ③ ④
下列说法错误的是
A.元素①的一种单质可用于消毒杀菌 B.元素②所在周期中其原子半径最大
C.元素①③在周期表中位于第17列 D.元素④的简单氢化物常作制冷剂
31. 元素X、Y、Z在周期表中的相对位置如图。已知Y元素原子的外围电子排布为 ,则下列说
法不正确的是
A.X元素原子核外无d能级
B.Y元素在周期表的第三周期ⅥA族
C.在元素周期表中,Y元素所在周期含非金属元素最多
D.Z元素基态原子的核外电子排布式为
32. 请将表格补充完整:
原子电子排布式 族 周期 区
①1s22s22p63s2 _____ _____ _____
②[Kr]4d105s25p2 _____ _____ _____
③[Ar]3d14s2 _____ _____ _____
④[Ar]3d104s1 _____ _____ _____
核心知识7 粒子半径大小比较与判断
33. 下列元素的原子半径最小的是
A.Na B.Mg C.Al D.Cl
34. 已知下列原子的半径:原子 N S O
半径
0.70 1.06 0.66 1.17
根据以上数据,P原子的半径可能是A. B.
C. D.
35. 下列关于粒子半径的说法正确的是
①
②
③
④
A.①②④ B.①③ C.③④ D.①④
36. 下列四种粒子中,半径按由大到小排列顺序正确的是
①基态X的原子结构示意图为
②基态Y的价电子排布式为3s23p5
③基态Z2-的轨道表示式为
④W基态原子有2个电子层,其电子式为
A.①>②>③>④ B.③>④>①>②
C.③>①>②>④ D.①>②>④>③
核心知识8 元素的电离能及其变化规律
37. 下列说法正确的是
A.第三周期中钠元素的第一电离能最小
B.因同周期主族元素的原子半径从左到石逐渐减小,故其第一电离能逐渐增大
C.在所有元素中,氟元素的第一电离能最大
D.钾的第一电离能比镁的第一电离能大
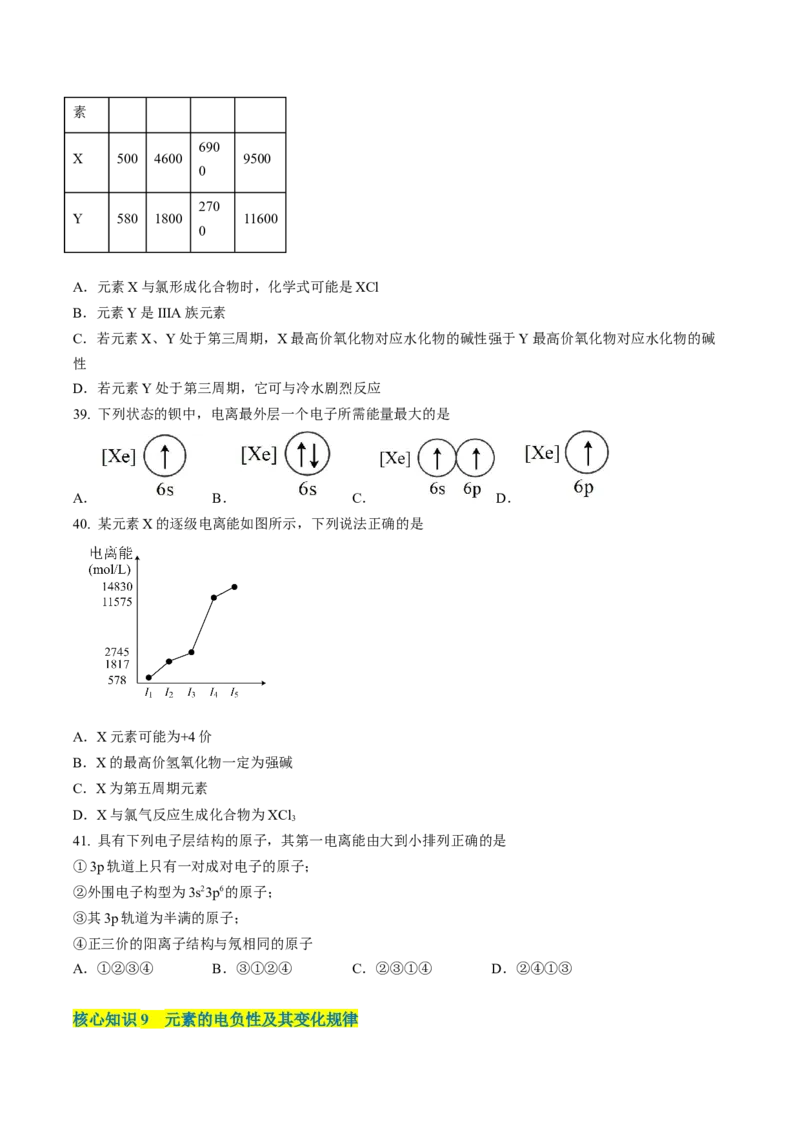
38. 已知X、Y是主族元素,I为电离能,单位是kJ·mo1-1。请根据下表所列数据判断,错误的是
I I I I
元 1 2 3 4素
690
X 500 4600 9500
0
270
Y 580 1800 11600
0
A.元素X与氯形成化合物时,化学式可能是XCl
B.元素Y是IIIA族元素
C.若元素X、Y处于第三周期,X最高价氧化物对应水化物的碱性强于Y最高价氧化物对应水化物的碱
性
D.若元素Y处于第三周期,它可与冷水剧烈反应
39. 下列状态的钡中,电离最外层一个电子所需能量最大的是
A. B. C. D.
40. 某元素X的逐级电离能如图所示,下列说法正确的是
A.X元素可能为+4价
B.X的最高价氢氧化物一定为强碱
C.X为第五周期元素
D.X与氯气反应生成化合物为XCl
3
41. 具有下列电子层结构的原子,其第一电离能由大到小排列正确的是
①3p轨道上只有一对成对电子的原子;
②外围电子构型为3s23p6的原子;
③其3p轨道为半满的原子;
④正三价的阳离子结构与氖相同的原子
A.①②③④ B.③①②④ C.②③①④ D.②④①③
核心知识9 元素的电负性及其变化规律42. 下列是原子基态的最外层电子排布,其电负性最大的是
A.2s2 B.2s22p 1 C.3s23p4 D.2s22p5
43. 下列各组元素的电负性大小顺序正确的是
A. B. C. D.
44. 下列微粒对应的元素电负性最大的是
A.
B.基态原子核外电子排布式:
C.基态原子价电子排布图:
D.第二周期元素基态原子p能级电子数比s能级电子数多1
45. 电负性是一种重要的元素性质,某些元素的电负性(鲍林标度)数值如下表所示:
元素 H Li O Al P S Cl
电负性 2.1 1.0 3.5 1.5 2.1 2.5 3.0
下列说法不正确的是A.LiAlH 中H是-1价,该物质具有还原性
4
B.非金属性:O>Cl
C.H-Cl键比H-S键极性大
D.Si的电负性范围在2~3之间
46. 下列说法中正确的是
①元素电负性越大表示该元素的金属性越强 ②元素电负性越大表示该元素的非金属性越强 ③元素电负
性很小表示该元素的单质不发生化学反应 ④元素电负性很大表示该元素的单质在发生化学反应时一般易
得到电子
A.①③ B.①④ C.②③ D.②④