文档内容
北京市朝阳区第一学期期末质量检测
高一年级化学试卷
可能用到的相对原子质量:C12 O16 Na23 Cl35.5 Fe56
第一部分(选择题共42分)
本部分共14小题,每小题3分,在每小题列出的四个选项中,选出最符合题目要求的一项。
1. 下列物质中,不属于电解质的是
A. HSO B. NaOH C. Cu D. NaSO
2 4 2 4
2. 当光束通过下列分散系时,能观察到丁达尔效应 的是
A. KCl溶液 B. Fe(OH) 胶体 C. 蔗糖溶液 D. CuSO 溶液
3 4
3. 下列物质中,不属于盐类的是
A. KOH B. MgCl C. KNO D. NaHCO
2 3 3
4. 下列物质中,含有离子键的是
A. Cl B. HCl C. CaCl D. HClO
2 2
5. 下列关于物质用途的说法不正确的是
A. CaO用作食品脱氧剂 B. Na O 用作呼吸面具供氧剂
2 2
C. Ca(ClO) 用作游泳池消毒剂 D. Fe O 用作油漆红色颜料
2 2 3
6. 下列化学用语书写不正确 的是
A. N 的电子式:
2
B. KNO 的电离方程式:KNO=K++
3 3
C. 用电子式表示NaCl的形成过程:
D. H 还原CuO反应中电子的转移:
2
7. 1911年卢瑟福用α粒子(即氦核 )轰击 ,得到 ,由此发现了质子( ): + → + 。
下列叙述不正确的是A. 的中子数为9 B. 原子半径:O>N
C. 非金属性:O>N D. 稳定性:HO>NH
2 3
8. 下列实验过程中的颜色变化,与氧化还原反应无关的是
A. 淡黄色NaO 固体露置于空气中,逐渐变成白色
2 2
B. 用强光照射氯水,一段时间后溶液变成无色
C. 向氯水中滴加KI溶液,溶液变成棕黄色
D. 向FeCl 溶液中滴加NaOH溶液,产生红褐色沉淀
3
9. 下列说法不正确的是
A. Fe的摩尔质量是56g·mol−1
B. 常温常压下,22.4LN 中含有2molN
2
C. 44gCO 含有的氧原子数约为2×6.02×1023
2
D. 1L0.5mol·L−1MgCl 溶液中,含有的Cl-数约为6.02×1023
2
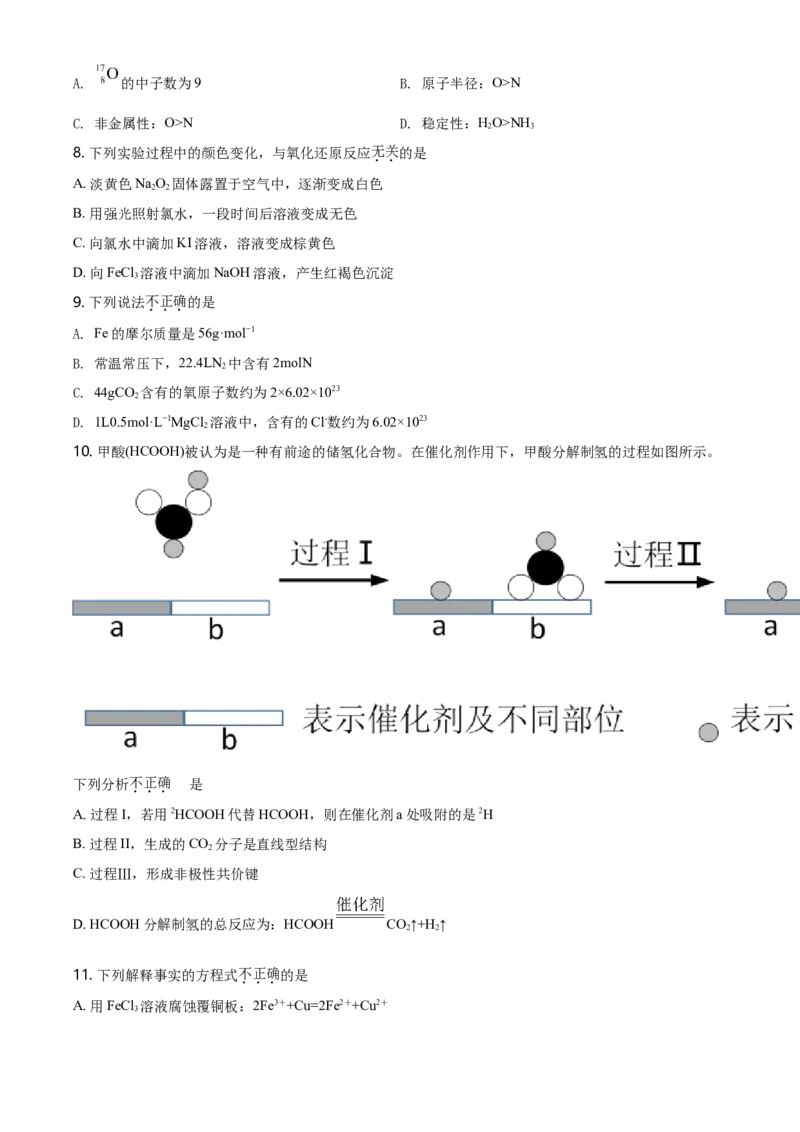
10. 甲酸(HCOOH)被认为是一种有前途的储氢化合物。在催化剂作用下,甲酸分解制氢的过程如图所示。
下列分析不正确 的是
A. 过程I,若用2HCOOH代替HCOOH,则在催化剂a处吸附的是2H
B. 过程II,生成的CO 分子是直线型结构
2
C. 过程Ⅲ,形成非极性共价键
D. HCOOH分解制氢的总反应为:HCOOH CO↑+H ↑
2 2
11. 下列解释事实的方程式不正确的是
A. 用FeCl 溶液腐蚀覆铜板:2Fe3++Cu=2Fe2++Cu2+
3B. 打磨过的铝片遇NaOH溶液产生气泡:2Al+2OH−+2H O=2 +3H ↑
2 2
C. 常温下,新切开的钠表面很快变暗:2Na+O=Na O
2 2 2
D. 炽热的铁水不能注入未经干燥的模具,是为防止:3Fe+4H O(g) Fe O+4H
2 3 4 2
12. 某粗盐水a中含有Mg2+、 杂质,可用下列方法去除(部分产物、步骤略去):
下列说法不正确的是
A. 盐泥的主要成分是Mg(OH)
2
B. 生成N 的反应为:3Cl+2 +8OH−=N +6Cl−+8H O
2 2 2 2
C. 粗盐水b中还可能含有ClO−
D. 上述除杂过程涉及到的反应都是氧化还原反应
13. 下列“实验结论”与“实验操作及现象”不相符的一组是
实验操作及现象 实验结论
A 向紫色石蕊溶液中滴加氯水,溶液先变红后褪色 氯水具有酸性和漂白性
B 向某溶液中滴加AgNO 溶液,产生白色沉淀 该溶液中一定含有Cl-
3
铝元素表现出一定的非金属
C 向Al(OH) 沉淀中滴加NaOH溶液,沉淀溶解
3 性
把绿豆大的Na和K分别投入水中,K与水反应
D 金属性:Na<K
更剧烈
A. A B. B C. C D. D
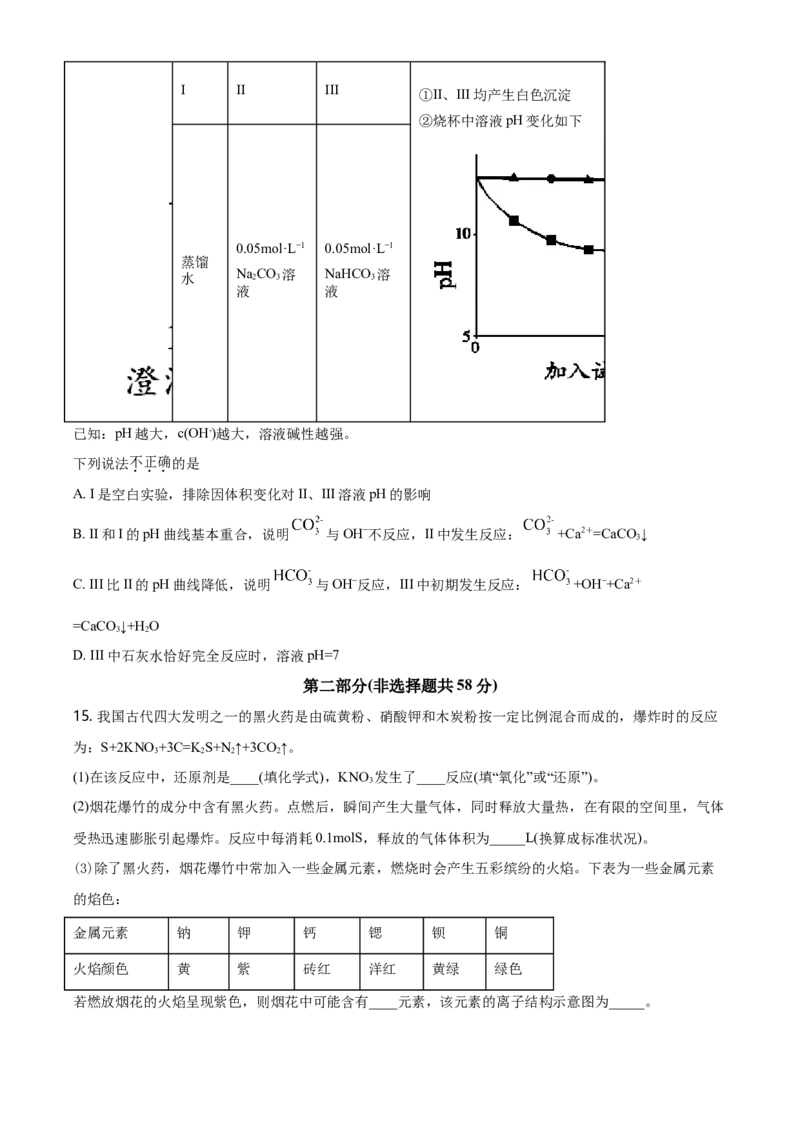
14. 小组探究NaCO 和NaHCO 与碱的反应,实验过程及结果如下。
2 3 3
实验装置 试剂X 实验结果I II III
①II、III均产生白色沉淀
②烧杯中溶液pH变化如下
0.05mol·L−1 0.05mol·L−1
蒸馏
水 Na 2 CO 3 溶 NaHCO 3 溶
液 液
已知:pH越大,c(OH-)越大,溶液碱性越强。
下列说法不正确的是
A. I是空白实验,排除因体积变化对II、III溶液pH的影响
B. II和I的pH曲线基本重合,说明 与OH−不反应,II中发生反应: +Ca2+=CaCO ↓
3
C. III比II的pH曲线降低,说明 与OH−反应,III中初期发生反应: +OH−+Ca2+
=CaCO ↓+H O
3 2
D. III中石灰水恰好完全反应时,溶液pH=7
第二部分(非选择题共58分)
15. 我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应
为:S+2KNO +3C=K S+N↑+3CO ↑。
3 2 2 2
(1)在该反应中,还原剂是____(填化学式),KNO 发生了____反应(填“氧化”或“还原”)。
3
(2)烟花爆竹的成分中含有黑火药。点燃后,瞬间产生大量气体,同时释放大量热,在有限的空间里,气体
受热迅速膨胀引起爆炸。反应中每消耗0.1molS,释放的气体体积为_____L(换算成标准状况)。
(3)除了黑火药,烟花爆竹中常加入一些金属元素,燃烧时会产生五彩缤纷的火焰。下表为一些金属元素
的焰色:
金属元素 钠 钾 钙 锶 钡 铜
火焰颜色 黄 紫 砖红 洋红 黄绿 绿色
若燃放烟花的火焰呈现紫色,则烟花中可能含有____元素,该元素的离子结构示意图为_____。16. 摩擦剂是牙膏的主体成分,SiO 是一种常见的摩擦剂。
2
(1)Si在元素周期表中的位置是_____。
(2)根据用途推测SiO 在水中的溶解性:_____(填“易溶”或“难溶”)。
2
(3)制备SiO 的方法如下:
2
①写出反应I的离子方程式_____。
②比较酸性强弱:HSO _____HSiO(填“>”或“<”)。
2 4 2 3
③结合原子结构解释②中酸性关系:Si和S 电子层数相同,_____。
(4)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF )。锡的原子结构示
2
意图如图。
下列说法正确的是_____(填序号)。
a.Sn元素的最高正化合价为+4
b.Sn的原子半径比Si大
c.Sn和Si均可以作半导体材料
17. 二氧化氯(ClO )泡腾片由NaClO、固体酸及辅助剂混合制得,是一种用来消毒的家庭用品。使用时只
2 2
需将泡腾片放入水中,5~10分钟即可完全溶解,释放出ClO 反应a:5 +4H+=4ClO +Cl-+2H O
2 2 2注:ClO 是一种易溶于水的气体。
2
(1)ClO 中Cl元素的化合价为_______。
2
(2)反应a中氧化剂与还原剂物质的量之比为_______。
(3)二氧化氯泡腾片使用时需要加水,水的作用是_______。
(4)测定二氧化氯泡腾片有效成分的含量。
i.取1片二氧化氯泡腾片,加稀硫酸充分溶解。
ii.通N 将ClO 吹出,并用过量的硫酸和淀粉碘化钾溶液吸收。
2 2
iii.用xmol·L-1的NaSO 溶液滴定生成的I,消耗NaSO 溶液的体积为ymL。
2 2 3 2 2 2 3
有关反应方程式为:2ClO +10I-+8H+=5I +2Cl-+4H O;I+2 =2I-+ ,二氧化氯泡腾片有效成分的
2 2 2 2
含量为__mg/片(以ClO 计)。
2
18. 小组同学探究NaCO 的性质及工业制法。
2 3
(1)用NaCO 固体配制100mL0.200mol·L−1NaCO 溶液。
2 3 2 3
①用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和_______。
②计算需要NaCO 固体的质量是_______g。
2 3
③下列情况中,会使所配溶液浓度偏高的是_______(填字母)。
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
(2)探究NaCO 与盐酸的反应。向0.200mol·L−1NaCO 溶液中滴加稀盐酸,开始无气泡,继续滴加,产生气
2 3 2 3
泡,反应的离子方程式为: +H+= 、_______。
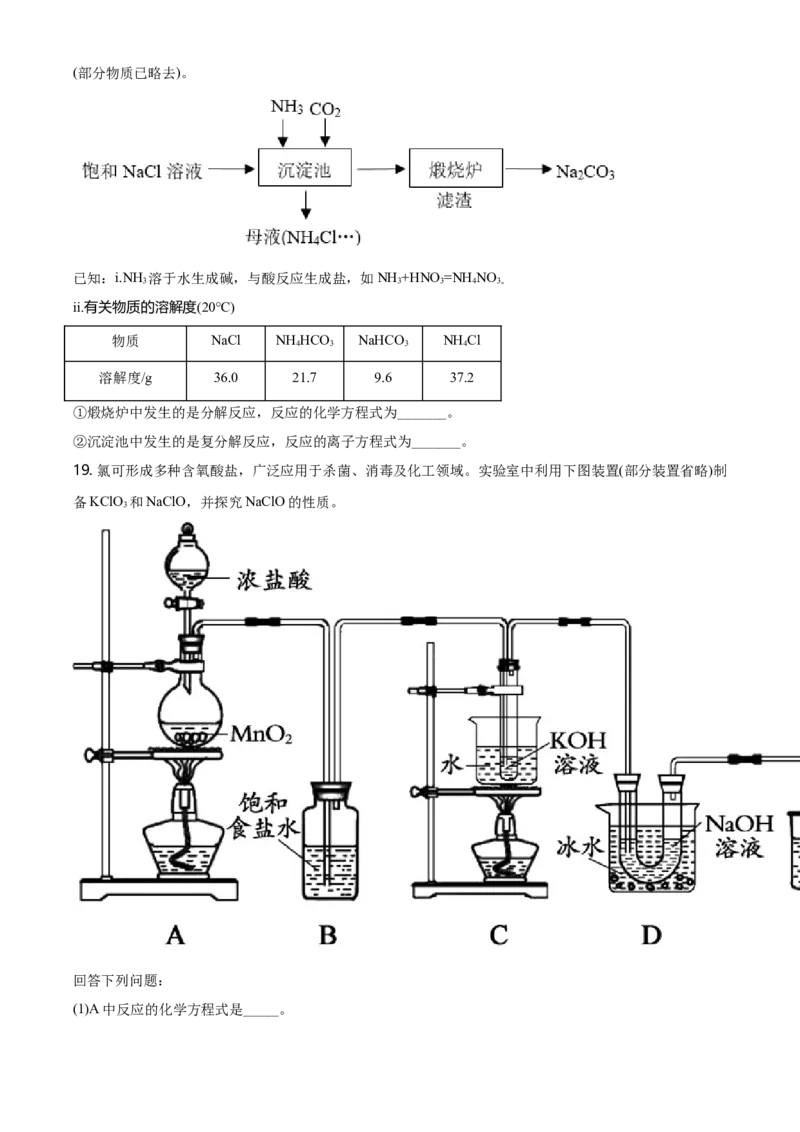
(3)我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。下图为联合制碱法的主要过程(部分物质已略去)。
已知:i.NH 溶于水生成碱,与酸反应生成盐,如NH +HNO =NHNO
3 3 3 4 3。
ii.有关物质的溶解度(20℃)
物质 NaCl NH HCO NaHCO NH Cl
4 3 3 4
溶解度/g 36.0 21.7 9.6 37.2
①煅烧炉中发生的是分解反应,反应的化学方程式为_______。
②沉淀池中发生的是复分解反应,反应的离子方程式为_______。
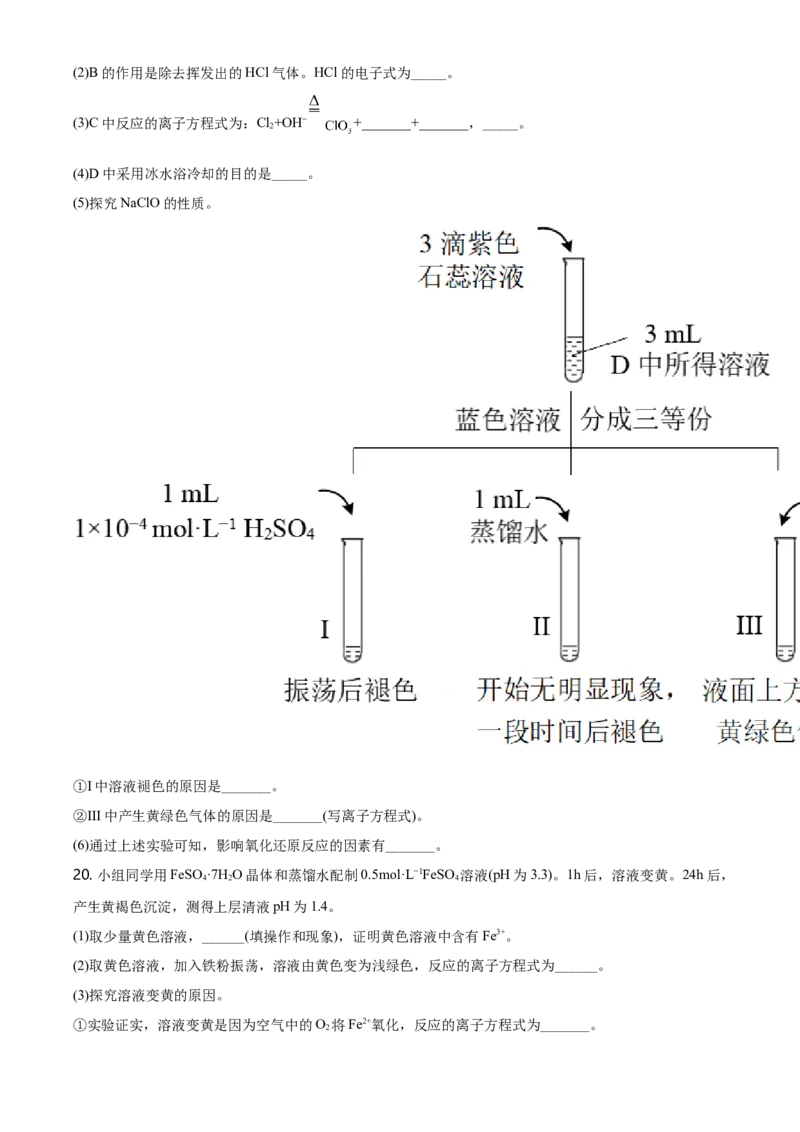
19. 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制
备KClO 和NaClO,并探究NaClO的性质。
3
回答下列问题:
(1)A中反应的化学方程式是_____。(2)B的作用是除去挥发出的HCl气体。HCl的电子式为_____。
(3)C中反应的离子方程式为:Cl+OH− +_______+_______,_____。
2
(4)D中采用冰水浴冷却的目的是_____。
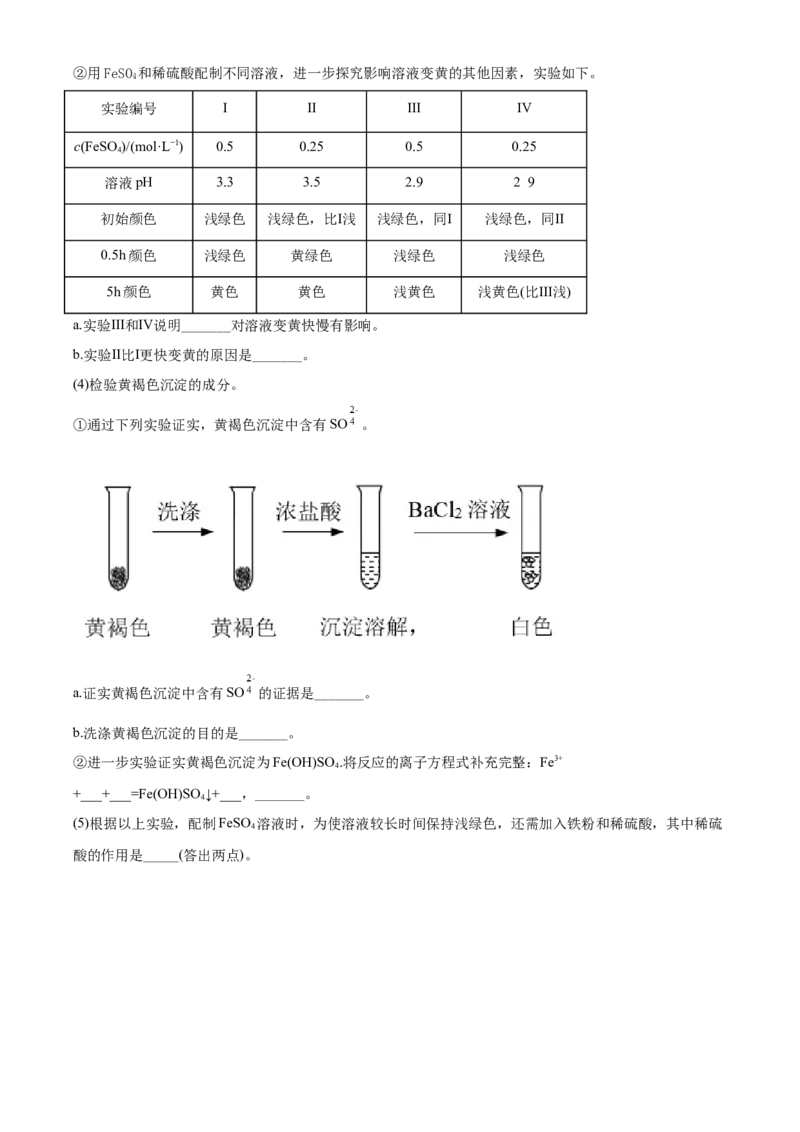
(5)探究NaClO的性质。
①I中溶液褪色的原因是_______。
②III中产生黄绿色气体的原因是_______(写离子方程式)。
(6)通过上述实验可知,影响氧化还原反应的因素有_______。
20. 小组同学用FeSO ·7H O晶体和蒸馏水配制0.5mol·L−1FeSO 溶液(pH为3.3)。1h后,溶液变黄。24h后,
4 2 4
产生黄褐色沉淀,测得上层清液pH为1.4。
(1)取少量黄色溶液,______(填操作和现象),证明黄色溶液中含有Fe3+。
(2)取黄色溶液,加入铁粉振荡,溶液由黄色变为浅绿色,反应的离子方程式为______。
(3)探究溶液变黄的原因。
①实验证实,溶液变黄是因为空气中的O 将Fe2+氧化,反应的离子方程式为_______。
2②用FeSO 和稀硫酸配制不同溶液,进一步探究影响溶液变黄的其他因素,实验如下。
4
实验编号 Ⅰ Ⅱ Ⅲ Ⅳ
c(FeSO )/(mol·L−1) 0.5 0.25 0.5 0.25
4
.
溶液pH 3.3 3.5 2.9 2 9
初始颜色 浅绿色 浅绿色,比Ⅰ浅 浅绿色,同Ⅰ 浅绿色,同Ⅱ
0.5h颜色 浅绿色 黄绿色 浅绿色 浅绿色
5h颜色 黄色 黄色 浅黄色 浅黄色(比Ⅲ浅)
a.实验Ⅲ和Ⅳ说明_______对溶液变黄快慢有影响。
b.实验Ⅱ比Ⅰ更快变黄的原因是_______。
(4)检验黄褐色沉淀的成分。
①通过下列实验证实,黄褐色沉淀中含有SO 。
a.证实黄褐色沉淀中含有SO 的证据是_______。
b.洗涤黄褐色沉淀的目的是_______。
②进一步实验证实黄褐色沉淀为Fe(OH)SO .将反应的离子方程式补充完整:Fe3+
4
+___+___=Fe(OH)SO ↓+___,_______。
4
(5)根据以上实验,配制FeSO 溶液时,为使溶液较长时间保持浅绿色,还需加入铁粉和稀硫酸,其中稀硫
4
酸的作用是_____(答出两点)。