文档内容
高二化学考试
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改
动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在
本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版选择性必修1第一章至第三章第一节。
5.可能用到的相对原子质量:H 1 C 12 N 14 O 16 I 127
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1.化学与生产、生活密切相关,下列说法错误的是( )
A.铁粉可用作袋装食品的脱氧剂
B.点燃爆竹后,硫直接生成硫酸
C.氢气燃烧时,主要由化学能转化为热能
D.大量燃烧化石燃料是造成雾霾天气的一个重要因素
2.常温下,下列溶液呈酸性的是( )
A.稀盐酸 B.硫酸钠溶液 C.澄清石灰水 D.氢氧化钾溶液
3.下列物质属于强电解质的是( )
A.稀硫酸 B.冰醋酸 C.浓氨水 D.碳酸钙固体
4.下列物质在水中的电离方程式书写错误的是( )
A. B.
C. D.
5.化学反应过程中产生的热量在科学研究中具有广泛的应用,下列反应属于放热反应的是( )
A.天然气的燃烧 B.高温煅烧大理石
C.氢氧化钡与氯化铵的反应 D.二氧化碳和C反应生成一氧化碳
6.增大下列过程的化学反应速率对人类有益的是( )
A.氨的合成 B.钢铁的腐蚀
C.废旧电池的焚烧 D.肉质食品的腐败
7.冰融化成水的过程中,其熵变和焓变均正确的是( )
A. , B. ,
C. , D. ,
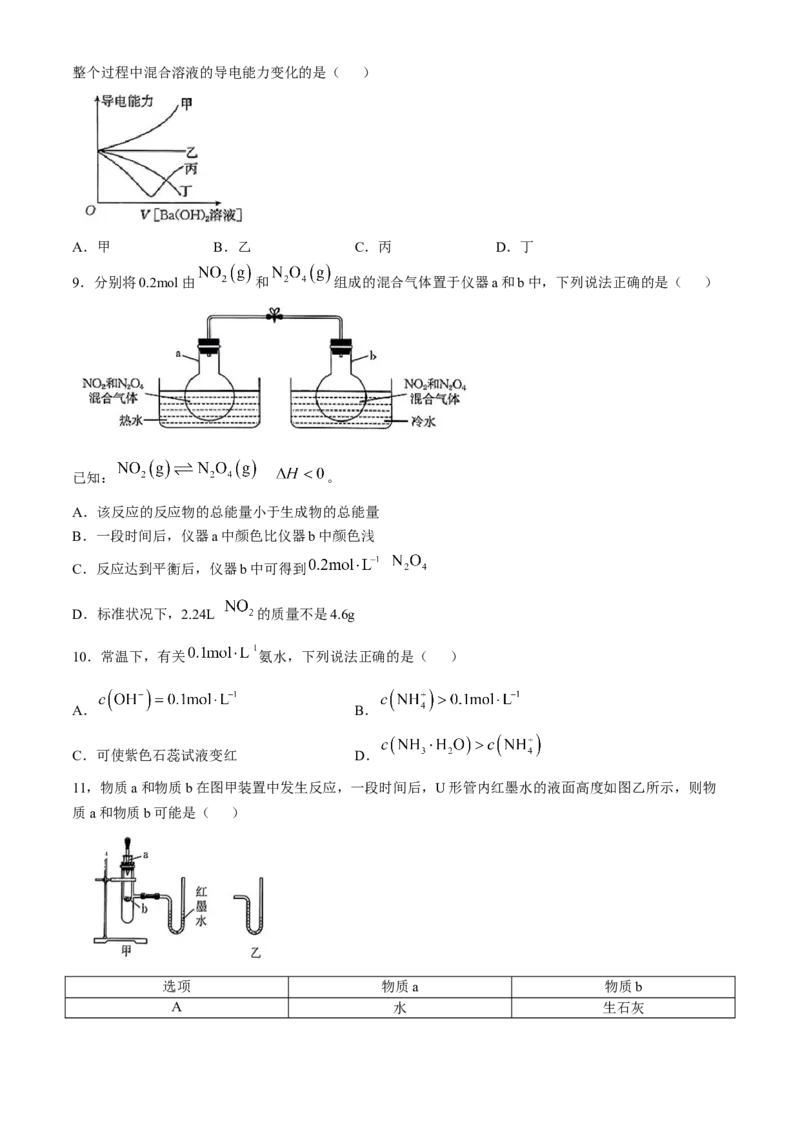
8.向盛有一定量 溶液的烧杯里逐滴加入稀 溶液,直至过量。图中的曲线可近似表示整个过程中混合溶液的导电能力变化的是( )
A.甲 B.乙 C.丙 D.丁
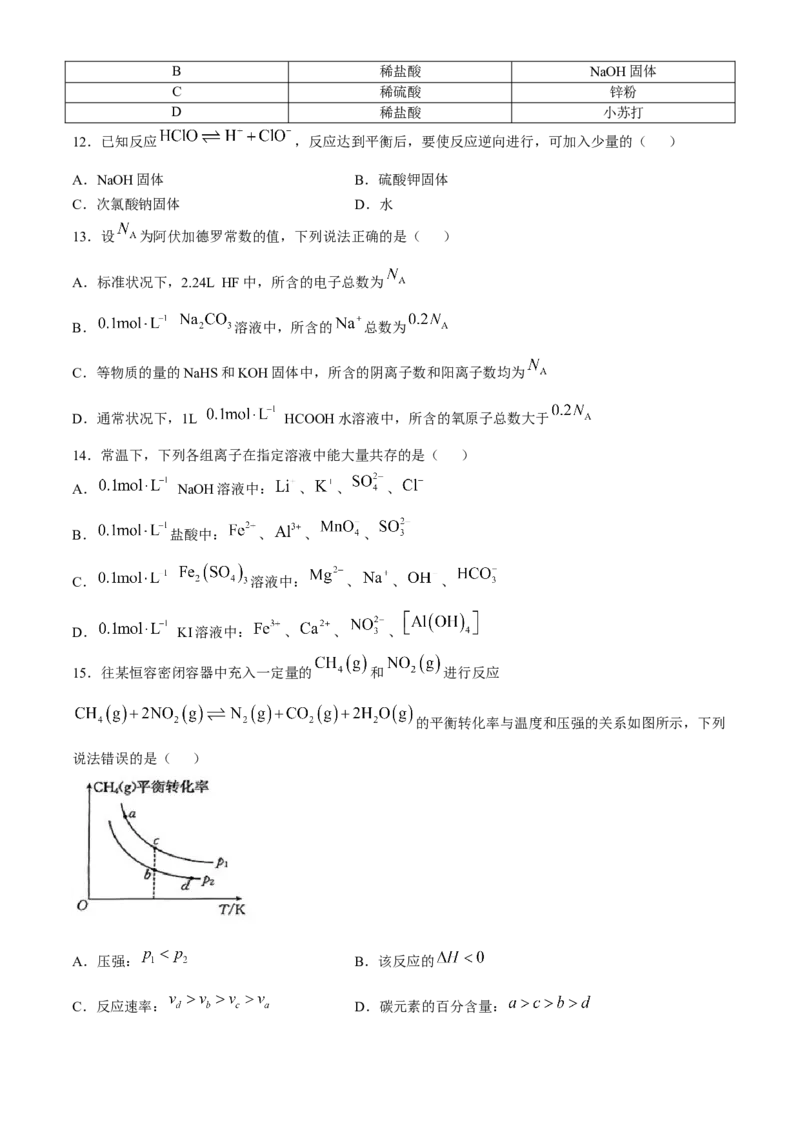
9.分别将0.2mol由 和 组成的混合气体置于仪器a和b中,下列说法正确的是( )
已知: 。
A.该反应的反应物的总能量小于生成物的总能量
B.一段时间后,仪器a中颜色比仪器b中颜色浅
C.反应达到平衡后,仪器b中可得到
D.标准状况下,2.24L 的质量不是4.6g
10.常温下,有关 氨水,下列说法正确的是( )
A. B.
C.可使紫色石蕊试液变红 D.
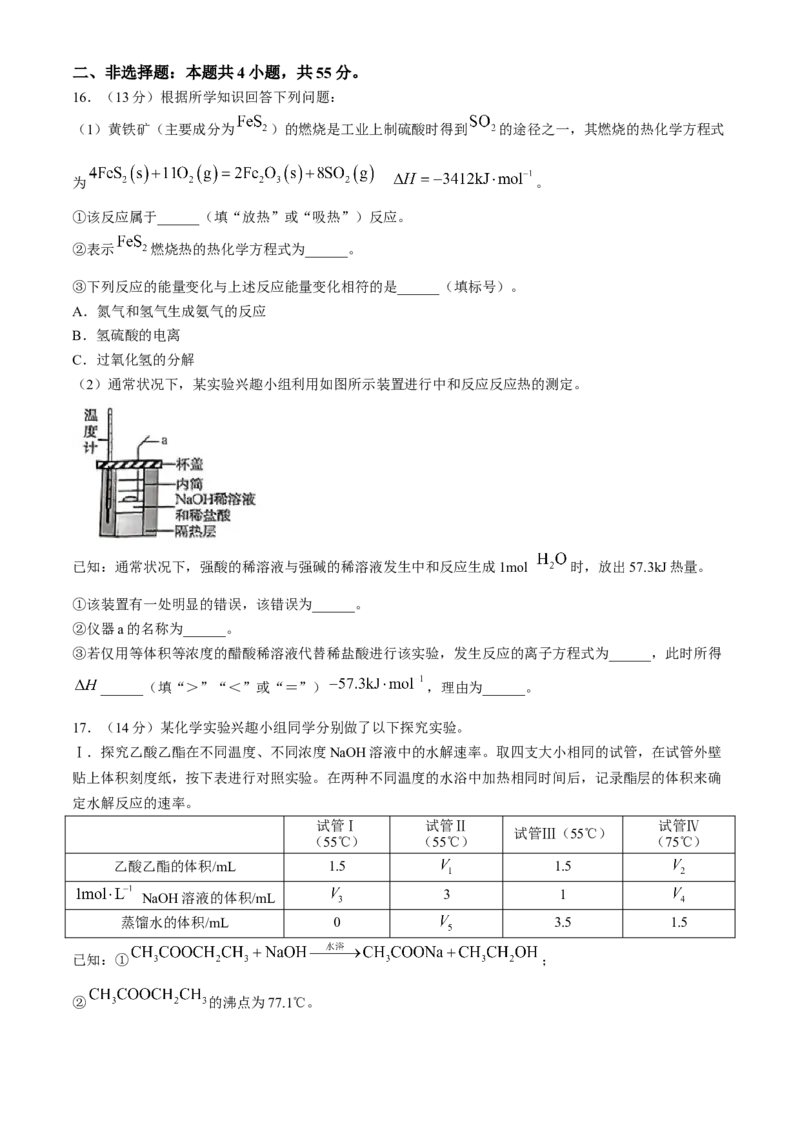
11,物质a和物质b在图甲装置中发生反应,一段时间后,U形管内红墨水的液面高度如图乙所示,则物
质a和物质b可能是( )
选项 物质a 物质b
A 水 生石灰B 稀盐酸 NaOH固体
C 稀硫酸 锌粉
D 稀盐酸 小苏打
12.已知反应 ,反应达到平衡后,要使反应逆向进行,可加入少量的( )
A.NaOH固体 B.硫酸钾固体
C.次氯酸钠固体 D.水
13.设 为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,2.24L HF中,所含的电子总数为
B. 溶液中,所含的 总数为
C.等物质的量的NaHS和KOH固体中,所含的阴离子数和阳离子数均为
D.通常状况下,1L HCOOH水溶液中,所含的氧原子总数大于
14.常温下,下列各组离子在指定溶液中能大量共存的是( )
A. NaOH溶液中: 、 、 、
B. 盐酸中: 、 、 、
C. 溶液中: 、 、 、
D. KI溶液中: 、 、 、
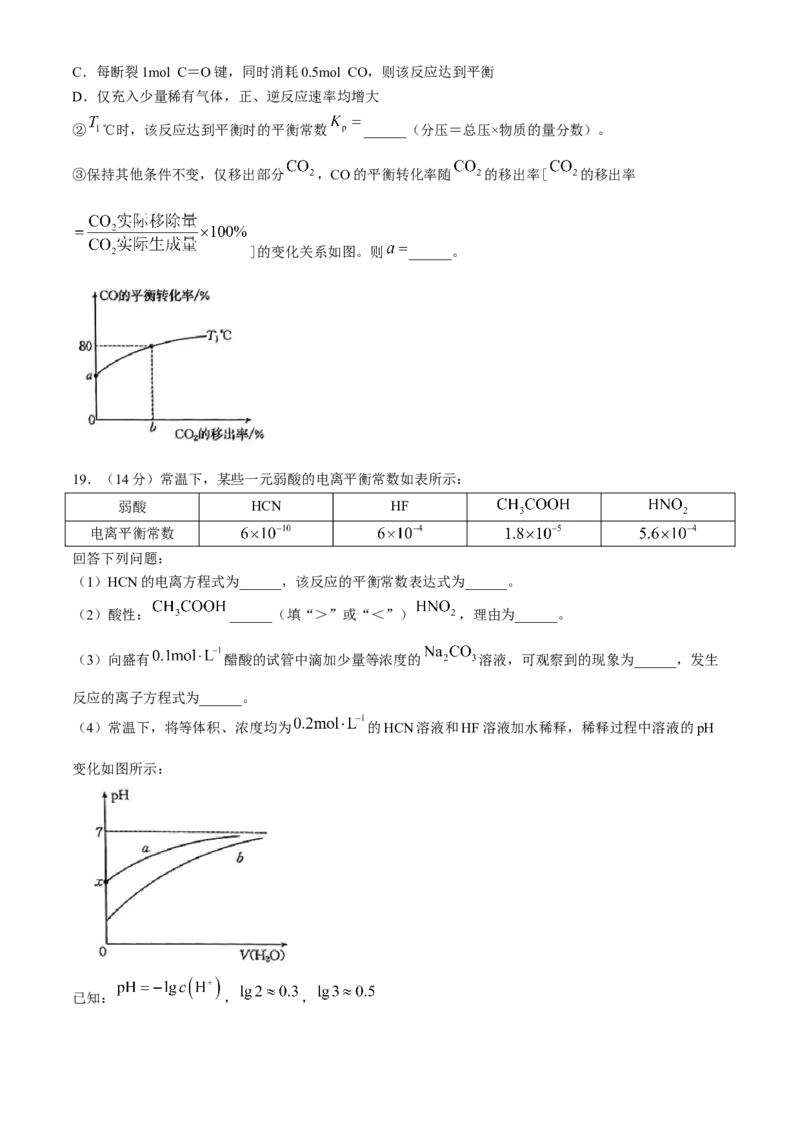
15.往某恒容密闭容器中充入一定量的 和 进行反应
的平衡转化率与温度和压强的关系如图所示,下列
说法错误的是( )
A.压强: B.该反应的
C.反应速率: D.碳元素的百分含量:二、非选择题:本题共4小题,共55分。
16.(13分)根据所学知识回答下列问题:
(1)黄铁矿(主要成分为 )的燃烧是工业上制硫酸时得到 的途径之一,其燃烧的热化学方程式
为 。
①该反应属于______(填“放热”或“吸热”)反应。
②表示 燃烧热的热化学方程式为______。
③下列反应的能量变化与上述反应能量变化相符的是______(填标号)。
A.氮气和氢气生成氨气的反应
B.氢硫酸的电离
C.过氧化氢的分解
(2)通常状况下,某实验兴趣小组利用如图所示装置进行中和反应反应热的测定。
已知:通常状况下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1mol 时,放出57.3kJ热量。
①该装置有一处明显的错误,该错误为______。
②仪器a的名称为______。
③若仅用等体积等浓度的醋酸稀溶液代替稀盐酸进行该实验,发生反应的离子方程式为______,此时所得
______(填“>”“<”或“=”) ,理由为______。
17.(14分)某化学实验兴趣小组同学分别做了以下探究实验。
Ⅰ.探究乙酸乙酯在不同温度、不同浓度NaOH溶液中的水解速率。取四支大小相同的试管,在试管外壁
贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确
定水解反应的速率。
试管Ⅰ 试管Ⅱ 试管Ⅳ
试管Ⅲ(55℃)
(55℃) (55℃) (75℃)
乙酸乙酯的体积/mL 1.5 1.5
NaOH溶液的体积/mL 3 1
蒸馏水的体积/mL 0 3.5 1.5
已知:① ;
② 的沸点为77.1℃。回答下列问题:
(1) ______, ______, 。
(2)实验中,可用饱和食盐水代替蒸馏水,以减小乙酸乙酯在水中的溶解度,使实验结果更准确,但不
能用饱和 溶液代替蒸馏水,其原因为______。
(3)用油浴代替水浴,且当油浴温度超过100℃时,除乙酸乙酯的水解速率会加快外,还可能有______。
Ⅱ.用稀硫酸与锌(足量)制取氢气的实验中,发现加入少量硫酸铜可以加快氢气的生成速率。为了进一
步研究硫酸铜对氢气生成速率的影响,该同学设计了一系列实验。
(4)锌与硫酸铜反应的离子方程式为______。
(5)该同学通过实验得出的结论为(假设其他条件均保持不变);
①当加入少量 固体时,生成氢气的速率会大大提高,原因为______。
②但当加入的 固体超过一定量时,生成氢气的速率反而会下降,其原因可能为______。
18.(14分)五氧化二碘 是一种重要的工业试剂,常温下为白色针状晶体,可作氧化剂,除去空
气中的一氧化碳。
反应Ⅰ: ;
反应Ⅱ: ;
反应Ⅲ: 。
回答下列问题:
(1)对于上述反应Ⅰ、Ⅱ、Ⅲ:
① ______(用含 、 的代数式表示), ______(用含 、 的代数式表示)。
②查阅资料可知: , ,则反应Ⅱ的平衡常数 随着温度的升高而______(填“增大”
或“减小”),判断的理由为______。
(2) ℃时向盛有足量 的V L恒容密闭容器中通入0.8mol CO,此时压强为p,仅发生反应
, ℃时, min后,该反应达到平衡,且反应达到
平衡后固体质量减小6.4g。
①下列关于反应 的说法正确的是______(填标号)。
A.仅加入合适的催化剂,反应速率加快且 的值变大
B.该反应的反应物的总键能小于生成物的总键能C.每断裂1mol C=O键,同时消耗0.5mol CO,则该反应达到平衡
D.仅充入少量稀有气体,正、逆反应速率均增大
② ℃时,该反应达到平衡时的平衡常数 ______(分压=总压×物质的量分数)。
③保持其他条件不变,仅移出部分 ,CO的平衡转化率随 的移出率[ 的移出率
]的变化关系如图。则 ______。
19.(14分)常温下,某些一元弱酸的电离平衡常数如表所示:
弱酸 HCN HF
电离平衡常数
回答下列问题:
(1)HCN的电离方程式为______,该反应的平衡常数表达式为______。
(2)酸性: ______(填“>”或“<”) ,理由为______。
(3)向盛有 醋酸的试管中滴加少量等浓度的 溶液,可观察到的现象为______,发生
反应的离子方程式为______。
(4)常温下,将等体积、浓度均为 的HCN溶液和HF溶液加水稀释,稀释过程中溶液的pH
变化如图所示:
已知: , ,①曲线______(填“a”或“b”)表示HF溶液加水稀释过程中溶液pH的变化。
②x约为______。高二化学考试参考答案
1.B 2.A 3.D 4.C 5.A 6.A 7.C 8.C 9.D 10.D 11.D 12.C 13.D 14.A
15.D
16.(1)①放热(1分)
② (2分) ③AC(2分)
(2)①温度计未放入内筒中(2分) ②玻璃搅拌器(1分)
③ (2分);>(1分); 的电离需要吸收热量,使
得中和反应反应热的 数值变小,但该反应为放热反应,则 (或其他合理答案,2
分)
17.(1)1.5(2分);3(2分);1.5(2分)
(2)碳酸氢钠水溶液呈碱性,干扰了NaOH溶液浓度对水解速率的影响(或其他合理答案,2分)
(3)温度越高,乙酸乙酯挥发越快(或其他合理答案,1分)
(4) (2分)
(5)①生成的Cu与原有的Zn形成了原电池(或其他合理答案,1分)
②生成的Cu会沉积在Zn的表面,减小了Zn与溶液的接触面积(2分)
18.(1)① (2分) (2分)
②减小(2分);依据 ,又因为 、 ,则 ,即温度升高
减小(或其他合理答案,2分)
(2)①BC(2分) ②1(2分) ③50(2分)
19.(1) (2分); (2分)
(2)<(1分);弱酸的电离平衡常数越大,酸性越强(2分)
(3)有气泡产生(1分); (2分)
(4)①b(2分) ②4.95(2分)