文档内容
2023~2024 学年第一学期 10 月六校联合调研试题
高三化学
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Zn 65
一、单项选择题:共 13题,每题 3分,共 39 分。
1.CO 捕集与封存是CO 减排的重要手段。下列关于CO 综合利用与处理方法不正确的是
2 2 2 ...
A.电化学氧化法 B.环加成制聚碳酸酯 C.碱液吸收法 D.加氢制碳氢化合物
2.下列有关化学用语的表述正确的是
A.NH Br的电子式:
4
B.O 分子的球棍模型:
3
C.NaBH 中H元素的化合价为+1
4
D.CuSO ·5H O中含离子键、共价键、配位键、氢键
4 2
3.下列实验装置与操作正确的是
图甲 图乙 图丙 图丁
A.用图甲所示装置分离CCl 和H O
4 2
B.用图乙所示装置干燥氨气
C.用图丙所示装置做制取氯气的发生装置
D.用图丁所示装置比较HCl、H CO 、H SiO 的酸性
2 3 2 3
4.N、O、Na、Mg是周期表中的短周期主族元素。下列有关说法正确的是
A.碱性:NaOH<Mg(OH) B.第一电离能:I (Na)<I (Mg)
2 1 1
C.原子半径:r(N)<r(O) D.N 、Na O、Mg的晶体类型相同
2 2
阅读下列材料,完成5~7题:
周期表中ⅥA族元素及其化合物应用广泛。H S(燃烧热为562.2 kJ·mol-1)是一种易燃的
2
有毒气体,可制取各种硫化物;硫酸、硫酸盐是重要化工原料;硫酰氯(SO Cl )是重要的化
2 2
工试剂,常作氯化剂或氯磺化剂。硒( Se)和碲( Te)的单质及其化合物在电子、冶金、材料
34 52
等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收Se,以电解强碱性
Na TeO 溶液制备Te。
2 3
5.下列说法正确的是
A.H O 是非极性分子
2 2
B.SO 中的∠O-S-O与SO2-中的相等
3 3
C.基态Se原子核外价电子排布式为4s24p4
D.ⅥA族元素氢化物的沸点从上到下依次增大
高三化学 第1页 共6页
{#{QQABBYQAggCgAgAAAQgCQwWgCAOQkBAAAAoOQAAAsAIBQRFABAA=}#}6.下列化学反应表示正确的是
△
A.Cu和浓硫酸反应:Cu+2H SO (浓)=====CuSO +2H O+SO ↑
2 4 4 2 2
B.H S的燃烧:2H S(g)+3O (g)===2SO (g)+2H O(g) ΔH=−1124.4 kJ·mol-1
2 2 2 2 2
C.电解强碱性Na TeO 溶液的阴极反应:TeO2-+4e-+6H+===Te+3H O
2 3 3 2
D.SO Cl 遇水强烈水解生成两种酸:SO Cl +2H O===4H++SO2-+2Cl-
2 2 2 2 2 3
7.下列有关物质的性质与用途具有对应关系的是
A.硫化钠具有还原性,可用作Hg2+沉淀剂
B.浓硫酸具有吸水性,可用于干燥二氧化硫
C.硫黄为淡黄色固体,可用作制硫磺皂
D.二氧化硫具有氧化性,可用于漂白纸浆
放电
8.某过渡金属(M)—锂离子电池的结构如图所示,总反应式为Li C +Li MO Li C +
x n y 2 充电 x-1 n
Li MO ,下列说法不正确的是
y+1 2 ...
A.放电时电子从C 流入Al,还原电极B中的金属元素M
n
B.充电时B电极的反应式为:Li MO -e-=== Li MO +Li+
y+1 2 y 2
C.电解质不能用水溶液,但可用离子液体
D.当Li+移向电极A时,化学能转化为电能
9.Y是合成药物查尔酮类抑制剂中间体,由X在一定条件下反应制得。下列叙述正确的是
A.K CO 是为了结合反应产生的HBr
2 3
B.FeCl 溶液不能鉴别X和Y
3
C.Y存在顺反异构体
D.X与H 完全加成所得产物分子中含2个手性碳原子
2
10.750℃时,NH 和O 发生以下两个反应:
3 2
①4NH (g)+5O (g) 4NO(g)+6H O(g) ΔH
3 2 2 1
②4NH (g)+3O (g) 2N (g)+6H O(g) ΔH
3 2 2 2 2
下列说法正确的是
c4(NO)
A.反应①的平衡常数可表示为K =
1 c4(NH )·c5(O )
3 2
B.反应②的ΔS<0
C.反应①中每生成2 mol NO,转移电子数约为6.02×1024
D.反应②的ΔH =2E(N≡N)+12E(H-O)-12E(N-H)-3E(O=O)
2
11.实验室向CaSO 悬浊液中加入过量(NH ) CO 溶液,充分搅拌后过滤得到CaCO 。已知室
4 4 2 3 3
温时,K (CaSO )=9.0×10-6,K (CaCO )=3.0×10-9。下列说法正确的是
sp 4 sp 3
A.(NH ) CO 溶液中存在:c(OH-)=c(H+)+c(HCO-)+2c(H CO )
4 2 3 3 2 3
B.CaSO 悬浊液中存在:c(Ca2+)<10-5 mol·L-1
4
cSO2-
C.反应CaSO +CO2- CaCO +SO2-正向进行,需满足 4 <3.0×103
4 3 3 4 cCO2-
3
D.过滤后所得滤液中一定存在:c(H+)+c(NH+)=c(OH-)+2c(SO2-)
4 4
高三化学 第2页 共6页
{#{QQABBYQAggCgAgAAAQgCQwWgCAOQkBAAAAoOQAAAsAIBQRFABAA=}#}12.下列设计的实验方案不能达到实验目的是
..
选项 实验现象和操作 实验目的
向2 mL 0.1mol·L-1 Na S溶液中滴加0.1 mol·L-1 ZnSO 溶
2 4
A 液至不再有沉淀产生,再滴加几滴0.1 mol·L-1 CuSO 溶 验证K (ZnS)>K (CuS)
4 sp sp
液,出现黑色沉淀
向装有电石的圆底烧瓶中逐滴加入适量饱和NaCl溶液,
B 检验乙炔中含有碳碳三键
将产生的气体通入酸性高锰酸钾溶液中,溶液紫色褪去
以Zn、Fe为电极,以酸化的3% NaCl 溶液作电解质溶
液,连接成原电池装置。过一段时间,从Fe电极区域取
C 探究金属的牺牲阳极保护法
少量溶液于试管中,再向试管中滴入 2 滴 K [Fe(CN) ]
3 6
溶液,观察现象
向盛有 2 mL 0.1 mol·L-1 K Cr O 溶液的试管中滴加
2 2 7
D 5~10滴NaOH溶液,再继续滴加5~10滴6 mol·L-1 H SO 探究浓度对化学平衡的影响
2 4
溶液,观察现象
13.中国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将CO 催化还
2
原为CH OH。已知CO 催化加氢的主要反应有:
3 2
①CO (g)+3H (g) CH OH(g)+H O(g) ΔH =-49.4 kJ·mol-1
2 2 3 2 1
②CO (g)+H (g) CO(g)+H O(g) ΔH =+41.2 kJ·mol-1
2 2 2 2
其他条件不变,在相同时间内温度对CO 催化加氢的影响如下图。下列说法不正确的是
2 ...
n(生成CH OH消耗的CO )
3 2
已知:CH OH的选择性= ×100%
3 n(反应消耗的CO )
2
n(H )
A.增大 2 有利于提高CO 的平衡转化率
n(CO ) 2
2
B.使用催化剂,能降低反应的活化能,增大活化分子百分数
C.其他条件不变,增大压强,有利于反应向生成CH OH的方
3
向进行
D.220~240 ℃,升高温度,对反应②速率的影响比对反应①
的小 题13图
高三化学 第3页 共6页
{#{QQABBYQAggCgAgAAAQgCQwWgCAOQkBAAAAoOQAAAsAIBQRFABAA=}#}二、非选择题:共4题,共61分。
14.(15分)从某冶锌工厂的工业废料[除ZnO外,还含有铋(Bi)、锗(Ge)等的氧化物]中回收
几种金属的单质或化合物的工业流程如图:
(已知:Ge4+易水解)
(1)下列措施更有利于完成“酸浸1”目的,提高“酸浸1”浸取率的是 ▲ (填字母)。
A.延长酸浸时间 B.浓硫酸代替稀硫酸
C.酸浸过程中不断搅拌 D.增多工业废料的用量
(2)“酸浸2”时Bi O 发生反应的离子方程式为 ▲ 。
2 3
(3)“沉锗”的反应原理为Ge4++2H R GeR ↓+4H+,该操作中需调节pH约为2.5,不
2 2
能过高或过低,其原因是 ▲ 。
(4)①ZnO的一种晶胞结构如题14图-1所示,每个Zn原子周围紧邻的O原子个数为 ▲ 。
题14图-1 题14图-2
②ZnO也可用作半导体材料,晶体中部分O原子被N原子替代后可以改善半导体的性能,
Zn-N键中离子键成分百分数小于Zn-O键,从元素电负性的角度分析其原因为
▲ 。
③加热ZnSO ·7H O固体,固体质量保留百分数与温度的关系如题14图-2所示。1050℃时
4 2
所得固体的化学式为 ▲ 。(写出计算过程)
高三化学 第4页 共6页
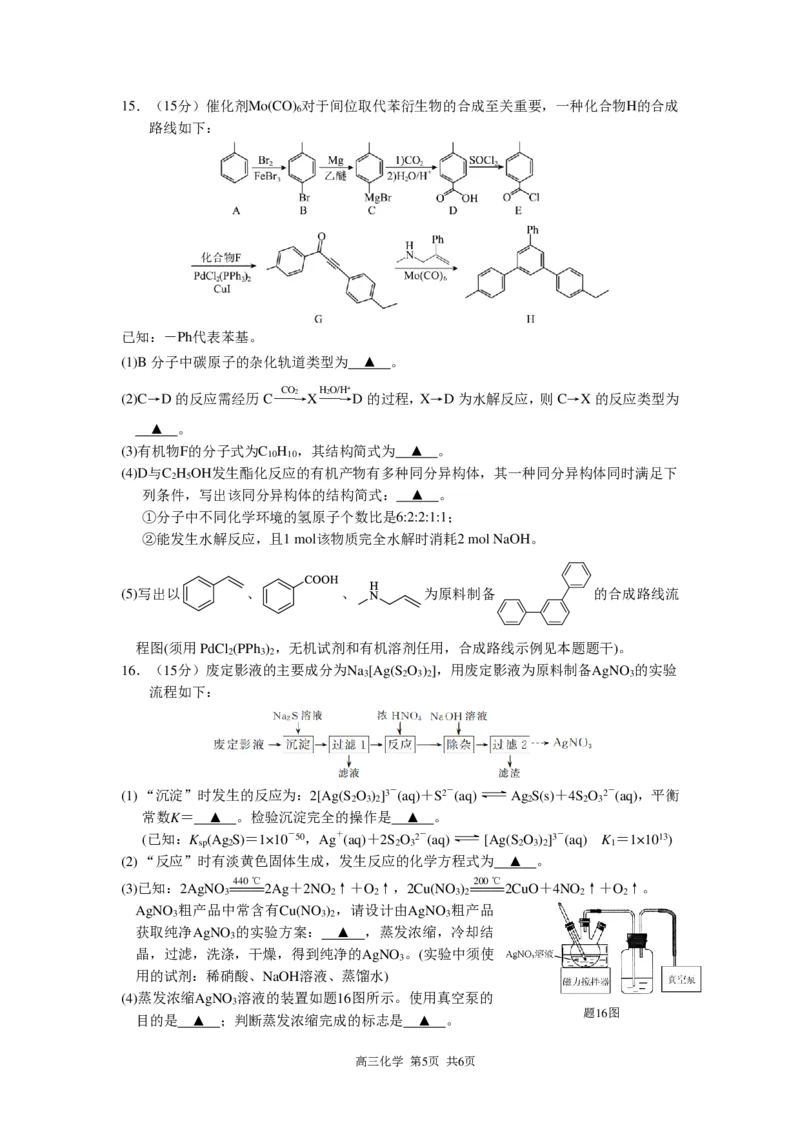
{#{QQABBYQAggCgAgAAAQgCQwWgCAOQkBAAAAoOQAAAsAIBQRFABAA=}#}15.(15分)催化剂Mo(CO) 对于间位取代苯衍生物的合成至关重要,一种化合物H的合成
6
路线如下:
已知:-Ph代表苯基。
(1)B分子中碳原子的杂化轨道类型为 ▲ 。
(2)C→D的反应需经历C― C ― O →2 X― H2― O/ → H+ D的过程,X→D为水解反应,则C→X的反应类型为
▲ 。
(3)有机物F的分子式为C H ,其结构简式为 ▲ 。
10 10
(4)D与C H OH发生酯化反应的有机产物有多种同分异构体,其一种同分异构体同时满足下
2 5
列条件,写出该同分异构体的结构简式: ▲ 。
①分子中不同化学环境的氢原子个数比是6:2:2:1:1;
②能发生水解反应,且1 mol该物质完全水解时消耗2 mol NaOH。
(5)写出以 、 、 为原料制备 的合成路线流
程图(须用PdCl (PPh ) ,无机试剂和有机溶剂任用,合成路线示例见本题题干)。
2 3 2
16.(15分)废定影液的主要成分为Na [Ag(S O ) ],用废定影液为原料制备AgNO 的实验
3 2 3 2 3
流程如下:
(1) “沉淀”时发生的反应为:2[Ag(S O ) ]3-(aq)+S2-(aq) AgS(s)+4S O 2-(aq),平衡
2 3 2 2 2 3
常数K= ▲ 。检验沉淀完全的操作是 ▲ 。
(已知:K (AgS)=1×10-50,Ag+(aq)+2S O 2-(aq) [Ag(S O ) ]3-(aq) K =1×1013)
sp 2 2 3 2 3 2 1
(2) “反应”时有淡黄色固体生成,发生反应的化学方程式为 ▲ 。
440 ℃ 200 ℃
(3)已知:2AgNO =====2Ag+2NO ↑+O ↑,2Cu(NO ) =====2CuO+4NO ↑+O ↑。
3 2 2 3 2 2 2
AgNO 粗产品中常含有Cu(NO ) ,请设计由AgNO 粗产品
3 3 2 3
获取纯净AgNO 的实验方案: ▲ ,蒸发浓缩,冷却结
3
晶,过滤,洗涤,干燥,得到纯净的AgNO 。(实验中须使
3
用的试剂:稀硝酸、NaOH溶液、蒸馏水)
(4)蒸发浓缩AgNO 溶液的装置如题16图所示。使用真空泵的
3
题16图
目的是 ▲ ;判断蒸发浓缩完成的标志是 ▲ 。
高三化学 第5页 共6页
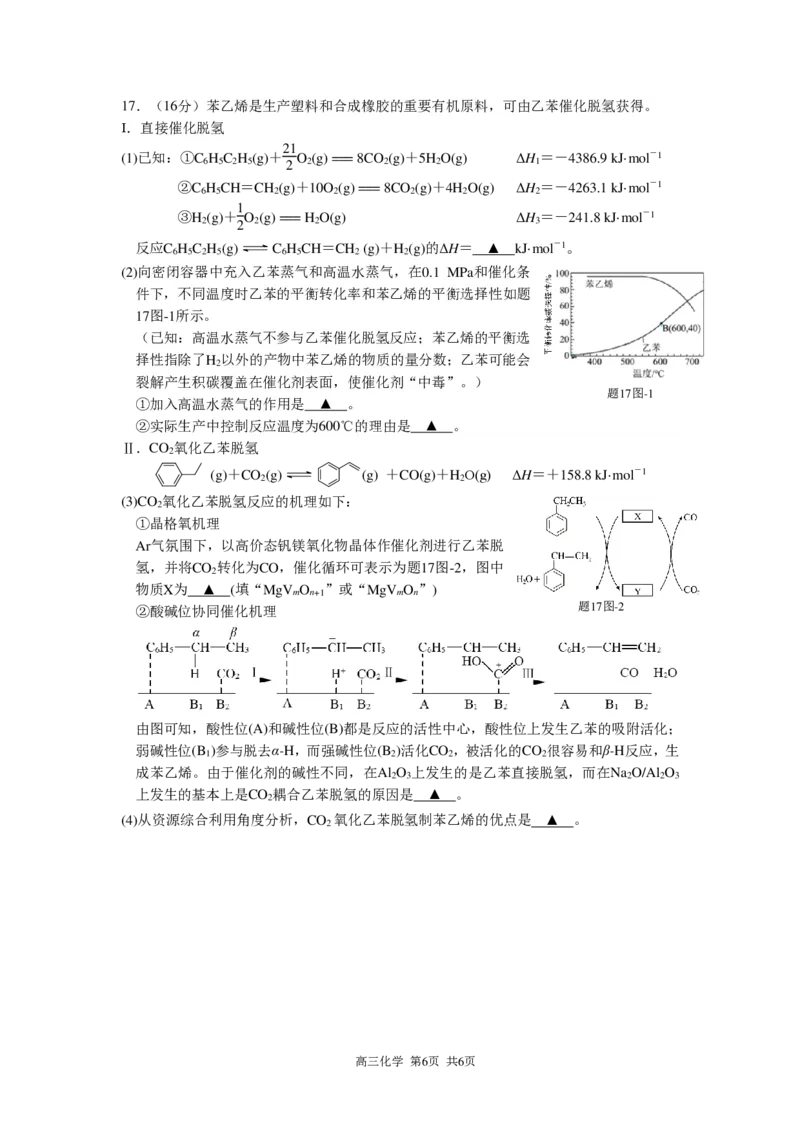
{#{QQABBYQAggCgAgAAAQgCQwWgCAOQkBAAAAoOQAAAsAIBQRFABAA=}#}17.(16分)苯乙烯是生产塑料和合成橡胶的重要有机原料,可由乙苯催化脱氢获得。
Ⅰ.直接催化脱氢
21
(1)已知:①C H C H (g)+ O (g) === 8CO (g)+5H O(g) ΔH =-4386.9 kJ·mol-1
6 5 2 5 2 2 2 2 1
②C H CH=CH (g)+10O (g) === 8CO (g)+4H O(g) ΔH =-4263.1 kJ·mol-1
6 5 2 2 2 2 2
1
③H (g)+ O (g) === H O(g) ΔH =-241.8 kJ·mol-1
2 2 2 2 3
反应C H C H (g) C H CH=CH (g)+H (g)的ΔH= ▲ kJ·mol-1。
6 5 2 5 6 5 2 2
(2)向密闭容器中充入乙苯蒸气和高温水蒸气,在0.1 MPa和催化条
件下,不同温度时乙苯的平衡转化率和苯乙烯的平衡选择性如题
17图-1所示。
(已知:高温水蒸气不参与乙苯催化脱氢反应;苯乙烯的平衡选
择性指除了H 以外的产物中苯乙烯的物质的量分数;乙苯可能会
2
裂解产生积碳覆盖在催化剂表面,使催化剂“中毒”。)
题17图-1
①加入高温水蒸气的作用是 ▲ 。
②实际生产中控制反应温度为600℃的理由是 ▲ 。
Ⅱ.CO 氧化乙苯脱氢
2
(g)+CO (g) (g) +CO(g)+H O(g) ΔH=+158.8 kJ·mol-1
2 2
(3)CO 氧化乙苯脱氢反应的机理如下:
2
①晶格氧机理
Ar气氛围下,以高价态钒镁氧化物晶体作催化剂进行乙苯脱
氢,并将CO 转化为CO,催化循环可表示为题17图-2,图中
2
物质X为 ▲ (填“MgV O ”或“MgV O ”)
m n+1 m n
②酸碱位协同催化机理
题17图-2
由图可知,酸性位(A)和碱性位(B)都是反应的活性中心,酸性位上发生乙苯的吸附活化;
弱碱性位(B )参与脱去α-H,而强碱性位(B )活化CO ,被活化的CO 很容易和β-H反应,生
1 2 2 2
成苯乙烯。由于催化剂的碱性不同,在Al O 上发生的是乙苯直接脱氢,而在Na O/Al O
2 3 2 2 3
上发生的基本上是CO 耦合乙苯脱氢的原因是 ▲ 。
2
(4)从资源综合利用角度分析,CO 氧化乙苯脱氢制苯乙烯的优点是 ▲ 。
2
高三化学 第6页 共6页
{#{QQABBYQAggCgAgAAAQgCQwWgCAOQkBAAAAoOQAAAsAIBQRFABAA=}#}