文档内容
… … … …
… … … …
… … … …
○ … ○ …
… … … … 2025 年 1 月“八省联考”考前猜想卷
…
… … … …
学 校
… …
外 … _____ 内 … 化 学
_____
… … … …
____
… … … …
姓 名 (考试时间:75分钟 试卷满分:100分)
… …
_____
○ … ○ … 注意事项:
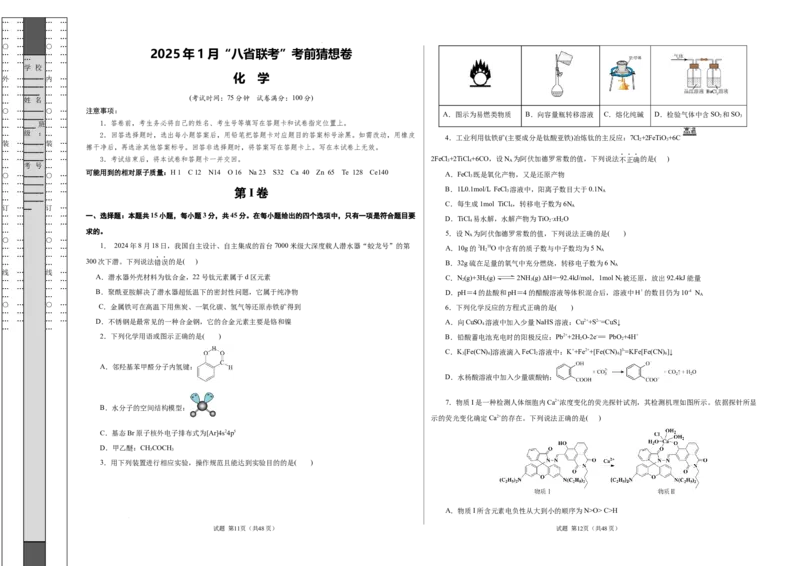
… … _____ … … A.图示为易燃类物质 B.向容量瓶转移溶液 C.熔化纯碱 D.检验气体中含SO 2 和SO 3
___ 班 1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置上。
… … … …
… 级 : … 2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮
4.工业利用钛铁矿(主要成分是钛酸亚铁)冶炼钛的主反应:7Cl+2FeTiO+6C
_____ 2 3
装 … 装 …
擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
_____
… … … …
… …_____ … … 3.考试结束后,将本试卷和答题卡一并交回。 2FeCl+2TiCl +6CO,设N 为阿伏加德罗常数的值,下列说法不正确的是( )
3 4 A
… 考 号 …
○ …_____ ○ … 可能用到的相对原子质量:H 1 C 12 N14 O 16 Na 23 S32 Ca 40 Zn 65 Te 128 Ce140 A.FeCl 3 既是氧化产物,又是还原产物
… …_____ … …
… …_____ … … 第 I 卷 B.1L0.1mol/L FeCl 3 溶液中,阳离子数目大于0.1N A
… _____ …
C.每生成1mol TiCl ,转移电子数为6N
订 …__ 订 … 4 A
… … … … 一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要
D.TiCl 易水解,水解产物为TiO·xHO
4 2 2
… … … …
… … 求的。 5.设N 为阿伏伽德罗常数的值,下列说法正确的是( )
A
○ … ○ …
1. 2024年8月18日,我国自主设计、自主集成的首台7000米级大深度载人潜水器“蛟龙号”的第
… … … … A.10g的2H18O中含有的质子数与中子数均为5 N
2 A
… … … …
… … 300次下潜。下列说法错误的是( ) B.32g硫在足量的氧气中充分燃烧,转移电子数为6 N A
线 … 线 …
A.潜水器外壳材料为钛合金,22号钛元素属于d区元素 C.N(g)+3H(g) 2NH (g) ΔH=−92.4kJ/mol,1mol N 被还原,放出92.4kJ能量
… … … … 2 2 3 2
… … … …
B.聚酰亚胺解决了潜水器超低温下的密封性问题,它属于纯净物 D.pH=4的盐酸和pH=4的醋酸溶液等体积混合后,溶液中 的数目仍为10-4 N
… … A
○ … ○ …
C.金属铁可在高温下用焦炭、一氧化碳、氢气等还原赤铁矿得到 6.下列化学反应的方程式正确的是( )
… … … …
… … … … D.不锈钢是最常见的一种合金钢,它的合金元素主要是铬和镍 A.向CuSO 溶液中加入少量NaHS溶液:Cu2++S2--=CuS↓
4
… …
2.下列化学用语或图示正确的是( ) B.铅酸蓄电池充电时的阳极反应:Pb2++2H O-2e-= PbO +4H+
2 2
C.K[Fe(CN) ]溶液滴入FeCl 溶液中:K++Fe2++[Fe(CN)]3-=KFe[Fe(CN) ]↓
3 6 2 6 6
A.邻羟基苯甲醛分子内氢键:
D.水杨酸溶液中加入少量碳酸钠:
7.物质I是一种检测人体细胞内Ca2+浓度变化的荧光探针试剂,其检测机理如图所示。依据探针所显
B.水分子的空间结构模型:
示的荧光变化确定Ca2+的存在。下列说法正确的是( )
C.基态Br原子核外电子排布式为[Ar]4s24p5
D.甲乙醚:CHCOCH
3 3
3.用下列装置进行相应实验,操作规范且能达到实验目的的是( )
A.物质I所含元素电负性从大到小的顺序为N>O> C>H
试题 第11页(共48页) 试题 第12页(共48页)
学科网(北京)股份有限公司… … … …
… … … …
… … … …
○ … ○ …
… … … …
… … … …
… …
外 … 内 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
装 … 装 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
订 … 订 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
线 … 线 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
… … … …
… … … …
… … … …
B.物质I中N原子的杂化类型为sp2、sp3
○ … ○ …
… … … …
C.物质Ⅱ中H-O-H键角小于水中H-O-H的键角
… … … …
此
… …
D.物质Ⅱ中Ca2+与O形成4个配位键
卷
内 … 外 …
只
8.根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不正确的是( ) … … … …
装
… … … …
订
… …
实验目的 方案设计 现象 结论 不
○ … ○ …
密
… … … …
将适量硫粉和铁粉混合堆成条状。用灼 混合物继续保持红热 … … 封 … …
探究Fe和S
A 热的玻璃棒触及一端,当混合物呈红热 并持续扩散,粉末呈 该反应为放热反应 … …
反应特点
状态时,移开玻璃棒。 黑色 装 … 装 …
下列说法正确的是( ) … … … …
比较沉淀的 向相同浓度和体积的浓氨水中,分别加 氯化银溶解,碘化银 … … … …
B K :AgCl>AgI
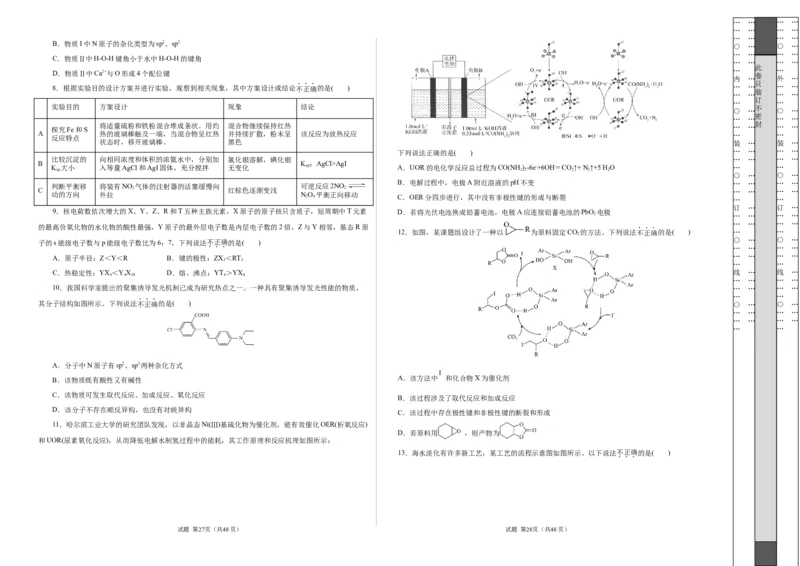
K 大小 入等量AgCl和AgI固体,充分搅拌 无变化 sp A.UOR的电化学反应总过程为CO(NH)-6e-+6OH-= CO↑+ N ↑+5 H O … …
sp 2 2 2 2 2
○ … ○ …
B.电解过程中,电极A附近溶液的pH不变 … … … …
判断平衡移 将装有NO 气体的注射器的活塞缓慢向 可逆反应2NO
C 2 红棕色逐渐变浅 2 … … … …
动的方向 外拉 NO 平衡正向移动
2 4 C.OER分四步进行,其中没有非极性键的形成与断裂 … …
订 … 订 …
9.核电荷数依次增大的X、Y、Z、R和T五种主族元素,X原子的原子核只含质子,短周期中T元素 D.若将光伏电池换成铅蓄电池,电极A应连接铅蓄电池的PbO 电极
2 … … … …
… … … …
的最高价氧化物的水化物的酸性最强,Y原子的最外层电子数是内层电子数的2倍,Z与Y相邻,基态R原
12.如图,某课题组设计了一种以 为原料固定CO 的方法。下列说法不正确的是( ) … …
2
子的s能级电子数与p能级电子数比为6:7,下列说法不正确的是( ) ○ … ○ …
… … … …
A.原子半径:Z<Y<R B.键的极性:ZX<RT … … … …
3 3
… …
C.热稳定性:YX <YX D.熔、沸点:YT>YX 线 … 线 …
4 4 10 4 4
… … … …
10.我国科学家提出的聚集诱导发光机制已成为研究热点之一。一种具有聚集诱导发光性能的物质, … … … …
… …
其分子结构如图所示。下列说法不正确的是( ) ○ … ○ …
… … … …
… … … …
… …
A.分子中N原子有sp2、sp3两种杂化方式
A.该方法中 和化合物X为催化剂
B.该物质既有酸性又有碱性
C.该物质可发生取代反应、加成反应、氧化反应
B.该过程涉及了取代反应和加成反应
D.该分子不存在顺反异构,也没有对映异构
C.该过程中存在极性键和非极性键的断裂和形成
11.哈尔滨工业大学的研究团队发现,以非晶态Ni(Ⅲ)基硫化物为催化剂,能有效催化OER(析氧反应)
D.若原料用 ,则产物为
和UOR(尿素氧化反应),从而降低电解水制氢过程中的能耗,其工作原理和反应机理如图所示:
13.海水淡化有许多新工艺,某工艺的流程示意图如图所示。以下说法不正确的是( )
试题 第27页(共48页) 试题 第28页(共48页)… … … …
… … … …
… … … …
○ … ○ …
… … … …
… … … …
… …
内 … 外 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
装 … 装 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
订 … 订 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
线 … 线 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
… … … …
… … … …
… … … …
○ … ○ …
15.CaF 是一种难溶于水、可溶于酸的盐,工业上常用NaF固体除去工业废水中的Ca2+。常温下,向
… … … … 2
…
… … … …
学 校
… …
_____
外 … 内 …
_____
… … … … 一定体积的工业废水中加入 固体,溶液中 , 表示Ca2+或 与
____
… … … …
姓 名
… …
_____
○ … ○ …
_____
… … … …
… …
___ 班
… …
的关系如图所示 的电离常数 ,下列说法不正确的是( )
级 :
… …
_____ A.由于连续的热交换,a处海水的温度更高
装 … 装 …
_____
… … … …
B.减压蒸馏时的压强二级闪蒸室内更低
… …_____ … …
… 考 号 … C.广泛使用太阳能、风能和发电厂的余热以及热交换可降低海水淡化成本
○ …_____ ○ …
… …_____ … … D.淡化后的盐水常用于生产食盐、钾、铝、碘等化工产品
… …_____ … …
… _____ … 14.中国科学家首次用C 60 改性铜基催化剂,将草酸二甲酯加氢制乙二醇的反应条件从高压降至常压。
订 …__ 订 …
… … … … 草酸二甲酯加氢的主要反应有:
… … … …
… …
①
○ … ○ …
A.曲线II表示 与 变化关系
… … … …
… … … …
②CH
3
OOCCH
2
OH(g)+2H
2
(g) HOCH
2
CH
2
OH(g)+CH
3
OH(g)
… …
③HOCH CHOH(g)+H(g) CHCHOH(g)+HO(g) B.CaF 的溶度积常数K = 10-10.57
线 … 线 … 2 2 2 3 2 2 2 sp
… … … …
其他条件相同时,相同时间内温度对产物选择性的影响结果如图。 C.c(HF)=104c(F-)时,溶液中c(Ca2+)>c(F-)
… … … …
… …
D.反应CaF(s)+2H+(aq) Ca2+(aq) +2HF(aq)的平衡常数 的值为10-4.21
2
○ … ○ …
… … … …
第 II 卷
… … … …
… …
二、非选择题:本题共4小题,共55分。
16. (13分)稀土元素铈及其化合物在生产生活中有重要用途,硝酸铈铵[(NH )Ce(NO )]是重要化工原
4 2 3 6
料,它易溶于水和乙醇,几乎不溶于浓硝酸。以氟碳铈矿(主要成分为CeFCO)为原料制备制备硝酸铈铵流
3
程如下:
已知:i.
ii.450~500K,反应③的平衡常数远大于反应①和反应②的平衡常数
下列说法不正确的是
(1)焙烧过程中发生的主要反应的化学方程式为__________________ 。
A.制乙二醇适宜的温度范围是470~480K
(2)下列说法不正确的是_______。
B.实验条件下反应③的活化的最高,升温更有利于反应③
A.“焙烧”中常采用高压空气、逆流操作
C.减压可提高乙二醇的平衡产率
B.酸浸过程中用稀硫酸和HO,氧化剂和还原剂物质的量之比为2:1
D.铜基催化剂用C 改性后反应速率增大,可以降低反应所需的压强 2 2
60
试题 第31页(共48页) 试题 第32页(共48页)
学科网(北京)股份有限公司… … … …
… … … …
… … … …
○ … ○ …
… … … …
… … … …
… …
外 … 内 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
装 … 装 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
订 … 订 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
线 … 线 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
… … … …
… … … …
… … … …
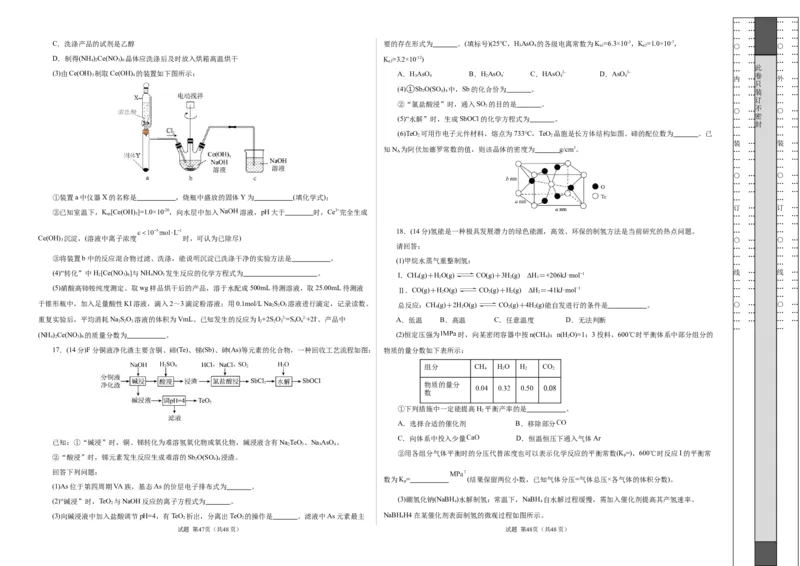
C.洗涤产品的试剂是乙醇 要的存在形式为 。(填标号)(25℃,HAsO 的各级电离常数为K =6.3×10-3,K =1.0×10-7,
3 4 a1 a2 ○ … ○ …
… … … …
D.制得(NH
4
)
2
Ce(NO
3
)
6
晶体应洗涤后及时放入烘箱高温烘干 K
a3
=3.2×10-12)
… … … …
此
… …
(3)由Ce(OH) 3 制取Ce(OH) 4 的装置如下图所示: A.H 3 AsO 4 B.H 2 AsO 4 - C.HAsO 4 2- D.AsO 4 3- 内 … 卷 外 …
只
… … … …
(4)①Sb O(SO ) 中,Sb的化合价为 。
2 4 4 装
… … … …
订
②“氯盐酸浸”时,通入SO 的目的是 。 … …
2 不
○ … ○ …
密
(5)“水解”时,生成SbOCl的化学方程式为 。 … … … …
封
… … … …
(6)TeO 2 可用作电子元件材料,熔点为733℃,TeO 2 晶胞是长方体结构如图。碲的配位数为 。已 … …
装 … 装 …
知N A 为阿伏加德罗常数的值,则该晶体的密度为 g/cm3。 … … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
①装置a中仪器X的名称是 ,烧瓶中盛放的固体Y为 (填化学式); … …
订 … 订 …
②已知室温下,K [Ce(OH) ]=1.0×10-20,向水层中加入 溶液,pH大于 时,Ce3+完全生成
sp 3 … … … …
… … … …
18.(14分)氢能是一种极具发展潜力的绿色能源,高效、环保的制氢方法是当前研究的热点问题。 … …
Ce(OH) 3 沉淀,(溶液中离子浓度 时,可认为已除尽) ○ … ○ …
请回答: … … … …
… … … …
③将装置b中的反应混合物过滤、洗涤,能说明沉淀已洗涤干净的实验方法是 。
(1)甲烷水蒸气重整制氢:
… …
(4)“转化”中H 2 [Ce(NO 3 ) 6 ]与NH 4 NO 3 发生反应的化学方程式为 。 I.CH(g)+HO(g) CO(g)+3H(g) ΔH =+206kJ·mol−1 线 … 线 …
4 2 2 1 … … … …
(5)硝酸高铈铵纯度测定。取wg样品烘干后的产品,溶于水配成500mL待测溶液,取25.00mL待测液 Ⅱ.CO(g)+HO(g) CO(g)+H(g) ΔH =-41kJ·mol−1 … … … …
2 2 2 2
… …
于锥形瓶中,加入足量酸性KI溶液,滴入2~3滴淀粉溶液;用0.1mol/L Na 2 S 2 O 3 溶液进行滴定,记录读数。 总反应:CH 4 (g)+2H 2 O(g) CO 2 (g)+4H 2 (g)能自发进行的条件是 。 ○ … ○ …
… … … …
重复实验后,平均消耗Na 2 S 2 O 3 溶液的体积为VmL。已知发生的反应为I 2 +2S 2 O 3 2-=S 4 O 6 2-+2I-。产品中 A.低温 B.高温 C.任意温度 D.无法判断 … … … …
… …
(NH )Ce(NO ) 的质量分数为 。 (2)恒定压强为 时,向某密闭容器中按n(CH):n(H O)=1:3投料,600℃时平衡体系中部分组分的
4 2 3 6 4 2
17.(14分)F分铜液净化渣主要含铜、碲(Te)、锑(Sb)、砷(As)等元素的化合物,一种回收工艺流程如图: 物质的量分数如下表所示:
组分 CH HO H CO
4 2 2 2
物质的量分
数
①下列措施中一定能提高H 平衡产率的是 。
2
A.选择合适的催化剂 B.移除部分
C.向体系中投入少量 D.恒温恒压下通入气体Ar
已知:①“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有NaTeO 、NaAsO 。
2 3 3 4
②用各组分气体平衡时的分压代替浓度也可以表示化学反应的平衡常数(K =),600℃时反应I的平衡常
②“酸浸”时,锑元素发生反应生成难溶的Sb O(SO ) 浸渣。 p
2 4 4
回答下列问题:
数为K= (结果保留两位小数,已知气体分压=气体总压×各气体的体积分数)。
p
(1)As位于第四周期VA族,基态As的价层电子排布式为 。
(2)“碱浸”时,TeO 2 与NaOH反应的离子方程式为 。 (3)硼氢化钠(NaBH 4 )水解制氢:常温下,NaBH 4 自水解过程缓慢,需加入催化剂提高其产氢速率。
(3)向碱浸液中加入盐酸调节pH=4,有TeO 析出,分离出TeO 的操作是 。滤液中As元素最主 NaBH H4在某催化剂表面制氢的微观过程如图所示。
2 2 4
试题 第47页(共48页) 试题 第48页(共48页)… … … …
… … … …
… … … …
○ … ○ …
… … … …
… … … …
… …
内 … 外 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
装 … 装 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
订 … 订 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
线 … 线 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
… … … …
… … … …
… … … …
○ … ○ …
… … … …
…
… … … …
学 校
… …
_____
外 … 内 …
_____
… … … …
____
… … … …
姓 名
… …
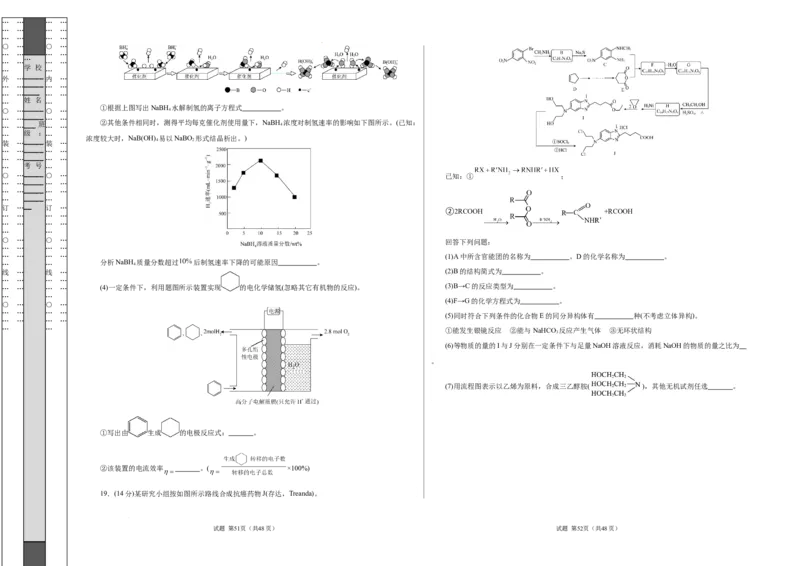
_____ ①根据上图写出NaBH 水解制氢的离子方程式 。
○ … ○ … 4
_____
… … … …
… … ___ 班 … … ②其他条件相同时,测得平均每克催化剂使用量下,NaBH 4 浓度对制氢速率的影响如下图所示。(已知:
级 :
… …
浓度较大时,NaB(OH) 易以NaBO 形式结晶析出。)
装 … _____ 装 … 4 2
_____
… … … …
… …_____ … …
… 考 号 …
○ …_____ ○ … 已知:① ;
… …_____ … …
… …_____ … …
… _____ …
订 …__ 订 …
②2RCOOH +RCOOH
… … … …
… … … …
… …
○ … ○ …
回答下列问题:
… … … …
… … … … (1)A中所含官能团的名称为 。D的化学名称为 。
… … 分析NaBH 4 质量分数超过 后制氢速率下降的可能原因 。
线 … 线 … (2)B的结构简式为 。
… … … …
… … … … (4)一定条件下,利用题图所示装置实现 的电化学储氢(忽略其它有机物的反应)。 (3)B→C的反应类型为 。
… …
(4)F→G的化学方程式为 。
○ … ○ …
… … … …
(5)同时符合下列条件的化合物E的同分异构体有 种(不考虑立体异构)。
… … … …
… … ①能发生银镜反应 ②能与NaHCO 反应产生气体 ③无环状结构
3
(6)等物质的量的I与J分别在一定条件下与足量NaOH溶液反应,消耗NaOH的物质的量之比为
。
(7)用流程图表示以乙烯为原料,合成三乙醇胺( ),其他无机试剂任选 。
①写出由 生成 的电极反应式: 。
②该装置的电流效率 。( ×100%)
19.(14分)某研究小组按如图所示路线合成抗癌药物J(存达,Treanda)。
试题 第51页(共48页) 试题 第52页(共48页)
学科网(北京)股份有限公司